一种大熊猫源植物乳酸杆菌及应用的制作方法
本申请属于生物技术领域,具体地说,涉及一种大熊猫源植物乳酸杆菌及应用。
背景技术:
在过去的几十年里,人们致力于大熊猫营养和繁殖技术的改进,忽略了传染性胃肠道疾病的预防和控制。产肠毒素大肠杆菌(Enterotoxigenic Escherichia coli,ETEC)是圈养大熊猫胃肠道疾病常见病原菌之一,该菌引起的旅行者、畜禽和发展中国家婴儿分泌性细菌腹泻具有较高的发病率和死亡率。目前,ETEC感染及其相关性腹泻的控制在很大程度上依赖于抗生素,然而耐药菌株和多重耐药性的出现,对公共卫生具有潜在的威胁。寻求经济上切实可行的抗生素类替代品如有机酸、益生菌或益生元用于控制胃肠道感染性疾病是当前的研究热点。
益生菌是活的微生物(通常是细菌或酵母),当摄入足够量时对宿主健康发挥有益作用。乳酸菌是应用最为广泛的益生菌种之一,因其悠久的发酵起始物地位及其发酵制品的广泛消费而通常被认为是安全的。自1908年梅契尼柯夫(Elie Metchnikoff)提出,发酵酸奶有助于维持肠道菌群稳态,抑制腐败的假设以来。越来越多的研究表明,益生乳酸菌可以通过减少病原菌定植,改善肠道屏障功能,维持肠道共生微生物菌群平衡,增强机体免疫力等作用机制抵御部分胃肠道致病菌感染,包括沙门氏菌、产气荚膜梭菌、李斯特杆菌和致泻性大肠杆菌。然而,益生菌粘附具有宿主物种特异性,使用异源益生菌可能仅仅发挥短暂免疫保护作用。大熊猫作为中国特有的濒危珍稀物种,专用益生菌的开发局限于体外菌种生物特性研究。
技术实现要素:
有鉴于此,本申请针对上述的问题,提供了一种大熊猫源植物乳酸杆菌及应用。
为了解决上述技术问题,本申请公开了一种大熊猫源植物乳酸杆菌,该菌种为大熊猫源植物乳酸杆菌BSGP201683,Lactobacillus plantarum,该菌株于2016年05月04日保藏于中国典型培养物保藏中心,保藏号为CCTCC NO:M2016245。
本申请还公开了上述的大熊猫源植物乳酸杆菌在大熊猫传染性胃肠道疾病的预防和控制中的应用。
进一步地,传染性胃肠道疾病为肠道急性炎症。
本申请还公开了上述的大熊猫源植物乳酸杆菌在制备缓解肠道急性炎症药物中的应用。
进一步地,肠道急性炎症是由产肠毒素大肠杆菌引起的。
进一步地,大熊猫源植物乳酸杆菌能够耐受pH2.0 3小时、2%猪胆盐4小时。
进一步地,大熊猫源植物乳酸杆菌通过提高血清IgA、IgM、IgG免疫球蛋白抗体水平,抑制产肠毒素大肠杆菌感染诱导的淋巴细胞百分比降低、中性粒细胞百分比升高;显著下调炎症相关因子IL-1β、IL-8、IL-6、TLR4和MyD88mRNA表达水平,进一步缓解产肠毒素大肠杆菌引起的肠道急性炎症反应。
与现有技术相比,本申请可以获得包括以下技术效果:
1)本发明提供1株从健康大熊猫粪样中分离得到植物乳酸杆菌,保藏编号:CCTCC No.2016245。
2)本发明提供的大熊猫源植物乳酸杆菌BSGP201683可耐受pH2.0 3小时、2%猪胆盐4小时,对病原菌产肠毒素大肠杆菌、沙门氏菌和金黄色葡萄球菌的抑菌直径分别达22.48mm、20.10mm和17.90mm。
3)本发明提供的大熊猫源植物乳酸杆菌可改善肠道紧密连接相关蛋白表达,保护产肠毒素大肠杆菌感染诱导的肠道损伤。
4)本发明提供的大熊猫源植物乳酸杆菌可提高血清IgA、IgM、IgG免疫球蛋白抗体水平,抑制产肠毒素大肠杆菌感染诱导的淋巴细胞百分比降低、中性粒细胞百分比升高;显著下调炎症相关因子IL-1β、IL-8、IL-6、TLR4和MyD88mRNA表达水平,缓解产肠毒素大肠杆菌引起的肠道急性炎症反应。
5)本发明提供的大熊猫源植物乳酸杆菌可增加结肠乳酸杆菌、双歧杆菌数量,降低拟杆菌、肠杆菌丰度,且显著降低产肠毒素大肠杆菌感染模型结肠肠杆菌和不耐热肠毒素基因含量。
当然,实施本申请的任一产品并不一定需要同时达到以上所述的所有技术效果。
附图说明
此处所说明的附图用来提供对本申请的进一步理解,构成本申请的一部分,本申请的示意性实施例及其说明用于解释本申请,并不构成对本申请的不当限定。在附图中:
图1是本申请不同剂量植物乳酸杆菌对小鼠感染前后体重的影响;
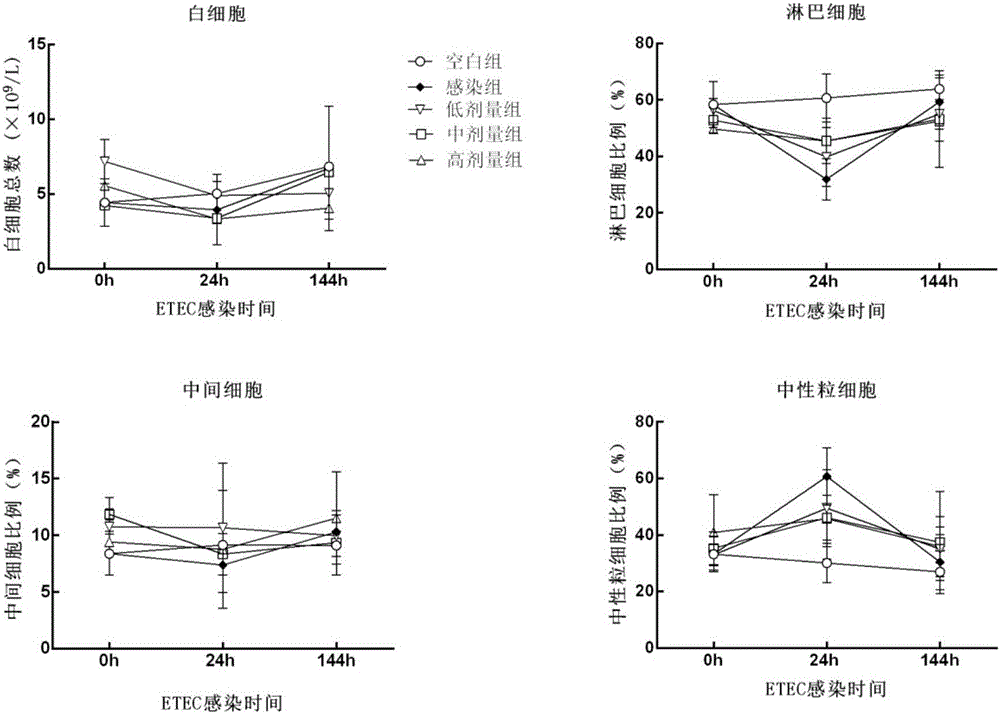
图2是本申请不同剂量植物乳酸杆菌对小鼠感染前后血液白细胞总数及分类的影响;
图3是本申请不同剂量植物乳酸杆菌对小鼠感染前后血清DAO活性和D-乳酸含量的影响;
图4是本申请不同剂量植物乳酸杆菌对小鼠感染前后血清IgA、IgM、IgG含量的影响;
图5是本申请不同剂量乳酸杆菌对小鼠感染前后空肠紧密连接相关蛋白mRNA表达水平的影响;
图6是本申请不同剂量植物乳酸杆菌对小鼠感染前后空肠细胞因子和Toll样受体mRNA表达水平的影响;
图7是本申请不同剂量植物乳酸杆菌对小鼠感染前后结肠菌群组成的影响;
图8是本申请ETEC感染24h各试验组小鼠结肠不耐热肠毒素基因含量。
具体实施方式
以下将配合实施例来详细说明本申请的实施方式,藉此对本申请如何应用技术手段来解决技术问题并达成技术功效的实现过程能充分理解并据以实施。
实施例1菌的分离与鉴定
一、菌的分离
称取新鲜大熊猫粪球内部粪样10g,加入装有90mL无菌生理盐水三角瓶(带玻璃珠),振荡混匀20min,10倍系列稀释至10-3样液。取100μL10-3稀释度样液均匀涂布MRS平板,置于37℃恒温培养箱厌氧培养24~48h后,接种环挑取疑似乳酸菌单个菌落在MRS平板上反复划线纯化,直至镜检无杂菌。
二、鉴定
(一)按照“伯杰细菌鉴定手册”(第八版)和《乳酸细菌分离鉴定及实验方法》(凌代文,东秀珠等编著,北京:中国轻工业出版社,1999.3)中描述的方法,对菌株BSGP201683进行形态特征、培养特性和生理生化特性鉴定,具体结果如下:
菌体的形态和生理生化特性:
在MRS培养基,37℃培养2天,菌体杆状,直径约为0.9-1.2μm×3.0-8.0μm;菌落奶白色,圆形,凸起,边缘整齐。
生理生化特征:
过氧化氢酶:-;明胶水解:-;硝酸盐还原:-;七叶灵水解:+;Tween80水解:-;吲哚实验:-;脲酶:-;H2S生成:-;VP实验:-;厌氧生长:+;6.5%NaCl:+;15℃:+;45℃:+;pH 4.5:+;果糖:+;葡萄糖:+;乳糖:+;纤维二糖:+;七叶苷:+;麦芽糖:+;甘露醇:+;葡萄糖酸盐:+;蔗糖:-;山梨醇:-;阿拉伯糖:-;木糖:-。
(二)16S rDNA试验
提取BSGP201683的总DNA,以其为模板,利用细菌16S rDNA通用引物(27F,1492R)进行PCR扩增,得到长度约为1.5kb的扩增产物,将扩增产物回收并进行测序,测得的序列如SEQ ID No.1所示。根据Gen-Bank序列同源性比较,菌株BSGP201683与Lactobacillus plantarum KLAB10(GenBank登录号KM497503.1)同源性为99%,判定该菌为植物乳酸杆菌(Lactobacillus plantarum)。
基于以上特征,将菌株BSGP201683鉴定为Lactobacillus plantarum。该菌株已于2016年5月4日保藏于中国典型培养物保藏中心(简称CCTCC NO:M2016245,地址:湖北省武汉市武昌区八一路299号,武汉大学保藏中心,邮编430072),保藏号为CCTCC NO:M2016245。
三、耐酸性能试验
将菌株BSGP201683接种MRS液体培养基过夜培养后,调整菌体浓度至108CFU/mL,无菌条件下接种至pH 1.0、pH 2.0和pH 3.0的MRS液体培养基,37℃恒温培养3h,并进行稀释平板计数计算活菌数,以0小时活菌数为参考。
菌株BSGP201683 0小时活菌数为6.67×108CFU/mL,在pH3.0MRS液体培养基中3小时后活菌数为2.33×108CFU/mL;在pH2.0MRS液体培养基中培养3小时后活菌数为3.33×107CFU/mL;在pH1.0MRS液体培养基中培养3小时后活菌数为0CFU/mL。
四、耐胆盐性能试验
将菌株BSGP201683接种MRS液体培养基过夜培养后,调整菌体浓度至108CFU/mL,无菌条件下接种至添加0.3%、1.0%、2.0%猪胆盐MRS液体培养基(所述%均为质量体积百分比(g/100mL)),37℃恒温培养4h,并进行稀释平板计数计算活菌数,以0小时活菌数为参考。
菌株BSGP201683 0小时活菌数为4.67×108CFU/mL,在含0.3%猪胆盐MRS液体培养基中培养4小时后活菌数为4.33×107CFU/mL;在含1%猪胆盐MRS液体培养基中培养4小时后活菌数为1.20×107CFU/mL;在含2%猪胆盐MRS液体培养基中培养4小时后活菌数为1.23×106CFU/mL。
五、病原菌拮抗试验
采用牛津杯法检测菌株BSGP201683对病原菌的拮抗活性。将菌株BSGP201683接种MRS肉汤培养基,于37℃培养24h。取培养菌液,15,600×g离心10min获得无细胞上清液。将产肠毒素大肠杆菌、沙门氏菌、金黄色葡萄球菌分别接种于10mL营养肉汤培养基,37℃培养18h后,稀释至107CFU/mL作指示菌备用。取100μL指示菌液均匀涂布无菌LB固体培养基,待其吸收后,垂直放置直径8mm牛津杯,轻轻按压牛津杯使其与琼脂紧密结合,吸取200μL分离菌株无细胞上清液至牛津杯中,37℃培养12h,测量抑菌圈直径。
菌株BSGP201683对产肠毒素大肠杆菌的抑菌圈直径为22.48mm,对沙门氏菌的抑菌圈直径为20.10mm,对金黄色葡萄球菌的抑菌圈直径为17.90mm。
实施例2植物乳酸杆菌BSGP201683对大肠杆菌感染小鼠免疫应答和肠道菌群影响
1.1动物分组及处理
90只普通级4周龄雌性ICR小鼠(16±2g),适应性饲养一周后,随机分为5组(n=18):空白组、产肠毒素大肠杆菌感染组、低剂量乳酸杆菌组、中剂量乳酸杆菌组和高剂量乳酸杆菌组,试验期21d。试验1-14d,空白对照组和产肠毒素大肠杆菌感染组小鼠每日灌喂200μL无菌PBS,低、中、高剂量乳酸杆菌组小鼠则每只每日分别灌喂200μL 5.0×108CFU/mL、5.0×109CFU/mL及5.0×1010CFU/mL L.plantarum BSGP201683菌悬液。试验第15d,空白组仍旧灌喂无菌空白组仍旧灌喂无菌PBS,其余试验组小鼠每只灌喂200μLPBS配制的产肠毒素大肠杆菌菌悬液(1.0×109CFU/mL)。小鼠同室分笼饲养,室温22±2℃,自然光照,自由采食和饮水。
1.2临床观察
试验期间,每天观察记录小鼠临床症状,每组随机选取6只小鼠空腹称重,用于统计分析小鼠体重变化情况。
1.3血液白细胞总数及其分类检测
于ETEC感染0h、24h、144h,每组随机选取6只小鼠眼眶静脉丛采血200μL,采用普康PE-6800VET三分群自动动物血细胞分析仪检测血液中白细胞总数,淋巴细胞、中间细胞和中性粒细胞百分比。
1.4血清二胺氧化酶活性、抗体及D-乳酸含量检测
于ETEC感染0h、24h、144h,每组随机选取6只小鼠眼球采血,所有血样4℃凝固,高度冷冻离心机4℃3000×g,离心10min,小心分离血清,用于测定血清中二胺氧化酶(DAO)活性,D-乳酸、IgA、IgM、IgG含量,所有检测方法依照试剂盒说明书进行。
1.5空肠组织细胞因子及Toll样受体检测
于ETEC感染0h、24h、144h,每组随机选取6只小鼠,脱臼处死,剪取空肠肠段6cm,预冷PBS(PH≈7.4)冲洗去除肠管内容物,锡箔纸包裹后迅速放入液氮速冻,后取出于-80℃冰箱保存。采用RNAiso plus试剂盒提取样品总RNA,具体操作步骤参照RNAiso plus试剂盒说明书。使用超微量核酸蛋白测定仪和1%琼脂糖凝胶电泳检测总RNA的纯度和完整性。对符合要求的RNA样品采用RT reagent Kit With gDNAEraser试剂盒反转录成cDNA,并冻存于-80℃。
以cDNA为模板,采用SYBR Premix Ex Taq II(Tli RNaseH Plus)染料法,在CFX ConnectTM实时定量PCR仪上检测各基因(表1)mRNA表达水平。25μL反应体系包括:1μL上、下引物,2μL DNA模板,ddH2O 8.5μL,12.5μL SYBR Premix Ex TaqTMII。PCR反应程序为:95℃,5min;95℃15s、Tm 30s、72℃30s,35个循环。以β-actin为内参基因,采用2-ΔΔCT法计算目的基因相对表达量。即待测目的基因表达量(-ΔΔCT)=(CT,目的基因一CT,β-actin)试验组一(CT,目的基因一CT,β-actin)对照组。
表1相对荧光定量检测引物
1.6结肠粪样细菌荧光定量检测
于ETEC感染0h、24h、144h,收集结肠内容物。使用试剂盒提取细菌总DNA。提取出的总DNA用超微量核酸蛋白测定仪和1%琼脂糖凝胶电泳检测其质量,置-20℃保存备用。采用SYBR Premix Ex TaqTMII试剂盒和Bio-Rad CFX96TMreal-time PCR Detection System对各DNA样品进行绝对荧光定量PCR检测。25μL反应体系包括:1μL上、下引物,2μL DNA模板,ddH2O 8.5μL,12.5μL SYBR Premix Ex TaqTMII。PCR反应程序为:95℃,5min;95℃15s、Tm 30s、72℃30s,35个循环。基于16S rDNA基因绝对定量分析样品中总菌、厚壁杆菌、拟杆菌、乳酸杆菌、双歧杆菌、链球菌、肠球菌、肠杆菌和不耐热肠毒素基因LT的含量(表2)。
表2细菌绝对荧光定量检测引物
1.7统计学处理
采用SPSS 19.0进行显著性分析,不同处理组间比较采用单因素方差分析,所有数据均以表示,结果以P<0.05为差异显著。
2结果与分析
2.1临床观察和体重变化
口服灌喂植物乳酸杆菌14d期间,小鼠未见任何异常或死亡现象;感染ETEC后,感染小鼠精神沉郁,采食减少,仅感染组有1只小鼠出现轻微腹泻,其余试验组小鼠未见腹泻症状。对试验期间小鼠体重进行记录分析,结果见图1。感染前,乳酸杆菌组小鼠体重较空白对照组小鼠有所增加,但无显著差异(P>0.05)。ETEC感染24h后,感染小鼠体重明显下降。感染期间,感染组小鼠较未感染小鼠生长缓慢,但各试验组体重变化差异不显著(P>0.05)。
2.2血液白细胞总数及分类变化
利用自动血球仪监测小鼠外周血液中白细胞总数及其分布的变化,结果见图2。感染ETEC 0h,各试验组小鼠外周血淋巴细胞百分比、中间细胞百分比、中性粒细胞百分比及白细胞总数均无显著差异(P>0.05)。感染ETEC 24h,与空白组比较,感染组和乳酸杆菌组淋巴细胞百分比显著降低(P<0.05),中性粒细胞百分比显著升高(P<0.05),且乳酸杆菌组与感染组无显著差异(P>0.05)。感染ETEC 144h,各试验组间外周血淋巴细胞百分比、中间细胞百分比、中性粒细胞百分比及白细胞总数均无显著差异(P>0.05)。
2.3血清DAO活性和D-乳酸含量变化
感染ETEC 0h,各试验组血清DAO活性和D-乳酸含量均无显著差异(P>0.05)。感染ETEC 24h,感染组DAO活性和D乳酸含量均显著高于空白组、乳酸杆菌中剂量组(P<0.05),但与乳酸杆菌高剂量组无显著差异(P>0.05)。感染ETEC 144h,各试验组血清DAO活性和D-乳酸含量均无显著差异(P>0.05),见图3。
2.4血清IgA、IgM、IgG含量的变化
试验期间小鼠血清抗体水平变化见图4。感染ETEC 0h,乳酸杆菌中、低剂量血清IgA,中、高剂量血清IgM及高剂量血清IgG含量较空白组显著增加(P<0.05)。感染ETEC 24h,乳酸杆菌组血清IgA含量显著高于空白组(P<0.05),但与感染组差异不显著(P>0.05)。感染ETEC 144h,各试验组间血清IgA、IgM、IgG含量均无显著差异(P>0.05)。
2.5空肠紧密连接相关蛋白mRNA表达水平变化
空肠紧密连接蛋白(Claudin-1,Occludin和ZO-1)mRNA表达水平见图5。感染ETEC0h,乳酸杆菌中剂量组空肠Occludin和ZO-1mRNA表达水平显著高于空白组(P<0.05)。感染ETEC 24h,三种紧密连接蛋白表达水平均呈现降低趋势,其中感染组Claudin-1和Occludin mRNA的表达水平显著低于空白组(P<0.05),而乳酸杆菌低剂量、中剂量组与空白组无显著差异(P>0.05)。感染ETEC 144h,各试验组间Claudin-1、Occludin和ZO-1mRNA表达水平均无显著差异(P>0.05)。
2.6空肠组织细胞因子和Toll样受体mRNA表达水平变化
感染前后空肠组织细胞因子和Toll样受体表达水平变化见图6。感染ETEC 0h,仅乳酸杆菌高剂量组IL-1β和IL-8mRNA表达水平显著高于空白组(P<0.05),其余检测因子在各试验组间均无显著差异(P>0.05)。感染ETEC 24h,感染组IL-1β、IL-8、IL-6、TLR4和MyD88mRNA表达水平显著高于空白组及乳酸杆菌中、低剂量组(P<0.05),而乳酸杆菌高剂量组IL-8表达水平与感染组无显著差异(P>0.05)。感染ETEC 144h,感染组IL-1βmRNA表达水平显著高于空白组及乳酸杆菌各剂量组(P<0.05)。
2.7结肠菌群组成变化
ETEC感染前后各试验组结肠菌群检测结果如图7所示。感染ETEC 0h,乳酸杆菌中剂量组结肠乳酸杆菌和双歧杆菌数量较空白组显著增加(P<0.05),而拟杆菌、肠杆菌科数量显著降低(P<0.05)。感染ETEC 24h,感染组肠杆菌数量显著高于乳酸杆菌各剂量组(P<0.05)。感染ETEC 144h,各试验组间所检测细菌均无显著差异(P>0.05)。
2.8结肠不耐热肠毒素基因含量变化
ETEC感染24h,感染组结肠内容物不耐热肠毒素LT基因拷贝数显著高于空白组和乳酸杆菌各剂量组(P<0.05),且各剂量组间无显著差异(P>0.05)(图8)。ETEC感染0h和144h,各试验组小鼠均未检测到不耐热肠毒素LT基因。
3讨论
本试验中,绝大多数大肠杆菌CVCC196(LT+STa-STb+)感染小鼠未出现明显的腹泻或死亡,仅表现出体重下降和生长缓慢等症状。其原因可能是试验动物敏感性和感染菌株毒力差异所致。迄今为止,益生菌被用于促进家畜生长已有30年。本试验小鼠体重变化监测结果显示,无论是感染前还是感染后,均未观察到植物乳酸杆菌显著的促生长作用。同样,补充植物乳酸杆菌对小鼠体重没有显著影响。这些结果表明,不同乳酸杆菌菌株对动物的促生长作用效果不同。
本试验中,灌喂中、低剂量植物乳酸杆菌显著抑制了ETEC感染引起的血清DAO活性和D-乳酸含量升高。本试验中,空肠组织跨膜蛋白Claudin-1和Occludin mRNA表达水平显著下调,表明ETEC感染破坏了肠道紧密连接。本试验结果显示,灌喂不同剂量乳酸杆菌显著提高了感染前血清IgA、IgG和IgM含量,但对感染后血清免疫球蛋白水平无显著影响;本试验仅对血清中总IgG、IgA和IgM进行了检测,植物乳酸杆菌BSGP201683能否改善血清或肠道粘膜抗ETEC特异性抗体水平有待进一步研究。
本试验亦发现ETEC感染诱导空肠组织促炎性细胞因子和Toll样受体的大量表达,包括IL-1β、IL-6、IL-8、MCP-1、MyD88和TLR4。本试验中,TLR4和MyD88mRNA表达水平的下调伴随促炎性细胞因子表达水平的降低。灌喂低、中剂量植物杆菌显著降低感染24h空肠组织IL-1β、IL-6和IL-8mRNA表达水平,而高剂量组感染24h IL-8mRNA表达水平较感染组无显著差异;ETEC感染144h,仅感染组IL-1β显著高于空白组和乳酸杆菌剂量组。这些结果表明,饲喂中、低剂量植物乳酸杆菌BSGP201683可缓解ETEC感染引起的肠道急性炎症反应。
本试验中,尽管灌喂高剂量乳酸杆菌显著提高健康小鼠血清IgG抗体水平,但对ETEC感染引起的肠道急性炎症反应的调节作用次于中、低剂量。其原因可能是高剂量乳酸杆菌的摄入在感染前诱导了促炎因子的过度表达(如IL-8,L-1β),从而扰乱了肠道粘膜免疫功能。
本试验结果显示,灌喂植物乳酸杆菌BSGP201683可增加小鼠结肠乳酸杆菌和双歧杆菌的丰度,降低拟杆菌和肠杆菌数量。肠道革兰氏阴性细菌尤其是拟杆菌的减少与体重表型密切相关。结肠拟杆菌数量的减少可能加速了机体代谢,从而促进小鼠的体重增加。本试验结果中,灌喂植物乳酸杆菌BSGP201683显著降低了结肠肠杆菌和LT毒力因子含量,可能从本质上解释了其对ETEC感染的保护作用。
4、小结
1)灌喂不同剂量大熊猫源植物乳酸杆菌BSGP201683可不同程度地提高血清IgA、IgG、IgM抗体水平,增加结肠乳酸杆菌、双歧杆菌数量,降低肠杆菌、拟杆菌数量,但仅高剂量显著提高空肠组织IL-1β和IL-8mRNA表达水平。
2)小鼠感染产肠毒素大肠杆菌CVCC196虽未出现明显腹泻,但却表现出体重下降、生长缓慢等症状。灌喂低、中剂量大熊猫源乳酸杆菌可抑制ETEC感染引起的外周血淋巴细胞百分比降低和中性粒细胞百分比升高;抑制紧密连接相关蛋白mRNA表达水平的下降,降低血浆DOA活性和D-乳酸含量,从而阻碍病原菌感染引起的肠道粘膜损伤;改善肠道菌群组成,减少结肠肠杆菌和不耐热肠毒素基因含量;下调促炎调控因子表达,缓解ETEC感染引起的急性肠道炎症反应,且中、低剂量植物乳酸杆菌BSGP201683对产肠毒素大肠杆菌感染的干预作用优于高剂量。
上述说明示出并描述了发明的若干优选实施例,但如前所述,应当理解发明并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、修改和环境,并能够在本文所述发明构想范围内,通过上述教导或相关领域的技术或知识进行改动。而本领域人员所进行的改动和变化不脱离发明的精神和范围,则都应在发明所附权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!