产高活性角蛋白水解酶的菌株及其应用的制作方法
本发明属于生物工程领域,具体地,本发明涉及一种产高活性角蛋白水解酶的菌株及其应用。
背景技术:
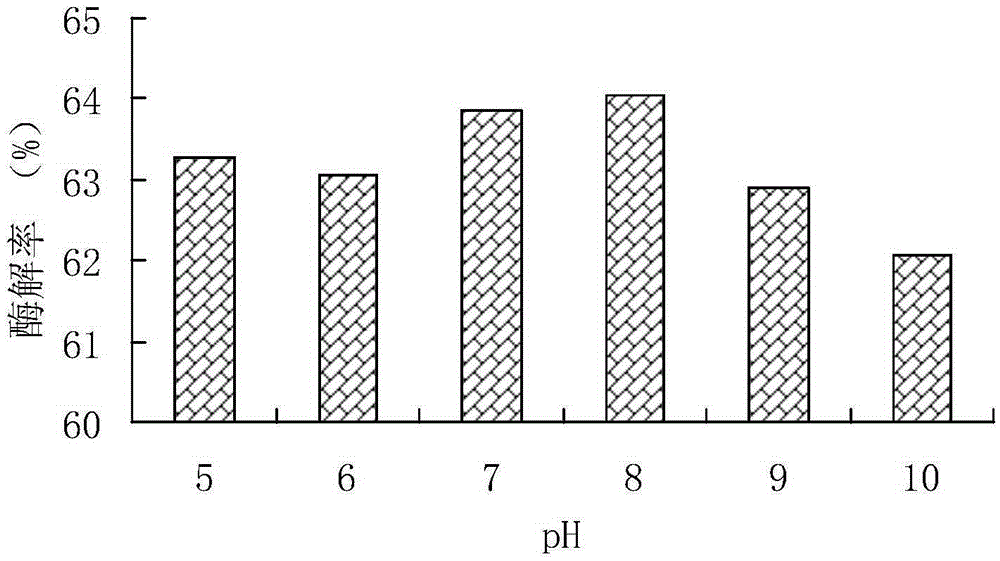
:羽毛是家禽饲养和屠宰工业的重要副产物,我国羽毛产量丰富,目前每年羽毛的年产量达120多万吨。羽毛中有着丰富的蛋白质、氨基酸,对羽毛的合理利用一方面可以减少废弃物对环境的污染,另一方面可以作为一种饲料蛋白质应用于畜禽的饲养。羽毛是禽类的外保护层,它的抗逆能力很强。对羽毛蛋白分析可知,其中含硫氨基酸在总的氨基酸中所占的比重较大,这样在羽毛蛋白分子内跟分子间,除许多氢键、盐键,还存在着大量的二硫键,因此普通的蛋白酶难以降解羽毛蛋白,导致其消化不佳,这是羽毛蛋白作为动物饲料蛋白源存在的主要问题之一。目前,工业上处理羽毛粉的方法一般为高温高压蒸煮,这样将导致一些热敏性氨基酸的变性,一些非营养性的氨基酸生成,产品的稳定性下降,还会导致动物食用后的消化不良。微生物降解法虽然反应条件温和,但目前还处在实验室研究阶段,另一方面因其发酵过程中需消耗大量的能源,将会使大大增加羽毛粉的生产成本,所以还无法在实际生产中应用。目前已知的分解角蛋白的菌分布在细菌、放线菌和真菌中,主要有地衣芽孢杆菌,高温单胞菌属,白色假丝酵母和链霉菌等,它们普遍酶活力不高,酶解效果不好。因此,本领域迫切需要开发一种新菌属、可适用于多种角蛋白原料且蛋白裂解效率高的新型角蛋白酶、制剂及相应的技术。技术实现要素:本发明的目的是提供一种可新菌属、可适用于多种角蛋白原料且蛋白裂解效 率高的新型角蛋白酶、制剂及相应的技术。本发明第一方面提供了一种产角蛋白水解酶的菌株,所述菌株为耐辐射异常球菌(Deinococcusradiodurans),并且所述菌株表达角蛋白水解酶。在另一优选例中,所述的角蛋白水解酶酶解选自下组的底物:角蛋白、家禽羽毛。在另一优选例中,所述菌株的保藏号为CCTCCNO.2015459。在另一优选例中,所述的角蛋白水解酶的活性≥5万U/g,较佳地≥10万U/g0,更佳地为10-25万U/g。在另一优选例中,所述菌株的发酵液上清中蛋白水解酶的酶活为1000-10000U/mL,较佳地为1500-5000U/mL,更佳地为2000-3500U/mL。在另一优选例中,所述的衍生菌株是保藏号为CCTCCNO.2015459的衍生菌株,并且所述衍生菌株所产生的角蛋白水解酶的酶活性≥5万U/g。在另一优选例中,所述的衍生菌株所产生的角蛋白水解酶的酶活性为10-25万U/g。在另一优选例中,所述的衍生菌株是CCTCCNO.2015459经1-100传代而获得的衍生菌株。在另一优选例中,所述的衍生菌株与CCTCCNO.2015459具有相同的16srRNA。在另一优选例中,所述的衍生菌株在上述传代过程中经诱变处理或不经诱变处理。在另一优选例中,所述的角蛋白水解酶以角蛋白或角蛋白原料为底物,降解生成分子量为100Da-2000Da小肽,较佳地为180Da-1000Da的小肽。在另一优选例,在以下测定条件下,经所述的角蛋白水解酶酶解后,酶解产物中小肽的含量≥70%,较佳地≥75%,更佳地≥80%,按酶解产物的干重计:pH8.0-8.5,角蛋白底物浓度10-12%,酶添加量为40000U/g底物,温度35-55℃(较佳地,45℃),和酶解时间6-12小时。本发明第二方面提供了一种用于降解角蛋白的酶制剂,所述的制剂含有(a)本发明第一方面所述的菌株的发酵产物、或从所述发酵产物中分离出的角蛋白水解酶;和/或(b)本发明第一方面所述的菌株的菌体;以及(c)任选的辅料或载体。在另一优选例中,所述的菌体包括活菌体。在另一优选例中,所述的分离出的角蛋白水解酶包括粗酶产品或经纯化的酶产品。在另一优选例中,所述的粗酶产品包括:(i)发酵液去除菌体后获得的粗酶液;(ii)所述粗酶液经冻干后获得的酶粉制剂。在另一优选例中,所述制剂中角蛋白水解酶的酶活性为≥5万U/g,较佳地≥10万U/g,更佳地为10-25万U/g。在另一优选例中,所述粗酶液中蛋白水解酶的酶活为1000-10000U/mL,较佳地为1500-5000U/mL,更佳地为2000-3500U/mL。在另一优选例中,所述的制剂为固定化酶制剂。本发明第三方面提供了一种生产角蛋白水解酶的方法,所述的方法包括步骤:(1)用本发明第一方面所述的菌株进行发酵,得到含角蛋白水解酶的发酵液;和(2)从发酵液中分离所述的角蛋白水解酶。在另一优选例中,在步骤(1)中,在以下pH条件下进行发酵:pH5.0-12,较佳地pH5.0-10,更佳地,pH6.0-9.0。在另一优选例中,步骤(1)中所述发酵在以下条件下进行:(i)发酵培养基的起始pH为5.0-10.0,较佳地,7.0-8.0,更佳地,8.0;(ii)发酵接种量为4-10(v/v)%,较佳地,4-6(v/v)%,更佳地,4(v/v)%;按发酵液的总体积计。在另一优选例中,所述接种所用的接种液含有0.005~0.4g/ml(较佳地,0.01-0.3g/ml)或1×105-1×108个/ml(较佳地,2×105-1×107)的所述菌体。在另一优选例中,所述的培养基碳源选自下组:羽毛粉、葡萄糖、淀粉、乳糖、或其组合。在另一优选例中,所述碳源为羽毛粉。在另一优选例中,所述的培养基的氮源选自下组:羽毛粉、硫酸铵、蛋白胨、酵母膏、或其组合。在另一优选例中,所述氮源为羽毛粉。在另一优选例,在步骤(1)中的发酵条件包括:所述碳源的添加量为0.1-3.0wt%,基于培养基总重量计;所述氮源添加量为0.1-3.0wt%,基于培养基总重量计。在另一优选例中,所述的发酵液是含菌体的发酵液。在另一优选例中,所述发酵液是通过包括以下步骤的方法制备:将所述菌株接种至培养基进行培养,得到种子液;将所述种子液接种入发酵罐,形成发酵体系;和对所述发酵体系进行培养,得到发酵后的发酵液。在另一优选例中,在发酵培养时,在以下条件下培养:培养温度37±3℃,发酵起始pH5-10(较佳地8.0±0.5)。本发明第四方面提供了一种水解的方法,所述方法包括步骤:在本发明第一方面所述菌株的存在下,和/或在本发明第二方面所述用于降解角蛋白的酶制剂的存在下,对角蛋白或角蛋白原料进行水解,从而形成水解产物。在另一优选例中,所述水解在pH8-10(较佳地,8.5-9.5)的条件下进行。在另一优选例中,所述的酶解条件为底物浓度为10-12%(以干物质计),酶添加量为30000-50000U/g(以干物质计),温度为35-55℃,时间为6-12h,pH为6.0-12.0。在另一优选例中,所述的角蛋白原料包括:家禽羽毛、蹄、角。在另一优选例中,所述方法为非治疗性和非诊断性的。本发明第五方面提供了一种如本发明第一方面所述的菌株的用途,用于制备角蛋白水解酶,或用于制备降解角蛋白的制剂。在另一优选例中,所述的制剂为酶制剂或活菌制剂。应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。附图说明图1显示了本发明的菌株的菌落形态,菌落扁平,表面光滑,为革兰氏阳性菌。图2显示了不同初始pH对产酶的影响。图3显示了不同接种量对产酶的影响。图4显示了不同碳源对菌发酵的影响。图5显示了不同氮源对菌发酵的影响。图6显示了不同酶解pH对羽毛酶解的影响。图7显示了不同酶添加量对羽毛酶解的影响。图8显示了不同酶解温度对羽毛酶解的影响。具体实施方式发明人经过广泛而深入的研究,首次从环境(含角蛋白的堆积物)中筛选到一株对角蛋白具有优良降解效果的菌株,并经过进一步诱变处理,最终筛选到一株对角蛋白有优异降解效果的耐辐射异常球菌,该菌株被命名为耐辐射异常球菌J1。性能测试表明,该耐辐射异常球菌J1的遗传稳定性好,产酶量高,安全性高,产品稳定,制备工艺简便。对于多种常见的角蛋白原料的测试表明,经本发明菌株所产的角蛋白酶降解后,小肽含量可高达75%以上,具有极高的应用价值。本发明可有助利用角蛋白生产功能性蛋白肽。在此基础上完成了本发明。定义酶活单位的定义。以粗酶液为例,每1mL粗酶液,在一定温度和pH值条件下(pH7.2和40℃),1min水解酪素产生1ug酪氨酸为一个酶活力单位,以(u/mL)表示。对于冻干制剂等其他形式的酶,依此类推。菌株如本文所用,术语“本发明菌株”、“本发明耐辐射异常球菌”、“本发明耐辐射异常球菌J1”、“本发明工程菌”、“本发明的保藏菌株”可互换使用,指保藏于CCTCC的保藏号为CCTCCNO.2015459菌株或由该菌株得到的衍生菌株,其中包括经传代培养得到的菌株。本发明菌株是如下获得的:(a)对从可能存在动物蛋白酶菌株的环境(如含角蛋白的堆积物)取一定量的样本,于富集培养基中进行富集,然后对富集液进行稀释,通过涂布进行分离,得到各种不同的单菌落。(b)对获得的各种单菌落进行初筛,得到酶活性较高的菌株。(c)对初筛所获得的菌株,进一步制备其发酵产物,制得粗酶液后,测定酶活,进一步选取酶活性高的菌株。(d)对于步骤(c)中选出的菌株,进一步进行诱变处理,并测定诱变处理后菌株的酶活性,最终确定诱变后酶活性效果优异的菌株,作为工程菌。在本发明中,经过上述方法,成功地筛选到一株角蛋白酶活性优异的菌株,即本发明的耐辐射异常球菌J1。对本发明的所述耐辐射异常球菌J1进行的研究表明,本发明菌株为耐辐射异常球菌。如图1所示,菌株的菌落呈红色,扁平,表面光滑,为革兰氏阳性菌。对该耐辐射异常球菌的特性进行的研究表明,该菌株的一些主要特性如下:最适培养温度37±3℃,发酵起始pH5.0至10.0(较佳地8.0±0.5),碳源和氮源优选羽毛粉为唯一碳源和氮源。对于所制备的本发明角蛋白酶,其合适酶解pH7.5-9.0(较佳地pH8.0-8.5),30000-50000U/g底物(较佳地40000U/g底物),酶解温度为35℃-55℃(较佳地45℃)。用于培养本发明菌株的培养基中的营养源没有特别的限制。本领域技术人员可以根据公知的技术来选择合适的碳源、氮源和其他营养源。例如,碳源可以是淀粉、糊精、葡萄糖、果糖、蔗糖、甘油、肌醇、甘露醇等。氮源可以是胨、大豆蛋白胨、大豆粉、黄豆饼粉、肉膏、蛋白粉、麦皮、米糖、酵母粉、玉米浆、铵盐以及其他有机物或无机含氮化合物。另外,培养基中还可适当加入一些无机盐类,如氯化钠、磷酸盐(如磷酸二氢钾和磷酸氢二钾等)、硫酸锰、硫酸铵、硫酸镁、碳酸钙等金属盐。通常可采用各种已知的常规培养基,如LB琼脂培养基、营养琼脂培养基、葡萄糖酵母膏琼脂培养基和牛肉浸汁琼脂培养基等对本发明菌株进行斜面固体培养并4℃环境下进行初步保藏。对于本发明菌株而言,可以选用本领域常用的培养基进行培养。在具体实施方案中,一些代表性的培养基包括(但并不限于):(1)富集培养基(g/L):蛋白胨10,牛肉浸膏3,NaCl3;pH7.2-7.4。(2)平板筛选培养基(g/L):羽毛粉10,NaCl3,琼脂15;pH7.2-7.4(3)液体活化培养基(g/L):羽毛粉10,葡萄糖5,NaCl3;pH7.2-7.4(4)种子培养基(g/L):葡萄糖3,蛋白胨5,酵母膏3,NaCl3;pH7.2-7.4(5)发酵培养基(g/L):羽毛粉10,NaCl1.5,CaCl23,K2HPO41.4,KH2PO40.7,MgSO40.1;pH7-8然而,本领域技术人员应当理解,本发明并不局限于本文中列举的这些具体培养基配方。培养本发明中的菌株的温度、pH、气液比、罐压、转速等条件没有特别严格的限制,只要该条件适合该菌的生长即可。在一些较佳的实施方案中,pH宜控制在7.5~8.5之间,培养温度宜在35~ 40℃之间。应理解,本发明的发酵可以是连续发酵,也可以是间歇式发酵。角蛋白酶的制备和制剂在本发明中,还提供了基于本发明菌株的角蛋白酶,以及含有所述角蛋白酶的制剂。在本发明中,一种优选的角蛋白酶制剂是本发明菌株的粗酶制剂,即将本发明菌株的发酵产物经离心去除固体杂质(包括菌体)后,所获得的溶液。该粗酶溶液可以直接作为酶制剂使用,也可进一步经后续处理(如冻干处理)后获得固态形式的酶制剂。在本发明酶制剂中,可任选地添加有利于保持酶活性的物质,如稳定剂等。对角蛋白进行水解的方法(应用)本发明还提供一种对角蛋白进行水解(或酶解)的方法,该方法包括在本发明菌株所产生的角蛋白酶存在下,对角蛋白原料进行酶解处理(如保温一段时间),从而将角蛋白酶解为小肽。通常,本发明的酶解反应可在合适的酶解温度(如35℃-60℃)、pH(如pH8.0-10,较佳地pH8.5-9.5)进行。在本发明中,酶解时酶用量没有特别限制,通常为10000-100000U/g蛋白(底物),较佳地为30000-40000U/g蛋白。在本发明中,酶解时间没有特别限制,可以为1小时至数天、甚至数周。通常,酶解时间为2-72小时,较佳地6-12小时。在本发明中,角蛋白原料没有特别限制,可以是任何含角蛋白的原料,如羽毛。通常,在本发明中,酶解反应时,底物(动物蛋白)的浓度为5-15wt%,较佳地10-12wt%。典型地,在本发明中,酶解反应时,底物浓度为10%-12%(以干物质计),酶添加量为30000-50000U/g(以干物质计),温度为35℃-55℃,时间为6h-12h,pH为6.0-12.0。菌种保藏本发明的上述菌种已于2015年7月20日保藏在中国典型培养物保藏中心 (ChinaCenterforTypeCultureCollection,简称CCTCC),地址:湖北省武汉市武昌珞珈山,保藏号:CCTCCNO.2015459,名称为:耐辐射异常球菌(Deinococcusradiodurans)J1。本发明的主要优点包括:1、产酶活性高、酶解效果好。2、获得的菌株稳定性好。3、生产成本低,安全性高。本发明的菌株和酶制剂有助于将我国大量的废弃角蛋白转变为优质蛋白肽产品,对缓解国内角蛋白资源缺乏现状具有重大意义和应用价值。下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如Sambrook等人,分子克隆:实验室手册(NewYork:ColdSpringHarborLaboratoryPress,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。通用实验方法和材料:材料1.培养基:(1)富集培养基(g/L):蛋白胨10,牛肉浸膏3,NaCl3;pH7.2-7.4。(2)平板筛选培养基(g/L):羽毛粉10,NaCl3,琼脂15;pH7.2-7.4(3)液体活化培养基(g/L):羽毛粉10,葡萄糖5,NaCl3;pH7.2-7.4(4)种子培养基(g/L):葡萄糖3,蛋白胨5,酵母膏3,NaCl3;pH7.2-7.4(5)发酵培养基(g/L):羽毛粉10,NaCl1.5,CaCl23,K2HPO41.4,KH2PO40.7,MgSO40.1;pH7-8紫外分光光度法测蛋白酶酶活测定实验前配制pH为7.4的磷酸缓冲液及10%的TCA溶液,称取1g角蛋白底物(偶氮楼蛋白)溶于150mL的磷酸缓冲液中。设置实验组及空白组组, 实验组:1.5mL角蛋白溶液+1mL粗酶液;空白组:1.5mL角蛋白溶液+1mL水,放置37℃的水浴锅中反应1h,加1mL10%的TCA终止反应,4℃静置30min,静置完成后于4℃离心15min,取上清在280nm处测定吸光度,每增加0.01的吸光度及为一个酶活单位。实施例1菌株的筛选和诱变1.1.菌株的筛选分离取一定量的角蛋白堆积物(0.1-1g),加入到含有50mL富集培养基的250ml三角瓶中,37℃、180r/min振荡培养5-7天,观察培养基颜色变化。对富集培养液进行梯度稀释,将稀释度为10-5、10-6及10-7的稀释液分别涂布于羽毛粉筛选平板上,挑取生长的单菌落于筛选平板上继续再次培养,进行分离纯化以得到单菌落。将上述获得的单菌落进行试管保存备用。结果,筛选到27株不同的菌株,其酶活性在300U/ml内。1.2.酶活复筛将上一步骤中筛选获得并保存菌株以6%的接种量接种于装有50ml发酵培养基的250ml三角瓶中,180r/min、36℃振荡培养72h,8000r/min离心10min去除菌体,粗酶液采用紫外分光光度法进行酶活测定。经测定,所述菌株中有17株的酶活性在250-300U/ml。1.3.菌株的γ-射线诱变挑选上一步骤中经鉴定酶活性较高的10株菌株,调整对数期菌液的浓度为105左右,送至辐照公司进行γ-射线辐照,辐照剂量60Gy,时间10-360s,稀释涂布后用黑布包裹置培养箱中培养,并与未照射的菌种做对照。选取生长的单菌落进行酶活复筛,最终确定诱变效果较好的菌株,选取诱变效果最好的进行培养基的优化。经过多轮筛选,成功筛选到一株角蛋白酶活性优异的菌株,经培养和16srRNA鉴定,与耐辐射异常球菌(Deinococcusradiodurans)匹配达99.9%,命名为耐辐射异常球菌J1。实施例2发酵条件的优化在本实施例中,对实施例1中所获得的耐辐射异常球菌J1,进行培养条件和培养基优化。2.1.不同初始pH对产酶的影响设定初始pH为5、6、7、8、9、10,考察初始pH对发酵产酶的影响。结果如图2所示。其中,pH中性(如pH为8)时,羽毛的酶解率最高(高达64%),并且菌株的长势更好,更有利发酵产酶。2.2.不同接种量对产酶的影响设计接种量为4%,6%,8%,10%,12%,考察接种量对菌株生长的影响。结果如图3所示。其中,接种量为4%时羽毛酶解率较高。2.3.不同碳源对菌发酵的影响分别设置实验组和对照组,研究外加碳源对菌株生长的影响。其中,外加碳源的添加量为0.5%。其他碳源的种类为:葡萄糖、可溶性淀粉、乳糖。其余成分和条件与初始发酵培养基相同。实验组:在羽毛粉为碳源的基础上添加其他的碳源。对照组:未添加其他碳源。结果如图4所示。添加外加碳源不利于菌株发酵产酶。2.4.不同氮源对菌发酵的影响分别设置实验组和对照组,研究外加氮源对菌株生长的影响。其中,外加氮源的添加量为0.5%。其他氮源的种类为:硫酸铵、蛋白胨、酵母浸膏。其余成分和条件与初始发酵培养基相同。结果如图5所示。添加外加氮源不利于菌株发酵产酶。实施例3酶制剂的制备在实施例2所获得的最佳发酵初始pH、接种量、碳源和氮源的基础上,进行发酵试验,其中发酵条件为36℃,摇床培养96h,将所得发酵液离心去菌体后得到的粗酶液和冷冻干燥制备酶粉制剂。结果显示,粗酶液酶活为2500U/mL,冷冻干燥后,酶粉制剂活性在12.5万U/g(碱性条件检测为23.8万)以上(其中,冻干后的含酶物质(干物质)占发 酵液重量的约2%左右)。实施例4羽毛酶解实验在本实施例中,将所得发酵液离心去菌体后得到的粗酶液(实施例3制备)用作酶制剂,进行羽毛蛋白的酶解试验。初始酶解温度55℃,pH8.0,羽毛底物5g,酶添加量60mL(酶活2500U/mL),酶解时间12h。1.在pH6、8、10、12条件下,考察不同酶解pH对羽毛酶解的影响。结果如图6所示,结果显示,pH8.0条件下酶解产物中小肽/干物质含量达到75.63%。2.在温度35℃,40℃,45℃,50℃,55℃条件下,考察不同酶解温度对羽毛酶解的影响。结果如图8所示,结果显示,45℃条件下酶解产物中小肽/干物质含量达到70.33%。3.在酶液添加量为60mL,80mL,100mL,120mL条件下,考察不同酶添加量对羽毛酶解的影响。结果如图7所示,结果显示,酶液添加80mL(酶活2500U/mL)条件下酶解产物中小肽/干物质含量达到77.21%。4.同时,对于优化后酶解条件,还用一种市售的蛋白酶(2709碱性蛋白酶)作为对照,对酶解活性进行比较。其中,实验组的酶添加量为4×104U/g羽毛,对照组(2709酶)的酶活为20×104U/g,其酶添加量与实验组一样,均为4×104U/g羽毛。测试结果如下表所示:表1.本发明蛋白酶与市售蛋白酶的酶解活性比较(按酶解后,产物中小肽含量计算)酶解底物(10%)2709酶本发明酶羽毛43.2%77.2%注:①酶解条件为厂家推荐酶解条件:2709碱性蛋白酶,40-50℃、pH9-12。②所述的小肽指出180Da≤分子量≤1000Da的肽。菌种保藏本发明的菌种耐辐射异常球菌J1(与保藏名称相同)已于2015年7月20日保藏在中国典型培养物保藏中心(ChinaCenterforTypeCultureCollection, 简称CCTCC),地址:湖北省武汉市武昌珞珈山,保藏号:CCTCCNO.2015459。在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1