β‑菲并氮杂氟硼二吡咯染料及其制备方法和应用与流程
本发明涉及染料领域,具体地,涉及β-菲并氮杂氟硼二吡咯染料及其制备方法和应用。
背景技术:
氮杂氟硼二吡咯荧光染料(azaBODIPY)由于具有近红外吸收并且窄的吸收峰和发射峰、较高的摩尔吸光系数、较好的光稳定性以及化学稳定性等良好的使用性能,使得其近二十几年在生物成像、光敏剂、离子探针等领域得到广泛的研究和使用。但是传统的氮杂氟硼二吡咯(azaBODIPY)荧光染料在应用上有一定的缺陷,比如它们的吸收波长不能满足近红外需求、溶解度不好、荧光处于尴尬位置等。而一些成像技术需要长波吸收,并且无荧光,如光声造影成像技术。但是目前具有长波(800nm左右)吸收的染料很少,且大多具有长波吸收的染料在使用时具有一定的局限性,如吲哚菁绿,虽然其具有长波吸收,但是吲哚菁绿的稳定性不好,而其他结构的具有长波吸收的染料由于共轭体系较大,因而都存在溶解度的问题。
因此,提供一种具有较长吸收波长,而且稳定性较高的全新的生物染料具有十分重要的意义。
技术实现要素:
针对上述现有技术,本发明的目的在于克服现有技术中传统的氮杂氟硼二吡咯荧光染料因其具有吸收波长不能满足近红外需求、溶解度不好、荧光处于尴尬位置、光学选择性差等缺点,使得其在需要长波吸收,并且无荧光的一些成像技术中无法得到应用,而普通的具有长波吸收的染料不仅种类少,且大多在使用时具有局限性的问题,从而提供一种具有较长的吸收波长和发射波长,且具有较好的光学选择性,稳定性较高,并且制备步骤简单,原料易得的β-菲并氮杂氟硼二吡咯染料及其制备方法和应用。
为了实现上述目的,本发明提供了一种β-菲并氮杂氟硼二吡咯染料,其中,所述β-菲并氮杂氟硼二吡咯染料的结构如式(I)所示:
其中,R1为C1-C6的烷氧基;R2和R4各自独立地选自C1-C6的烷氧基或C1-C6的烷基;R3和R5各自独立地选自氢或C1-C6的烷氧基。
本发明还提供了一种如式(I)所示结构的β-菲并氮杂氟硼二吡咯染料的制备方法,其中,所述制备方法包括:
1)在钯存在的条件下,将如式(II)所示的化合物与芳基硼酸进行第一接触反应,制得混合物M1;
2)在三乙胺存在的条件下,将步骤1)中制得混合物M1与三氟化硼乙醚进行第二接触反应,制得混合物M2;
3)将混合物M2与氧化剂进行第三接触反应,制得如式(I)所示结构的β-菲并氮杂氟硼二吡咯染料;
其中,R1为C1-C6的烷氧基;R2和R4各自独立地选自C1-C6的烷氧基或C1-C6的烷基;R3和R5各自独立地选自氢或C1-C6的烷氧基;X为卤素。
本发明还提供了一种上述所述的β-菲并氮杂氟硼二吡咯染料在光学传感器和光声造影成像中的应用。
通过上述技术方案,本发明通过将如式(II)所示的化合物与芳基硼酸进行第一接触反应,再将制得的混合物M1与三氟化硼乙醚进行第二接触反应,制得混合物M2,而后将混合物M2与氧化剂进行第三接触反应,从而制得如式(I)所示结构的β-菲并氮杂氟硼二吡咯染料,同时,上述如式(I)所示结构的β-菲并氮杂氟硼二吡咯染料在实际使用时具有较长的吸收波长和发射波长,且具有较窄的吸收峰和发射峰以及优异的摩尔吸光系数,进而使得其光学传感器和光声造影成像中具有潜在的应用。
本发明的其他特征和优点将在随后的具体实施方式部分予以详细说明。
附图说明
附图是用来提供对本发明的进一步理解,并且构成说明书的一部分,与下面的具体实施方式一起用于解释本发明,但并不构成对本发明的限制。在附图中:
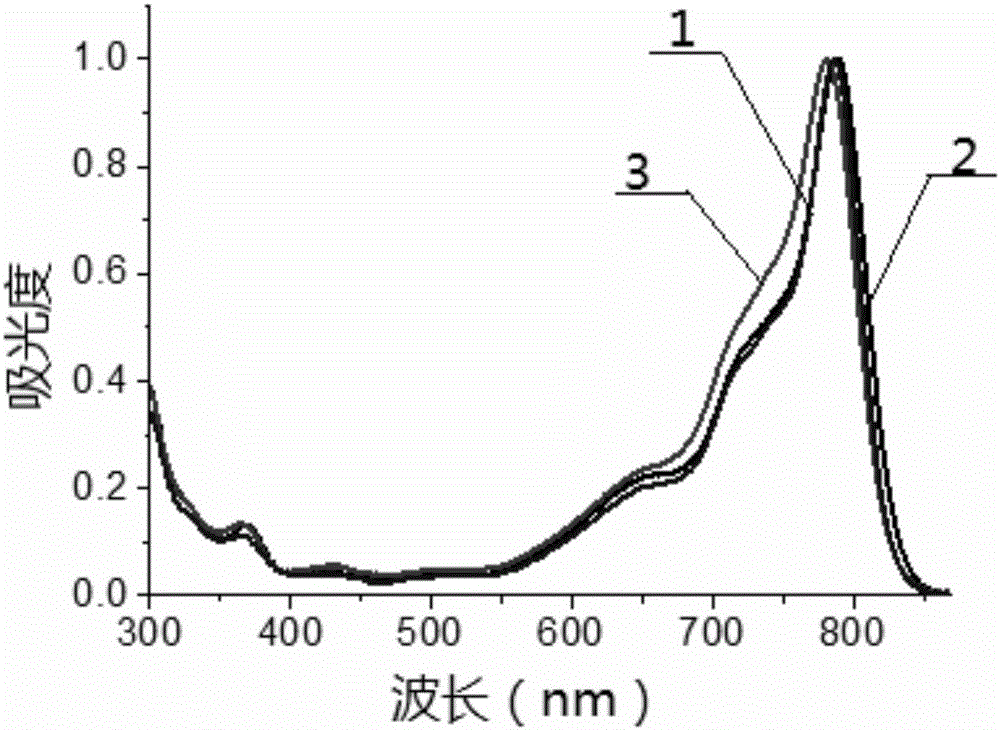
图1是实施例4制得的T4在不同溶剂中的紫外吸收光谱图;
图2是实施例5制得的T5在不同溶剂中的紫外吸收光谱图;
图3是实施例6制得的T6在不同溶剂中的紫外吸收光谱图。
附图标记说明
1-甲苯 2-三氯甲烷
3-四氢呋喃。
具体实施方式
以下对本发明的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不用于限制本发明。
本发明提供了一种β-菲并氮杂氟硼二吡咯染料,其中,所述β-菲并氮杂氟硼二吡咯染料的结构如式(I)所示:
其中,R1为C1-C6的烷氧基;R2和R4各自独立地选自C1-C6的烷氧基或C1-C6的烷基;R3和R5各自独立地选自氢或C1-C6的烷氧基。
本发明提供的如式(I)所示结构的β-菲并氮杂氟硼二吡咯染料在实际使用时具有较长的吸收波长和发射波长,且具有较窄的吸收峰和发射峰以及优异的摩尔吸光系数,进而使得其在光学传感器和光声造影成像中具有广泛的应用。
当然,在本发明的一种优选的实施方式中,为了使如式(I)所示结构的β-菲并氮杂氟硼二吡咯染料在实际使用时具有更长的吸收波长和发射波长,从而在光学传感器和光声造影成像中具有更为广泛的应用,R1为C1-C3的烷氧基;R2和R4各自独立地选自C1-C3的烷氧基或C4-C6的烷基;R3和R5各自独立地选自氢或C1-C3的烷氧基。
在本发明的一种更为优选的实施方式中,R1为甲氧基。
为了进一步提高制得的如式(I)所示结构的β-菲并氮杂氟硼二吡咯染料的使用性能,在一种优选的实施方式中,R2和R4各自独立地选自甲氧基或叔丁基。
进一步优选的实施方式中,R3和R5各自独立地选自氢或甲氧基。例如,根据上述实施方式,该β-菲并氮杂氟硼二吡咯染料的结构可以具体如下式(T1)-式(T6)所示,其中,MeO为甲氧基,tBu为异丁基。
当然,本发明并不局限于上述几种结构,只要符合上述所述的实施方式的结构的β-菲并氮杂氟硼二吡咯染料均为本发明的保护范围。
本发明还提供了一种如式(I)所示结构的β-菲并氮杂氟硼二吡咯染料的制备方法,其中,所述制备方法包括:
1)在钯存在的条件下,将如式(II)所示的化合物与芳基硼酸进行第一接触反应,制得混合物M1;
2)在三乙胺存在的条件下,将步骤1)中制得混合物M1与三氟化硼乙醚进行第二接触反应,制得混合物M2;
3)将混合物M2与氧化剂进行第三接触反应,制得如式(I)所示结构的β-菲并氮杂氟硼二吡咯染料;
其中,R1为C1-C6的烷氧基;R2和R4各自独立地选自C1-C6的烷氧基或C1-C6的烷基;R3和R5各自独立地选自氢或C1-C6的烷氧基;X为卤素。
当然,在步骤2)中制得的混合物M2含有如式(III)所示的化合物,式(III)为经过第二接触反应后制得的中间产物。
这里的钯存在的条件中钯可以以任意形式存在,例如,可以为离子形式存在,钯可以由任意含有钯的化合物提供,例如,可以由四三苯基磷钯提供。当然,本发明并不局限于此,在此不多作赘述。
当然,在本发明的一种优选的实施方式中,为了使如式(I)所示结构的β-菲并氮杂氟硼二吡咯染料在实际使用时具有更长的吸收波长和发射波长,从而在光学传感器和光声造影成像中具有更为广泛的应用,R1为C1-C3的烷氧基;R2和R4各自独立地选自C1-C3的烷氧基或C4-C6的烷基;R3和R5各自独立地选自氢或C1-C3的烷氧基;X为溴。
在本发明的一种更为优选的实施方式中,R1为甲氧基。
为了进一步提高制得的如式(I)所示结构的β-菲并氮杂氟硼二吡咯染料的使用性能,在一种优选的实施方式中,R2和R4各自独立地选自甲氧基或叔丁基。
进一步优选的实施方式中,R3和R5各自独立地选自氢或甲氧基。
各原料的用量可以根据实际需要进行调节,例如,在本发明的一种优选的实施方式中,为了使产品的转化率较高,进一步降低制备成本,相对于1mol所述如式(II)所示的化合物,所述芳基硼酸的用量为2-6mol,所述氧化剂的用量为10-40mol。
更为优选的实施方式中,相对于1mol所述如式(II)所示的化合物,所述芳基硼酸的用量为3-5mol,所述氧化剂的用量为15-30mol。
所述芳基硼酸可以为本领域常规使用的芳基硼酸类型,例如,在本发明的一种优选的实施方式中,所述芳基硼酸可以进一步选择为对叔丁基苯硼酸。
所述氧化剂可以为本领域常规使用的氧化剂类型,例如,在本发明的另一优选的实施方式中,所述氧化剂可以进一步选择为无水三氯化铁。
在本发明的一种更为优选的实施方式中,步骤1)中第一接触反应为置于甲苯中进行;
步骤3)中第三接触反应为置于无水二氯甲烷中进行。
第一接触反应、第二接触反应和第三接触反应的反应条件可以不作进一步限定,当然,在本发明的一种优选的实施方式中,为了使原料的转化率更高,步骤1)中第一接触反应的反应时间为12-24h,反应温度为85-90℃。
另一优选的实施方式中,步骤2)中第二接触反应的反应时间为0.5-2h,反应温度为50-60℃。
同样地,更为优选的实施方式中,步骤3)中第三接触反应的反应时间为0.5-2h,反应温度为20-25℃。
本发明还提供了一种根据上述所述的β-菲并氮杂氟硼二吡咯染料在光学传感器和光声造影成像中的应用。
以下将通过实施例对本发明进行详细描述。以下实施例中,四氢呋喃、三氟化硼乙醚、液溴和无水三氯化铁是上海凌峰化学试剂有限公司的产品,甲醇、三氯甲烷、三乙胺、二乙胺、硝基甲烷、二氯甲烷、甲苯和是国药集团化学试剂有限公司的产品,氢氧化钠、碳酸钠、醋酸铵是西陇化工股份有限公司的产品。制备原料所用的芳基醛酮是武汉长成化成试剂,四三苯基磷钯、芳基硼酸是苏凯路试剂。
核磁测定采用瑞士Bruker公司的AV-300型核磁共振仪进行;质谱的测定采用美国仪器集团的HPLC/ESI-MS型质谱仪进行;紫外光谱的测定采用日本岛津公司的UV-2450型紫外/可见分光光度计进行,荧光光谱的测定日本日立公司的F-4500FL荧光分光光度计进行,相对荧光量子产率的测定采用荧光光谱的测定日本日立公司的F-4500FL荧光分光光度计进行,单晶衍射的测定采用德国Bruker AXS公司的SMAR APEXⅡX-单晶衍射仪进行,其中λmax表示最大吸收波长、εabs表示摩尔消光系数,λemmax表示最大荧光发射波长,φF表示相对荧光量子产率,Stokes-shift表示Stokes位移;相对荧光量子产率(φF)的测定是以其中相对荧光量子产率φF的测定以荧光黄(φ=0.90,在氢氧化钠溶液中)为标准染料,根据公式计算所得,其中φS为标准物荧光黄的荧光量子产率,I为谱图积分面积,A为吸光度,n为溶剂的折光率,下角标S表示标准物,下角标X表示待测物。
制备例1
将9g氢氧化钾置于30g甲醇溶液中混合,制得氢氧化钾的甲醇溶液,将8g对甲氧基苯乙酮和8g对甲氧基苯甲醛加入上述氢氧化钾的甲醇溶液中反应30min,得到大量沉淀,经抽滤制得查尔酮;取上述制得的查尔酮14g,与6g硝基甲烷混合后,再加入7g二乙胺和50g甲醇混合后回流12h,制得混合物M1;将上述制得的混合物M1中溶剂减压蒸馏后,取固体混合物M2;向上述制得的固体混合物M2中加入50g甲醇和15g醋酸铵后回流12h,制得红色金属光泽粉末M3;将上述制得的粉末M3置于圆底烧瓶中,并向其中加入100g甲苯溶解后加热至60℃,再加入10g三乙胺和10g三氟化硼乙醚,反应30min后重结晶,制得产物M4,将上述制得的产物M4用100g二氯甲烷溶解后,再加入2g液溴,搅拌5min后,水洗,而后重结晶,制得化合物A1。制得的化合物A1的核磁氢谱和核磁碳谱参数如下所述:
1H NMR(300MHz,CDCl3):δ7.98(d,J=8.0Hz,4H),7.56(d,J=8.0Hz,4H),6.97(s,4H),3.94(s,6H),3.58(s,12H),1.39(s,18H).13C NMR(125MHz,CDCl3):δ153.9,153.0,152.4,147.7,140.5,138.3,128.9,128.6,127.1,125.8,108.4,107.0,60.8,55.9,35.1,31.2.
制备例2
按照制备例1的制备方法进行制备,不同的是,将对甲氧基苯乙酮替换为对叔丁基苯乙酮,将对甲氧基苯甲醛替换为3,4,5-三甲氧基苯甲醛,制得化合物A2。制得的化合物A2的核磁氢谱和核磁碳谱参数如下所述:1HNMR(300MHz,CDCl3)δ:8.07-8.03(m,8H),7.08-6.97(m,8H),6.92(s,2H),3.89(s,6H),3.88(m,6H).13C NMR(75MHz,CDCl3)δ:161.7,160.7,157.8,145.1,142.8,131.5,130.8,125.5,124.4,117.1,114.2,55.4.
制备例3
将200mg制备例1中制得的化合物A1和200mg对甲氧基苯硼酸加入20g甲苯作为溶剂,在10mg四三苯基磷钯存在的条件下,置于90℃的条件下搅拌12h,制得如式(a)所示的化合物。(产率为78%)
制备例4
按照制备例3的制备方法进行制备,不同的是,将对甲氧基苯硼酸换成3,5-二甲氧基苯硼酸,制得如式(b)所示的化合物。
制备例5
按照制备例3的制备方法进行制备,不同的是,将对甲氧基苯硼酸换成3,4,5-三甲氧基苯硼酸,制得如式(c)所示的化合物。
制备例6
按照制备例3的制备方法进行制备,不同的是,将对甲氧基苯硼酸换成对叔丁基苯硼酸,制得如式(d)所示的化合物。
制备例7
按照制备例3的制备方法进行制备,不同的是,将化合物A1换成制备例2中制得的化合物A2,将对甲氧基苯硼酸换成对叔丁基苯硼酸,制得如式(e)所示的化合物。
制备例8
按照制备例3的制备方法进行制备,不同的是,将化合物A1换成制备例2中制得的化合物A2,将对甲氧基苯硼酸换成3,4,5-三甲氧基苯硼酸,制得如式(f)所示的化合物。
实施例1
称取51mg制备例3中制得的如式(a)所示的化合物于50mL圆底烧瓶中,向其中加入5mL干燥的二氯甲烷搅拌溶解,制得混合物X1;将161mg无水三氯化铁与1mL无水硝基甲烷溶解,制得混合物X2;将上述制得的混合物X2慢慢滴加入上述制得的混合物X1中,继续搅拌2h后,加入饱和碳酸氢钠溶液后搅拌5min,制得混合物X3;将上述制得的混合物X3用二氯甲烷进行萃取,得到粗产物X4;将上述制得的粗产物X4用无水硫酸钠干燥后,减压蒸馏,而后再用硅胶柱层析制得如式(T1)所示的化合物(产率为42%)。如式(T1)所示的化合物的核磁氢谱参数如下所述:
1H NMR(300MHz,CDCl3)δ:9.44(d,J=12.00Hz,2H),8.07(d,J=9.0Hz,2H),7.87(s,2H),7.77(s,2H),7.56(d,J=9.0Hz,4H),7.37(d,J=9.0Hz,2H),6.98(d,J=9.0Hz,4H),6.90(d,J=6.0Hz,4H),4.08(s,6H),3.94(s,6H),3.93(s,6H).
实施例2
按照实施例1的制备方法进行制备,不同的是,将如式(a)所示的化合物用制备例4中制得的如式(b)所示的化合物代替,制得如式(T2)所示的化合物(产率为95%)。如式(T2)所示的化合物的核磁氢谱参数如下所述:
1H NMR(300MHz,CDCl3)δ:9.40(d,J=9.0Hz,2H),8.97(s,2H),7.53(d,J=6.0Hz,4H),7.25(s,2H),6.95(d,J=6.0Hz,4H),6.56(s,2H),4.02(s,12H),3.87(s,6H),3.47(s,6H).
实施例3
按照实施例1的制备方法进行制备,不同的是,将如式(a)所示的化合物用制备例5中制得的如式(c)所示的化合物代替,制得如式(T3)所示的化合物(产率为94%)。如式(T3)所示的化合物的核磁氢谱和核磁碳谱参数如下所述:
1H NMR(300MHz,CDCl3)δ9.41(s,2H),9.07(d,J=2.6Hz,2H),7.56(d,J=6.75Hz,4H),7.53(d,J=6.30Hz,2H),7.33(d,J=9.30Hz,2H),6.99(d,J=6.90Hz,4H),4.07(s,6H),4.00(s,6H),3.94(s,6H),3.90(s,6H),3.51(s,6H).13C NMR(75MHz,CDCl3)δ162.2,159.9,153.2,152.6,150.6,142.5,137.3,132.6,131.5,129.0,128.2,126.4,125.7,125.4,117.0,115.1,113.4,111.5,104.0,61.2,60.6,55.5,55.4,55.3.
实施例4
按照实施例1的制备方法进行制备,不同的是,将如式(a)所示的化合物用制备例6中制得的如式(d)所示的化合物代替,制得如式(T4)所示的化合物(产率为95%)。如式(T4)所示的化合物的核磁氢谱和核磁碳谱参数如下所述:
1H NMR(300MHz,CDCl3)δ9.50(d,J=9.0Hz,2H),8.32(s,2H),8.08(d,J=8.4Hz,2H),7.98(s,2H),7.56(d,J=8.7Hz,4H),7.36-7.33(m,4H),6.97(d,J=8.7Hz,4H),4.09(s,6H),3.92(s,6H),1.42(s,18H).13C NMR(75MHz,CDCl3)δ173.4,161.9,160.0,150.6,149.6,148.8,138.0,132.6,132.2,128.2,126.2,125.6,125.1,119.9,117.6,114.5,113.4,108.7,55.6,55.3,35.0,31.3.
实施例5
按照实施例1的制备方法进行制备,不同的是,将如式(a)所示的化合物用制备例7中制得的如式(e)所示的化合物代替,制得如式(T5)所示的化合物(产率为31%)。如式(T5)所示的化合物的核磁氢谱和核磁碳谱参数如下所述:
1H NMR(300MHz,CDCl3):δ9.43(d,J=8.7Hz,2H),8.54(s,2H),8.44(s,2H),8.07(d,J=8.4Hz,2H),7.84(d,J=8.1Hz,2H),7.37(d,J=7.8Hz,2H),6.78(s,4H),4.02(s,6H),3.64(s,12H),1.54(s,18H),1.44(s,18H).13C NMR(125MHz,CDCl3):δ154.9,152.7,151.6,150.2,149.1,138.5,138.4,135.8,129.9,129.1,128.4,127.4,126.1,125.5,125.3,124.9,121.2,120.1,119.8,108.6,61.0,56.1,35.6,35.1,31.3,31.1.
实施例6
按照实施例1的制备方法进行制备,不同的是,将如式(a)所示的化合物用制备例8中制得的如式(f)所示的化合物代替,制得如式(T6)所示的化合物(产率为33%)。如式(T6)所示的化合物的核磁氢谱和核磁碳谱参数如下所述:
1H NMR(300MHz,CDCl3):δ9.54(s,2H),9.38(d,J=9.0Hz,2H),7.79(d,J=9.0Hz,2H),7.41(s,2H),6.76(s,4H),3.99(s,6H),3.94(s,6H),3.91(s,6H),3.67(s,12H),3.49(s,6H),1.51(s,18H).13C NMR(125MHz,CDCl3)δ155.4,153.3,152.9,152.5,151.7,149.2,143.0,138.4,137.9,135.5,129.5,128.8,127.8,125.1,125.0,124.6,120.6,117.9,108.4,104.3,61.3,60.9,60.6,56.2,55.2,35.8,31.2.
测试例
将上述实施例4-6中制得的T4-T6分别检测其在甲苯、三氯甲烷和四氢呋喃中的光谱性质,T4得到的结果如表1所示,其紫外吸收光谱图如图1所示,T5得到的结果如表2所示,其紫外吸收光谱图如图2所示,T6得到的结果如表3所示,其紫外吸收光谱图如图3所示。
表1
表2
表3
以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
此外,本发明的各种不同的实施方式之间也可以进行任意组合,只要其不违背本发明的思想,其同样应当视为本发明所公开的内容。
- 还没有人留言评论。精彩留言会获得点赞!