一种建立农杆菌介导观音莲高效转染体系的方法与流程
本发明属于农杆菌介导植物转染体系技术领域,尤其涉及一种建立农杆菌介导观音莲高效转染体系的方法。
背景技术:
观音莲(Sempervivum tectorum),景天科长生草属多肉植物,也叫做长生草、观音座莲、佛座莲。原产于西班牙、法国、意大利等欧洲国家的山区,属于高山多肉植物。是一种以观叶为主的小型多肉植物,也是销量比较大的多肉植物之一,中国各地都很普及。是多肉植物中最常见的品种之一堪称普货之王。观音莲肉如其名,叶片莲座状环生,其株形端庄,犹如一朵盛开的莲花。叶片扁平细长,叶端渐尖,叶缘有小绒毛,充分光照下,叶端形成非常漂亮咖啡色或紫红色;若光照不充足,则叶端只为深绿色。其品种很多,叶盘直径从3-15厘米都有,发育良好的植株在大莲座下面会着生一圈小莲座,此外每年的春末还会从叶丛下部抽出类似吊兰的红色走茎,走茎前端长有莲座状小叶丛。长生草的小花呈星状,粉红色。观音莲叶色富于变化,紫红色的叶尖极为别致,适合做中小型盆栽或组合盆栽,用不同造型的花盆栽种,其观赏效果也相差很大,用卡通型的花盆栽种,活泼可爱,深受孩子们的欢迎;用紫砂盆或青花瓷器盆种植,端庄大方,颇受中老年人的青睐;而栽于木质的小花盆,时尚自然,很受年轻人的喜爱。
农杆菌介导的植物基因转化系统目前广泛应用于植物基因工程研究。根癌农杆菌中含Ti质粒,该质粒的部分DNA片段可整合到宿主细胞中,从而整合到植物的基因组中,农杆菌介导的转染方法同其他方法相比具有以下优点:转化效率高,转化效果好,可转移大片段DNA;转移的外援基因成为单拷贝;遗传稳定,并且多数符合孟德尔遗传定律;价格低廉。
目前在观音莲生产中还没有使用农杆菌进行转化的报道,使用农杆菌介导观音莲转化,可以使观音莲快速获得目的性状,而且可以突破观音莲自身遗传屏障,获得难以通过传统育种方式生产的新品种。
技术实现要素:
针对现有技术的不足,本发明提供一种建立农杆菌介导观音莲高效转染体系的方法,本发明使用农杆菌介导观音莲转化,打通观音莲农杆菌介导高效转染体系,这是通过农杆菌转染体系培育新型观音莲最为重要的一步。建立观音莲农杆菌介导高效转染体系意味着能够突破观音莲自身遗传屏障,获得难以通过传统育种方式生产的新品种。
本发明的技术方案如下:一种建立农杆菌介导观音莲高效转染体系的方法,所述方法包括以下步骤:
侵染和共培养阶段:将观音莲无菌苗叶片切成小块放入三角瓶中,加入菌液,瓶口密封,真空条件下侵染,侵染后倒去菌液,将叶片晾干,转接到共培养培养基中进行共培养;
所述侵染条件如下:真空度为0.2~1.0Kpa,侵染时间为12~48h;所述共培养条件如下:所述共培养为暗培养,培养温度为20~28℃,培养时间为3~7天。
所述共培养培养基为:SH基础配方+2,4-D 0.20~0.30mg·L-1+NAA1.0~5.0mg·L-1+6-BA1.0~5.0mg·L-1+KT 0.1~1.0mg·L-1+GA3 0.1~1.0mg·L-1+蔗糖10~30g·L-1+葡萄糖5~15g·L-1+琼脂5.0~10.0g·L-1+AS 100~200μmol·L-1,pH5.2~6.0,118~125℃灭菌20~30min;
SH基础配方:硝酸钾2~5.0g·L-1,硫酸镁0.1~0.4g·L-1,磷酸二氢铵0.3~0.6g·L-1,氯化钙150~300mg·L-1,甘氨酸2~4mg·L-1,肌醇100~200mg·L-1,盐酸硫胺素0.4~0.8mg·L-1,盐酸吡哆素0.5~1.0mg·L-1,烟酸0.5~1.0mg·L-1,乙二胺四乙酸铁纳10~40mg·L-1,六水氯化钴0.1~0.2mg·L-1,五水硫酸铜0.2~0.4mg·L-1,硼酸5~10mg·L-1,碘化钾1~2mg·L-1,一水硫酸锰10~20mg·L-1,二水钼酸钠0.1~0.2mg·L-1,七水硫酸锌1~2mg·L-1。
筛选阶段:将共培养获得的愈伤组织转接到筛选培养基中进行两次筛选培养得到幼芽;
进一步地,共培养获得的愈伤组织在延迟筛选培养基中进行延迟筛选培养,培养10~15天后,更换筛选培基进行筛选培养,培养20~30天得到幼芽;
所述延迟筛选培养基成分如下:SH基础配方+2.4-D 0.2~0.3mg·L-1+NAA1.0~5.0mg·L-1+6-BA 1.0~5.0mg·L-1+KT 0.1~1.0mg·L-1+GA3 0.1~1.0mg·L-1+蔗糖10~50g·L-1+琼脂5~10g·L-1+cef 100~500mg·L-1+carb 100~500mg·L-1,pH5.2~6.0,118~125℃高压灭菌20~30min;
筛选培养基成分如下:SH基础配方+2,4-D 0.2~3.0mg·L-1+NAA 1.0~5.0mg·L-1+6-BA 1.0~5.0mg·L-1+KT 0.1~1.0mg·L-1+GA3 0.1~1.0mg·L-1+蔗糖10~50g·L-1+琼脂5~10g·L-1+cef 100~500mg·L-1+carb 100~500mg·L-1+Hyg 5~20mg·L-1,pH 5.2~6.0,118~125℃高压灭菌20~30min;
所述延迟筛选培养与筛选培养条件如下:22~28℃光照培养,每天光照12~16h,光照强度1500~2500lx。
抗性苗培养阶段:将获得的幼芽转接到抗性苗培养基培养得到抗性苗;
进一步地,幼芽在抗性苗培养基中培养20~25天后更换一次抗性苗培养基加速抗性苗生长;
所述抗性苗培养基成分如下:SH基础配方+蔗糖10~50g·L-1+琼脂5~10g·L-1+cef 100~500mg·L-1+carb 100~500mg·L-1,pH 5.2~6.0,118~125℃高压灭菌20~30min。
抗性苗培养条件如下:22~28℃光照培养7~8周,光照强度为1500~2500lx,光照时间为12~16h/天。
阳性苗检测阶段:取获得的抗性苗的叶片,提取DNA,进行PCR扩增,将PCR产物进行凝胶电泳,得到农杆菌成功侵染观音莲的阳性苗,建立农杆菌介导观音莲高效转染体系。
无菌苗获得阶段将观音莲腋芽消毒灭菌后将叶片撕下切为两段接种于诱导直接分化培养基中培养获得愈伤组织,更换一次诱导直接分化培养基培养获得小芽,将小芽移至基础培养基获得无菌苗;
所述观音莲腋芽消毒杀菌过程如下:剪取大棚种植的观音莲植株上的腋芽,使用无菌水冲洗5~12次,75%酒精浸泡1~3min,无菌水洗5~12次,在0.1~0.5%升汞中浸泡5~15min,无菌水洗5~15次,无菌滤纸上晾干;
进一步地,可以根据需要进行扩繁,无菌苗扩繁阶段:将无菌苗获得阶段萌发长到3~5cm的无菌苗的叶片切为两段接种到诱导直接分化培养基培养获得愈伤组织后更换一次诱导直接分化培养基培养获得小芽,将小芽移至基础培养基扩繁得到无菌苗;
所述诱导直接分化培养基的成分如下:SH基础配方+2,4-D 0.10~1mg·L-1+NAA 0.5~5.0mg·L-1+6-BA 0.5~5.0mg·L-1+KT 0.1~1.0mg·L-1+GA3 0.1~1.0mg·L-1+蔗糖10.0~50.0g·L-1+琼脂5.0~10.0g·L-1,pH 5.2~6.0,118~125℃高压灭菌20~30min。
所述基础培养基为MS基础培养基,具体成分如下:硝酸钾1.0~5.0g·L-1,硝酸铵2.5~5.0g·L-1,硫酸镁0.195~0.4g·L-1,磷酸二氢钾0.1~0.3g·L-1,氯化钙150~500mg·L-1,甘氨酸2~4mg·L-1,肌醇100~200mg·L-1,盐酸硫胺素0.1~0.4mg·L-1,盐酸吡哆素0.5~1.0mg·L-1,烟酸0.5~1.0mg·L-1,乙二胺四乙酸纳19.8~40mg·L-1,七水硫酸亚铁27.8~40mg·L-1,六水氯化钴0.025~0.1mg·L-1,五水硫酸铜0.025~0.1mg·L-1,硼酸5~10mg·L-1,碘化钾0.5~2mg·L-1,四水硫酸锰22.3~30mg·L-1,二水钼酸钠0.25~0.3mg·L-1,七水硫酸锌8~10mg·L-1。
所述无菌苗获得阶段培养条件为:22~28℃光照培养,每天光照12~16h,光照强度1500~2500lx,培养25~30天获得愈伤组织,更换培养基后培养25~30天获得小芽;
农杆菌菌液制备:将农杆菌加入到添加有40~65mg/L卡那霉素和40~70mg/L利福平的YM培养基中,2000~4000r/min,4~8℃离心10~20min,弃上清,下层加入重悬液使OD值达到0.4~0.8,最后向菌液中加入AS,终浓度为100~200μmol·L-1,混匀备用;
所述YM培养基成分如下:蛋白胨5-20g/L,酵母提取物5-10g/L,氯化钠5-20g/L,农杆菌在YM培养基中培养条件如下:26~32℃培养12~24h;
所述重悬液成分如下为:SH基础配方+琼脂5.8~8g·L-1+蔗糖30~60g·L-1,pH5.2~5.8,118~125℃高温灭菌20~30min。
农杆菌植物转化虽然比较常见,但一般都针对水稻等谷物植物;由于观音莲的基因屏障作用较强,农杆菌很难侵染到观音莲基因中,因此其他植物的农杆菌转化方法对观音莲的借鉴意义很小。
以观音莲为模型的研究平台,建立观音莲的组织培养体系以及转基因体系的重点在于共培养、筛选和抗性苗培养等过程。而共培养基、筛选培养基、以及抗性苗培养基中加入的激素种类及组合、激素添加量以及培养时间,都有不可预知、不可控的结果。根据研究,发现在本发明提供的侵染条件下容易打破其基因屏障,农杆菌能够成功介导观音莲,且本发明采用的激素配方以及培养时间比较适合侵染后的观音莲共培养、筛选等,愈伤组织形成频率较高。
本发明通过对共培养、筛选和抗性苗培养步骤的不断探索,摸索出最佳培养条件,成功打通观音莲农杆菌介导高效转染体系,可以满足观音莲育种需求,适合大规模工业生产和商业育种。
与现有技术相比,本发明具有以下有益效果:本发明中建立了高效的农杆菌介导观音莲转化的方法,可以满足观音莲育种需求,适合大规模工业生产和商业育种。
附图说明
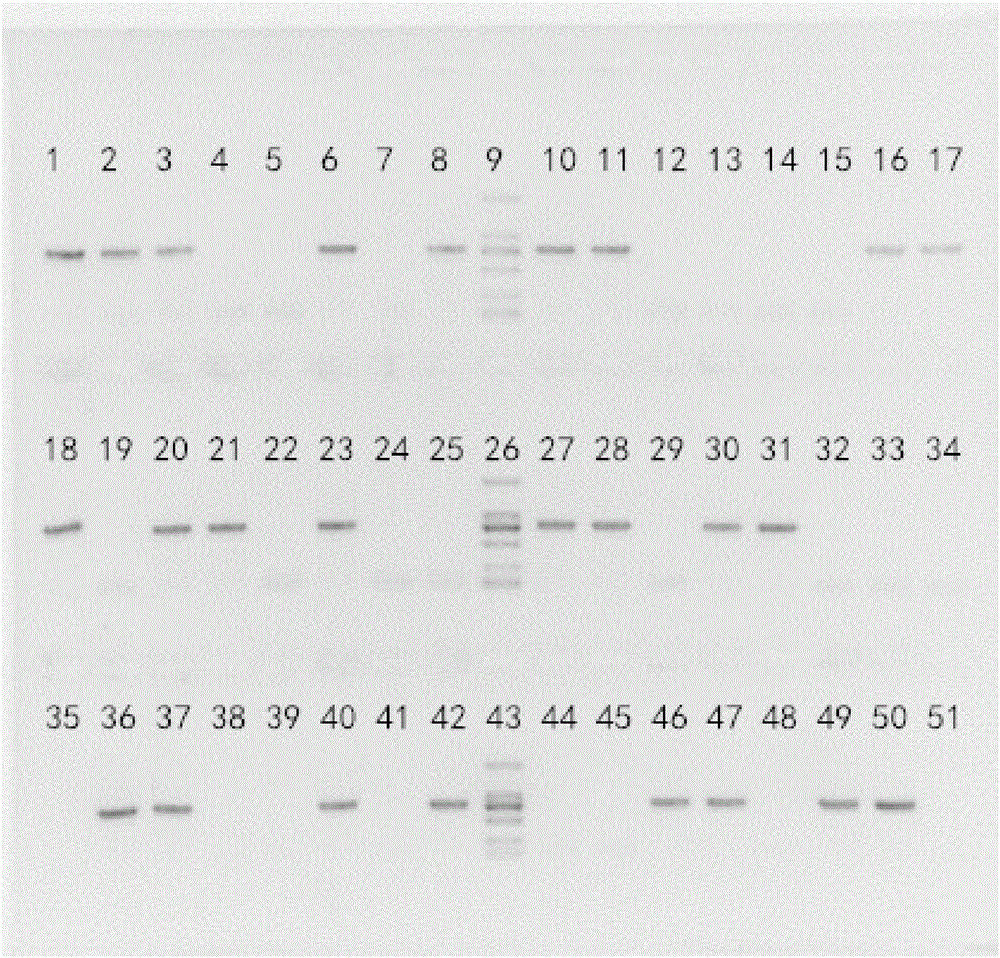
图1为实施例1观音莲潮霉素转化阳性苗PCR扩增后的凝胶电泳图;
图2为实施例2观音莲潮霉素转化阳性苗PCR扩增后的凝胶电泳图。
具体实施方式
下面结合具体实施例对本发明的技术方案做进一步详细说明。
中英文对照
SH:SH培养基;
MS:MS培养基;
6-BA:6-苄氨基腺嘌呤;
NAA:a-萘乙酸
AS:乙酰丁香酮;
Hyg:潮霉素;
Cef:头孢霉素;
Carb:羧苄青霉素;
2,4-D:2,4-二氯苯氧乙酸;
GA3:赤霉素
KT:激动素(6-糖基氨基嘌呤)
实施例1:观音莲诱导愈伤及农杆菌介导高效转染
步骤1获得无菌苗阶段:将观音莲腋芽置于无菌水中冲洗6次,倒去无菌水,加入75%乙醇,摇晃60s,倒出乙醇,无菌水清洗6次,倒出无菌水,加入0.1%升汞,浸泡6min,倒出升汞并回收,无菌水清洗腋芽6次,把腋芽放在滤纸上吹干。将观音莲腋芽叶片撕下切为两段接种于诱导直接分化培养基中培养获得愈伤组织,更换一次诱导直接分化培养基培养获得小芽,将小芽移至基础培养基获得无菌苗;培养条件为:22~26℃光照培养,每天光照12h,光照强度1500~2000lx,培养时间为培养30天获得愈伤组织,更换培养基后培养25天获得小芽。
所述诱导直接分化培养基的成分如下SH基础配方+2.4-D 0.25mg·L-1+NAA2.0mg·L-1+6-BA 2.0mg·L-1+KT 0.5mg·L-1+GA3 0.5mg·L-1+蔗糖30g·L-1+琼脂8g·L-1,pH 5.8,118℃高压灭菌20min;
SH基础配方:硝酸钾2g·L-1,硫酸镁0.1·L-1,磷酸二氢铵0.3g·L-1,氯化钙150mg·L-1,甘氨酸2mg·L-1,肌醇100mg·L-1,盐酸硫胺素0.4mg·L-1,盐酸吡哆素0.5mg·L-1,烟酸0.5mg·L-1,乙二胺四乙酸铁纳10mg·L-1,六水氯化钴0.1mg·L-1,五水硫酸铜0.2mg·L-1,硼酸5mg·L-1,碘化钾1mg·L-1,一水硫酸锰10mg·L-1,二水钼酸钠0.1mg·L-1,七水硫酸锌1mg·L-1;以下步骤也采用该配方。
所述基础培养基为MS基础培养基,具体成分如下:硝酸钾1.9g·L-1,硝酸铵1.65g·L-1,硫酸镁0.37g·L-1,磷酸二氢钾0.17g·L-1,氯化钙440mg·L-1,甘氨酸2mg·L-1,肌醇100mg·L-1,盐酸硫胺素0.4mg·L-1,盐酸吡哆素0.5mg·L-1,烟酸0.5mg·L-1,乙二胺四乙酸纳37.25mg·L-1,七水硫酸亚铁27.85mg·L-1,六水氯化钴0.025mg·L-1,五水硫酸铜0.025mg·L-1,硼酸6.2mg·L-1,碘化钾0.83mg·L-1,四水硫酸锰22.3mg·L-1,二水钼酸钠0.25mg·L-1,七水硫酸锌8.6mg·L-1;以下步骤也采用该配方。
步骤2无菌苗扩繁阶段:将步骤(1)中萌发长到3~5cm的无菌苗的叶片切为两段接种到诱导分化培养基培养获得愈伤组织后更换一次诱导直接分化培养基培养获得小芽,将小芽移至基础培养基获得无菌苗;
所述诱导直接分化培养基的成分如下:SH基础配方+2.4-D 0.25mg·L-1+NAA 2.0mg·L-1+6-BA 2.0mg·L-1+KT 0.5mg·L-1+GA3 0.5mg·L-1+蔗糖30g·L-1+琼脂8g·L-1,pH 5.8,118℃高压灭菌20min;
所述基础培养基为MS基础培养基,成分同步骤1。
步骤3农杆菌准备阶段:将导入植物双元载体PCAMBIA1300的农杆菌加入到添加有40mg/L卡那霉素和40mg/L利福平的抗生素的YM培养基中,摇床培养的转速100r/min,28℃培养12h,之后把菌液放入离心机,2000r/min,4℃离心10min,倒掉上清液,加入重悬液使OD值达到0.4;重悬液为SH基础配方+蔗糖30g·L-1,pH5.2,120℃高温灭菌20min。最后向菌液中加入100μmol·L-1AS,混匀备用;
YM培养基成分:蛋白胨5g/L,酵母提取物5g/L,氯化钠5g/L。
所述重悬液成分如下为:SH基础配方+琼脂5.8~8g·L-1+蔗糖30~60g·L-1,pH5.2~5.8,118~125℃高温灭菌20~30min。
步骤4侵染和共培养阶段:将步骤2中获得的无菌苗叶片切成5mm2左右的叶片块,放入100mL三角瓶中约600~800块叶片块,向三角瓶中倒入适量步骤3获得的菌液,套上封口膜并用橡筋勒紧,抽真空到0.5kPa,保持1.5h,倒去菌液,将叶片晾干,转接到共培养培养基(SH基础配方(同步骤1)+2,4-D 0.2mg·L-1+NAA 2.0mg·L-1+6-BA 2mg·L-1+KT 0.5mg·L-1+GA3 0.5mg·L-1+蔗糖15g·L-1+葡萄糖10g·L-1+琼脂5.8g·L-1+AS 100μmol·L-1,pH 5.2,118℃灭菌25min,22~26℃暗培养。
步骤5筛选阶段:在共培养基中暗培养3天后,将步骤4中获得的愈伤组织转接到延迟筛选培养基(SH基础配方(同步骤1)+2.4-D 0.25mg·L-1+NAA2.0mg·L-1+6-BA 2.0mg·L-1+KT 0.5mg·L-1+GA3 0.5mg·L-1+蔗糖30g·L-1+琼脂8g·L-1+cef 250mg·L-1+carb 250mg·L-1,pH 5.8,120℃高压灭菌20min),22~26℃光照培养,每天光照12h,光照强度1500~2000lx。延迟筛选培养10天后,更换筛选培养基(SH+2.4-D 0.25mg·L-1+NAA 2.0mg·L-1+6-BA 2.0mg·L-1+KT 0.5mg·L-1+GA3 0.5mg·L-1+蔗糖30g·L-1+琼脂8g·L-1+cef 250mg·L-1+carb 250mg·L-1+Hyg 5mg·L-1,pH 5.8,120℃高压灭菌20min),筛选培养条件如下:22~26℃光照培养,每天光照12h,光照强度1500~2000lx;
步骤6生根阶段:将步骤(5)获得的幼芽转接到抗性苗培养基培养20天得到抗性苗,更换一次抗性苗培养基加速抗性苗生长;培养条件为22~25℃光照培养8周,光照强度为1800~2000lx,光照时间为12h/天。
所述抗性苗培养基成分如下:SH基础配方+蔗糖30g·L-1+琼脂8g·L-1+cef250mg·L-1+carb 250mg·L-1,pH 5.8,120℃高压灭菌20min。
步骤7阳性检测阶段:在抗性苗培养基培养约7周后,将步骤6获得的抗性苗取叶片,提取DNA,进行PCR扩增,将PCR产物进行凝胶电泳,确定是否存在阳性条带,确定阳性苗。
PCR扩增条件:
其中2c-3c-4c循环30次。
电泳条件:电压100v,电流100mA
本发明检测的抗性植株对于潮霉素具有一定的抗性,证明导入的潮霉素抗性基因已经表达。
凝胶电泳图参考图1,9号,26号,43号泳道为标记DNA(DL2000marker);51号泳道是阴性对照,50号泳道是潮霉素基因PCR阳性对照;1号,2号,3号,5号,6号,10号,11号,12号,13号,14号,15号,16号,20号,21号,22号,23号,24号,25号,27号,28号,30号,32号,33号,34号,35号,36号,37号,39号,40号,41号,42号,45号,46号,47号,48号,49号,共计36个泳道获得与阳性对照相同的电泳条带,证明为阳性植株。
实施例1中愈伤组织形成频率为70%,愈伤组织分化率在89.7%,转化效率高达14.3%,如表1、表2和表3所示。
表1
表2
表3
实施例2:观音莲诱导愈伤及农杆菌介导高效转染
步骤1获得无菌苗阶段:将观音莲腋芽置于无菌水中冲洗10次,倒去无菌水,加入75%乙醇,摇晃300s,倒出乙醇,无菌水清洗10次,倒出无菌水,加入0.5%升汞,浸泡15min,倒出升汞并回收,无菌水清洗腋芽10次,把腋芽放在滤纸上吹干。将观音莲腋芽叶片撕下切为两段接种于诱导直接分化培养基中培养获得愈伤组织,更换一次诱导直接分化培养基培养获得小芽,将小芽移至基础培养基获得无菌苗;培养条件为:26~28℃光照培养,每天光照15h,光照强度2000~2500lx,培养时间为培养30天获得愈伤组织,更换培养基后培养25~30天获得小芽。
所述诱导直接分化培养基的成分如下SH基础配方+2.4-D 0.3mg·L-1+NAA2.5mg·L-1+6-BA2.5mg·L-1+KT 1mg·L-1+GA3 1mg·L-1+蔗糖50g·L-1+琼脂5.8g·L-1,pH 5.2,120℃高压灭菌25min;
SH基础配方:硝酸钾4.0g·L-1,硫酸镁0.3g·L-1,磷酸二氢铵0.5g·L-1,氯化钙250mg·L-1,甘氨酸4mg·L-1,肌醇180mg·L-1,盐酸硫胺素0.75mg·L-1,盐酸吡哆素1.0mg·L-1,烟酸1.0mg·L-1,乙二胺四乙酸铁纳35mg·L-1,六水氯化钴0.2mg·L-1,五水硫酸铜0.4mg·L-1,硼酸10mg·L-1,碘化钾2mg·L-1,一水硫酸锰18mg·L-1,二水钼酸钠0.2mg·L-1,七水硫酸锌2mg·L-1;以下步骤也采用该配方。
所述基础培养基为MS培养基,具体成分如下:硝酸钾2.5g·L-1,硝酸铵3.5g·L-1,硫酸镁0.195g·L-1,磷酸二氢钾0.25g·L-1,氯化钙500mg·L-1,甘氨酸3.0mg·L-1,肌醇150mg·L-1,盐酸硫胺素0.3mg·L-1,盐酸吡哆素1.0mg·L-1,烟酸1.0mg·L-1,乙二胺四乙酸纳40.0mg·L-1,七水硫酸亚铁30.0mg·L-1,六水氯化钴0.05mg·L-1,五水硫酸铜0.05mg·L-1,硼酸7.0mg·L-1,碘化钾1.0mg·L-1,四水硫酸锰23mg·L-1,二水钼酸钠0.3mg·L-1,七水硫酸锌9mg·L-1;以下步骤也采用该配方。
步骤2无菌苗扩繁阶段:将步骤(1)中萌发长到3~5cm的无菌苗的叶片切为两段接种到诱导分化培养基培养获得愈伤组织后更换一次诱导直接分化培养基培养获得小芽,将小芽移至基础培养基获得无菌苗;
所述诱导直接分化培养基的成分如下SH基础配方+2.4-D 0.5mg·L-1+NAA3.0mg·L-1+6-BA3.0mg·L-1+KT 1.0mg·L-1+GA3 1.0mg·L-1+蔗糖50g·L-1+琼脂5.8g·L-1,pH 5.8,118℃高压灭菌20min;
所述基础培养基为MS培养基,成分同步骤1。
步骤3农杆菌准备阶段:将导入植物双元载体PCAMBIA1300的农杆菌加入到添加有60mg/L卡那霉素和65mg/L利福平的抗生素的YM培养基中培养,摇床培养的转速200r/min,28℃培养过夜,之后把菌液放入离心机,4000r/min,4℃离心15min,倒掉上清液,加入重悬液使OD值达到0.75;重悬液为SH基础配方+蔗糖50g·L-1,pH5.6,125℃高温灭菌30min。最后向菌液中加入200μmol·L-1AS,混匀备用;
YM培养基成分:蛋白胨15g/L,酵母提取物10g/L,氯化钠20g/L;
步骤4侵染和共培养阶段:在基础培养基中培养70天后,将步骤2中获得的无菌苗切成7mm2左右的叶片块,放入100mL三角瓶中约400块叶片块,向三角瓶中倒入适量步骤3获得的菌液,套上封口膜并用橡筋勒紧,抽真空到0.8kPa,保持2h,倒去菌液,将叶片晾干,转接到共培养培养基(SH基础配方(同步骤1)+2,4-D 0.3mg·L-1+NAA3.0mg·L-1+6-BA3mg·L-1+KT 1mg·L-1+GA31mg·L-1+蔗糖30g·L-1+葡萄糖15g·L-1+琼脂8g·L-1+AS 200μmol·L-1,pH 5.8,120℃灭菌25min,26~28℃暗培养。
步骤5筛选阶段:在共培养基中暗培养3天后,将步骤4中获得的愈伤组织转接到延迟筛选培养基(SH基础配方(同步骤1)+2.4-D 0.3mg·L-1+NAA3.0mg·L-1+6-BA3.0mg·L-1+KT 1.0mg·L-1+GA3 1.0mg·L-1+蔗糖50g·L-1+琼脂5.8g·L-1+cef 300mg·L-1+carb 300mg·L-1,pH 5.2,125℃高压灭菌25min),26~28℃光照培养,每天光照15h,光照强度2000~2500lx。延迟筛选培养15天后,更换筛选培养基(SH基础配方(同步骤1)+2.4-D 0.3mg·L-1+NAA3.0mg·L-1+6-BA3.0mg·L-1+KT 1.0mg·L-1+GA3 1.0mg·L-1+蔗糖50g·L-1+琼脂5.8g·L-1+cef 300mg·L-1+carb 300mg·L-1+Hyg 10mg·L-1,pH 5.2,125℃高压灭菌25min),筛选培养条件如下:26~28℃光照培养,每天光照15h,光照强度2000~2500lx;
步骤6生根阶段:将步骤(5)获得的幼芽转接到抗性苗培养基培养25天得到抗性苗,更换一次抗性苗培养基加速抗性苗生长;培养条件为26~28℃光照培养7周,光照强度为2000~2500lx,光照时间为15h/天。
所述抗性苗培养基成分如下:SH基础配方+蔗糖50g·L-1+琼脂5.8g·L-1+cef300mg·L-1+carb 300mg·L-1,pH 5.2,125℃高压灭菌25min。
步骤7阳性检测阶段:在抗性苗培养基培养约8周后,将步骤6获得的抗性苗取叶片,提取DNA,进行PCR扩增,将PCR产物进行凝胶电泳,确定是否存在阳性条带,确定阳性苗。
PCR扩增条件:
其中2c-3c-4c循环30次。
电泳条件:电压100v,电流100mA
本发明检测的抗性植株对于潮霉素具有一定的抗性,证明导入的潮霉素抗性基因已经表达。
凝胶电泳图参考图2,9号,26号,43号泳道为DL2000marker;50号泳道为阳性对照;51号泳道为阴性对照;1号,2号,3号,6号,8号,10号,11号,16号,17号,18号,20号,21号,23号,27号,28号,30号,31号,36号,37号,40号,42号,46号,47号,49号泳道为阳性,共计24个泳道获得与阳性对照相同的电泳条带,证明为阳性植株。
实施例2中愈伤组织形成频率为73%,愈伤组织分化率在91.2%,转化效率高达13.5%,如表4、表5和表6所示。
表4
表5
表6
筛选之后分化所得的阳性苗经过如上验证,证实了本发明中通过农杆菌遗传介导的方法能将外源基因引入观音莲基因组。因此,采用此方法进行观音莲的诱导愈伤及农杆菌介导的高效转染,可以使观音莲快速获得目的性状,而且可以突破观音莲自身遗传屏障,获得难以通过传统育种方式生产的新品种。
实施例3
分别改变侵染条件、共培养条件,具体结果如表7、表8所示。
表7
由表7可知:本发明提供的侵染条件和共培养条件容易打破观音莲基因屏障,农杆菌成功介导豆瓣绿转化体系,且转化率相对较高。
分别改变农杆菌重悬液条件、筛选条件,具体结果如表8所示。
表8
由表8可知:本发明提供的农杆菌重悬液条件和筛选条件容易比较好,且转化率相对较高。
- 还没有人留言评论。精彩留言会获得点赞!