一种新型天然蛋白及其应用的制作方法
本发明涉及一种新型天然蛋白及其应用,该蛋白可用于预防和治疗因毒性蛋白积累导致的疾病。
背景技术:
在正常的生理活动中,机体产生大量垃圾蛋白,其中包括氧化蛋白、糖基化蛋白和一些异常剪切蛋白(多肽)等。机体保留多种清除垃圾蛋白的机制以维持正常的生理功能。垃圾蛋白在细胞内或细胞外异常积累是导致一系列疾病的关键机制,典型疾病包括老年痴呆症、亨廷顿氏症等[1-4]。
老年痴呆症又称阿尔茨海默病(alzheimer’sdiease,ad),是一种神经退行性疾病,病理学特征之一是神经组织中β-淀粉样蛋白(aβ)沉积导致的斑块。β淀粉样蛋白假说认为aβ蛋白在组织中产生和清除失衡导致的毒性蛋白进行性堆积,由此引起的突触功能紊乱、神经元死亡是导致疾病的关键机制[5]。基于aβ的致病机制,科学家希望通过药物抑制aβ蛋白的聚集,从而达到预防或治疗疾病的目的[6][7]。在动物ad模型取得的进展表明,通过抗体[8]、多肽药物[9]或小分子药物[10]可以阻断aβ聚集,减少神经组织斑块形成,提高动物认知水平。因此,通过药物抑制并清除aβ病理性沉积成为治疗ad的可行办法。
前期的研究表明,当细胞内发生氧化应激时,dss1(deletedsplithand/splitfoot1),一种在真核生物中高度保守的小蛋白,能够在酶的介导下,被共价修饰到氧化蛋白上,这种修饰介导氧化蛋白在细胞内的降解[11]。高表达dss1蛋白的细胞对氧化应激或抗肿瘤药物诱导的细胞凋亡表现显著的抗性[12]。这些结果显示dss1蛋白在生物活动中的重要作用。
上述中涉及的参考文献如下:
1.dobsoncm(1999)proteinmisfolding,evolutionanddisease.trendsbiochemsci24:329–332.
2.marzbanl1,rhodescj,steinerdf,haatajal,halbanpa,vercherecb(2006)impairednh2-terminalprocessingofhumanproisletamyloidpolypeptidebytheprohormoneconvertasepc2leadstoamyloidformationandcelldeath.diabetes55(8):2192-201.
3.sadigh-eteghads,sabermaroufb,majdia,talebim,farhoudim,mahmoudij(2015)amyloid-beta:acrucialfactorinalzheimer'sdisease.medprincpract24(1):1-10.
4.choeyj,parksh,hassemert,
5.zhaoln,longh,muy,chewly(2012)thetoxicityofamyloidβoligomers.intjmolsci13(6):7303-27.
6.guptaa,iadecolac(2015)impairedaβclearance:apotentiallinkbetweenatherosclerosisandalzheimer'sdisease.frontagingneurosci7:115.
7.fernándezms(2014)humaniappamyloidogenicpropertiesandpancreaticβ-celldeath.cellcalcium56(5):416-27.
8.winbladb,andreasenn,minthonl,floessera,imbertg,dumortiert,maguirerp,blennowk,lundmarkj,staufenbielm,orgogozojm,grafa(2012)safety,tolerability,andantibodyresponseofactiveaβimmunotherapywithcad106inpatientswithalzheimer'sdisease:randomised,double-blind,placebo-controlled,first-in-humanstudy.lancetneurol11(7):597-604.
9.changl,cuiw,yangy,xus,zhouw,fuh,hus,maks,huj,wangq,mavp,choitc,maed,taol,pangy,rowanmj,anwylr,hany,wangq(2015)protectionagainstβ-amyloid-inducedsynapticandmemoryimpairmentsviaalteringβ-amyloidassemblybybis(heptyl)-cognitin.scirep5:10256.
10.kimhy,kimhv,jos,leecj,choisy,kimdj,kimy(2015)eppsrescueshippocampus-dependentcognitivedeficitsinapp/ps1micebydisaggregationofamyloid-βoligomersandplaques.natcommun6:8997.
11.zhangy,changfm,huangj,juncojj,maffisk,pridgenhi,catanog,dangh,dingx,yangf,kimdj,slagatj,her,weisj(2014)dssylation,anovelproteinmodificationtargetsproteinsinducedbyoxidativestress,andfacilitatestheirdegradationincells.proteincell5(2):124-40.
12.rezanoa,kuwaharak,yamamoto-ibusukim,kitabatakem,moolthiyap,phimsens,sudat,tones,yamamotoy,iwaseh,sakaguchin(2013)breastcancerswithhighdss1expressionthatpotentiallymaintainsbrca2stabilityhavepoorprognosisintherelapse-freesurvival.bmccancer13:562.
技术实现要素:
在最新的研究中,我们(发明人)发现在高等灵长类(类人猿亚科)基因组中存在一类新亚型dss1蛋白,命名为分泌型dss1蛋白(secretarydss1;sdss1)。sdss1是首次发现的一种dss1蛋白亚型,是类人猿亚目动物特有的蛋白。sdss1蛋白在序列和性质和功能上与dss1高度相似,但是存在于血液和脑脊液中,性质更活泼,不需要通过耗能的酶促反应就可以与溶液中的aβ蛋白形成共价聚集物并抑制aβ寡聚体的形成,从而缓解aβ寡聚体引起的细胞毒性。sdss1蛋白也可以与血清中的毒性蛋白反应,缓解毒性蛋白的细胞毒性。因而我们判断这种新型蛋白sdss1有潜力成为药物用于预防和治疗老年痴呆症以及其他因毒性蛋白积累导致的疾病。
本发明提供的新型天然sdss1蛋白是一种高等灵长类动物特有的蛋白,进化上高度特异。该蛋白在细胞内合成并分泌到细胞外,可以与血清中的氧化蛋白,或者溶液中的aβ结合并且抑制它们的聚集反应,从而缓解这些毒性蛋白沉积导致的细胞毒性。
具体的技术方案如下:
一种新型天然蛋白sdss1,包括人在内的类人猿亚目动物存在天然蛋白sdss1,其中人源天然蛋白sdss1的氨基酸序列如seqidno:1。
优选地,所述类人猿亚目动物还包括黑猩猩、倭黑猩猩、大猩猩、红毛猩猩和长臂猿;其中黑猩猩的天然蛋白sdss1的氨基酸序列如seqidno:5,倭黑猩猩的天然蛋白sdss1的氨基酸序列如seqidno:6,大猩猩的天然蛋白sdss1的氨基酸序列如seqidno:7,红毛猩猩的天然蛋白sdss1的氨基酸序列如seqidno:8,长臂猿的天然蛋白sdss1的氨基酸序列如seqidno:9。
优选地,人源天然蛋白sdss1分为n端58个氨基酸序列和c端31个氨基酸序列,其中人源sdss1蛋白n端58个氨基酸序列如seqidno:3,人源sdss1蛋白c端的31氨基酸序列如seqidno:2。
优选地,类人猿亚目动物的sdss1蛋白包含的c端氨基酸通式为:
x1x2x3x4x5x6x7x8x9x10x11x12x13x14x15x16x17x18x19x20x21x22x23x24x25x26x27x28x29x30x31;
x1为中性氨基酸;x2为非极性氨基酸;x3,x4分别为非极性氨基酸;x5为中性氨基酸;x6为非极性氨基酸;x7为非极性氨基酸;x8为非极性氨基酸;x9为中性氨基酸;x10为酸性氨基酸;x11为中性氨基酸;x12为非极性氨基酸;x13为中性氨基酸;x14为中性氨基酸;x15为中性氨基酸;x16为中性氨基酸;x17为非极性氨基酸;x18为非极性氨基酸;x19为碱性氨基酸;x20为酸性氨基酸;x21为碱性氨基酸;x22为中性氨基酸;x23为碱性氨基酸;x24为中性氨基酸;x25为中性氨基酸;x26为中性氨基酸;x27为非极性氨基酸;x28为非极性氨基酸;x29为非极性氨基酸;x30为中性氨基酸;x31为中性氨基酸;
当c端氨基酸序列中有50%或50%以上同源性氨基酸序列,该序列与人源sdss1蛋白c端的氨基酸序列在多肽中的性质和发挥的功能相同或相似。
一种多肽序列,其以上述方案所述的新型天然蛋白sdss1的n端58个氨基酸序列和c端31个氨基酸序列为基础构建的多肽序列,其是:
1)该多肽序列的n端58个氨基酸序列有70%或70%以上同源性,c端氨基酸序列有50%或50%以上同源性的蛋白,该蛋白与人源天然蛋白的性质和功能相同或相似;或者,
2)以人源天然蛋白的多肽序列的n端58个氨基酸序列或其70%或70%以上同源性序列为基础,在c端或n端修饰其他氨基酸序列,用于修饰的氨基酸序列能实现与人源天然蛋白中c端31个氨基酸序列相同或相似的性质并且发挥相同或相似的功能,修饰后的蛋白能发挥与人源天然蛋白相同或相似功能的蛋白;或者,
3)用新型天然蛋白sdss1c端的多肽序列修饰其他天然或非天然多肽序列得到的蛋白。
一种融合蛋白,其包括上述方案所述的新型天然蛋白sdss1完整序列或部分序列形成的蛋白。
优选地,所述融合蛋白是与该蛋白自身、载体蛋白、抗体或其他任意氨基酸序列连接形成的蛋白复合体。
一种复合体,其包括上述方案所述的融合蛋白。
优选地,所述复合体是与医药上可应用的药物载体连接形成的复合体。
优选地,所述载体包含微球/囊、脂质体、微乳液、纳米颗粒、磁颗粒和凝胶中的一种或一种以上。
一种核苷酸序列,所述核苷酸序列可以编码上述方案所述的蛋白或多肽序列。
优选地,所述核苷酸序列包括dna序列和rna序列。
一种细胞,所述细胞表达上述方案所述的蛋白或多肽序列。
优选地,所述细胞是任意一种哺乳动物的干细胞、前体细胞或成体细胞。
优选地,所述哺乳动物是人、猩猩、猴、马、牛、羊、猪、驴、狗、兔、猫、大鼠或小鼠。
优选地,所述细胞来源于原代培养干细胞、胚胎干细胞、诱导多能干细胞或其他类型干细胞分化。
一种表达体系,其把编码上述方案所述蛋白或多肽序列的核苷酸序列导入生物体,并在生物体中表达上述方案所述的蛋白或多肽序列。
优选地,所述表达体系包括真核表达质粒载体、腺病毒、慢病毒、逆转录病毒、crispr/cas技术及其他可行的基因编辑技术。
优选地,所述生物体是人、猩猩、猴、马、牛、羊、猪、驴、狗、兔、猫、大鼠、小鼠、鸡、鸭或鹅。
一种药物,所述药物以上述方案所述蛋白或多肽序列为主要靶点,并在施用后可以影响机体内上述方案所述蛋白或多肽序列的表达水平。
优选地,所述药物是化学小分子药物、蛋白/多肽药物、核酸药物、纳米药物。
优选地,所述的核酸药物包括sirna,microrna,反义寡核苷酸,三链dna和核酶的一种或一种以上。
一种上述方案所述蛋白的生产方法,所述方法包括以下步骤:
s1.表达载体构建:将可编码上述方案所述蛋白或多肽序列的核苷酸序列插入质粒中并导入到细菌或酵母菌细胞中,或将可编码上述方案所述蛋白的核苷酸序列插入昆虫细胞、哺乳动物细胞基因组中;
s2.蛋白表达:将s1中所述改造细菌、酵母菌、昆虫细胞或哺乳动物细胞进行扩大培养,收集包含上述方案所述蛋白或多肽序列的培养液或细胞裂解物;
s3.蛋白纯化:将s2中得到的培养液或细胞裂解物经过粗过滤和纯化得到蛋白。
该蛋白的生产方法,也可以为,利用化学合成技术生产上述方案所述蛋白或多肽序列;还可以为,利用体外核糖体表达系统生产上述方案所述蛋白或多肽序列。
一种上述方案中所述的蛋白、多肽序列、融合蛋白、复合体、核苷酸序列、细胞、表达体系、药物在疾病诊断、预防和治疗中的应用。
优选地,所述疾病指任何因毒性蛋白/多肽聚集和沉积导致的疾病。
优选地,所述毒性蛋白/多肽是氧化、硝基化、糖基化、剪切、热变性、超磷酸化的产物;基因突变导致的异常聚集的蛋白质;蛋白酶异常剪切引起的聚集的蛋白质;载脂蛋白、淀粉样前体蛋白及其剪切体、tau蛋白、亨廷顿蛋白、胰岛淀粉样多肽或突触核蛋白、朊蛋白。
优选地,所述疾病诊断包括检测上述方案所述蛋白或多肽序列全部或部分氨基酸序列表达水平、mrna水平、基因拷贝数量的一种或一种以上。
优选地,所述预防包括基因改造、核酸导入、药物注射/服用、细胞移植、组织移植中的一种或一种以上。
优选地,所述治疗包括基因改造、核酸导入、药物注射/服用、细胞移植、组织移植中的一种或一种以上。
本发明的特点和/或有益效果有:
1.本发明提供的新型天然蛋白sdss1,典型的人源sdss1蛋白多肽序列为msekkqpvdlglleeddefeefpaedwagldededahvwednwdddnveddfsnqlratvllmilvcetpygcyvlhqkgrmcsaflcc(参见seqidno:1)。经过生物信息学分析发现该蛋白是类人猿亚科动物特有的一种蛋白。
2.本发明根据生物信息学分析和细胞实验验证,多肽sdss1碳端31个氨基酸序列是信号肽,它们对该蛋白质的性质和分泌特性有关键作用。c端31个氨基酸序列为:tvllmilvcetpygcyvlhqkgrmcsaflcc(参见seqidno:2)。
3.本发明所述的sdss1蛋白可以与血清中的氧化蛋白、aβ蛋白结合并缓解这些毒性蛋白聚集诱导的细胞毒性,因而具有治疗老年痴呆症及其他毒性蛋白积累导致的疾病的重要潜力。
4.本发明的sdss1蛋白通过大肠杆菌发酵生产。将编码sdss1蛋白的核苷酸序列导入pet151d质粒中,sdss1表达的同时,其氮端融合了一个6个连续组氨酸标签和一个v5标签用于纯化和免疫印迹检测。蛋白在大肠杆菌中表达,利用镍-nta凝胶柱进行初步纯化,然后利用sds-page进行切胶纯化。将切出的含有his-v5-sdss1蛋白的胶条装入含有转膜液的透析袋中,在电场的驱动下,蛋白从凝胶中移出,收集在透析袋中。sds聚丙烯酰胺凝胶电泳分析蛋白纯度达到可以用于生物实验的水平。
5.本发明经过分子实验验证,sdss1蛋白可以与血清中氧化蛋白、缓冲液中的aβ蛋白结合并抑制这些蛋白的聚集。
6.本发明通过细胞实验证明sdss1蛋白可以有效缓解aβ聚集诱导的细胞毒性,维持细胞活力并降低细胞凋亡水平。
综上,本发明提供了一种新型天然sdss1蛋白,通过生物信息学、分子生物学、细胞生物学三个层次的研究证明sdss1蛋白的生物学性质和活性。sdss1蛋白可以有效降低aβ形成寡聚物而诱导的细胞毒性,帮助细胞存活。由于sdss1蛋白是高等灵长类动物本身具有的蛋白,在临床使用时可以免除免疫反应的问题。因而,本发明提供了一种新型预防和治疗老年痴呆症及其他由于毒性蛋白聚集导致的相关疾病的候选药物,在生物医学上有重要的应用前景。
附图说明
下面结合附图,对本发明做进一步详细的阐述,以使本发明能够清楚、完整,但不是为了限制本发明的保护范围。
图1:sdss1基因是dss1基因的新亚型,dss1基因cdna与sdss1基因cdna比对显示二者有重叠区。
图2a.质粒转染293t细胞,24h后观察gfp蛋白分布。与对照细胞(gfp)相比,sdss1蛋白与gfp螯合蛋白(sdss1-gfp)或sdss1蛋白c端31个氨基酸序列与gfp螯合蛋白(sdss1-c-gfp)可以分泌到细胞外,在溶液中观察到明显的绿色荧光。图2b.点膜免疫印迹方法检测转染细胞培养基,结果显示在sdss1-gfp和sdss1-c-gfp组培养基中检测到gfp信号,在空白对照(blank)和gfp对照组没有检测到明显的信号。图2c.在人血清(humanserum)或脑脊液(humancerebralspinalfluid,csf)样本中可以检测到sdss1信号存在。humancsf样本来源于老年人,a血清样本来源剧烈运动后青年人血液,b,c,d血清样本来源保持静息的青年人血液。
图3a-图3b:考马斯亮蓝染色显示sdss1蛋白生产和纯化过程中目的蛋白的含量。图3a.挑选阳性克隆菌株扩大培养,加入iptg后可以诱导sdss1蛋白的表达,没有诱导的细胞中目的蛋白的表达量极低。图3b.检测镍-nta凝胶柱初步纯化后浓缩的裂解物和纯化之后目的蛋白含量,a通道显示纯化的sdss1蛋白,b通道显示初步纯化的裂解液。
图4a-4c:生化实验检测sdss1蛋白可以与血清中的氧化蛋白和aβ蛋白结合。图4a.用0.72ugsdss1蛋白与不同比例的血清蛋白混合后孵育,用v5结合蛋白(v5-hrp)检测sdss1蛋白,结果显示sdss1蛋白与血清的氧化蛋白形成共价蛋白复合体。图4b.不同比例的sdss1蛋白与10ugaβ蛋白混合后孵育,经aβ抗体检测显示,sdss1蛋白与aβ形成共价结合的高分子量蛋白复合体,这种结合可以减少有细胞毒性的aβ寡聚体的形成。图4c.v5结合蛋白(v5-hrp)检测sdss1蛋白,结果显示sdss1蛋白与aβ形成蛋白复合体。
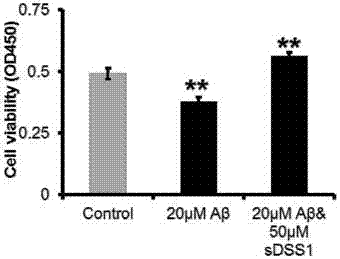
图5a-图5d:细胞活力检测实验显示,sdss1蛋白可以缓解aβ寡聚体、amylin聚集体或血清中毒性蛋白导致的细胞毒性。图5a&图5b.细胞贴壁12小时后换成添加不同浓度sdss1蛋白的无血清培养基,随着sdss1蛋白浓度增加,细胞活力逐渐增加。对照组中添加50umbsa对细胞活力没有明显影响。图5c.培养基中添加aβ寡聚体导致细胞毒性,从而降低细胞活力,sdss1蛋白可以降低毒性蛋白导致的细胞活力下降。图5d.sdss1蛋白能挽回amylin聚集体引起的细胞活力下降。数据用t-test双尾检验分析并用anove分析验证。**,p-value<0.01;n.s.,p-value>0.5。
图6a-图6c:细胞凋亡实验显示,sdss1蛋白降低aβ寡聚体导致的细胞凋亡。图6a.典型的流式细胞仪检测图显示sdss1蛋白可以减少aβ寡聚体引起的sh-sy5y细胞凋亡。图6b&图6c.统计结果显示,培养液中加入sdss1蛋白可以有效降低aβ寡聚体引起的sh-sy5y细胞或者神经干细胞(nsc)早期和晚期细胞凋亡,从而保护细胞不受毒性蛋白的影响。数据用t-test双尾检验分析并用anove分析验证。**,p-value<0.01;*,p-value<0.05。
具体实施方式
以下内容将结合实例对本发明中的优选方案进行说明和验证,不是对本发明的范围进行限定。本发明的所有范围限定以权利要求书中的限定为准。
下述实施案例中所用的实验方法如无特殊说明,均为常规实验方法。
下述实施案例中sdss1蛋白由自己生产并检验纯度达到生物实验的水平,其他材料和试剂均可以通过商业途径获取。
实施例1、多肽sdss1的生物信息学分析及生物学验证
生物信息学工具:美国国家生物技术信息中心(nationalcenterofbiotechnologyinformation,ncbi)基因组数据库;nucleotideblasttool(ncbi);alignsequencesnucleotideblasttool(ncbi),translatetool(sibbioinformaticsresourceportal);multiplesequencealignment(embl-ebi);wolfpsorttool。
实验方法:
1.细胞培养293t细胞购自美国模式培养物集存库(americantypeculturecollection,atcc),细胞培养在含有90%基础培养基(dulbecco'smodifiedeaglemedium,dmem)(lifetechnology公司c#12500062)和10%胎牛血清(fetalbovineserum,fbs)(gibco公司c#10100-147)的细胞培养基中,放在在细胞培养箱(温度37℃,湿度95%,co2浓度5%)中培养,每两天传代一次。
2.细胞转染293t细胞按照3x105每孔接种到6孔板中,添加1.5ml细胞培养基,细胞贴壁12小时后开始转染质粒。质粒2500ng用750μl
3.人血清和脑脊液样品处理。收集新鲜的人全血,室温静置10-20分钟后,3500g离心30分钟,取上清即为人血清。向血清中加入100mmbeta巯基乙醇,混匀后沸水浴10分钟,12000g高速离心10分钟,取上清与1/4体积的5x上样缓冲液混合。从医院得到新鲜脑脊液放置于冰盒中运输,当天处理。新鲜脑脊液与5xloadingbuffer混合后直接用于上样样品备用。
4.点膜蛋白免疫印迹实验pvdf膜用甲醇活化后干燥,分别把对照培养基和不同转染细胞培养基滴加到膜上。等待膜干燥后,pvdf膜依次完成1%bsa封闭、第一级抗体(rabbit-anti-gfp)(cellsignaltechnology公司c#2956)孵育,第二级抗体(goat-anti-rabbithrp抗体)(中杉金桥,zdr-5403)孵育。膜用pbst清洗三次,用发光液(中杉金桥,zli-9017)显影并用x光胶片曝光条带。
5.蛋白免疫印迹实验(westernblotting)15μl制备的上样样品加入上样孔,4-12%预制胶(lifetechnology公司c#np0321box)分离蛋白后转移到pvdf膜上。膜依次经过第一级抗体(rabbit-anti-sdss1)(抗原:lhqkgrmc)孵育,pbst溶液清洗三遍;第二级抗体(goat-anti-rabbithrp抗体)孵育。用pbst清洗三遍,完成后用发光液显影并用x光片显示条带。
结果分析:
在对人基因组中shfm1基因进行生物信息学分析时,我们发现该基因有多条转录本(参考ncbi数据库中shfm1基因信息,http://www.ncbi.nlm.nih.gov/gene/7979)。除了共同编码dss1蛋白序列的一条mrna序列(nm_006304.1,509bp),还有一条更长的mrna序列(ak309241.1,1195bp),短mrna序列与长mrna序列仅有256bp重复序列(图1)。长mrna序列编码89个氨基酸的多肽序列,其中n端与人源dss1蛋白序列有相同的58个氨基酸,但是其余氨基酸序列完全不同,我们命名这条新的多肽为分泌型dss1蛋白(secretorydss1,sdss1),如下面所示:
dss1(homosapiens):
msekkqpvdlglleeddefeefpaedwagldededahvwednwdddnveddfsnqlraelekhgykmets(参见seqidno:4)
s-dss1(homosapiens):
msekkqpvdlglleeddefeefpaedwagldededahvwednwdddnveddfsnqlratvllmilvcetpygcyvlhqkgrmcsaflcc(参见seqidno:1)
比较可知,dss1多肽序列与sdss1多肽序列比对显示二者有n端58个氨基酸的重叠区,另有31个氨基酸的变异区。
通过对ncbi数据库中已测序的灵长目动物基因组和其他模式动物基因组的筛查,我们发现只有在类人猿亚目动物的基因组中存在类似的长mrna序列并且得到与人源sdss1蛋白相似的氨基酸序列。参见下表1所示,
表1
注:表1中abcde对应聚类分析中从高到低的层级。
表1可知,sdss1基因是类人猿亚目动物所特有的基因,在其他物种动物基因组中没有找到类似的序列。mrna序列的聚类分析显示sdss1基因的进化层级与类人猿亚目动物的进化层级大致符合。
在原猴亚目和其他物种的动物中,仅仅找到编码dss1蛋白唯一的shfm1基因转录本。此外,通过对编码c端31个氨基酸序列的基因片段进行数据库比对(全基因组blast),在原猴亚目和其他物种动物的基因组中也没有找到类似的序列。通过以上生物信息学分析,我们发现sdss1蛋白是类人猿亚目动物所特有的一类蛋白,与dss1序列有相似性。
通过继续对sdss1蛋白的序列进行分析,结果预测该蛋白是一类分泌型蛋白,在细胞内合成并定位于细胞外发挥作用,参见表2所示,
表2
利用wolfpsorts软件分析sdss1氨基酸序列,预测结果显示sdss1蛋白定位于细胞外,是一种分泌蛋白。
把该蛋白全序列或c端31个氨基酸序列与绿色荧光蛋白(greenfluorescentprotein,gfp)连接并表达到293t细胞中(sdss1-gfp,sdss1-c-gfp),可以观察到溶液中出现荧光(图2a),证明sdss1蛋白被分泌到细胞外,c端31个氨基酸序列发挥了信号肽的功能。用点膜免疫印迹方法检测细胞培养基,发现在sdss1-gfp和sdss1-c-gfp组的细胞培养基中检测到gfp信号(图2b),在对照组中都没有检测到信号。另外,在人脑脊液或血清中,我们也检测到sdss1蛋白的信号(图2c)。基于这些结果,我们发现sdss1蛋白是一类分泌蛋白,其c端31个氨基酸序列作为信号肽。
实施例2、多肽sdss1的生产和活性验证
实验方法
1.sdss1蛋白制备:全基因合成编码人sdss1蛋白的核苷酸片段,插入到pet151d中hisx6-v5标签后面。然后将质粒转入表达菌株bl21(de3)中。大肠杆菌中融合表达hisx6-v5-sdss1蛋白,利用镍-nta凝胶柱进行初步纯化,然后利用sds-page进行切胶纯化。将切出的含有his-v5-sdss1蛋白的胶条装入含有转膜液的透析袋中,在电场的驱动下,蛋白从凝胶中移出,收集在透析袋中。浓缩蛋白至500微升左右,在pbs溶液中4度透析4次,每次200毫升。
2.sds聚丙烯酰胺凝胶电泳纯化制备的sdss1蛋白或细菌裂解液蛋白与5x上样缓冲液混合后,沸水浴处理10分钟,12000g高速离心10分钟,取上清液用于分析。用4-12%预制胶分离蛋白后,考马斯亮蓝染液染色胶块1小时,然后用脱色液室温下脱色过夜。脱色完成后,观察胶块上的条带并拍照保存。
结果分析:
挑选阳性克隆的大肠杆菌菌株,扩大培养,在细菌生长的对数期开始用iptg刺激细菌细胞表达目的蛋白。裂解细菌,检测目的蛋白的表达水平,结果显示iptg刺激后,细菌细胞表达sdss1蛋白的水平显著上升,在胶图上可以看到明显的蛋白条带(图3a)。细菌裂解液经过镍-nta凝胶柱初步纯化之后,浓缩液中目的蛋白得到极大的浓缩(b通道),杂蛋白含量减少;继续纯化可以得到纯度极高的sdss1蛋白(a通道)(图3b),可以用于后续的生物实验。纯化之后的sdss1蛋白经bca蛋白定量,终浓度为0.72mg/ml,4度保存备用。
实施例3、分子生物学实验检验sdss1蛋白功能
实验方法
1.氧化蛋白与sdss1蛋白反应新鲜人血液经3500g离心30分钟,取上层血清用于后续实验。实验中在10μlsdss1蛋白溶液(0.72mg/ml)中分别与10,20,50和100微升血清混合,sdss1与血清蛋白质量比大概为1:100,1:200,1:500,1:1000,另外添加20μmfenton试剂(feso4和h2o2按照1:1的质量比混合),混合均匀后放在4℃避光孵育过夜。第二天,用10微升ni-nta磁珠,将各反应中的his-v5-sdss1分离出来。反应液与磁珠4度混合2小时,用磁力架将磁珠吸附在管壁上,用真空泵吸走液体,加入1mlpbst,将管子从磁力架上取下,反复震荡洗涤后,磁力架吸附磁珠,吸走pbst,如此反复4次,最后用50微升含50mmedta的tbs洗脱蛋白。洗脱液加入等体积2xsds溶液,100度处理10分钟。
2.aβ与sdss1蛋白反应aβ蛋白(human,1-42)冻干粉由苏州强耀生物科技有限公司提供。aβ冻干粉用dmso溶解为10mg/ml,继续用pbs稀释为2mg/ml。-20度冷冻保存。反应体系中首先加入300μlpbs溶液中10μgaβ与sdss1蛋白按摩尔质量比1:1,1:5,1:10混合,混合后放在4℃孵育过夜。
3.蛋白免疫印迹实验反应完成的蛋白混合物与5xloadingbuffer混合后,沸水浴10分钟并用于westernblotting分析。具体方法与前述相同。
结果分析:
血清中含有大量蛋白,在fenton试剂的作用下,血清中的蛋白被氧化能产生细胞毒性。在对照组,可以看到dss1单体,没有发生明显的蛋白聚集;在实验组,与血清共同孵育导致大量高分子量蛋白聚集体形成(图4a)。结果说明,sdss1蛋白可以与血清中氧化蛋白结合。
经过孵育,aβ蛋白发生明显的聚集,在10-20kd之间形成大小不一的蛋白聚集体,这些aβ寡聚体产生对细胞的毒性。加入sdss1蛋白共同孵育之后,sdss1蛋白可以与aβ蛋白聚集形成大分子量的聚集体,10-20kd之间形成的寡聚体明显减少(图4b)。另外,检测sdss1蛋白信号也可以看到大分子量的蛋白聚集体信号(图4c)。这些结果说明sdss1蛋白抑制了aβ蛋白形成寡聚物,从而形成了大分子量聚集体,这种效应可以缓解aβ蛋白的细胞毒性。
实施例4、细胞生物学实验检验sdss1蛋白功能
实验方法
1.细胞系培养人神经母细胞瘤细胞(sh-sy5y)生长于基础培养基dmem添加10%胎牛血清;细胞每两天传代一次。
2.神经干细胞培养神经干细胞(neuralstemcell,nsc)来自p2小鼠脑组织,原代悬浮培养的神经干细胞经过两次传代后用于毒性检测实验,神经干细胞培养于干细胞培养基中,包含88%dmem/f12基础培养基(gibco公司c#12500-062),10%proliferationsupplementary添加物(stemcelltechnology公司c#05701),2%bsa(sigma公司c#v900933),10ng/mlheparin(sigma公司c#h3149),10ng/mlbfgf(roche公司c#11104616001),20ng/mlegf(bdbioscience公司c#354010)。
3.毒性蛋白预处理用基础培养基稀释10mg/ml的aβ或amylin储液至1000μg/ml,aβ和amylin稀释液放在4℃孵育24小时后用于细胞实验。后续实验中aβ和amylin的浓度始终按孵育前的蛋白浓度来标注。
4.细胞活性检测细胞系按照1.5x104每孔接种到96孔板中,贴壁6小时后,将旧培养基换成实验溶液。神经元细胞弃去旧培养基后换成实验溶液。细胞继续处理24小时后,收集旧培养基用于后续细胞毒性检测实验,更换成检测细胞活力的工作液[10%cck-8(dojindo,ck04)和基础培养基dmem]。培养板放在37℃孵育1.5小时,在酶标仪上读取450nm吸光度(od450),吸光度值反映细胞活力水平。
其中,检测sdss1蛋白对细胞的保护作用时,实验溶液包含基础培养基dmem,设置0μm、10μm、25μm、50μm、75μm、100μm六个浓度梯度。50μmbsa用于阴性对照实验。检测sdss1蛋白对毒性蛋白细胞毒性的抑制,实验溶液包含20μmaβ,20μμaβ加50μmsdss1蛋白组;10μmamylin,10μμamylin加25μmsdss1蛋白组。
5.细胞凋亡检测细胞凋亡检测试剂盒购自东仁化学科技(上海)有限公司(ad10)。细胞系按照3x105每孔接种到6孔板中,贴壁6小时后将旧培养基换成实验溶液。神经干细胞首先贴壁培养于6孔板中,孔板首先用0.025%laminin处理至少两个小时,然后用无菌pbs清洗6遍备用。神经干细胞制成单细胞后,按照3x105每孔接种到6孔板中,细胞贴壁24h后用于后续实验。实验溶液包括20μμaβ,20μμaβ加50μmsdss1蛋白组。细胞系或神经干细胞用不同的溶液处理24小时后,收集所有溶液和细胞,离心弃去上清。用400μl凋亡试剂盒提供的染色缓冲液重悬细胞,吸取其中的185μl细胞悬液用于后续检测。在细胞悬液中加入5μlannexinv染色液后混匀,细胞放在37℃孵育10分钟。继续加入10μlpi染液,混匀后用流式细胞仪检测细胞凋亡水平。
结果分析
为了检测sdss1蛋白对血清中的毒性蛋白诱导的细胞毒性的保护效应,首先检测了在基础培养基中添加sdss1蛋白后细胞活力的变化。结果显示,加入sdss1蛋白后,细胞活力显著高于对照组,并且细胞活力随sdss1蛋白增加而增加,到75μμ后不再增加(图5a)。用bsa作为对照时,50μmbsa在溶液中没有起到显著的保护效应(图5b)。这些结果说明sdss1蛋白可以缓解血清中毒性蛋白的毒性效应,提高细胞活力。
继续检测sdss1蛋白对aβ引起的细胞毒性的保护效应。在细胞活力检测实验中,添加预处理的aβ寡聚物之后,细胞活力显著下降。在培养液中加入sdss1蛋白后,sh-sy5y细胞活力得到显著的恢复并且细胞活力高于对照组(图5c)。用在2型糖尿病中出现累积的毒性蛋白amylin重复细胞活力实验,结果也显示sdss1蛋白可以挽回amylin导致的细胞活力下降(图5d)。在细胞凋亡检测实验中,aβ寡聚物加入培养液后诱导sh-sy5y细胞或神经干细胞的细胞凋亡,在培养液中添加sdss1蛋白可以显著降低细胞的早期凋亡和晚期凋亡水平(图6a-图6c)。这些结果说明,sdss1蛋白可以缓解毒性蛋白引起的细胞毒性,对细胞发挥显著的保护作用。
上文所列出的一系列的详细说明仅仅是针对本发明的可行性实施例的具体说明,它们并非用以限制本发明的保护范围,凡未脱离本发明精神所作的等效实施例或变更均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!