用于控制植物抗逆性的农用化学制剂的制作方法
相关申请的交叉参考本申请要求于2009年2月13日递交的美国临时申请No.61/207,684的优先权,其为所有目的以参阅的方式并入于此。
背景技术:
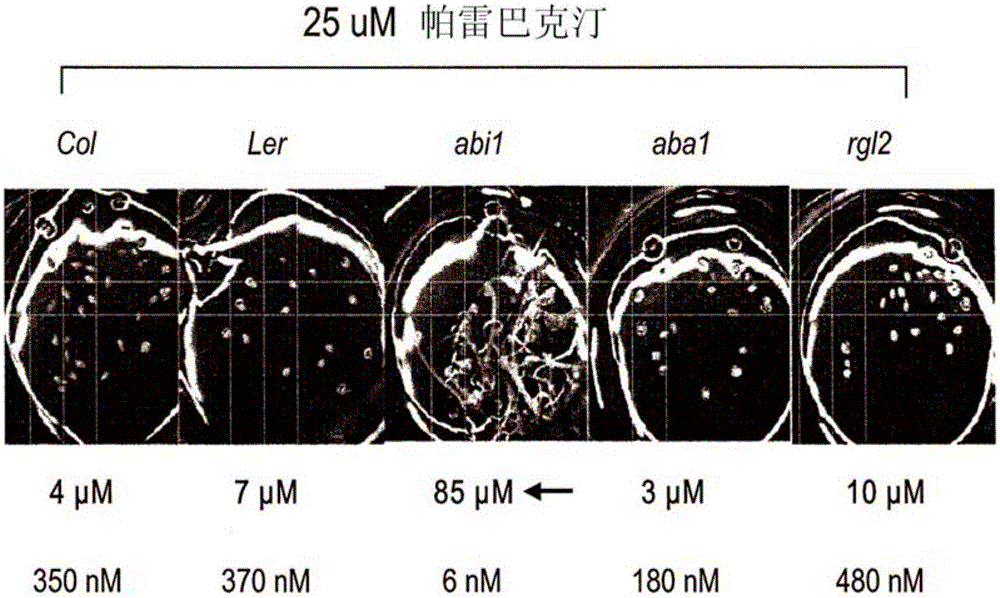
:脱落酸(ABA)自从二十世纪六十年代被证实作为内源小分子生长抑制剂和植物逆境(stressphysiology)生理调节剂之后,一直以来都是深入研究的热点(K.Ohkuma,J.L.Lyon,F.T.Addicott,O.E.Smith,Science142,1592(1963);C.F.Eagles,P.E.Wareing,PhysiologiaPlantarum17,697(1964);J.W.Cornforth,B.V.Milborrow,G.Ryback,Nature206,715(1965);J.W.Cornforth,B.V.Milborrow,G.Ryback,P.F.Wareing,Nature205,1269(1965);D.Imber,M.TaI,Science169592(1970)。事实上,只要提高植物ABA敏感性,就会导致增强的耐旱性及另外的抗逆性。例如,参见Wang等人,PlantJ.43:413-424(2005);Pei等人Science282:287-290(1998);美国专利公开No.2004/0010821。遗传分析已表明ABA信号转导涉及许多因子,包括2型蛋白磷酸酶(PP2C)ABI1、ABI2及形成密切相关的ABI1/AHG1进化枝(clade)的相关物质,该进化枝作为ABA信号转导的冗余负调节子(R.R.Finkelstein,S.S.L.Gampala,C.D.Rock,ThePlantCell14,S15(2002);P.McCourt,AnnualReviewofPlantPhysiologyandPlantMolecularBiology50,219(1999);A.Schweighofer,H.Hirt,I.Meskiene,TrendsinPlantScience9,236(2004))。已报道了几种ABA结合蛋白,然而,尚不清楚它们是如何调控ABA的多种效应,因为它们不通过已知的信号转导通路的调节子发挥作用(X.Liu等人,Science315,1712(Mar23,2007);F.A.Razem,A.El-Kereamy,S.R.Abrams,R.D.Hill,Nature439,290(2006);Y.Y.Shen等人,Nature443,823(Oct19,2006))。另外,特征受体表现出与非天然立体异构体(-)-ABA1可忽略的结合,其浓度高于它们的(+)-ABA2Kds约1000倍。(-)-ABA在大多数ABA检测中是有生物活性的(B.-L.Lin,H.-J.Wang,J.-S.Wang,L.I.Zaharia,S.R.Abrams,JournalofExperimentalBotany56,2935(2005);D.Huang等人,ThePlantJournal50,414(2007)),且通过相同的信号转导通路以(+)-ABA发挥作用(E.Nambara等人,Genetics161,1247(Jul,2002)),表明识别(-)和(+)-ABA的受体仍有待发现。发明简述本发明提供含有异源表达盒的植物(或这类植物的植物细胞、种子、花、叶、果实或其它植物部位),该表达盒包括与编码PYR/PYL受体多肽的核苷酸可操作连接的启动子,其中所述植物与缺少该表达盒的植物相比,抗逆性增强。在一些实施方案中,PYR/PYL受体多肽包括SEQIDNOs:1、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107和/或138中的一个或多个。在一些实施方案中,PYR/PYL受体多肽与SEQIDNOs:2-90或108-137中的任一序列具有至少70%(例如,至少70%、80%、90%、95%)的同源性。在一些实施方案中,PYR/PYL受体多肽为组成型活性(constitutively-active)形式,使得受体在不存在脱落酸或ABA激动剂的酵母双杂交检测中,可以结合2型蛋白磷酸酶(PP2C)。在一些实施方案中,PYR/PYL受体多肽在存在而非缺乏脱落酸或ABA激动剂的酵母双杂交检测中结合2型蛋白磷酸酶(PP2C)。在一些实施方案中,所述植物与缺少该表达盒的植物相比,耐旱性增强。在一些实施方案中,启动子为根特异性启动子。在一些实施方案中,启动子对植物的地上部分具有特异性。在一些实施方案中,启动子是可诱导的。本发明还提供增强上述植物的抗逆性的方法。在一些实施方案中,该方法包括,使植物接触足量的化合物,从而与不接触该化合物的植物相比,增强其抗逆性,其中所述化合物选自下式:其中,R1选自由可任选被1-3个R1a基团取代的芳基和杂芳基组成的组;各R1a独立选自下组:H、卤素、C1-6烷基、C1-6卤代烷基、C2-6烯基、C2-6炔基、C1-6烷氧基、C1-6卤代烷氧基、C1-6羟烷基、-NR'R"、-SR'、-OH、-CN、-NO2、-C(O)R'、-C(O)OR'、-C(O)NR'R"、-N(R')C(O)R"、-N(R')C(O)OR"、-N(R')C(O)NR'R"、-OP(O)(OR')2、-S(O)2OR'、-S(O)2NR'R"、环烷基、杂环烷基、芳基和杂芳基,其中芳基基团可任选被-NO2取代,且杂芳基可任选被C1-6烷基取代;可选择地,相邻R1a基团可结合形成选自下组中的成员:环烷基、杂环烷基、芳基和杂芳基,其中芳基基团可任选被-OH取代;R'和R"各自独立选自由H和C1-6烷基组成的组;R2选自下组:C2-6烯基、环烯基、芳基和杂芳基;R3为H或任选与R2和各自连接的原子结合形成可任选被1-3个R1a基团取代的杂环烷基;R4为可任选被1-3个R1a基团取代的杂芳基;R5选自由C1-6烷基和芳基组成的组,其中所述芳基可任选被1-3个R1a基团取代;各R6和R7独立选自由芳基和杂芳基组成的组,各自可任选被1-3个R1a基团取代;R8选自由环烷基和芳基组成的组,各自可任选被1-3个R1a基团取代;R9为H或任选与R8的R1a基团和各自连接的原子结合形成杂环烷基;下标n为0-2;X不存在或选自由-O-和-N(R')-组成的组;Y不存在或选自由-C(O)-和-C(R',R")-组成的组;Z不存在或选自由-N=和-C(S)-N(R')-组成的组,使Y和Z之一不存在;各R10和R11独立选自由H、C1-6烷基、-C(O)OR'和C1-6烯基-C(O)OH组成的组,其中R10和R11基团中至少两个为C1-6烷基,R10和R11基团中至少一个为C1-6烯基-C(O)OH;可选择地,连接于同一碳原子上的两个R10或R11基团结合形成=O;可选择地,一个R10基团和一个R11基团结合形成具有3至6个环成员的环烷基;各下标k和m为整数1-3,使k和m之和为3-4;各下标p和r为整数1-10;其中位于相邻碳原子上的R10或R11基团两者结合形成键;R12为被=O取代的C1-6烷基;R13为C1-6烯基-C(O)OH;R14选自由H和C1-6烷基组成的组;以及下标r为整数1-10;条件是,当R1为4-溴-萘-1-基,且n为1时,R2为除未取代的吡啶-2-基以外的基团。本发明还提供含有与编码PYR/PYL受体多肽的核苷酸可操作连接的启动子的表达盒,其中将该表达盒引入植物中使得该植物与缺少该表达盒的植物相比,抗逆性增强。在一些实施方案中,PYR/PYL受体多肽包括SEQIDNOs:1、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107和/或138中的一个或多个。在一些实施方案中,PYR/PYL受体多肽与SEQIDNOs:2-90或108-137中的任一序列具有至少70%(例如,至少70%、80%、90%、95%)的同源性。在一些实施方案中,PYR/PYL受体多肽为组成型活性形式,使受体在不存在脱落酸或ABA激动剂的酵母双杂交检测中,可以结合2型蛋白磷酸酶(PP2C)。在一些实施方案中,PYR/PYL受体多肽在存在而非缺乏脱落酸或ABA激动剂的酵母双杂交检测中结合2型蛋白磷酸酶(PP2C)。在一些实施方案中,所述植物与缺少该表达盒的植物相比,耐旱性增强。在一些实施方案中,启动子为根特异性启动子。在一些实施方案中,启动子对植物的地上部分具有特异性。在一些实施方案中,启动子是可诱导的。本发明还提供含有本发明表达盒(例如,上述的表达盒)的表达载体。本发明还提供制备抗逆性增强的植物的方法。在一些实施方案中,该方法包括:将本发明表达盒(例如,以上描述的表达盒)引入多株植物中;以及筛选含有所述表达盒的且与缺少该表达盒的植物相比抗逆性增强的植株。本发明还提供用于接触植物而配制的农用化学制剂,该制剂包括选自下式的化合物:其中,R1选自由可任选被1-3个R1a基团取代的芳基和杂芳基组成的组;各R1a独立选自下组:H、卤素、C1-6烷基、C1-6卤代烷基、C2-6烯基、C2-6炔基、C1-6烷氧基、C1-6卤代烷氧基、C1-6羟烷基、-NR'R"、-SR'、-OH、-CN、-NO2、-C(O)R'、-C(O)OR'、-C(O)NR'R"、-N(R')C(O)R"、-N(R')C(O)OR"、-N(R')C(O)NR'R"、-OP(O)(OR')2、-S(O)2OR'、-S(O)2NR'R"、环烷基、杂环烷基、芳基和杂芳基,其中所述芳基可任选被-NO2取代,且所述杂芳基可任选被C1-6烷基取代;可选择地,相邻R1a基团可结合形成选自下组中的成员:环烷基、杂环烷基、芳基和杂芳基,其中芳基可任选被-OH取代;R'和R"各自独立选自由H和C1-6烷基组成的组;R2选自下组:C2-6烯基、环烯基、芳基和杂芳基;R3为H或任选与R2和各自连接的原子结合形成可任选被1-3个R1a基团取代的杂环烷基;R4为可任选被1-3个R1a基团取代的杂芳基;R5选自由C1-6烷基和芳基组成的组,其中所述芳基可任选被1-3个R1a基团取代;各R6和R7独立选自由芳基和杂芳基组成的组,各自可任选被1-3个R1a基团取代;R8选自由环烷基和芳基组成的组,各自可任选被1-3个R1a基团取代;R9为H或任选与R8的R1a基团和各自连接的原子结合形成杂环烷基;下标n为0-2;X不存在或选自由-O-和-N(R')-组成的组;Y不存在或选自由-C(O)-和-C(R',R")-组成的组;Z不存在或选自由-N=和-C(S)-N(R')-组成的组,使Y和Z之一不存在;各R10和R11独立选自由H、C1-6烷基、-C(O)OR'和C1-6烯基-C(O)OH组成的组,其中R10和R11基团中至少两个为C1-6烷基,R10和R11基团中至少一个为C1-6烯基-C(O)OH;可选择地,连接于相同碳原子上的两个R10或R11基团结合形成=O;可选择地,一个R10基团和一个R11基团结合形成具有3至6个环成员的环烷基;各下标k和m为整数1-3,使k和m之和为3-4;各下标p和r为整数1-10;其中位于相邻碳原子上的两个R10或R11基团结合形成键;R12为被=O取代的C1-6烷基;R13为C1-6烯基-C(O)OH;R14选自由H和C1-6烷基组成的组;以及下标r为整数1-10;条件是,当R1为4-溴-萘-1-基,且n为1时,R2为除未取代的吡啶-2-基以外的基团。在一些实施方案中,所述制剂进一步包括除草剂、杀菌剂、杀虫剂或肥料中的至少一种。在一些实施方案中,所述制剂进一步包括表面活性剂。本发明还提供增强植物抗逆性的方法,该方法包括,使植物接触足够量的上述制剂,从而与不接触化合物的植物相比,增强其抗逆性。在一些实施方案中,所述接触步骤包括通过飞机空洒或灌溉向植物施用制剂。本发明还提供鉴定激动PYR/PYL多肽的试剂的方法。在一些实施方案中,该方法包括:使一种或多种试剂接触PYR/PYL多肽;以及测定一种或多种试剂是否结合和/或激活PYR/PYL受体多肽,其中结合或激活表明该试剂为PYR/PYL多肽的激动剂。在一些实施方案中,测定步骤包括:使试剂接触含有双杂交系统的细胞,其中所述双杂交系统检测PYR/PYL多肽和2型蛋白磷酸酶(PP2C)的相互作用,其中PYR/PYL多肽和PP2C的试剂依赖型相互作用表明该试剂为PYR/PYL多肽的激动剂。附图说明图1、帕雷巴克汀(Pyrabactin)是种子选择性ABA激动剂。(A)本研究中所述的分子结构。(B)帕雷巴克汀活性被abi1-1抑制。将上方所示基因型的种子浸泡于含有25μM帕雷巴克汀的培养基中,层积处理(stratification)后4天给种子萌发打分。底部所示为IC50值,用于评价帕雷巴克汀作用于所述基因型种子的萌发效果。(C)帕雷巴克汀和ABA处理的种子的微阵列比较。Y轴为探针对25μM帕雷巴克汀(相对于未处理的对照)响应的log2转换值,X轴为探针对1μMABA响应的log2转换值。绘图所用数据为去除萌发响应转录产物(germinationresponsivetranscripts)后,针对ABA或帕雷巴克汀具有显著响应的探针组(probesets)。(D)种子对放线菌酮和ABA响应的微阵列比较。该图表示对在C组(panel)中分析的相同探针组的响应,但比较的是经放线菌酮处理的种子的mRNA(y轴)。(E)幼苗对帕雷巴克汀和ABA响应的微阵列比较。将7天大的幼苗转移到含有10μMABA或50μM帕雷巴克汀的平板中24h,然后绘制mRNA样本。各分散图中插入的是每个比较的皮尔逊(Pearson)相关系数。详细的微阵列方法描述于实施例部分。图2、PYR1编码ABA响应的START-结构域(domain)蛋白。(A)Pyr1等位基因。示出了等位基因名称、植株名称(括号内)及通过筛选帕雷巴克汀抗性突变鉴定得到的,由Pyr1突变等位基因引起的氨基酸变化。(B)图示为公开的微阵列数据库中包括的Pyr1和Pyr1-Pyr4表达值。右上方热图(heatmap)所示为首批上面的三个组(firstupperthreepanels),底部热图为保卫细胞数据。绘图使用的是eFP浏览器(D.Winter等人,PLoSONE2,e718(2007))。(C)35S::GFP-PYR1互补pyr1-1。所示基因型种子在25μM帕雷巴克汀培养基上层积处理4天,然后在室温(RT)、90%相对湿度(RH)下置于黑暗处萌发3天。Columbia野生型在这些条件下不能萌发,但pyr1-1由于其抗帕雷巴克汀,所以能够萌发。将35S::GFP-PYR1构建体引入pyr1-1遗传背景中,能够恢复帕雷巴克汀敏感性,表明GFP融合蛋白能够起作用。(D)Pyr/Pyls对于正常幼苗中ABA诱导的基因表达是必需的。图示为ABA响应基因RD29的qRT-PCR结果。L表示Ler,C表示对照,Q表示四倍体突变。(E)Pyr/Pyls基因对于正常幼苗中ABA诱导的逆境诱导的(stress-induced)基因表达是必需的。图示为实施例部分所述的两个ABA响应taqman探针的qRT-PCR结果。L=Ler,C=对照,Q=四倍体突变。图3、ABA促进PYR/PYL与PP2Cs结合。(A)PYR/PYL蛋白与HAB1相互作用的特点。图示为生长于含有上方所示化合物的平板上的酵母菌落X-gal染色。拟南芥基因组全序列测序(ArabidopsisGenomeInitiative,AGI)对每个PYR/PYL基因的注释示于图的右侧。PYL8(AT5G53160)和PYL13(AT4G18620)未被检测。每个测试株表达了AD-HAB1融合蛋白,BD融合示于左侧。除了表油菜素内酯(50nM)外,化学物质测试为10μM。(B)PYR1突变蛋白不能与HAB1发生相互作用。测试了在拟南芥种子中显示出帕雷巴克汀高敏感性的3个PYR1氨基酸替换突变与HAB1在Y2H中发生的相互作用。(C)PYR1与ABI1和ABI2发生相互作用,而不与abi2-1编码的突变蛋白发生作用。图4、GFP-PYR1定位于细胞质和核质中。共聚焦图象显示为在pyr1-1突变体背景中的35S::GFP-PYR1构建体。该构建体补足了(complement)pyr1-1突变体的帕雷巴克汀不敏感表型。图5、Pyr1以及Pyr1、2和4在ABA敏感中发挥冗余功效。(A)三倍体和四倍体突变系中的ABA响应在萌发期间改变。上方所示基因型的种子在含有0.9μM(+)-ABA的培养基中层积处理4天,然后在黑暗处萌发3天后拍照。由于与pyl2-1插入等位基因紧密相关的erecta突变的存在,在(+)-ABA上萌发的四倍体突变上观察到短下胚轴。(B)三倍体和四倍体突变系中的ABA响应在根生长期间改变。上方所示基因型的种子层积处理4天,然后转移至暗处(常温,90%相对湿度)。30小时后,将出现幼根的种子转移至含有10μM(+)-ABA的平板上,在黑暗处再生长3天后对它们的根拍照。图6、PYR1为调节PP2C活性的ABA受体。(A)体外ABA感受重建。采用GST-HAB1和6xHis-PYR1(或突变体)对纯化的重组蛋白(左侧)进行转蛋白试验(Pull-downassays)。另外采用纯化的6xHis-PYR11(或突变体)及含有所示PP2C的粗细胞裂解物在转蛋白试验中测试GST-ABI1和ABI2。使用10μM(+)-ABA。(B)在ABA存在下,PYR1抑制PP2C活性。在PYR1或PYR1P88S存在下,以不同的ABA浓度,用底物pNPP测试GST-HAB1的PP2C活性。(C)HAB1PP2C活性的ABA/PYL4型抑制。重组的PYL4(由包涵体重新折叠)和HAB1用于所述的PP2C检测。使用磷酸酶底物pNPP测定GST-HAB1活性。采用酶标仪(platereader)监测一段时间的反应(3次),计算磷酸酶的起始反应速率(3次),用于计算活性。上图显示为所研究的整个浓度范围;下图显示为所测试的较低浓度的放大部分。这些试验中的GST-HAB1特异活性为452.4±12.3μmol/min/mg。绘图使用±SD误差线(errorbar)。图7、预测的PYR/PPYL调节ABA信号转导模型。不限于本发明范围,我们设计了以下模型:在无ABA时(左侧),PYR/PYL蛋白与PP2Cs结合弱,因此PP2C活性高,防止了SnRK2s以及下游因子(DFs)的磷酸化和激活。在ABA存在时,PYR/PYL结合并抑制PP2Cs。使磷酸化的下游因子和ABA转录响应得到积累。PYR/PYLs对SnRK2s的调节可能是间接的,或可能涉及其它因子。图8、ABA激动剂小分子的活性。该表概括了来自于筛选的小分子对于PYR1、PYL1、PYL2、PYL3和PYL4受体活性的数据。图9、在PP2C酵母双杂交检测中鉴定的一些化合物的IC50值。左栏中所列化合物编号对应于表9中概括的检测时确定的化合物;化合物7653159对应于图9中的化合物7;化合物6655097对应于图9中的化合物6;以及化合物7561035对应于图9中的化合物9。对于每个化合物,以pNPP为底物采用磷酸酶试验检测该化合物拮抗PYR/PYL抑制PP2CHAB1的能力。图10、PYL4过表达系中的ABA相关基因表型列表。检测了PYU4过表达以及pyr1;py11;py12;py14四倍体突变拟南芥植株对于胁迫响应的相关性状,包括开花时间、株高、叶绿素含量和萎蔫相对于对照拟南芥植株的变化。突变植株构建的详细描述由实施例部分提供。图11、来自拟南芥的PYR1及同系物的比对。该图提供了拟南芥PYR/PYL蛋白序列的比对。比对显示了,例如绝对保守氨基酸以及处于通常的保守位置的氨基酸。图中序列包括以下PYR/PYL多肽:PYL12(SEQIDNO:77)、PYL8(SEQIDNO:78)、PYL7(SEQIDNO:79)、PYL9(SEQIDNO:80)、PYL11(SEQIDNO:81)PYL10(SEQIDNO:82)、PYL13(SEQIDNO:83)、PYL5(SEQIDNO:84)、PYL4(SEQIDNO:85)、PYL6(SEQIDNO:86)、PYL2(SEQIDNO:87)、PYL3(SEQIDNO:88)、PYR1(SEQIDNO:89)和PYL1(SEQIDNO:90)。来自特定成员的一致性序列列于比对下方。ALL_Con=SEQIDNOs:93-95;l_12_Con=SEQIDNOs:96-99;l_6_Con=SEQIDNOs:100、139和102;7_10_Con=SEQIDNOs:103和140;11_13_Con=SEQIDNOs:106和107。图12、其它ABA激动剂的活性。所列化合物包括天然产生的植物化合物青蒿酸及其类似物。定义本文中使用的术语“启动子”是指能够启动细胞中编码序列进行转录的多核苷酸序列。因此,本发明中使用的启动子的多核苷酸结构中包括顺式作用转录调控元件和涉及调控或调节基因的转录时间和/或速率的调控序列。例如,启动子可以是顺式作用转录调控元件,包括涉及转录调控的增强子、启动子、转录终止子、复制起始位点、染色体整合序列、5'和3'非翻译区或内含序列。这些顺式作用序列一般与蛋白或其它分子作用实现(开启/关闭、调控、调节等)基因转录。“植物启动子”是指能够在植物细胞中起始转录的启动子。“组成型启动子”是指能够在几乎所有组织中起始转录的启动子,而“组织特异性启动子”仅在一种或几种特定组织中起始转录。术语“植物”包括整个植株、枝条的营养器官和/或结构(例如,叶、茎和块茎)、根、花和花器官(例如,苞片、萼片、花瓣、雄蕊、心皮、花药)、胚珠(包括卵细胞和中央细胞)、种子(包括受精卵、胚胎、胚乳和种皮)、果实(例如,成熟的子房)、种苗、植物组织(例如,维管组织、基本组织等)、细胞(例如,保卫细胞、卵细胞、毛状体等)及其子代。可用于本发明方法中的植物种类一般是指可广泛适合于转化技术的高等和低等植物种类,包括被子植物(单子叶和双子叶植物)、裸子植物、蕨类植物和多细胞藻类植物。它包括多种倍性水平的植物,包括非整倍体、多倍体、二倍体、单倍体和半合子。如果多核苷酸序列来自外源物种,或如果来自经过修饰的相同物种的原始形式,则它对于有机体是“异源的”或者是第二多核苷酸序列(asecondpolynucleotidesequence)。例如,当说到启动子与外源编码序列可操作连接时,是指所述编码序列来自一个物种,而启动子来自另一不同物种;或如果二者来自相同物种,所述编码序列不是与该启动子天然连接的(例如,遗传工程编码序列,如来自相同物种的不同基因或来自不同生态型或品种的等位基因)。某株植物的“外源的”多核苷酸,是指通过除了有性杂交以外的任何方法将核苷酸引入该植株中的多核苷酸。可采用的方法的实例如下,包括农杆菌介导转化法、基因枪法、电穿孔等。这类含有外源核酸的植物此处称为T1(例如,通过真空渗透得到的拟南芥)或R0(从体外转化细胞再生的植物)代转基因植物。本文中使用的术语“转基因”描述了非天然存在的含有人工修饰的基因组的植物,其中植物基因组中包括来自相同或不同植物物种的外源核酸分子。所述外源核酸分子可以是基因调控元件,如启动子、增强子或其它调控元件,或可含有可与异源基因调控元件连接的编码序列。这类植物通过有性杂交或自交产生的转基因植物的后代,也被称为“转基因的”。“表达盒”是指核酸构建体,当引入至宿主细胞中时,分别导致RNA或多肽的转录和/或翻译。不能被翻译的反义或正义构建体特别地包括在该定义内。在转基因表达且内源基因抑制(例如,通过反义或正义抑制)的情况下,本领域技术人员应知道插入的多核苷酸序列不必相同,但可以仅与衍生该多核苷酸序列的基因序列“大体相同”。如下面所解释的,这些大体相同的变体(variants)通过引用被特定核酸序列专门涵盖。“提高的”或“增强的”PYR/PYL表达或活性是指蛋白表达或活性增强的变化。这种增强的活性或表达的实例包括,例如使PYR/PYL的表达高于对照水平,和/或其在对照中不表达的例如某个位置或时间上异位(ectopically)表达。在一些实施方案中,PYR/PYL表达或活性高于其在野生型、非转基因对照植物中的水平(即,PYR/PYL的活性或PYR/PYL基因的表达增强)。在一些实施方案中,PYR/PYL的表达或活性可存在于,例如,野生型、非转基因对照植物中通常检测不到的器官、组织或细胞中(即,PYR/PYL表达或活性在某些组织中增强)。在一些实施方案中,当存在于器官、组织或细胞中的PYR/PYL表达或活性的时间比在野生型、非转基因对照植物中的时间长(即,PYR/PYL表达或活性的时间增加了),PYR/PYL的表达或活性增强。如果在进行下述最大对应的比对时,核苷酸或氨基酸残基序列中两条序列中分别相同,则称两个核酸序列或多肽是“相同的”。两条或多条核酸或多肽序列中的术语“相同的”或“相同”百分数,是指在比较窗口中进行最大对应的比较和比对时,两条或多条序列或子序列(subsequence)是相同的或有特定百分数的氨基酸或核苷酸是相同的,测定采用的是以下一种序列比较算法或人工比对和目测比对。当序列相同百分数被用于蛋白或多肽时,应认识到不同的残基位置通常由于保守氨基酸的替换而不同,氨基酸残基被替换成其它具有相似化学性质(例如,电荷或疏水性)的氨基酸残基,因此不改变该分子的功能。由于保守替换导致序列不同,针对替换的保守性质可上调序列相同百分数予以纠正。调整的方法是本领域技术人员所熟知的。一般包括给部分而不是全部错配的保守替换打分,从而提高序列相同百分数。因此,例如,相同的氨基酸给定分值为1,非保守替换给定分值为0,保守替换给定分值为0-1。保守替换分值的计算根据,例如Meyers&Miller,ComputerApplic.Biol.ScL4:11-17(1988)的算法,例如,执行程序PC/GENE(Intelligenetics,MountainView,California,USA)。本文中使用的短语“大体相同”是指两条核酸或多肽,与对照序列至少25%序列相同。或者,相同百分数可以是25%-100%之间的整数。采用上述程序,与对照序列比较,一些实施方案包括至少25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或99%;优选BLAST采用下述标准参数。本发明提供核酸编码的、与SEQIDNO:2-90或108-137之一大体相同的多肽。在进行序列比较时,一般以一条序列作为参考序列,待测序列与其比较。当采用序列比较算法时,将待测序列和参考序列输入计算机,进行序列匹配,如有必要,可设定序列算法程序参数。可使用默认程序参数或可设定另外的参数。然后基于所述程序参数,序列比较算法计算出待测序列相对于参考序列的序列相同百分数。本文中使用的“比较窗口”包括在两条序列进行最优比对后,参考任一选自由20-600,通常约50-约200,更通常为约100-约150个组成的组的连续位置数目的区域,使序列与相同数目的连续位置的参考序列相比较。比较序列的比对方法为本领域熟知。序列最优比对的比较可按照Smith&Waterman,Adv.Appl.Math.2:482(1981)的局部同源性算法进行,按照Needleman&Wunsch,J.Mol.Biol.48:443(1970)的同源性比对算法进行,按照Pearson&Lipman,Proc.Nat'l.Acad.ScLUSA85:2444(1988)搜索相似性的方法进行,利用这些算法的计算机运行(GAP,BESTFIT,FASTA,andTFASTAintheWisconsinGenetics.SoftwarePackage,GeneticsComputerGroup,575ScienceDr.,Madison,WI),或通过人工比对和目测比对。适合于测定序列相同百分数和序列相似百分数的算法的实例是BLAST和BLAST2.0算法,分别描述于Altschul等人(1990)/.Mol.Biol.215:403-410和Altschul等人(1977)NucleicAcidsRes.25:3389-3402中。用于进行BLAST分析的软件可通过美国国家生物技术信息中心(NCBI)网站公开获得。所述算法包括首先通过在查询序列(querysequence)中确定长度W的短词,从而确定高分序列配对(HSPs),当与数据库中的相同长度序列的词比对时,该查询序列或者匹配或者达到满意的正阈分值T。T是指相邻词的分值阈值(Altschul等人,同上)。以这些起始相邻词采样数(wordhits)作为种词用于起始搜索找到更长的含有它们的HSPs。然后,所述词采样数沿每条序列的两个方向延伸,只要累计的比对分能够增加。采用参数M(匹配残基对则加分;总是>0)和N(不匹配残基则罚分;总是<0)计算核苷酸序列的累计分。对于氨基酸序列,分值矩阵用于计算累计分。当累计比对分X量落入其最大获取值以外时;由于一个或多个负分残基比对的积累,当累计分趋于零或更低时;或达到任一条序列的末端时,每个方向上词采样数的延伸停止。BLAST算法参数W、T和X决定了比对的敏感性和速度。BLASTN程序(用于核苷酸)使用默认的词大小(W)为28,期望值(E)为10,M=1,N=2,比较两条链。对于氨基酸序列,BLASTP程序使用默认的词大小(W)为3,期望值(E)为10,BLOSUM62分值矩阵(见Henikoff&Henikoff,Proc.Natl.Acad.ScLUSA89:10915(1989))。BLAST算法还可进行两条序列间相似性的统计分析(见,例如Karlin&Altschul,Proc.Nat'l.Acad.ScLUSA90:5873-5787(1993))。BLAST算法提供的一种相似性测定是最小总和概率(P(N)),其根据两条核苷酸或氨基酸序列之间随机产生的匹配提供概率的指示。例如,如果待测核酸与参考核酸比较中,最小总和概率≤约0.01,更优选≤约10-5,最优选≤约10-20,则认为核酸与参考序列相似。“保守修饰的变体”适用于氨基酸和核苷酸序列。对于特定的核酸序列,保守修饰的变体是指那些编码相同或基本相同氨基酸序列的核苷酸,或所述核苷酸不编码基本相同的氨基酸序列。由于遗传密码的简并性,大量功能相同的核苷酸编码任何给定的蛋白。例如,密码子GCA、GCC、GCG和GCU都编码丙氨酸。因此,在每个位置,丙氨酸由密码子限定,密码子可改变为任何所述相关密码子而不改变所编码的多肽。这类核苷酸变化为“沉默变化(silentvariation)”,是一种保守修饰变化。本文中每条编码多肽的核苷酸序列还描述了各种可能的核苷酸的沉默变化。本领域技术人员应知道每个核苷酸密码子(除AUG之外,其通常仅编码甲硫氨酸)可被修饰以产生功能相同的分子。因此,每个编码多肽的核苷酸的沉默变化在各所述序列中是隐含的。至于氨基酸序列,本领域技术人员应知道,核苷酸、肽、多肽或蛋白序列的单个替换改变单个氨基酸或编码序列中的少量氨基酸,其为“保守修饰变体”,该变化导致氨基酸被替换成化学性质相似的氨基酸。提供功能相似氨基酸的保守替换表是本领域熟知的。以下六组,各含有彼此保守替换成另一氨基酸的氨基酸:1)丙氨酸(A),丝氨酸(S),苏氨酸(T);2)天门冬氨酸(D),谷氨酸(E);3)天门冬酰胺(N),谷氨酰胺(Q);4)精氨酸(R),赖氨酸(K);5)异亮氨酸(I),亮氨酸(L),甲硫氨酸(M),缬氨酸(V);以及6)苯丙氨酸(F),酪氨酸(Y),色氨酸(W)。(见,例如Creighton,Proteins(1984))。本文中使用的术语“抗旱性”或“耐旱性”,包括任何其变体,是指植物从干旱胁迫期(即,很少水或没有水的天数)恢复的能力。一般地,干旱胁迫至少为5天,也可长达例如18或20天或更长(例如,至少6、7、8、9、10、11、12、13、14、15、16、17、18、19、20天),取决于例如植物的物种。发明详述Ⅰ.介绍本发明部分基于对小有机分子选择性脱落酸(ABA)激动剂以及需要ABA激动剂活性的PYR1蛋白的发现。还进一步发现PYR1是PYR/PYL受体蛋白家族的一个成员。待测植物表达≥一种PYR/PYL受体蛋白家族成员,且具有至少某些冗余活性。增强一种或多种PYR/PYL蛋白在植物中的表达或活性,将导致ABA敏感性增强以及相应提高的胁迫(例如,冷、热、盐或旱)响应和耐受以及其它期望的ABA介导的表型。脱落酸是一种多功能的植物激素,参与各种植物的保护功能,包括芽休眠、种子休眠和/或成熟,叶片和果实的脱落,以及各种各样的生物胁迫(例如冷、热、盐和旱)响应。通过一个独立于CO2浓度的机制,ABA还负责调节气孔关闭。因此,由于PYR/PYLABA受体蛋白介导ABA信号转导,这些表型可通过调节PYR/PYL的表达进行调节。植物中ABA诱导的表型可以通过增加的PYR/PYL表达来增加或加速,而这样的植物表型,可以通过减少PYR/PYL的表达来减少或减缓。PYR/PYL介导ABA信号转导作为例如,种子发芽、发芽后生长、气孔运动和植物对胁迫的耐受性,包括但不限于干旱的正调节子。因此,当通过过表达PYR/PYL使脱落酸敏感性增强时,可获得期望的植物特点,如增加的胁迫(例如,干旱)耐受和延迟的种子发芽。其它可在本发明的植物中产生的期望的特点包括,例如,开花时间的变化和/或增加的叶绿素含量。Ⅱ.ABA激动剂本发明提供小分子ABA激动剂,即激活PYR/PYL蛋白的化合物。示例ABA激动剂包括,例如,选自下式的化合物:其中,R1选自由可任选被1-3个R1a基团取代的芳基和杂芳基组成的组;各R1a独立选自下组:H、卤素、C1-6烷基、C1-6卤代烷基、C2-6烯基、C2-6炔基、C1-6烷氧基、C1-6卤代烷氧基、C1-6羟烷基、-NR'R"、-SR'、-OH、-CN、-NO2、-C(O)R'、-C(O)OR'、-C(O)NR'R"、-N(R')C(O)R"、-N(R')C(O)OR"、-N(R')C(O)NR'R"、-OP(O)(OR')2、-S(O)2OR'、-S(O)2NR'R"、环烷基、杂环烷基、芳基和杂芳基,其中芳基可任选被-NO2取代,且杂芳基可任选被C1-6烷基取代;可选择地,相邻R1a基团可结合形成选自下组中的成员:环烷基、杂环烷基、芳基和杂芳基,其中芳基可任选被-OH取代;R'和R"各自独立选自由H和C1-6烷基组成的组;R2选自下组:C2-6烯基、环烯基、芳基和杂芳基;R3为H或任选与R2和各自连接的原子结合形成可任选被1-3个R1a基团取代的杂环烷基;R4为可任选被1-3个R1a基团取代的杂芳基;R5选自由C1-6烷基和芳基组成的组,其中所述芳基可任选被1-3个R1a基团取代;各R6和R7独立选自由芳基和杂芳基组成的组,各自可任选被1-3个R1a基团取代;R8选自由环烷基和芳基组成的组,各自可任选被1-3个R1a基团取代;R9为H或任选与R8的R1a基团和各自连接的原子结合形成杂环烷基;下标n为0-2;X不存在或选自由-O-和-N(R')-组成的组;Y不存在或选自由-C(O)-和-C(R',R")-组成的组;Z不存在或选自由-N=和-C(S)-N(R')-组成的组,使Y和Z之一不存在;各R10和R11独立选自由H、C1-6烷基、-C(O)OR'和C1-6烯基-C(O)OH组成的组,其中R10和R11基团中至少两个为C1-6烷基,R10和R11基团中至少一个为C1-6烯基-C(O)OH;可选择地,连接于相同碳原子上的两个R10或R11基团结合形成=O;可选择地,一个R10基团和一个R11基团结合形成3至6元的环烷基;各下标k和m为整数1-3,使k和m之和为3-4;各下标p和r为整数1-10;其中位于相邻碳原子上的两个R10或R11基团结合形成键;R12为被=O取代的C1-6烷基;R13为C1-6烯基-C(O)OH;R14选自由H和C1-6烷基组成的组;以及下标r为整数1-10;条件是,当R1为4-溴-萘-1-基,且n为1时,R2为除未取代的吡啶-2-基以外的基团。示例化合物进一步描述于实施例和附图中。参见,例如图9、10和13。本发明的ABA激动剂化合物可通过本领域技术人员已知的各种方法制备得到。例如,磺胺化合物可由磺酰氯和胺反应以制备得到磺胺。本发明的酰胺化合物可通过类似的方式,采用酰基氯替代磺酰氯或本领域技术人员已知的碳二亚胺耦合试剂来制备。其它制备本发明化合物的方法是本领域技术人员已知的,例如,描述于ComprehensiveOrganicTransformations,2ded.,RichardC.Larock,1999的方法。上述方法的起始原料为市售获得(Sigma-Aldrich),或采用本领域技术人员已知的方法进行制备。植物(或植物部位如种子)中ABA诱导的表型可通过使植物与足量的本发明ABA激动剂接触以诱导ABA诱导型表型来增加或加速。本发明的ABA激动剂是有益的,用作例如正增强剂,例如延迟种子发芽、发芽后生长、气孔运动和植物抗逆性包括但不限于干旱。Ⅲ.ABA激动剂制剂本发明提供用于接触植物而配制的农用化学制剂,其中该制剂包括本发明的ABA激动剂。在一些实施方案中,与激动剂接触的植物不含有或表达异源PYR/PYL多肽(例如,植物不是转基因植物,或植物是转基因植物但表达异源蛋白而不是异源PYR/PYL蛋白)。在一些实施方案中,与激动剂接触的植物含有或表达本文中所述的异源PYR/PYL多肽。根据本发明,例如在载体中,所述制剂适合用于处理植物或植物繁殖材料,如种子。适合的添加剂包括缓冲剂、润湿剂、包膜剂、多糖和研磨剂。示例载体包括水、水溶液、浆料、固体和干燥粉末(例如泥炭、小麦、麸皮、蛭石、粘土、消毒的土壤、多种形式的碳酸钙、白云石、各种档次的石膏、膨润土和其它粘土矿物、磷矿石和其它磷化合物、二氧化钛、腐殖质、滑石、藻酸盐和活性炭。任何本领域技术人员已知的农业上适合的载体是可接受的,且可用于本发明中。任选地,所述制剂还可包括至少一种表面活性剂、除草剂、杀菌剂、杀虫剂或肥料。处理可采用已知的各种方法,例如,通过在繁殖材料上喷洒、喷雾、喷粉或播撒该组合物,或涂刷或泼洒或以其它方式使植物接触组合物,如果是种子,则通过涂布、包裹或以其它方式处理种子。另一种在种植前直接处理植物或种子的方法,还可将本发明的制剂引入土壤或其它待播种种子的培养基。在一些实施方案中,还可使用载体。所述载体可以是如上所述的固态、液态。在一些实施方案中,泥炭悬浮于水中,作为ABA激动剂的载体,在种植种子时,将这种混合物喷洒入土壤或种植介质中和/或喷洒于种子表面。IV.新ABA激动剂和拮抗剂的筛选本发明还提供筛选ABA激动剂和拮抗剂的方法,其通过筛选在激动剂情况下能够诱导PYR/PYL-PP2C结合的分子,或在拮抗剂情况下能够破坏ABA和其它激动剂促进PYR/PYL-PP2C结合的能力的分子。可使用许多不同的筛选方案以鉴定激动(agonize)或拮抗(antagonize)PYR/PYL多肽的试剂。筛选可使用分离的、纯化的或部分纯化的试剂进行。在一些实施方案中,可使用纯化的或部分纯化的PYR/PYL多肽。或者,可使用基于细胞的方法。例如,可使用天然表达PYR/PYL多肽的细胞或重组表达PYR/PYL多肽的细胞。在一些实施方案中,可使用植物细胞,动物细胞,细菌细胞,真菌细胞,包括但不限于酵母细胞,昆虫细胞或哺乳动物细胞。概括地,筛选方法包括筛选多种试剂以鉴定能够调节PYR/PYL多肽活性的试剂,例如,通过结合PYR/PYL多肽,或激活PYR/PYL多肽,或提高PYR/PYL多肽的表达,或增加编码PYR/PYL多肽的转录物。1、PYR/PYL多肽结合检测任选地,初级筛选可通过筛选能够结合PYR/PYL多肽的试剂来进行,因为至少其中一些这样鉴定出的试剂可能是PYR/PYL多肽调节剂。结合检测可包括用一种或多种检测试剂接触PYR/PYL多肽,用足够长的时间使蛋白质和检测试剂形成结合复合物。可采用任何一种已建立的分析技术检测任何形成的结合复合物。蛋白结合检测方法包括,但不限于,在非变性SDS聚丙烯酰胺凝胶上测定共沉淀或共迁移,以及在蛋白印迹(Westernblots)上检测共迁移(见,例如Bennet,J.P.和Yamamura,H.I.(1985)"Neurotransmitter,HormoneorDrugReceptorBindingMethods,"inNeurotransmitterReceptorBinding(Yamamura,H.L,等人,eds.),pp.61-89)。其它结合检测包括使用质谱或NMR技术鉴定结合PYR/PYL多肽的分子或标记底物的置换(例如,标记的ABA)。检测中使用的PYR/PYL多肽蛋白可以是天然表达的、克隆的或合成的。2、活性可通过筛选能够激活或增强PYR/PYL多肽活性的试剂来鉴定PYR/PYL多肽激动剂。可通过降低活性来鉴定拮抗剂。一种活性检测包括测试候选激动剂是否能够诱导PYR/PYL蛋白与2型蛋白磷酸酶(PP2C)多肽以激动剂特异的方式结合。哺乳动物或酵母双杂交法(见,例如,Bartel,P.L.等人MethodsEnzymol,254:241(1995))可用于鉴定当共同表达于细胞中时,发生相互作用或结合的多肽或其它分子。在一些实施方案中,在酵母双杂交检测中,在PYR/PYL多肽和2型蛋白磷酸酶(PP2C)多肽之间鉴定激动PYR/PYL多肽的试剂,其中能够激活或能够使PYR/PYL多肽与PP2C多肽结合的试剂被鉴定为ABA激动剂。因此,两种多肽在该试剂存在时结合,而在无该试剂的条件下不结合。在一些实施方案中,在酵母双杂交检测中,在PYR/PYL多肽和2型蛋白磷酸酶(PP2C)多肽之间鉴定拮抗PYR/PYL多肽的试剂,其中能够降低PYR/PYL多肽与PP2C多肽结合的试剂被鉴定为ABA拮抗剂,任选在ABA或PYR/PYLABA激动剂存在的条件下。因此,拮抗剂阻断在通常情况下受到ABA或其它激动剂促进的两种多肽的正常结合,或者,观察到其与PYR/PYL蛋白发生的结构性相互作用。3、表达检测本发明还提供对能够增强PYR/PYL多肽表达的化合物的筛选。筛选方法一般包括进行基于细胞的或基于植物的检测,受试化合物与一种或多种表达PYR/PYL多肽的细胞接触,然后检测PYR/PYL表达(或转录物或翻译产物)的增加。可采用天然表达PYR/PYL的细胞或经重组改造的表达PYR/PYL的细胞,或经重组改造在PYR/PYL启动子的控制下表达报告基因的细胞进行检测。可进行各种对照试验以确保检测到的活性是真实的,包括用不含该报告构建体的细胞,或通过使含有该报告构建体的细胞不与受试化合物接触而设置平行反应。4、验证通过任一种前述筛选方法最初鉴定得到的试剂可进一步进行测试以验证该试剂显著的活性和/或确定该试剂的其它生物学效果。在一些实例中,测试所鉴定得到的试剂作用于植物逆境(plantstress)(例如,耐旱性)、种子发芽或其它受ABA影响的表型的能力。许多这类检测方法和表型是本领域已知的,且可用于本发明的方法中。5、固相和可溶性高通量检测在本发明的高通量检测中,一天中可筛选高达数千个不同的调节剂或配体。特别是,每一个微孔板可用于单独检测所选的潜在调节剂,或如果算上检测浓度或孵育时间的影响,每5-10孔可测试一个调节剂。因此,一个标准的微孔板可检测约100(例如96)个调节剂。如果使用1536个微孔板,然后每一个微孔板可容易地检测出约100-约1500个不同的化合物。每天可以检测几个不同的微孔板,使用本发明的集成系统,可检测筛选出高达约6,000-20,000个或更多的不同的化合物。此外,试剂操作可使用微流体法(microfluidicapproaches)。目标分子(例如,PYR/PYL或表达PYR/PYL多肽的细胞)可以直接或间接地,通过共价或非共价键结合于固相组分。本发明提供高通量下在体外进行检测而鉴定能够调节PYR/PYL表达或活性的化合物。Ⅴ.PYR/PYL受体多肽本发明的多肽,当表达于植物中时,介导ABA和ABA类似物信号转导。在一些实施方案中,PYR/PYL多肽与PP2C多肽(例如,ABI1或2或它们的直系同源物,例如来自PP2Cs亚家族A组)以ABA、帕雷巴克汀、或本发明所述的其它ABA激动剂依赖的方式发生作用(例如,在酵母双杂交检测中)。多种PYR/PYL多肽序列是本领域已知的,且可用于本发明的方法和组合物。此处应注意的是,虽然PYR1起初在拟南芥中被鉴定为ABA受体,实际上PYR1是拟南芥中相同蛋白家族的至少14个蛋白(PYR/PYL蛋白)的组的成员,并且也介导ABA信号转导。该蛋白家族还存在于其它植物中(见,例如序列表(SEQUENCELISTING)),其部分特征为存在一个或多个或全部的聚酮环化酶(polyketidecyclase)结构域2(PF10604)、聚酮环化酶结构域1(PF03364)和BetⅤⅠ结构域(PF03364)。START/Betv1超家族结构域描述于,例如,Radauer,BMCEvol.Biol.8:286(2008)。在想获得上述序列的变体或直系同源物的情况下,可进行序列比对以鉴定保守的氨基酸或基序(motif)(即,序列的变化可改变蛋白功能)以及比对序列中发生变化的区域(即,序列的变化不显著影响蛋白的活性)。SEQIDNO:1、91和92提供一致性序列用于鉴定PYR/PYL多肽。其它有用的一致性序列包括,例如EXLXXXDXXXXXXXXXXXGGXHXL(SEQIDNO:138);CxSxxxxxxxAPxxxxWxxxxxFxxPxxxxxFxxxC(SEQIDNO:93),GxxRxVxxxSxxPAxxSxExLxxxD(SEQIDNO:94)和/或GGxHRLxNYxS(SEQIDNO:95)。此外,更多特定的一致性序列可通过比对拟南芥PYR/PYL蛋白14个成员的亚型(subsets)而呈现。这些一致性序列的实例包括,例如,PYR1-PYL12CxSxxxxxxxAPxxxxWxxxxxFxxPxxxKxFxxxC(SEQIDNO:96)GxxRxVxxxSxLPAxxSxExLxxxD(SEQIDNO:97)GGxHRLxNYxS(SEQIDNO:98)ESxxVDxPxGNxxxxTxxFxxxxxxxNLxxL(SEQIDNO:99)PYR1-PYL6HxxxxxxxxCxSxxxxxxxAPxxxxWxxxxxFxxPxxYKxFxxxC(SEQIDNO:100)VGRxVxVxSGLPAxxSxExLxxxDxxxxxxxFxxxGGxHRLxNYxSVT(SEQIDNO:101)VxESYxVDxPxGNxxxxTxxFxDxxxxxNLQxL(SEQIDNO:102)PYL7-PYL10HxHxxxxxQCxSxLVKxIxAPxHxVWSxVRRFDxPQKYKPFxSRCxVxGx(SEQIDNO:103)ExGxxREVxxKSGLPATxSTExLExLDDxEHILxIxIxGGDHRLKNYSSxxxxHxExIxGxxGTx(SEQIDNO:104)xxESFVVDVPxGNTKxxTCxFVExLIxCNLxSLAxxxERL(SEQIDNO:105)PYL11-PYL13CxSxxVxTIxAPLxLVWSILRxFDxPxxxxxFVKxCxxxSGxGG(SEQEDNO:106)GSVRxVTxVSxxPAxFSxERLxELDDESHVMxxSπGGxHRLVNYxSKT(SEQIDNO:107)因此,在一些实施方案中,本发明的PYR/PYL多肽包括一种或多种上述一致性序列或它们的保守变体。本领域技术人员应知道,上述一致性序列的变化位置可基于它们在特定PYR1多肽(例如,在SEQIDNOs:2-90中任一序列内出现)中的相关位置所出现的氨基酸进行选择,或者也可以是它们的保守取代。在一些实施方案中,本发明的PYR/PYL多肽与以下任一条序列大体相同(例如,至少70%、75%、80%、85%、90%、95%相同),SEQIDNO:2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136或137。本发明提供上述蛋白和/或编码所述多肽的核酸序列在本发明方法和组合物(例如,表达盒、植物等)中的应用。可采用多种技术,分离编码植物PYR/PYL(例如,从尚未鉴定的植物PYR/PYL序列中)的多核苷酸序列。例如,基于本文中公开的PYR/PYL编码序列(例如,序列表中列出的序列)的寡核苷酸探针,可用于鉴定cDNA或基因组DNA文库中想要的PYR/PYL基因。为了构建基因组文库,通过随机片段化,例如,用限制性内切核酸酶产生大的基因组DNA片段,并与DNA载体连接形成串联体(concatemer),其可被包装于适合的载体中。为了制备cDNA文库,从想要的组织如特定植物物种的叶片中分离mRNA,由该mRNA制备得到含有目标基因转录物的cDNA文库。或者,cDNA可由从其它表达PYR/PYL基因的组织中提取的mRNA制备得到。然后用基于本文中公开的PYR/PYL基因序列设计的探针筛选cDNA或基因组文库。探针可用于与基因组DNA或cDNA序列杂交以分离相同或不同植物物种中的同源基因。或者,针对多肽设计的抗体可用于筛选mRNA表达文库。或者,编码PYR/PYL的核酸可采用扩增技术由核酸样品扩增得到。例如,聚合酶链式反应(PCR)技术可用于直接从基因组DNA、cDNA、基因组文库或cDNA文库扩增得到编码PYR/PYL的序列。PCR及其它体外扩增方法还可用于,例如克隆编码表达PYR/PYL的核苷酸序列,制备用作探针的核酸用于检测样品中目的mRNA存在,用于核酸测序或用于其它目的。有关PCR的综述见PCR手册(PCRProtocols):AGuidetoMethodsandApplications.(Innis,M,Gelfand,D.,Sninsky,J.andWhite,T.,eds.),AcademicPress,SanDiego(1990)。用于鉴定植物组织序列的适合的引物和探针,通过将本文中提供的序列与其它相关基因进行比较而产生。在一些实施方案中,许多植物的部分或全部基因组已经进行了测序,且确定了开放阅读框。通过BLAST搜索,人们可以确定各种植物中编码PYR/PYL的序列。术语PYR/PYL多肽包括天然产生的PYR/PYL多肽(或编码此类多肽的核酸)变体。变体包括,例如融合蛋白、仍保留活性的缺失或突变。在一些实施方案中,PYR/PYL多肽在ABA(或ABA激动剂)存在下激活(例如,以PP2C进行双杂交检测或其它受体检测来测定),但在无ABA或激动剂时不具有显著活性。另外,在一些实施方案中,本发明的PYR/PYL多肽为组成型活性,即在ABA或ABA激动剂存在时具有活性。如实施例中描述的,本发明人发现拟南芥中PYR1的H60P、M158T、M158I、M158S或M158V突变将蛋白变为组成型活性蛋白。由于这些位置(H60和M158)存在于PYR/PYL蛋白二聚体的表面,可以认为通过在其它二聚体表面位置上(例如,F61、K63、I84、S85、L87、P88、A89、S152、D155、T156、F159、T162、L166和/或K170)引入氨基酸变化可以产生其它组成型突变。尽管上述位置是参考拟南芥PYR1蛋白设定的,然而其它PYR/PYL多肽中的相关位置也包含于上述说明中。用标准比对软件如BLAST可以容易地确定其它PYR/PYL多肽中的相关位置。尽管以上描述了特定的氨基酸变化,本发明旨在包括上述特定氨基酸旁侧的其它氨基酸的突变。在一些实施方案中,例如,保守氨基酸可包括在内取代上述突变。有趣的是,本发明人观察到一些天然出现的PYR/PYL蛋白在H60相关位置上天然具有一个P。例如,拟南芥PYL9在该位置上具有一个P。本发明人发现PYL9为组成型活性。在一些实施方案中,通过将“H60”位(参考拟南芥PYR1中的位置)上的脯氨酸改变为组氨酸或其它非脯氨酸的氨基酸,使组成型活性PYR/PYL蛋白转化为受ABA或ABA激动剂激活的蛋白。因此,本发明提供组成型活性的且含有上述突变的PYR/PYL多肽。在一些实施方案中,所述组成型多肽包括一条或多条上述一致性序列和/或与SEQIDNOs:2-90之一大体相同的序列。VI.本发明PYR/PYL核酸和多肽的应用本发明提供了通过改变PYR/PYL表达或活性,调节植物中ABA敏感性的方法,例如,通过向植物中引入含有与PYR/PYL核苷酸可操作连接的调控元件(例如,启动子)的重组表达盒,所述PYR/PYL核苷酸即编码PYR/PYL的核酸或含有PYR/PYLmRNA或其互补序列一部分的序列。在一些实施方案中,本发明的方法包括增加和/或异位表达编码植物中PYR/PYL多肽的一个或多个PYR/PYL多核苷酸。这种实施方案可用于提高植物的ABA敏感性,并导致例如增强的胁迫(例如,干旱)耐受和/或延迟的种子发芽(以避免过早萌发,例如可发生在潮湿的环境中或因其它暴露在湿气中)。针对胁迫耐受,一般可选择组成型且表达于大多数植物组织中,或者是叶或根特异的启动子。为了影响种子发芽,一般使用能够导致在种子中,在一些实施方案中在花器官或胚中表达的启动子。在一些实施方案中,本发明方法包括降低植物中内源PYR/PYL表达,从而降低植物中ABA敏感性。此类方法包括,例如植物中PYR/PYL序列的遗传突变(例如,化学、辐射、转座子或其它诱变),以降低PYR/PYL表达或活性,或引入与PYR/PYLcDNA序列或其互补序列(例如,“RNAi构建体”)至少部分大体相同的多核苷酸以降低PYR/PYL表达。下降的(或增强的)PYR/PYL表达可用于调控叶柄脱落区的形成,从而控制叶片脱落,即如果叶片脱落区中的表达降低,则延缓叶片脱落,如果叶子脱落区中的表达增加,则加速叶片脱落A.增加PYR/PYL表达或活性本文中制备的分离的序列还可用于制备能够增强或提高PYR/PYL基因表达的表达盒。当期望过表达目的基因时,可使用来自相同物种或不同物种(或与来自另一个物种的编码PYR/PYL多肽的基因或核苷酸大体相同)的目的基因(或至少编码PYR/PYL多肽的多核苷酸)。在一些实施方案中,为了降低潜在的正义抑制影响,可使用来自不同物种(或与来自另一个物种的编码PYR/PYL多肽的基因或多核苷酸大体相同)的编码PYR/PYL多肽的多核苷酸。可采用本领域熟知的众多方法中的任何一种来增强植物中PYR/PYL活性。任何器官或植物部位可作为靶标,如枝条的营养器官/结构(例如叶、茎和块茎)、根、花和花器官/结构(例如苞片、萼片、花瓣、雄蕊、心皮、花药和胚珠)、种子(包括胚、胚乳和种皮)、果实、脱落区等。或者,一个或几个PYR/PYL基因可组成型地表达(例如,使用CaMV35S启动子或其它组成型启动子)。本领域技术人员应知道由本发明基因编码的多肽,像其它蛋白一样,具有行使不同功能的不同结构域。因此,过表达或异位表达的多核苷酸序列不必是全长,只需表达想要的蛋白的结构域。或者,或此外,活性PYR/PYL蛋白可以是在不必大大改变PYR/PYL活性下的融合表达。融合表达参与者(partners)的实例包括,但不限于,多组氨酸或其它标签序列。B.降低PYR/PYL表达或活性可采用许多方法抑制植物中基因表达。各种抑制基因表达的方法是已知的,并可用于抑制多个PYR/PYL基因之一的表达。见,例如美国专利Nos.5,759,829、5,107,065、5,231,020、5,283,184、6,506,559、6,573,099,6,326,193、7,109,393。例如,可方便地使用反义技术。为了实现该技术,克隆来自目的基因的一段核酸,并与启动子可操作地连接,使RNA的反义链能够被转录。然后将表达盒转入植物中并生产RNA的反义链。在植物细胞中,已表明反义RNA通过阻止编码目的酶的mRNA的累积而抑制基因表达,见,例如Sheehy等人,Proc.Nat.Acad.ScLUSA,85:8805-8809(1988);Pnuelietal.,ThePlantCell6:175-186(1994);andHiattetal,U.S.PatentNo.4,801,340。转入植物中的反义核酸序列应与内源基因或被抑制的基因至少部分大体相同。然而,该序列不必与被抑制表达的基因完全相同。因此,仅编码PYR/PYL多肽的一部分或PYR/PYLcDNA的一部分的反义或正义核酸分子,可用于生产PYR/PYL表达受到抑制的植物。可设计本发明的载体,使抑制效果可应用于显示出与靶基因同源或基本同源的基因家族中的其它蛋白。在一些实施方案中,可使用一种或多种反义或正义或其它siRNA核酸分子同时抑制多于一个PYR/PYL多肽的表达。用于反义抑制,相对于初级转录物或完全加工的mRNA而言,所引入的序列可不必是全长。一般地,更高的同源性可用于补偿短序列的使用。而且,所引入的序列不必具有相同的内含子或外显子结构,且非编码区的同源性可同样有效。例如,可使用约30或40个核苷酸之间的序列,在一些实施方案中,尽管可以使用至少约20、50、100、200或500个核苷酸的序列,然而应当使用约全长的核苷酸。还可使用催化RNA分子或核酶抑制PYR/PYL的表达。可设计与几乎任何靶RNA特异配对的核酶,并在特定位置切断磷酸二酯骨架,从而功能性灭活靶RNA。在进行切割时,核酶本身不发生变化,因此能够循环使用并切割其它分子,使其成为真正的酶。反义RNA中含有的核酶序列使其具有RNA切割活性,从而提高了该构建体的活性。已确定了许多类别的核酶。一类核酶衍生自植物中能够自切割并复制的许多小环状RNA。RNA或者单独复制(类病毒RNA)或者随辅助病毒(卫星mRNA)一起复制。具体实例包括来自鳄梨日斑类病毒的RNA和来自烟草环斑病毒、卢塞恩瞬态条纹病毒、烟草绒斑驳病毒、茛菪斑驳病毒和地下三叶草斑驳病毒的卫星RNA。靶RNA特异核酶的设计和使用描述于Haseloff等人Nature,334:585-591(1988)。抑制的另一种方法为正义抑制(又称为共抑制)。引入含有沿启动子正向上配置的核酸的表达盒,已证明是一种有效的阻断靶基因转录的方法。采用该方法调节内源基因表达的实例见,Napoli等人,ThePlantCell2:279-289(1990);Flavell,Proc.Natl.Acad.ScI,USA91:3490-3496(1994);KooterandMol,CurrentOpin.Biol.4:166-171(1993);以及美国专利Nos.5,034,323、5,231,020和5,283,184.。一般地,只要抑制基因表达,就会出现一些引入序列的转录。该效果可能出现于本身不含编码序列、而仅含有内含子或与内源序列的初级转录物中存在的序列同源的非翻译序列的引入序列。一般引入序列与要被抑制的内源序列大体相同。最小同源性一般高于约65%,更高的同源性能够更有效地抑制内源序列的表达。在一些实施方案中,使用具有较高同源的序列,例如,使用具有至少约80%,至少约95%或100%同源性的序列。根据反义调控,可设定并检测效果,应用于显示出同源或大体同源的相似基因家族中的任何其它蛋白中。用于正义抑制,表达盒中所引入的序列相对于初级转录物或完全加工的mRNA而言,不需要完全一致,也不需要全长一致。优选避免同时产生一些过表达的植物。比全长序列短的同源性更高的序列补偿了长的、同源性较低的序列。而且,引入序列不必含有相同的内含子或外显子结构,且非编码区的同源性同等有效。在一些实施方案中,使用上述提到的用于反义调控的序列大小范围,即30-40,或至少约20、50、100、200、500或更多核苷酸。还可以通过RNA干扰(RNAi)(事实上可以认为共抑制是RNAi的一种类型)抑制内源基因表达,其使用具有与靶基因序列相同或近似序列的双链RNA。在RNAi现象中,当具有与靶基因相同或近似序列的双链RNA被引入细胞中时,插入的外源基因和靶内源基因都受到抑制。所述双链RNA可由两条互补的RNA形成,或可以是一条具有内部互补序列的RNA所形成的双链RNA。尽管RNAi机制的详情还不完全清楚,可以认为引入的双链RNA起始切割成小片段,然后以某些方式成为靶基因的指示(indexes),从而降解靶基因。已知RNAi在植物中也是有效的(见,例如Chuang,C.F.&Meyerowitz,E.M.,Proc.Natl.Acad.ScLUSA97:4985(2000);Waterhouse等人,Proc.Natl.Acad.ScLUSA95:13959-13964(1998);Tabara等人Science282:430-431(1998);Matthew,CompFunctGenom5:240-244(2004);Lu等人,NucleicAcidsResearch32(21):el71(2004))。例如,为了抑制编码蛋白的DNA的表达,采用RNAi,其具有编码蛋白的DNA序列的双链RNA,或使用其大体相同的序列(包括那些通过基因工程改造而不翻译蛋白的序列)或其片段,被引入到目标植物中。然后从所得植物中筛选与靶蛋白相关的表型和/或通过监测编码蛋白的转录物的稳态RNA水平。尽管用于RNAi的基因不必完全与靶基因相同,它们可以与靶基因序列(例如,PYR/PYL)具有至少70%、80%、90%、95%或更高的同源性,见,例如美国专利公开No.2004/0029283。与靶基因不相关且位于目的基因的特异性序列远端、带有茎环结构的编码RNA分子的构建体也可用于抑制靶基因表达。参见,例如美国专利公开No.2003/0221211。RNAi多核苷酸可包括全长靶RNA或与靶RNA的片段相对应。在一些实例中,所述片段含有不到100、200、300、400、500、600、700、800、900或1000个与靶序列对应的核苷酸。此外,在一些实施方案中,这些片段至少为,例如50、100、150、200或更长的核苷酸。在一些实例中,用于RNAi的片段应至少与在有机体的其它蛋白中不出现的靶蛋白区大体相似,或可选择与其它有机转录物尽可能不相似,例如,通过分析公众可获得的序列数据库而比较序列进行选择。将瞬时和稳定转染中不断表达siRNA的表达载体改造成表达小发夹RNA,其在体内加工成为能够实现基因特异沉默的siRNA分子(Brummelkamp等人,Science296:550-553(2002),以及Paddison等人,Genes&Dev.16:948-958(2002))。由双链RNA引起的转录后基因沉默进一步详细论述于Hammond等人,NatureRevGen2:110-119(2001),Fire等人,Nature391:806-811(1998)以及Timmons和FireNature395:854(1998)中。本领域技术人员应知道,使用基于特定核苷酸序列的技术(例如,反义或正义抑制技术),同源基因家族可被一条正义或反义转录物抑制。例如,如果将正义或反义转录物设计成含有基因家族中保守的序列,那么基因家族中的众多成员可被抑制。反之,如果目标仅为抑制同源基因家族中的一个成员,那么正义或反义转录物应靶向家族成员之间差异最大的序列。另一种抑制植物中PYR/PYL功能的方法是通过产生显性负突变(dominantnegativemutation)。在该方法中,将仍保留与野生型亚单位发生作用的能力的非功能性PYR/PYL多肽突变引入植物中。显性负构建体还可用于抑制植物中PYR/PYL表达。本发明中使用的显性负构建体通常含有完整PYR/PYL编码序列的一部分,其足以,例如,用于DNA结合或用于蛋白-蛋白相互作用,如同源二聚体或异源二聚体蛋白-蛋白相互作用,但其缺少野生型蛋白的转录活性。VII.重组表达载体一旦获得了PYR/PYL的编码或cDNA序列,还可将它用于制备在转基因植物中由异源启动子指导的表达PYR/PYL蛋白的表达盒。增加的PYR/PYL多核苷酸表达是有益的,例如,生产抗旱性增强的植物。或者,如上所述,表达载体也可用于表达PYR/PYL多核苷酸及其能够抑制内源PYR/PYL表达的变体。任何本领域熟知的方法可用于提高或降低植物中PYR/PYL活性或表达。任何器官可被靶定位,如枝条营养器官/结构(例如叶、茎和块茎)、根、花和花器官/结构(例如苞片、萼片、花瓣、雄蕊、心皮、花药和胚珠)、种子(包括胚、胚乳、种皮)和果实。或者,PYR/PYL基因可以组成型表达(例如,用CaMV35S启动子)。为了在上述技术中使用PYR/PYL编码或cDNA序列,制备适用于植物细胞转化的重组DNA载体。用于转化多种高等植物物种的技术是众所周知的,并描述于技术和科学文献中。参见,例如,Weising等人Ann.Rev.Genet.22:421-477(1988)。编码PYR/PYL多肽的DNA序列优选与转录和翻译起始调控序列结合,该调控序列指导转化植物的目标组织中基因序列的转录。例如,植物启动子片段可用于指导PYR/PYL基因在再生植株所有组织中的表达。本文中所指的这类启动子为“组成型”启动子,且在大多数环境条件下以及发育或细胞分化状态下具有活性。组成型启动子的实例包括花椰菜花叶病毒(CaMV)35S转录起始区,来自根癌农杆菌T-DNA的1'-或2'-启动子,以及来自本领域技术人员熟知的各种植物基因的其它转录起始区。另外,植物启动子可指导PYR/PYL蛋白在特定组织(组织特异性启动子)中或在更严格的环境控制下(诱导型启动子)的表达。受到发育控制的组织特异性启动子包括仅在特定组织,如叶子或保卫细胞(包括但不限于所描述于WO/2005/085449;美国专利No.6,653,535;Li等人,SciChinaCLifeSci.2005Apr;48(2):181-6;Husebye等人,PlantPhysiol,April2002,Vol.128,pp.1180-1188;以及Plesch等人,Gene,Volume249,Number1,16May2000,pp.83-89(7))中起始转录的启动子。可影响诱导型启动子转录的环境条件实例包括缺氧条件、升高的温度或有光照。如果想要得到正确的蛋白表达,应包括编码区3'末端的多腺苷酸区。多腺苷酸区可来自天然基因,来自其它植物基因或来自T-DNA。含有所述序列(例如,启动子或PYR/PYL编码区)的载体一般包括植物细胞中具有选择表型的标记基因。例如,标记基因可编码抗微生物剂(biocide)抗性,特别是抗生素抗性,如卡那霉素、G418、博莱霉素、潮霉素或除草剂抗性,如绿黄隆(chlorosluforon)或Basta抗性,在一些实施方案中,PYR/PYL核酸序列在植物细胞中重组表达以增强或提高总PYR/PYL多肽的水平。可制备多种不同的表达构建体,如表达盒及适于植物细胞转化的载体。用于转化多种高等植物物种的技术是众所周知的,并描述于技术和科学文献中。见,例如,Weising等人Ann.Rev.Genet.22:421-477(1988)。编码PYR/PYL蛋白的DNA序列可与顺式作用(启动子)和反式作用(增强子)转录调控序列结合以指导转化植物目标组织中转录的时间、组织类型和转录水平。还可以使用翻译调控元件。本发明提供可以与在一些实施方案中能够驱动植物中PYR/PYL编码序列转录的启动子可操作连接的PYR/PYL核酸。所述启动子可以是,例如来自植物或病毒。所述启动子可以是,例如,组成型活性、诱导型或组织特异性。在构建本发明的重组表达盒、载体、转基因时,可选择不同启动子,并用于差异指导基因表达,例如,在植物或动物的一些或全部组织中。A.组成型启动子启动子片段可以用来指导PYR/PYL核酸在所有转化细胞或组织,例如,那些再生植物中的表达。术语“组成型调控元件”表示能够使可操作连接的核酸分子,其相对独立于该组成型调控元件表达的细胞或组织类型,具有表达水平的调控元件。表达于植物中的组成型调控元件一般广泛表达于大量细胞和组织类型中。在生理条件下驱动连续表达的启动子是指“组成型”启动子,且在大多数环境条件下以及发育或细胞分化状态下具有活性。用于转基因植物中异位表达的多种组成型调控元件是本领域熟知的。例如,花椰菜花叶病毒35S(CaMV35S)启动子,是一种很有特点的的组成型调控元件,其能够在所有植物组织中产生高水平的表达(Odell等人,Nature313:810-812(1985))。由于CaMV35S启动子在许多不同的植物物种中具有活性,因此它是特别有益的(Benfey和Chua,Science250:959-966(1990);Futterer等人,Physiol.Plant79:154(1990);Odell等人,同上,1985)。串联35S启动子(其中内部启动子元件被复制)与未修饰的35S启动子相比具有更高的表达水平(Kay等人,Science236:1299(1987))。其它有用的组成型调控元件包括,例如花椰菜花叶病毒19S启动子、玄参花叶病毒启动子以及胭脂碱合酶(nos)基因启动子(Singer等人,PlantMolBiol.14:433(1990);An,PlantPhysiol.81:86(1986))。其它组成型调控元件包括那些本领域已知的在单子叶植物中有效表达的调控元件,例如pEmu启动子和基于水稻肌动蛋白-1(Actin-1)5'区的启动子(Last等人,Theor.ApplGenet.81:581(1991);Mcelroy等人,MolGen.Genet.231:150(1991);Mcelroy等人,PlantCell2:163(1990))。结合来自不同基因的元件的嵌合型调控元件,也可以用于异位表达编码PYR/PYL蛋白的核酸分子(Comai等人,PlantMol.Biol.15:373(1990))。其它组成型启动子的实例包括衍生自根癌农杆菌T-DNA的1'-或2'-启动子(见,例如Mengiste(1997)同上;O'Grady(1995)PlantMol.Biol.29:99-108);肌动蛋白启动子,如拟南芥肌动蛋白基因启动子(见,例如Huang(1997)PlantMol.Biol.199733:125-139);乙醇脱氢酶(Adh)基因启动子(见,例如Millar(1996)PlantMol.Biol31:897-904);来自拟南芥的ACT11(Huang等人,PlantMolBiol.33:125-139(1996)),来自拟南芥的Cat3(GenBankNo.U43147,Zhong等人,MolGen.Genet.251:196-203(1996)),来自甘蓝型油菜的编码硬脂酰-酰基载体蛋白脱饱和酶的基因(GenbankNo.X74782,Solocombe等人,PlantPhysiol.104:1167-1176(1994)),来自玉米的Gpc1(GenBankNo.X15596,Martinez等人J.Mol.Biol208:551-565(1989)),来自玉米的Gpc2(GenBankNo.U45855,Manjunath等人,PlantMol.Biol.33:97-112(1997)),其它来自各种植物基因的本领域技术人员已知的转录起始区。还参见HoltorfPlantMol.Biol.29:637-646(1995)。B.诱导型启动子另外,植物启动子可指导PYR/PYL基因在改变的环境条件或发育条件的影响下的表达。可由诱导型启动子影响转录的环境条件的实例包括缺氧条件、升高的温度、干旱或有光照。这类启动子在本文中是指“诱导型”启动子。例如,本发明可以整合干旱特异启动子如玉米的干旱诱导型启动子(Busk(1997)同上);或其它来自马铃薯的寒冷、干旱及高盐诱导型启动子(Kirch(1997)PlantMol.Biol.33:897-909)。另外,暴露于植物激素,如植物生长激素的诱导型植物启动子可用于表达PYR/PYL基因。例如,本发明可以使用大豆(GlycinemaxL)中的植物生长激素响应元件E1启动子片段(AuxREs)(Liu(1997)PlantPhysiol.115:397-407);植物生长激素响应拟南芥GST6启动子(也对水杨酸和过氧化氢有响应)(Chen(1996)PlantJ.10:955-966);来自烟草的植物生长激素诱导型parC启动子(Sakai(1996)37:906-913);植物生物素响应元件(Streit(1997)Mol.PlantMicrobeInteract.10:933-937);以及对逆境激素(stresshormone)脱落酸响应的启动子(Sheen(1996)Science274:1900-1902)。暴露于可用于植物的化学试剂,如除草剂或抗生素的植物诱导型启动子,也可用于表达PYR/PYL基因。例如,可以使用由苯磺酰胺除草安全剂(benzenesulfonamideherbicidesafeners)激活的玉米In2-2启动子(DeVeylder(1997)PlantCellPhysiol.38:568-577);应用不同的除草安全剂诱导不同的基因表达模式,包括在根、排水孔以及芽分生组织中的表达。PYR/PYL编码序列还可以在例如四环素诱导型启动子的控制下,例如所述含有燕麦L.(燕麦)精氨酸脱羧酶基因(Masgrau(1997)PlantJ.11:465-473)的转基因烟草;或水杨酸响应元件(Stange(1997)PlantJ.11:1315-1324;Uknes等人,PlantCell5:159-169(1993);Bi等人,PlantJ.8:235-245(1995))。有用的诱导型调控元件的实例包括铜诱导型调控元件(Mett等人,Proc.Natl.Acad.ScLUSA90:4567-4571(1993);Furst等人,Cell55:705-717(1988));四环素和氯四环素诱导型调控元件(Gatz等人,PlantJ.2:397-404(1992);Roder等人,Mol.Gen.Genet.243:32-38(1994);Gatz,Meth.CellBiol.50:411-424(1995));蜕皮激素诱导型调控元件(Christopherson等人,Proc.Natl.Acad.ScLUSA89:6314-6318(1992);Kreutzweiser等人,Ecotoxicol.Environ.Safety28:14-24(1994));热休克诱导型调控元件(Takahashi等人,PlantPhysiol.99:383-390(1992);Yabe等人,PlantCellPhysiol.35:1207-1219(1994);Ueda等人,Mol.Gen.Genet.250:533-539(1996));以及lac操纵子元件,其用于与组成型表达的lac阻遏剂结合以实现,例如IPTG诱导型表达(Wilde等人,EMBOJ.11:1251-1259(1992))。用于本发明转基因植物中的诱导型调控元件还可以是,例如来自菠菜亚硝酸盐还原酶基因的硝酸盐诱导型启动子(Back等人,PlantMol.Biol.17:9(1991))或光诱导型启动子,例如与RuBP羧化酶的小亚单位或LHCP基因家族结合的调控元件(Feinbaum等人,Mol.Gen.Genet.226:449(1991);Lam和Chua,Science248:471(1990))。C.组织特异性启动子另外,植物启动子可指导特异组织中(组织特异启动子)PYR/PYL基因的表达。组织特异启动子是仅在植物发育的特定时期的特定细胞或组织,如营养组织或生殖组织中具有活性的转录调控元件。发育调控下的组织特异启动子的实例包括仅(或主要仅)起始特定组织中的转录,如营养组织,例如根或叶,或繁殖组织,如果实、胚珠、种子、花粉、柱头(pistol)、花或任何胚组织(embryonictissue)或表皮或叶肉。繁殖组织特异启动子可以是,例如,胚珠特异、胚特异、胚乳特异、珠被特异、种子及种皮特异、花粉特异、花瓣特异、萼片特异或一些它们的组合。在一些实施方案中,所述启动子为细胞型特异,例如保卫细胞特异。其它组织特异启动子包括种子启动子。适合的种子特异启动子来自以下基因:玉米MAC1基因(Sheridan(1996)Genetics142:1009-1020);玉米Cat3基因(GenBankNo.L05934,Abler(1993)PlantMol..Biol.22:10131-1038);拟南芥vivparous-1基因(GenbankNo.U93215);拟南芥atmyc1基因(Urao(1996)PlantMol.Biol.32:571-57;Conceicao(1994)Plant5:493-505);甘蓝型油菜napA基因(GenBankNo.J02798,Josefsson(1987)JBL26:12196-1301);以及甘蓝型油菜napin基因家族(Sjodahl(1995)Planta197:264-271)。在营养组织,如叶、茎、根和块茎中具有特异活性的多种启动子也可用于表达编码PYR/PYL多肽的多核苷酸(或RNAi或反义或正义构建体)。例如,可使用控制马铃薯块茎中主要贮藏蛋白patatin的启动子,见,例如Kim(1994)PlantMol.Biol.26:603-615;Martin(1997)PlantJ.11:53-62。还可以使用来自毛根农杆菌,在根中显示高活性的ORF13启动子(Hansen(1997)Mol.Gen.Genet.254:337-343)。其它有用的营养组织特异启动子包括:来自主要的芋头(ColocasiaesculentaL.Schott)球茎蛋白家族的编码球蛋白的基因的tarin启动子,tarin(Bezerra(1995)PlantMol.Biol.28:137-144);芋头球茎发育期间有活性的仙茅甜蛋白启动子(deCastro(1992)PlantCell4:1549-155)以及马铃薯根特异基因TobRB7启动子,其表达位于根分生组织和未成熟的中轴区(Yamamoto(1991)PlantCell3:371-382)。可以使用叶特异启动子,如核酮糖二磷酸羧化酶(RBCS)启动子。例如,马铃薯RBCS1、RBCS2和RBCS3A基因表达于叶子和光种植苗中,仅RBCS1和RBCS2表达于发育的马铃薯果实(Meier(1997)FEBSLett.415:91-95)中。可以使用几乎仅在叶片的叶肉细胞和叶鞘中高水平表达的核酮糖二磷酸羧化酶启动子,描述于Matsuoka(1994)PlantJ.6:311-319。另一种叶特异启动子是集光叶绿素a/b结合蛋白基因启动子,见,例如Shiina(1997)PlantPhysiol.115:477-483;Casal(1998)PlantPhysiol.116:1533-1538。拟南芥myb相关基因启动子(Atmyb5),描述于Li(1996)FEBSLett.379:117-121,是叶特异启动子。Atmyb5启动子表达于发育的叶毛、托叶及丛生(rosette)和茎生(cauline)嫩叶边缘的表皮细胞中,并表达于未成熟的种子中。Atmyb5mRNA出现在受精和胚发育的16细胞阶段并持续至心形期(heartstage)之后。可以使用由Busk(1997)PlantJ.11:1285-1295,在玉米中鉴定的叶启动子。另一类有用的营养组织特异启动子是分生组织(根尖和茎尖)启动子。例如,可以使用由DiLaurenzio(1996)Cell86:423-433;以及Long(1996)Nature379:66-69描述的“SHOOTMERISTEMLESS”和“SCARECROW”启动子,其在发育的茎尖或根尖分生组织中具有活性。另一种有用的启动子可以控制3-羟基-3-甲基戊二酰辅酶A还原酶HMG2基因,其表达限于分生组织和花(气孔的分泌区、成熟花粉粒、雌蕊群的维管组织和受精的胚珠)组织中(见,例如Enjuto(1995)PlantCell.7:517-527)。还可以使用的是玉米kn-1相关基因以及具有分生特异表达的其它物种,见,例如Granger(1996)PlantMol.Biol.31:373-378;Kerstetter(1994)PlantCell6:1877-1887;Hake(1995)Philos.Trans.R.Soc.Lond.B.Biol.Sci350:45-51。例如,拟南芥KNAT1启动子(见,例如Lincoln(1994)PlantCell6:1859-1876)。本领域技术人员应知道组织特异启动子可以促使可操作连接序列在组织中表达,而不仅仅是在靶组织中表达。因此,本文中使用的组织特异启动子是能够优先促使在靶组织表达的启动子,但是也可以导致在其它组织中的一些表达。在另一实施方案中,PYR/PYL多核苷酸通过转座元件表达。这允许组成型活性多肽的组成性、然而是周期性和不频繁的表达。本发明还提供衍生自病毒的组织特异启动子的应用,所述启动子包括例如烟草花叶病毒亚基因组启动子(Kumagai(1995)Proc.Natl.Acad.ScLUSA92:1679-1683);水稻东格鲁杆状病毒(RTBV),其仅在感染的水稻植株的韧皮细胞中复制,它的启动子驱动韧皮特异报告基因的高表达;木薯脉花叶病毒(CVMV)启动子,其在维管元件、叶子的叶肉细胞和根尖中具有高活性(Verdaguer(1996)PlantMol.Biol.31:1129-1139)。VIII.转基因植株的生产如本文中详细描述的,本发明提供含有用于在植物中表达PYR/PYL蛋白或用于抑制或降低内源PYR/PYL表达的重组表达盒的转基因植物。因此,在一些实施方案中,生产转基因植物,其含有内源PYR/PYL编码多核苷酸的完整或部分序列,用于增强或降低PYR/PYL表达及活性。在一些实施方案中,生产转基因植物,其含有与内源PYR/PYL编码多核苷酸基本上同源的多核苷酸的完整或部分序列,用于增强或降低PYR/PYL表达及活性。在一些实施方案中,生产转基因植物,其含有来自物种而不仅仅是转基因植物物种的多核苷酸的完整或部分序列。应理解的是,转基因植物包括引入表达盒的植物或植物细胞以及这些植物或植物细胞的含有所述表达盒的后代,包括表达盒已稳定整合至染色体中的后代。含有由异源启动子驱动的PYR/PYL编码序列的重组表达载体可以通过各种常规技术引入目的植物宿主的基因组中。例如,采用技术如电穿孔以及植物细胞原生质的基因枪法,可以将DNA构建体直接引入植物细胞的基因组DNA中,或采用轰击的方法,如DNA粒子轰击,将DNA构建体直接引入植物组织中。或者,DNA构建体可以与适合的T-DNA旁侧区结合并转入常规的根癌农杆菌宿主载体中。根癌农杆菌宿主的侵入功能将指导构建体和相邻标记,在当细胞受到细菌侵染时,插入到植物细胞DNA中。本发明还包括PYR/PYL的瞬时表达,一般本发明构建体的表达是将表达盒插入植物基因组中,例如,使至少一些植物后代也含有整合的表达盒。为了实现本发明目的,还可以使用基因枪技术。这些技术是本领域熟知的,且完整地描述于文献中。采用聚乙二醇沉淀的方法引入DNA构建体描述于Paszkowski等人EMBOj.3:2717-2722(1984)中。电穿孔技术描述于Fromm等人Proc.Natl.Acad.ScLUSA82:5824(1985)。轰击转化技术描述于Klein等人Nature327:70-73(1987)。根癌农杆菌介导的转化技术,包括解毒(disarming)和使用双元载体,详细地描述于科学文献中。见,例如Horsch等人Science233:496-498(1984),和Fraley等人Proc.Natl.Acad.ScLUSA80:4803(1983)。由上述转化技术得到的转化的植物细胞可培养再生成为具有转化的基因型的整株植物,因此获得了想要的表型如增强的抗旱性。此类在再生技术有赖于组织培养生长培养基中含有的特定的植物激素,一般有赖于与目的核苷酸序列一起引入的抗微生物剂和/或除草剂标记。从培养的原生质体再生的植物描述于Evans等人,ProtoplastsIsolationandCulture,HandbookofPlantCellCulture,pp.124-176,MacMillilanPublishingCompany,NewYork,1983;以及Binding,RegenerationofPlants,PlantProtoplasts,pp.21-73,CRCPress,BocaRaton,1985。再生还可以由植物愈伤组织、外植体、器官或它们的部位获得。这种再生技术一般描述于Klee等人Ann.Rev.ofPlantPhys.38:467-486(1987)。本领域技术人员应知道,在表达盒稳定地整合至转基因植物并确定是可操作的之后,可通过有性杂交引入其它植物中。可根据待杂交的物种,使用任何一种标准的繁殖技术。本发明的表达盒可用于赋予几乎任何植物抗旱性。因此,本发明使用了大量植物,包括以下属的物种,天门冬属、颠茄属、燕麦属、芸薹属、柑桔属、西瓜属、辣椒属、黄瓜属、南瓜属、胡萝卜属、草莓属、大豆属、棉花属、向日葵属、萱草属、大麦属、天仙子属、莴苣属、亚麻属、黑麦草属、番茄属、苹果属、木薯属、墨角兰属、苜蓿属、烟草属、稻属、稷属、狼尾草属、鳄梨属、豌豆属、犁属、李属、萝卜属、黑麦属、千里光属、白芥属、茄属、高梁属、胡芦巴属、小麦属、葡萄属、豇豆属和玉蜀黍属。在一些实施方案中,所述植物选自下组:水稻、玉米、小麦、大豆、棉花、油菜、草坪草和苜蓿。在一些实施方案中,所述植物为观赏植物。在一些实施方案中,所述植物为蔬菜型或产果实的植物。本领域技术人员应知道,许多植物品种可用作模型来预测在其它植物中的转基因表达的表型效果。例如,应知道烟草(烟草属)和拟南芥是很有用的转基因表达模型,特别是在其它双子叶植物中。本发明的植物具有增强的或降低的脱落酸敏感性,与其它植物相比除表达PYR/PYL外,别的方面是一样的。脱落酸敏感性的监测可通过观察或测定由ABA介导的任何表型。本领域技术人员应知道,ABA是经过了深入研究的植物激素,ABA介导了许多特征的变化,可监测任何一种特征的变化以确定ABA敏感性是否已被调节。在一些实施方案中,被调节的ABA敏感性是通过改变的种子发芽时间及改变的胁迫(例如,干旱)耐受呈现出来的。可以根据任何一种众所周知的技术检测抗旱性。例如,植物能够在低于最适供给植物水分的条件下生长。可采用任何一种标准方法测定抗旱性,包括膨胀压力、长势、产量等。在一些实施方案中,所述方法描述于实施例部分,以下方法可被方便地使用。实施例以下提供的实施例用于说明,但不限制所要保护的发明。实施例1:PYR/PYL调节ABA信号转导与针对ABA结合蛋白的生物化学筛选不同,集中于ABA感知的遗传分析尚未鉴定出蛋白组装受体,这表明受体可能功能性冗余,具有重叠功能或不能突变产生活配子或种苗(P.McCourt,AnnualReviewofPlantPhysiologyandPlantMolecularBiology50,219(1999))。作为补充的方法,我们在植物中采取了化学遗传策略(Y.Zhao等人,NatChemBiol3,716(2007))。该方法适用于具有高冗余基因组的有机体,由于小分子可变的选择性能够产生单个基因突变所不能显现的表型(N.Raikhel,M.Pirrung,PLANTPHYSIOLOGY138,563(2005);S.Cutler,P.McCourt,PlantPhysiol.138,558(2005))。例如,低敏感性的拮抗剂能够干扰整个蛋白家族的功能(如采用微管拮抗剂观察到的),而高敏感性激动剂能够揭示正常冗余受体的单独成员的功能,如本文中我们用帕雷巴克汀3描述的(图1A)。帕雷巴克汀(Pyrabactin)是种子选择型ABA激动剂作为早期研究的一部分,我们鉴定了称为帕雷巴克汀的发芽抑制剂(Y.Zhao等人,NatChemBiol3,716(2007))。通过测定多个野生材料(accessions)对帕雷巴克汀的敏感性,我们发现ColdSpringHarborLab野生型,其为ABA高敏感并可高度休眠(hyperdormant),还对帕雷巴克汀高敏感,但不是一种阿帕雷巴克汀(apyrabactin)4灭活类似物(图1A)。这表明帕雷巴克汀可通过ABA响应通路发生作用。为了验证这一假设,我们检测了ABA信号转导、生物合成或赤霉酸(GA)感知改变的帕雷巴克汀敏感性突变系。我们发现ABA感知而不是生物合成突变株影响帕雷巴克汀敏感性(图1B)。此外,rgl2-1突变系,其发芽期间不需要GA(S.Lee等人,GenesDev.16,646(March1,2002,2002)),具有正常的帕雷巴克汀敏感性(图1B)。总之,这些观测表明帕雷巴克汀通过激活ABA信号转导通路,而不是通过调节ABA或GA生物合成来抑制发芽。接下来我们进行了微阵列试验以评价由ABA和帕雷巴克汀处理所诱导的转录响应的相似性。用于微阵列试验,我们制备了组织以及从播种于0.5XMS培养基(每个150mm直径平板约2500个种子)的Columbia野生型种子中提取RNA,所述培养基或者含有1μMABA、25μM帕雷巴克汀、25μM2,4-二硝基苯酚(DNP)、1μM放线菌酮、2μM甲氨喋呤或含有1%DMSO的对照平板(所有化学物质溶于DMSO中)。根据剂量曲线分析,将这些实验使用的浓度进行标准化用于发芽抑制活性,即当抑制后3天打分,所需的两种化合物的量确保100%发芽抑制。ABA(±立体异构体)、DNP、放线菌酮和甲氨喋呤均购自SigmaAldrich。将种子层积处理4天,置于黑暗处于室温培养24小时。收集种子,在液氮中冷冻,然后用冷冻的研钵和研杵将种子研磨成细粉末,然后用RNAqueous试剂盒(Ambion;Austin,USA)提取总RNA用于第一套重复样品。随后RNA提取物用酚氯仿提取法进行提取,其描述于(Y.Suzuki,T.Kawazu,H.Koyama,Biotechniques,37,542(Oct,2004))。对于每一份总RNA样品,根据GeneQuantRNA/DNACalculator(定量仪)(GEHealthcareBio-SciencesCorp.;NewJersey,USA),将1μlRNA定量于99μl10mMTris-Cl(pH7.4)中,在260nm和280nm下测定吸收值。根据OD260/OD280比测定RNA纯度(比值在1.7和2.2之间才可以使用),通过凝胶电泳测定RNA的量。根据制造商(Enzokit;Affymetrix;SantaClara,USA)的描述,采用寡dT引物将总RNA样品转化为生物素标记的cRNA,并与22KATHlAffymetrix微阵列在CAGEF(UniversityofToronto)中杂交。双份生物复制样品用于DNP、放线菌酮和甲氨喋呤杂交,三份用于对照,四份样品用于帕雷巴克汀和ABA处理杂交。通过如GCOS/MAS5.0算法(Affymetrix;SantaClara,USA)所述的用于微阵列的统计算法,将带有表达信号的探针组称为表达(present)或临界表达(marginal)。微阵列的显著性分析用于鉴定主要由处理所调节的探针组,采用未取对数的数据(unloggeddata),错误发现率(FDR)约5%。将平均转录水平与对照值比较以计算倍数的变化,依次进行log2转换,用于计算各实验之间的Pearson相关系数。我们首先检查了用两种化合物处理24小时的种子。由于对幼苗发育的抑制效应,任何两种发芽抑制剂都会有某些共同的响应;因此我们使用之前定义的一套发芽响应转录物(G.W.Bassel等人,PlantPhysiol147,143(2008))使比较中的发育影响最小化。采用SAM分析(V.G.Tusher,R.Tibshirani,G.Chu,Proc.Nat'I.Acad.ScLUSA98,5116(2001)),在去掉403个发芽调节转录物后,鉴定出1225个探针组对ABA或帕雷巴克汀有响应。比较探针对帕雷巴克汀和ABA响应的分散图显示出高相关响应(r=0.98;图1C),与帕雷巴克汀激活ABA信号转导的假设一致。作为对照,我们还绘制了三种发育抑制剂(G.W.Bassel等人,PlantPhysiol147,143(2008))放线菌酮、甲氨喋呤和2,4-二硝基苯酚的效果,与ABA处理(r=0.36、0.73和0.81;放线菌酮示于图1D)相比,观察到微弱的转录物响应。这表明间接的发育影响不足以解释(accountfor)帕雷巴克汀的类ABA转录效应。为了证实帕雷巴克汀是否为一般的ABA激动剂,我们检测了其在用任何一种化合物处理24小时的幼苗中的活性,显示出帕雷巴克汀诱导了幼苗组织中(图1E)极其沉默的ABA响应(r=0.72)。为了进行幼苗微阵列实验,将Columbia野生型种子进行表面杀菌并播种于0.5XMS,0.6%(w/v)琼脂平板(15mg种子,每个150mm直径大小的平板含有25ml培养基)中,然后于4℃层级处理4天,并在24小时光照下于室温生长9天。然后将40株幼苗转移至DMSO对照、10μMABA或33μM帕雷巴克汀平板中并返回至生长环境24小时,然后采用上述方法提取总RNA。每种处理进行三份样品杂交。用于幼苗实验的浓度是基于所需抑制初生根生长相等量的ABA或帕雷巴克汀浓度,即它们是根据测定的生物活性而标准化的浓度,在这些实验中,57个转录物对帕雷巴克汀和ABA显著响应,这表明帕雷巴克汀可诱导幼苗中ABA响应的各个方面。然而,由于实验中3021个转录物对ABA而不是帕雷巴克汀显示出显著的响应,我们推论与ABA相比,帕雷巴克汀对于种子途径(seedpathway)更具有选择性。帕雷巴克汀确实能激活(agonize)植物组织中的ABA响应。PYR1,一种START蛋白,对于帕雷巴克汀发挥作用是必要的为了分析帕雷巴克汀的作用机制,我们从筛选的约450,000EMS诱变处理的M2种子中共分离出16株帕雷巴克汀不敏感突变系。将表面杀菌的EMS种子播种于含有25μM帕雷巴克汀的0.33XMS培养基(每个150mm直径大小的平板50mg种子)中。种子置于4℃层积处理4天,在持续光照下室温生长4天,然后给平板打分,得到对帕雷巴克汀的发芽抑制效应具有抗性的突变。完全展开子叶的幼苗被认为是具有抗性的,然后对所有被鉴定为具有抗性的突变再检测它们的下一代以鉴定真正的突变。用约400株植物群体(来自与Ler杂交产生的后代)以强pyr1-7等位基因绘制Pyr1图谱。这将Pyr1限定为含有12个基因的约150Kb大小的间隔。对该间隔的12个基因进行测序并在At4g17870(Pyr1)鉴定出终止密码子后,首次证明了Pyr1的一致性。然后,对分离的16株突变中的14株的Pyr1编码序列进行测序,通过基于克隆以及对在相同座位,抗帕雷巴克汀1(PYRABACTINRESISTANCE1)(Pyr1)上含有突变的进行测序而绘制的图谱来确定12株独立的植株。Pyr1编码的蛋白是START/Betv1超家族中的一个成员,该家族中的成员共同具有一个保守的配体结合螺旋夹结构(helix-griparchitecture)(L.M.Iyer,E.V.Koonin,L.Aravind,Proteins:Structure,Function,andGenetics43,134(2001);C.Radauer,P.Lackner,H.Breiteneder,BMCEvolBiol8,286(2008))。PYR1位于与细菌聚酮合成酶/环化酶以及其它非酶蛋白相似的Betv1亚家族中(C.Radauer,P.Lackner,H.Breiteneder,BMCEvolBiol8,286(2008))。通过BLAST搜索,在拟南芥基因组中有13个基因显示出与Pyr1具有显著的相似性,将它们命名为PYL1-PYL13(对于类PYL1;它们的AGI列于表1中)。推测我们分离出的帕雷巴克汀不敏感pyr1等位基因在PYR1中产生多种缺陷,包括截短和非保守氨基酸替换(图2A)。将35S::GFP-PYR1表达构建体转化至强pyr1-1突变系中,恢复种子的帕雷巴克汀敏感性(图2C),其进一步支持了PYR1对于帕雷巴克汀发挥作用是必须的。没有一个分离出的pyr1等位基因显示出高的ABA不敏感性,其如以下所述,解释为由于冗余的Pyr1相关物(包括但不限于Pyr1、2、4)的作用。通过查询公开的微阵列数据库(M.Schmid等人,NatGenet37,501(2005);K.Nakabayashi,M.Okamoto,T.Koshiba,Y.Kamiya,E.Nambara,PlantJ41,697(Mar,2005);H.Goda等人,PlantJ55,526(Aug,2008);D.Winter等人,PLoSONE2,e718(2007);Y.Yang,A.Costa,N.Leonhardt,R.S.Siegel,J.I.Schroeder,PlantMethods4,6(2008)),可清楚地知道Pyr1mRNA在种子和保卫细胞中高表达,且对ABA响应(图2B),与PYR1在ABA信号转导中的作用一致。表1:PYR/PYL家族成员及相应的拟南芥基因组测序计划(AGI)注释GeneAGIPyr1AT4G17870Pyl1AT5G46790Pyl2AT2G26040Pyl3AT1G73000Pyl4AT2G38310Pyl5AT5G05440Pyl6AT2G40330Pyl7AT4G01026Pyl8AT5G53160Pyl9AT1G01360Pyl10AT4G27920Pyl11AT5G45860Pyl12AT5G45870Pyl13AT4G18620PYR/PYL蛋白结合PP2Cs响应ABA假设PYR1对于帕雷巴克汀发挥作用是必须的,并推测其为配体结合蛋白,我们假定帕雷巴克汀通过诱导PYR1和下游效应物之间的蛋白-蛋白相互作用激活ABA信号转导。为了验证这种假设,在含有10μM帕雷巴克汀的培养基上,筛选约两百万作用于PYR1Y2H诱饵构建体的cDNA克隆。为了制备PYR1Y2H诱饵构建体,通过PCR从基因组DNA中扩增Pyr1开放阅读框,将其克隆至pGem-Teasy载体(Promega)上。进行测序确认后,然后将Pyr1ORF框内(in-frame)克隆至pBD-GAL4Cam载体(Stratagene)的EcoRI和SalI位点之间,并转化至酵母菌株Y190中。使用黄化苗cDNA文库(J.Kim,K.,Harter,A.,Theologis,ProcNatlAcadSciUSA94,11786(Oct28,1997))(ABRCstockCD4-22)进行筛选。首先将该cDNA文库从噬菌体转化为质粒DNA,产生7.6x107个转化子。然后用由文库制备的质粒DNA转化Y190,如GAL4双杂交系统手册(Stratagene)中所描述。用于每个筛选,将40μg质粒转化至1ml带有诱饵构建体的感受态Y190细胞中,然后在不含有His、Leu和Trp,但含有15mM3-AT和10μM帕雷巴克汀的SD琼脂平板上生长。于30℃培养4天后,收获长势好的菌落并采用滤膜分析检测(filterliftassay)或氯仿琼脂覆盖法以及X-Gal染色,进行交互验证。鉴定出两株帕雷巴克汀依赖型样本(hits),经测序确定其编码PP2CHAB1的cDNA,与特点明显的ABA响应因子ABI1具有很近的亲缘关系(A.Saez等人,ThePlantJournal37,354(2004);N.Leonhardt等人,THEPLANTCELL16,596(2004))。然后,使表达AD-HAB1融合蛋白和BD-PYR1融合蛋白的Y2H菌株生长于平板中,并测试它们与各种化合物的相互作用,除了表油菜素内酯(50nM)和二甲基亚砜(DMSO)(载体溶剂,1%)之外,其它化合物为10μM。当在(+)-ABA测试帕雷巴克汀响应PYR1-HAB1Y2H菌株时,通过X-gal染色观察到强烈的相互作用,但是在(-)-ABA、激动素、2,4-D、赤霉酸(GA)、表油菜素内酯(BR)、茉莉酸甲酯(meJA)或阿帕雷巴克汀(apyrabactin)中都没有显示出活性(图3A)。因此,PYR1与HAB1作用是以(+)-ABA依赖的方式。为了验证ABA及帕雷巴克汀响应对于PYR1是否是唯一的,我们采用表达AD-HAB1融合蛋白和BD-PYR/PYL融合蛋白(列于图3A左侧)的Y2H菌株测试了上述13个PYL蛋白中的11个。以与对于上述BD-PYR1相同方式构建BD-PYR/PYL融合蛋白。该检测表明PYL1-PYL4与HAB1以ABA激活方式发生作用(图3A)。还观察到帕雷巴克汀的配体选择作用,其促进了HAB1和PYR1、PYL1或PYL3之间的相互作用(图3A)。其中仅Pyr1在种子中高转录,这很好地解释了Pyr1中的突变引起种子对帕雷巴克汀不敏感的原因。PYL2-PYL4对(+)-ABA和(-)-ABA都有响应(图3A),这表明它们可能参与了(+)-ABA和(-)-ABA响应。值得注意的是,余下的在酵母双杂交检测中测试的PYL显示出与HAB1的组成型相互作用,这表明它们可能与来自PYR1和PYLs1-4的PP2Cs的相互作用具有不同的阈值。然而,PYLs5-12与PP2Cs的相互作用表明,整个蛋白家族很可能与我们以下描述的PP2C调节具有相似的作用机制。因此,我们推论整个家族通过PP2C作用调节ABA响应。为了进一步研究ABA/帕雷巴克汀响应,我们采用上述的Y2H检测以测定引起植物中高的帕雷巴克汀不敏感表型的三种取代的突变蛋白。受试突变中的两个,PYRIS152L和PYR1P88S,显著降低了ABA诱导的PYR1-HAB1相互作用,而PYR1R157H突变不影响该相互作用(图3B)。HAB1具有ABI1、ABI2和其它相关PP2Cs的基因冗余(T.Yoshida等人,PLANTPHYSIOLOGY140,115(2006))。因此,我们采用ABI1和ABI2的公开可获得的已确定的cDNAs(分别为C104649和U24491),在Y2H检测中测试了ABI1和ABI2。我们观察到PYR1与野生型ABI1和ABI2发生作用,而与由abi2-l编码的ABA不敏感蛋白ABI2G168D不发生作用(图3C)。因此,植物中对于PYR1和PP2C的功能起重要作用的残基对于重组酵母中的ABA响应是重要的。这些PYR1和PP2C之间的体内相互作用易于出现在细胞质和核质中,正像观察到的GFP-PYR1定位模式所表明的(图4)。PYR/PYL蛋白在ABA信号转导中的冗余作用为了检测ABA响应PYL蛋白是否与ABA信号转导中的PYR1发生冗余作用,我们从公开的插入等位基因库(publicinsertion-allelecollections)中分离出纯合型插入等位基因PYL1、2和4(种子品种分别=Salk_054640、GT_2864、Sail_517_C08)(J.M.Alonso等人,Science301,653(2003);A.Sessions等人,THEPLANTCELL14,2985(2002);V.Sundaresan等人,GenesandDevelopment9,1797(1995))。纯合型插入系与pyr1-1杂交产生pyrl-1:pyl2-1和pyll-1:pyl4-1杂合系,然后它们彼此杂交。对约70株杂交后代通过PCR进行基因型分析,鉴定全部4个突变的杂合系,鉴定出2株。为了评价这些系是否分离出ABA不敏感植株,使源自四倍体杂合植株的F2代种子在0.7μM(+)-ABA上发芽。观察发芽及生长的广泛变化,从约1000个种子中选出ABA抗性最强的幼苗,并通过PCR和测序进行基因型分析。单独的纯合型突变亲本不具有显著的ABA不敏感性,但三倍体(pyrl-1、pyll-1、pyl4~l)和四倍体(pyrl-1、pyll-1、pyl2-l、pyU-1)突变系具有ABA不敏感性。通过与abi1-1比较,分离并确定为ABA最不敏感型突变比较,检测四倍体和三倍体突变系的根和发芽响应。为了发芽检测,将种子在含有(+)-ABA的0.33XMS平板上于4℃层积处理4天,然后在黑暗处于23℃、90%相对湿度发芽3天。将根部伸长为1/2种子长度或更长的种子打分为阳性发芽。为了研究根生长,允许种子在层积处理后4天,首先在MS平板上发芽,然后转移至23℃、90%相对湿度的黑暗处发芽。吸胀48小时后,将出现根部的幼苗转移至含有(+)-ABA或对照平板中,再于黑暗处垂直生长4天,然后测定长出的新根。在发芽检测中,四倍体突变比三倍体突变更不敏感,但二者均比abi1-1显示出更弱的表型(图5A)。在根生长检测中,四倍体和三倍体突变系均比abi1-1显示出更高的ABA不敏感性(图5B)。四倍体突变系还显示出ABA诱导的基因表达缺陷。采用与Fujii等所描述的相同的taqman探针,如前所述(H.Fujii,等人,PlantCell,19,485(2007))进行定量RT-PCR实验。简要地,将在连续光照下在0.3XMS平板上生长7天大的幼苗转移至含有载体溶剂(0.1%DMSO)或100μM(+)-ABA的0.3XMS培养基中5小时,然后用QiagenplantRNeasy分离试剂盒分离总RNA。用Superscript反转录酶,每20μLcDNA第一链合成反应使用5μg总RNA。用TE将反应物稀释至100μl,取1.5μl用于15μLqRT-PCR反应,使用前述(6)的taqman探针。显示的数值为三份测定的平均值。在(+)-ABA存在下,四倍体突变显示出ABA响应基因RD29(图2D)、NCED3(图2E)和P5CS1(图2E)转录下降。这些实验表明PYL1、PYL2和PYL4在ABA诱导的基因表达的控制下与PYL1发生冗余作用,以及发芽和根对ABA响应。ABA感知的体外重组:ABA和PYR1抑制PP2C活性为了研究PYR1-PP2C相互作用的功能含义,我们检测ABA响应是否能够在体外重组。重组GST-HAB1、GST-ABI1和GST-ABI2表达于E.coli中,并在转蛋白试验(pull-downassays)中测试与6xHis-PYR1的配体依赖型相互作用。将纯化的6xHis-PYR1和GST-HAB1(分别为20和100μg,8μMPYR1终浓度)结合于含有10μM(+)-ABA或1%DMSO的100μlTBS中作为阴性对照。于室温孵育该反应物90分钟,加入5μlPrepΕase(USB)His-标签蛋白纯化树脂。将树脂和反应混合物于室温孵育30min,每隔5min轻轻摇动。用含有10μM(+)-ABA的TBS洗涤五次。洗完后,结合的蛋白被洗脱于20μlSDS-PAGE缓冲液中,煮沸5分钟并离心。在SDS-PAGE上分析5μl洗脱物。用ABI1和ABI2进行转蛋白检测,除了将纯化的PP2C替换为澄清的E.coli裂解物,以相似的方法使用粗裂解物。加入的裂解物的量通过SDS-PAGE分析测定以产生约100μgPP2C,使其所用化学计量法与采用纯化蛋白的检测中所用方法相同。我们发现(+)-ABA和帕雷巴克汀均促进PP2C与PYR1的相互作用;然而,PYR1P88S在该检测中是不敏感的(图6A)。由于ABI1及其相关物是ABA信号转导通路的负调节子,我们假设ABA促进的PYR1-PP2C相互作用的功能是,抑制磷酸酶活性并去除该通路的负输入(input),然后将促进信号转导。为了验证该假设,我们用重组GST-HAB1、6xHis-PYR1或6xHis-PYR1P88S,以磷酸酶底物pNPP检测(+)-ABA对PP2C酶动力学的影响。通过PCR从来自ABRC的pUni克隆中扩增出拟南芥HAB1的ORF,并克隆至pGex-2T中产生GST-HAB1融合蛋白。将两个构建体转化至BL21[DE3]pLysS中。用于表达,使含有pGex-GST-HAB1的细胞在20mlLB中过夜生长,然后接着于含有1mMMnCl2的700ml培养基中于室温继续振荡培养8hr。然后通过加入IPTG至终浓度0.5mM诱导蛋白表达,细胞于室温过夜培养。然后4500rpm离心20min收集细胞,重悬于含有10mMMnCl2的10mlTBS中。将细胞贮存于-80℃。为了制备澄清的裂解液,将细胞冷冻-解冻两次并通过剪切降低裂解物的粘度。然后裂解物于12000Xg旋转(spun)10min,最后得到澄清的裂解液。将裂解液加入1ml固定化的谷胱甘肽柱中,用20mlTBS洗涤,然后结合的蛋白用20mM还原的谷胱甘肽洗脱。洗脱液在含有10mMMnCl2的TBS中透析。在纯化步骤中使用MnCl2,发现对于高活性HAB1蛋白的复性是关键的,如前述用于其它的PP2C(C.C.Fjeld,J.M.Denu,JBiolChem,21A,20336(JuI16,1999))。通过PCR,分别从野生型基因组DNA或pyrl-3突变中扩增PYR1和PYR1P88S编码序列,并克隆至pET28中,产生各种6xHis-PYR1蛋白,并通过测序确定。用于6xHis-PYR1和6xHis-PYR1p88S蛋白表达,将20ml过夜培养物接种于700mlLB中,于37℃振荡再生长3小时。通过加入IPTG至1mM诱导蛋白表达。5hr后收集细胞,于5000xg离心15min,沉淀重悬于5ml含有10mM咪唑(pH8.0)的缓冲液A(50mMNaH2PO4,300mMNaCl)中。纯化前,将细胞贮存于-80℃。解冻后,将细胞置于冰上超声破碎五次,每次30sec,超声间隔为30sec。12,000xg离心10min后得到澄清的裂解液,加入1mlNi-NTA柱(Qiagen)中,用20个柱体积的含有30mM咪唑的缓冲液A洗柱。结合的蛋白用10ml含有100mM咪唑的缓冲液A洗脱。将洗脱液置于TBS中透析。用于pNPP检测,采用合成的磷酸酶底物pNPP测定GST-HAB1的起始反应速度。反应物中含有1μMGST-HAB1、1.5μM6xHis-PYR1或6xHis-PYR1p88S,反应缓冲液由33mMTris-OAc,pH7.9,66mMKOAc,0.1%BSA,25mMMg(OAc)2,50mMpNPP和不同浓度的(+)-ABA组成。通过向蛋白/ABA混合物中加入检测缓冲液起始反应。混合后立即用Wallac酶标仪(platereader)在A405t下每隔约10秒,监测pNPP的水解,共监测20分钟。绘制反应进程曲线,计算起始反应速度并用4-硝基酚标准曲线转化为具体的活性,该标准曲线以相同的缓冲体系体积/用于测定酶反应的酶标仪制作。这些实验表明(+)-ABA在PYR1存在下,而不是PYR1P88S存在下,作为潜在的HAB1磷酸酶活性抑制剂(ICsO=0.18μM)(图6B)。近似地,ABA在重组PYL4存在下具有饱和HAB1PP2C活性抑制作用。用公开的pUni克隆构建PYL46xHis-标签(SEQIDNO:141)蛋白。将其重组至His-标签表达载体pHB3。该构建体表达于BL21[DE3]pLysS,如以上对于PYR1所述,但是蛋白形成包涵体,纯化前将其溶解于缓冲液B+8M尿素中。采用Ni-NTA树脂,根据制造商的说明在变性条件下纯化蛋白。蛋白结合至树脂后,用20个柱体积的缓冲液B(pH6.3)洗柱,并用缓冲液A(pH4.5)洗脱蛋白。洗脱的蛋白置于含有2M尿素的TBS中缓慢透析,将10mMDTT加入含有1mMDTT的TBS中透析三天,期间逐渐降低尿素浓度。用测定PYR1的体外转蛋白试验确定重新折叠的PYL4的活性,表明PYL4结合HAB1响应ABA。用于PP2C检测,使用重组的PYL4(由包涵体重新折叠)和HAB1。采用磷酸酶底物pNPP,测定GST-HAB1的磷酸酶活性,我们发现在PYL4存在下,(+)-ABA抑制HAB1磷酸酶活性(图6C)。因此,PP2C抑制为主要的ABA响应,其可在体外仅对蛋白进行重组。讨论我们已经证明PYR1具有期望的ABA受体性质,在配体存在时,其结合并抑制PP2C活性。与之前鉴定的ABA结合蛋白(P.McCourt,R.Creelman,CurrentOpinioninPlantBiology11,474(2008))相比,PYR1直接与ABA信号转导通路的核心组成发生作用。ABI1与ABA响应通路中的至少一种正向作用因子发生作用(R.Yoshida等人,JournalofBiologicalChemistry281,5310(2006)))。因此,在无信号时,ABI1/AHG1类PP2C的作用是抑制正向作用因子的作用。在该模型中,ABA作用于负调节通路的顶端,PP2C通过它们直接的靶标控制信号输出。这使PP2C在控制信号输出的选择性中起到关键作用,这可以解释PP2C基因家族在植物中的相对于在动物中的广泛多样化(A.Schweighofer,H.Hirt,I.Meskiene,TrendsinPlantScience9,236(2004))。基于PP2Cs与SnRK2蛋白的相互作用,以及SnRK2对ABA信号转导的关键作用(图7),我们提出以下ABA作用模型,其中ABA和PYR/PYLs抑制PP2C,其反过来缓解了正向因子,如SnRK2的抑制。这依次使阳性SnRK2激酶能够通过磷酸化调节下游因子的活性。我们的实验表明PYR/PYL基因家族14个成员中的至少12个结合PP2C,以下成员如PYL2s、3和4能够使酵母细胞对非天然立体异构体(-)-ABA响应。我们认为整个家族为ABA受体,且一些还可以是(-)-ABA受体。这一假设与较早的推论相一致,即两种立体异构体均通过相同的信号转导通路发生作用(E.Nambara等人,Genetics161,1247(JuI,2002))。PYR1不能结合由abil-1和abi2-l编码的蛋白,二者在两个保守的PP2C金属结合位点之一附近的甘氨酸处均含有突变。这些突变降低了但不消除PP2C活性(F.Gosti等人,ThePlantCell11,1897(1999);N.Robert,S.Merlot,V.N'Guyen,A.Boisson-Dernier,J.ISchroeder,FEBSLetters580,4691(2006)),完全消除abil-1的催化活性的第二个突变位点抑制了它的显性表型(F.Gosti等人,ThePlantCell11,1897(1999))。连同我们对缺陷PYR1相互作用的观察,这些数据表明abil-1和abi2-l突变主导的模型,是由它们逃避PYR/PYL蛋白负调节的能力所引起的。在该模型中,ABA的主要功能是通过PYR/PYL蛋白降低ABI1/AHG1类PP2C活性,但这没有恰当地出现于abil-1和abi2-l突变系中,其在ABA感知到信号转导干扰后,保留了足够的PP2C活性。还不清楚有关其它磷酸酶类的PP2C调节,鉴于它们在哺乳动物、蠕虫、苍蝇和酵母中的重要作用这点令人吃惊(G.Lu,Y.Wang,ClinicalandExperimentalPharmacologyandPhysiology35,107(2008))。我们的观察提供了一个PP2C活性的受体介导调节的新机制。尽管PYR1抑制PP2C的精确机制是未知的,PYR1R157H突变能够从体内下游功能中分离出配体感知。因此该残基在感知信号后导致抑制PP2PC活性的步骤中起到关键作用。无论PP2C抑制的精确细节如何,发现的新调节机制表明值得在其它模型中研究受体介导的PP2C调控,假定缺少这些重要磷酸酶的调节因子。ABA信号转导通路成为遗传分析的课题已近30年,但是在遗传筛选中,PYR/PYL蛋白从未作为ABA响应的必须因子出现。回想起来,明显是由于必须用三倍体突变来观察ABA不敏感表型。当使用帕雷巴克汀作为通路合成的激动剂时,然而,可容易地鉴定出Pyr1。其原因是由于帕雷巴克汀对整个受体家族亚型的选择性,使我们能够绕过基因冗余,其在单独的突变系中模糊了ABA表型。因此,我们的结果证实了化学遗传法揭示正常冗余基因表型的能力。由于植物基因组是高度冗余的,我们希望小分子方法能够对分类遗传分析提供有力的补充。实施例2:PYR/PYL激动剂的筛选我们接着研究除了ABA和帕雷巴克汀之外的其它化合物是否可以作为PYR/PYL蛋白的激动剂。在适合的载体中表达ABA受体和2型C蛋白磷酸酶的酵母双杂交菌株可用于监测ABA受体的活性。因此,这些酵母菌株产生方便的筛选系统用于鉴定作为ABA激动剂的渗透化合物,即促进PYR/PYL家族成员与它们的靶蛋白磷酸酶结合的化合物。当PYR/PYL蛋白结合于酵母双杂交中的靶PP2C时,报告基因被激活,这取决于使用的菌株,能够导致报告构建体如LacZ/β半乳糖苷酶标记的表达或导致能够使菌株在营养缺陷培养基上生长的营养报告基因的表达。为了进行这些激动剂检测,将筛选化合物加入微孔板中并加入适合的酵母生长培养基。然后将孔播种PYR/PYL-PP2C菌株,待菌株生长于含有化学物质的培养基之后,监测激动剂的活性。可采用多种方法检测激活,包括X-gal检测的简单生长(通过营养报告基因表达的恢复)比色法,其为本领域熟知的。另一种筛选方法,称为“Halo检测”,也可用于鉴定激动剂。在该检测中,酵母菌可被包埋于适合的含有琼脂糖的生长培养基中,然后用加样枪(pinreplicator)将化学物质点于平板上。缺少生长必需营养物的生长培养基阻止了酵母生长,除非一种筛选的化学物质进入酵母细胞中并激活了PYR/PYL受体,导致在酵母双杂交菌株中该营养标记基因的表达。激活的细胞显示出细胞生长区域,并能够容易地通过目测鉴定。采用常规方法和上述halo检测的结合,检测到65,000个激活酵母双杂交菌株表达PYR1、PYL2、PYL3或PYL4的筛选化合物。激活任一酵母菌的目标化合物(hitcompounds)在全部4株酵母菌上再次测试,采用X-gal染色检测对活性进行定量。这导致鉴定出图8所示的化合物。这些化合物作用于PYR/PYL受体PYR1、PYL1、PYL2、PYL3和PYL4的相关活性评价列于图8中。我们注意到用于这些筛选检测中的PYL3酵母菌对ABA尤其敏感,因此ABA或其它化合物对PYL3受体的相关活性将在随后的体外磷酸酶检测中进一步验证,描述如下。为了进一步确定在酵母双杂交检测中鉴定的目标化合物,在重组PYR/PYL受体蛋白PYR1、PYL1、PYL2或PYL3以及PP2CHAB1存在下,我们进行体外PP2C检测。如实施例1所述制备重组蛋白。如实施例1所述,用磷酸酶底物pNPP进行磷酸酶检测。根据IC50值所示,我们发现化合物7653159,与图8中化合物7为同一化合物,是潜在的HAB1的PYR1和PYL1抑制的激动剂,但不是PYL2或PYL3的激动剂(图9)。近似地,化合物6655097,与图8中化合物6为同一化合物,是潜在的HAB1的PYR1和PYL1抑制的激动剂,但不是PYL2或PYL3的激动剂(图9)。化合物7561035,与图8中化合物9为同一化合物,是潜在的HAB1的PYL2和PYL3抑制的激动剂,但不是PYR1或PYL1的激动剂(图9)。实施例3:PYR/PYL过表达的表型分析以及突变株的功能缺失脱落酸是多功能植物激素,其参与了多种植物保护功能,包括芽休眠、种子休眠和/或成熟、叶片及果实的脱落,并响应各种生物胁迫(例如,冷、热、盐和旱)。根据独立于CO2浓度的机制,ABA还负责调节气孔关闭。由于PYR/PYL受体蛋白调节ABA信号转导,这些表型可通过调节PYR/PYL的表达进行调节。然而,如以上讨论的,用单独的、三倍体和四倍体Pyr/Pyl突变株进行试验,表明PYL受体PYL1、2和4在发芽的控制下与PYR1发生功能冗余,且根对ABA响应。在这些试验中,我们想知道其它PYR/PYL受体在植物保护功能,如开花时间、株高、叶绿素含量及萎蔫的控制下是否与PYR1发生功能冗余。我们用实施例1中所述的pyrl;pyll;pyl2;pyl4四倍体突变检测多倍PYR/PYL受体对这些植物保护功能的功能缺失的影响。我们发现pyrl;pyll;pyl2;pyl4四倍体突变在开花时间、株高及萎蔫中显示出缺陷(图10)。相对于对照拟南芥,pyrl;pyll;pyl2;pyl4四倍体突变开花早,植株矮小且非常萎蔫。我们还检测了过表达PYR/PYL受体PYL4对植物保护功能的影响。我们生产了在高表达启动子Rbcs的控制下表达GFP-PYL4的转基因拟南芥,发现过表达PYL4的植株在植物的开花时间、株高、萎蔫及叶绿素含量中显示出缺陷;相对于对照植株,这些PYL4过表达植株开花晚,为深绿色且较少萎蔫(图10)。这些结果表明PYR/PYL受体调节植物中多种ABA介导的活性。实施例4:用于PYR/PYL激动剂的植物提取物的筛选还使用表达PYR/PYL受体和2型C蛋白磷酸酶的酵母菌筛选HPLC分离的植物提取物,以获得激活PYR/PYL受体PYR1、PYL2、PYL3和/或PYL4的内源化合物。采用提取物的HPLC分离鉴定不同于脱落酸(已知激动剂)的化合物。据此鉴定出来自贯叶连翘(Hypericumperforatum)地上部分组织提取物的PYL3/PYL4选择性激动剂。结合酵母双杂交通过多轮色谱分离纯化该激动剂,使该组分在纯化的每一步向前移。根据纯化的激动剂晶体的X-射线晶体学推断该纯化的激动剂的结构,揭示了该化合物为已知的化合物青蒿酸。该化合物除了在蒿属(菊科)之外,没有从其它属分离的报道,我们从金丝桃属(藤黄科)分离出该化合物,表明该化合物广泛存在于植物中,在植物生理中发挥重要的功能性作用。从商业来源得到的几种相关化合物,也发现具有PYL3/PYL4选择性激动剂活性(图12)。按照与所述的青蒿酸相似的方法,从Colaaccumulata种子中鉴定出第二种天然存在的ABA激动剂,并根据2D-NMR确定为未知的α-可巴烯(α-copaene)、copaenoicacid(图12)。应理解本文中的实施例和实施方案仅用于说明目的,各种改进和变化对于本领域熟练的技术人员而言均应包括在本申请的精神和范围内以及所附权利要求的范围内。本文中引用的所有出版物、专利和专利申请以参阅的方式全文并入于此。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1