一种具有α‑1,3‑葡聚糖链的烟薯多糖及其制备方法与流程
本发明涉及一种烟薯多糖及其制备方法。
背景技术:
多糖是一类复杂的高分子碳水化合物,与蛋白质、核酸和脂类构成生命体的四大基本物质。甘薯多糖还具抗氧化和免疫调节的作用。我国是甘薯生产大国,通过灰色多维综合分析在食用型甘薯品种评价的应用中,烟薯25产量和综合评估均排在第一位,其综合评估关联度为0.8621,比对照高20.22%,说明烟薯25解决了高产和优质的矛盾。因此,对烟薯多糖的提取和纯化为高效利用烟薯多糖应用于抗肿瘤研究提供了前期工作基础,同时也为中期放大试验、后期工业化生产、多糖结构修饰及修饰后多糖构效关系、修饰后多糖在细胞生物学方面的研究、甘薯保健品研发等提供参考。
技术实现要素:
本发明是为了解决目前甘薯的综合利用率低以及甘薯多糖品种繁多,不同品种的甘薯多糖的单糖组成,相对分子质量,糖苷键连接方式等结构信息千差万别的技术问题,而提供一种具有α-1,3-葡聚糖链的烟薯多糖及其制备方法。
本发明的具有α-1,3-葡聚糖链的烟薯多糖的结构式为:
其中n为340~345,相对分子质量为2.40×105Da~2.46×105Da,重复结构单元中含有1→3和1→6两种糖苷键,主链为1→3糖苷键,侧链由1→6糖苷键组成,糖残基为α构型,分支度为0.33。
本发明的具有α-1,3-葡聚糖链的烟薯多糖的制备方法如下:
一、制备烟薯粗多糖:将烟薯25清洗干净,去皮,切块,自然晾干,粉碎,过50目筛,得烟薯粉末,将烟薯粉末放入质量分数为95%的乙醇中浸泡24h~48h进行脱脂, 取出后自然晾干,然后进行热水浸提,抽滤得提取液,将提取液进行减压浓缩,得到浓缩液I,将浓缩液I放入质量分数为95%的乙醇溶液中浸泡12h~24h,抽滤得沉淀I,将沉淀I真空干燥后得到沉淀粉末,将沉淀粉末放入蒸馏水中,得到浓度为2mg/mL的粗多糖溶液I,然后用Sevag法脱蛋白,取上清液,将上清液进行减压浓缩,得到浓缩液II,将浓缩液II放入质量分数为95%的乙醇溶液中浸泡12h~24h,抽滤得沉淀II,然后将沉淀II进行真空干燥,得到烟薯粗多糖;所述的烟薯粉末的质量与质量分数为95%的乙醇的体积比为1g:(5mL~10mL);所述的将浓缩液I放入质量分数为95%的乙醇溶液中浸泡12h~24h中的浓缩液I与质量分数为95%的乙醇溶液的体积比为1:(3~4);所述的将浓缩液II放入质量分数为95%的乙醇溶液中浸泡12h~24h中的浓缩液II与质量分数为95%的乙醇溶液的体积比为1:(3~4);
二、纯化:将步骤一得到的烟薯粗多糖放入蒸馏水中,用0.45μm的微孔滤膜过滤,得到浓度为2mg/mL的粗多糖溶液II,用DEAE-52纤维素层析柱进行初步分离,得到分离后的洗脱液I,将分离后的洗脱液I依次进行流水透析1天,蒸馏水透析2天,再进行减压浓缩和真空冷冻干燥,得到烟薯多糖组分,将烟薯多糖组分放入蒸馏水中,用0.45μm的微孔滤膜过滤,得到浓度为2mg/mL的烟薯多糖组分溶液,然后用SephadexG-200层析柱对烟薯多糖组分溶液进行分离纯化,得到分离后的洗脱液II,将分离后的洗脱液II进行减压浓缩和真空冷冻干燥,得到具有α-1,3-葡聚糖链的烟薯多糖;
步骤二中所述的流水透析的具体步骤为:将洗脱液I装入截留分子量为8000道尔顿~11000道尔顿的透析袋中,将透析袋置于1000mL的烧杯中,室温下流水持续浸泡透析1天;
步骤二所述的蒸馏水透析的具体步骤为:将流水透析处理后的透析袋置于盛有1000mL蒸馏水的烧杯中,蒸馏水浸泡透析2天,其中每6h~12h更换1次蒸馏水;
所述的DEAE-52纤维素层析柱进行初步分离的条件为:进行氯化钠溶液梯度洗脱,所述的氯化钠溶液浓度依次为0.5mol/L和1.0mol/L,每次所用氯化钠溶液的体积为DEAE-52纤维素层析柱体积的1.5倍~2倍,恒流泵控制洗脱流速为1mL/min,粗多糖溶液II的上样量为2mL,用自动部分收集器每3mL收集1管,收集第20管至第60管的洗脱液为分离后的洗脱液I;所述的DEAE-52纤维素层析柱内径为2.6cm,长度为55cm;
所述的SephadexG-200层析柱对烟薯粗多糖组分溶液进行分离纯化的条件为:洗脱液为蒸馏水,所用蒸馏水的体积为SephadexG-200层析柱体积的1.5倍~2倍,恒流泵控制洗脱的流速为0.5mL/min,烟薯粗多糖组分溶液的上样量为1mL,用自动部分收集器每 3mL收集1管,收集第25管至第50管的洗脱液为分离后的洗脱液II;所述的SephadexG-200层析柱内径为1.6cm,长度为80cm。
本发明的具有α-1,3-葡聚糖链的烟薯多糖用于制备具有保肝及抗氧化作用的药物。
本发明的优点:
本发明首次从烟薯中提取纯化出水溶性分支型α-1,3-葡聚糖,该多糖具有保肝的作用。
本发明的具有α-1,3-葡聚糖链的烟薯多糖的多糖含量为98.47%。
从体外试验和体内试验两个部分进行阐述本发明的α-1,3-葡聚糖链的烟薯多糖用于治疗三-(2,3-二溴丙基)异氰酸酯致肝损伤的方法:
体外试验采用Wistar大鼠喂养试验。体内试验以HepG2细胞为靶细胞,以TBC【三-(2,3-二溴丙基)异氰酸酯(Tris-(2,3-dibromopropyl)isocyanurate,TBC】诱导HepG2细胞凋亡的剂量处理细胞后,再用不同剂量和不同处理时间来观察本发明的α-1,3-葡聚糖链的烟薯多糖对TBC致HepG2细胞凋亡的保护作用。
肝功能生化检测结果显示,应用本发明的α-1,3-葡聚糖链的烟薯多糖治疗三-(2,3-二溴丙基)异氰酸酯致肝损伤后,谷丙转氨酶、谷草转氨酶=血清总蛋白、血清白蛋白、尿素氮、肌酐、胆固醇及甘油三酯等相比TBC染毒组均有很大改善。
肝功能生化检测结果显示,应用本发明的α-1,3-葡聚糖链的烟薯多糖治疗三-(2,3-二溴丙基)异氰酸酯致肝损伤后,碱性磷酸酶(ALP),丙氨酸转氨酶(ALT),天冬氨酸转氨酶(AST),总蛋白(TP),白蛋白(ALB),总胆红素(TBIL),总胆汁酸(TBA),总胆固醇(TCHO),三酰甘油(TG),葡萄糖(GLU)相比TBC染毒组均有很大改善。
应用本发明的α-1,3-葡聚糖链的烟薯多糖治疗三-(2,3-二溴丙基)异氰酸酯致肝损伤后,肝/体比值相比TBC染毒组有明显的改善。
病理组织学检查结果显示,肝脏出现空泡和炎细胞浸润,可得出结论应用本发明的α-1,3-葡聚糖链的烟薯多糖治疗三-(2,3-二溴丙基)异氰酸酯致肝损伤后,对肝脏有改善和保护作用。
对由TBC诱导HepG2细胞凋亡的凋亡率检测结果显示,应用本发明的α-1,3-葡聚糖链的烟薯多糖治疗三-(2,3-二溴丙基)异氰酸酯致肝损伤后,凋亡率有明显的降低。
附图说明
图1为试验一步骤一制备的烟薯粗多糖在波长200-400nm区间进行紫外扫描的光谱图;
图2为试验一中标准葡聚糖凝胶色谱标准曲线;
图3为试验一步骤一制备的烟薯粗多糖的红外扫描图谱;
图4为试验一制备的具有α-1,3-葡聚糖链的烟薯多糖的甲基化糖残基气相色谱图,峰1对应着甲基化糖残基1,峰2对应着甲基化糖残基2,峰3对应着甲基化糖残基3;
图5是甲基化糖残基1的质谱图;
图6是甲基化糖残基2的质谱图;
图7是甲基化糖残基3的质谱图;
图8为试验五中对照组的肝组织病理学切片(x400)照片;
图9为试验五中100mg/kg·bw剂量本发明甘薯多糖干预组的肝组织病理学切片(x400)照片;
图10为试验五中50mg/kg·bw剂量本发明甘薯多糖干预组的肝组织病理学切片(x400)照片;
图11为试验五中TBC染毒组的肝组织病理学切片(x400)照片。
具体实施方式
具体实施方式一:本实施方式为一种具有α-1,3-葡聚糖链的烟薯多糖,其结构式为:
其中n为340~345,相对分子质量为2.40×105Da~2.46×105Da,重复结构单元中含有1→3和1→6两种糖苷键,主链为1→3糖苷键,侧链由1→6糖苷键组成,糖残基为α构型,分支度为0.33。
具体实施方式二:本实施方式为具体实施方案一中具有α-1,3-葡聚糖链的烟薯多糖的制备方法,具体为:
一、制备烟薯粗多糖:将烟薯25清洗干净,去皮,切块,自然晾干,粉碎,过50目筛,得烟薯粉末,将烟薯粉末放入质量分数为95%的乙醇中浸泡24h~48h进行脱脂,取出后自然晾干,然后进行热水浸提,抽滤得提取液,将提取液进行减压浓缩,得到浓缩 液I,将浓缩液I放入质量分数为95%的乙醇溶液中浸泡12h~24h,抽滤得沉淀I,将沉淀I真空干燥后得到沉淀粉末,将沉淀粉末放入蒸馏水中,得到浓度为2mg/mL的粗多糖溶液I,然后用Sevag法脱蛋白,取上清液,将上清液进行减压浓缩,得到浓缩液II,将浓缩液II放入质量分数为95%的乙醇溶液中浸泡12h~24h,抽滤得沉淀II,然后将沉淀II进行真空干燥,得到烟薯粗多糖;所述的烟薯粉末的质量与质量分数为95%的乙醇的体积比为1g:(5mL~10mL);所述的将浓缩液I放入质量分数为95%的乙醇溶液中浸泡12h~24h中的浓缩液I与质量分数为95%的乙醇溶液的体积比为1:(3~4);所述的将浓缩液II放入质量分数为95%的乙醇溶液中浸泡12h~24h中的浓缩液II与质量分数为95%的乙醇溶液的体积比为1:(3~4);
二、纯化:将步骤一得到的烟薯粗多糖放入蒸馏水中,用0.45μm的微孔滤膜过滤,得到浓度为2mg/mL的粗多糖溶液II,用DEAE-52纤维素层析柱进行初步分离,得到分离后的洗脱液I,将分离后的洗脱液I依次进行流水透析1天,蒸馏水透析2天,再进行减压浓缩和真空冷冻干燥,得到烟薯多糖组分,将烟薯多糖组分放入蒸馏水中,用0.45μm的微孔滤膜过滤,得到浓度为2mg/mL的烟薯多糖组分溶液,然后用SephadexG-200层析柱对烟薯多糖组分溶液进行分离纯化,得到分离后的洗脱液II,将分离后的洗脱液II进行减压浓缩和真空冷冻干燥,得到具有α-1,3-葡聚糖链的烟薯多糖;
步骤二中所述的流水透析的具体步骤为:将洗脱液I装入截留分子量为8000道尔顿~11000道尔顿的透析袋中,将透析袋置于1000mL的烧杯中,室温下流水持续浸泡透析1天;
步骤二所述的蒸馏水透析的具体步骤为:将流水透析处理后的透析袋置于盛有1000mL蒸馏水的烧杯中,蒸馏水浸泡透析2天,其中每6h~12h更换1次蒸馏水;
所述的DEAE-52纤维素层析柱进行初步分离的条件为:进行氯化钠溶液梯度洗脱,所述的氯化钠溶液浓度依次为0.5mol/L和1.0mol/L,每次所用氯化钠溶液的体积为DEAE-52纤维素层析柱体积的1.5倍~2倍,恒流泵控制洗脱流速为1mL/min,粗多糖溶液II的上样量为2mL,用自动部分收集器每3mL收集1管,收集第20管至第60管的洗脱液为分离后的洗脱液I;所述的DEAE-52纤维素层析柱内径为2.6cm,长度为55cm;
所述的SephadexG-200层析柱对烟薯粗多糖组分溶液进行分离纯化的条件为:洗脱液为蒸馏水,所用蒸馏水的体积为SephadexG-200层析柱体积的1.5倍~2倍,恒流泵控制洗脱的流速为0.5mL/min,烟薯粗多糖组分溶液的上样量为1mL,用自动部分收集器每3mL收集1管,收集第25管至第50管的洗脱液为分离后的洗脱液II;所述的 SephadexG-200层析柱内径为1.6cm,长度为80cm。
具体实施方式三:本实施方式与具体实施方式二不同的是:步骤一中所述的热水浸提的条件为:提取温度为65℃~85℃,提取时间1.5h~3h,所述的自然晾干后的烟薯25与水的质量比为1:(10~20),提取次数为2次~4次。其它与具体实施方式二相同。
具体实施方式四:本实施方式与具体实施方式二和三之一不同的是:步骤一所述的减压浓缩的过程为:将提取液放入旋转蒸发瓶中,在压强为0.05MPa~0.08MPa和水浴温度为55℃~65℃的条件下将提取液压缩至原体积的15%~30%。其它与具体实施方式二和三之一相同。
具体实施方式五:本实施方式与具体实施方式二至四之一不同的是:步骤一所述的Sevag法脱蛋白的过程为:将浓度为2mg/mL的粗多糖溶液I与Sevag液等体积混合,震荡充分混匀,然后在转速为3000r·min-1离心10min,取上清液;将上清液重复Sevag法脱蛋白的过程5次~10次。其它与具体实施方式二至四之一相同。
具体实施方式六:本实施方式与具体实施方式二至五之一不同的是:步骤一中所述的将沉淀I真空干燥的过程为:将沉淀I装入研钵中,将研钵置于真空干燥箱中,干燥温度为50℃~70℃,压强为0.02MPa~0.05MPa,干燥时间为12h~24h;
步骤一中所述的将沉淀II真空干燥的过程为:将沉淀II装入研钵中,将研钵置于真空干燥箱中,干燥温度为50℃~70℃,压强为0.02MPa~0.05MPa,干燥时间为12h~24h。其它与具体实施方式二至五之一相同。
具体实施方式七:本实施方式与具体实施方式二至六之一不同的是:步骤二中所述的将分离后的洗脱液I依次进行减压浓缩和真空冷冻干燥中的减压浓缩步骤为:将分离后的洗脱液I放入旋转蒸发瓶中,在压强为0.05MPa~0.08MPa和水浴温度为55℃~65℃的条件下将洗脱液I压缩至原体积的15%~30%,得浓缩液;
真空冷冻干燥的过程为:将浓缩液装入2mL的安瓿瓶中,将安瓿瓶置于真空冷冻干燥机中,设定冷冻干燥制品温度为-25℃~-40℃,冷冻时间为12h~24h,压力5Pa~40Pa,解析温度为20℃~40℃,解析时间为8h~18h。其它与具体实施方式二至六之一相同。
具体实施方式八:本实施方式与具体实施方式二至七之一不同的是:步骤二中所述的将分离后的洗脱液II依次进行减压浓缩和真空冷冻干燥中的减压浓缩步骤为:将分离后的洗脱液II放入旋转蒸发瓶中,在压强为0.05MPa~0.08MPa和水浴温度为55℃~65℃的条件下将洗脱液II压缩至原体积的15%~30%,得浓缩液;
真空冷冻干燥的过程为:将浓缩液装入2mL的安瓿瓶中,将安瓿瓶置于真空冷冻干 燥机中,设定冷冻干燥制品温度为-25℃~-40℃,冷冻时间为12h~24h,压力5Pa~40Pa,解析温度为20℃~40℃,解析时间为8h~18h。其它与具体实施方式二至七之一相同。
通过以下试验验证本发明效果:
试验一:本试验为具有α-1,3-葡聚糖链的烟薯多糖的制备方法具体为:
一、制备烟薯粗多糖:将烟薯25清洗干净,去皮,切块,自然晾干,粉碎,过50目筛,得烟薯粉末,将烟薯粉末放入质量分数为95%的乙醇中浸泡48h进行脱脂,取出后自然晾干,然后进行热水浸提,抽滤得提取液,将提取液进行减压浓缩,得到浓缩液I,将浓缩液I放入质量分数为95%的乙醇溶液中浸泡24h,抽滤得沉淀I,将沉淀I真空干燥后得到沉淀粉末,将沉淀粉末放入蒸馏水中,得到浓度为2mg/mL的粗多糖溶液I,然后用Sevag法脱蛋白,取上清液,将上清液进行减压浓缩,得到浓缩液II,将浓缩液II放入质量分数为95%的乙醇溶液中浸泡24h,抽滤得沉淀II,然后将沉淀II进行真空干燥,得到烟薯粗多糖;所述的烟薯粉末的质量与质量分数为95%的乙醇的体积比为1g:5mL;所述的将浓缩液I放入质量分数为95%的乙醇溶液中浸泡24h中的浓缩液I与质量分数为95%的乙醇溶液的体积比为1:3;所述的将浓缩液II放入质量分数为95%的乙醇溶液中浸泡24h中的浓缩液II与质量分数为95%的乙醇溶液的体积比为1:3;
二、纯化:将步骤一得到的烟薯粗多糖放入蒸馏水中,用0.45μm的微孔滤膜过滤,得到浓度为2mg/mL的粗多糖溶液II,用DEAE-52纤维素层析柱进行初步分离,得到分离后的洗脱液I,将分离后的洗脱液I依次进行流水透析1天,蒸馏水透析2天,再进行减压浓缩和真空冷冻干燥,得到烟薯多糖组分,将烟薯多糖组分放入蒸馏水中,用0.45μm的微孔滤膜过滤,得到浓度为2mg/mL的烟薯多糖组分溶液,然后用SephadexG-200层析柱对烟薯多糖组分溶液进行分离纯化,得到分离后的洗脱液II,将分离后的洗脱液II进行减压浓缩和真空冷冻干燥,得到具有α-1,3-葡聚糖链的烟薯多糖;
步骤二中所述的流水透析的具体步骤为:将洗脱液I装入截留分子量为8000道尔顿~11000道尔顿的透析袋中,将透析袋置于1000mL的烧杯中,室温下流水持续浸泡透析1天;
步骤二所述的蒸馏水透析的具体步骤为:将流水透析处理后的透析袋置于盛有1000mL蒸馏水的烧杯中,蒸馏水浸泡透析2天,其中每12h更换1次蒸馏水;
所述的DEAE-52纤维素层析柱进行初步分离的条件为:进行氯化钠溶液梯度洗脱,所述的氯化钠溶液浓度依次为0.5mol/L和1.0mol/L,每次所用氯化钠溶液的体积为DEAE-52纤维素层析柱体积的1.5倍~2倍,恒流泵控制洗脱流速为1mL/min,粗多糖溶 液II的上样量为2mL,用自动部分收集器每3mL收集1管,收集第20管至第60管的洗脱液为分离后的洗脱液I;所述的DEAE-52纤维素层析柱内径为2.6cm,长度为55cm;
所述的SephadexG-200层析柱对烟薯粗多糖组分溶液进行分离纯化的条件为:洗脱液为蒸馏水,所用蒸馏水的体积为SephadexG-200层析柱体积的1.5倍~2倍,恒流泵控制洗脱的流速为0.5mL/min,烟薯粗多糖组分溶液的上样量为1mL,用自动部分收集器每3mL收集1管,收集第25管至第50管的洗脱液为分离后的洗脱液II;所述的SephadexG-200层析柱内径为1.6cm,长度为80cm。
步骤一中所述的热水浸提的条件为:提取温度为80℃,提取时间2h,所述的自然晾干后的烟薯25与水的质量比为1:10,提取次数为3次。
步骤一所述的减压浓缩的过程为:将提取液放入旋转蒸发瓶中,在压强为0.07MPa和水浴温度为60℃的条件下将提取液压缩至原体积的20%。
步骤一所述的Sevag法脱蛋白的过程为:将浓度为2mg/mL的粗多糖溶液I与Sevag液等体积混合,震荡充分混匀,然后在转速为3000r·min-1离心10min,取上清液;将上清液重复Sevag法脱蛋白的过程8次。
步骤一中所述的将沉淀I真空干燥的过程为:将沉淀I装入研钵中,将研钵置于真空干燥箱中,干燥温度为60℃,压强为0.03MPa,干燥时间为12h;
步骤一中所述的将沉淀II真空干燥的过程为:将沉淀II装入研钵中,将研钵置于真空干燥箱中,干燥温度为60℃,压强为0.03MPa,干燥时间为12h。
步骤二中所述的将分离后的洗脱液I依次进行减压浓缩和真空冷冻干燥中的减压浓缩步骤为:将分离后的洗脱液I放入旋转蒸发瓶中,在压强为0.07MPa和水浴温度为60℃的条件下将洗脱液I压缩至原体积的20%,得浓缩液;
真空冷冻干燥的过程为:将浓缩液装入2mL的安瓿瓶中,将安瓿瓶置于真空冷冻干燥机中,设定冷冻干燥制品温度为-40℃,冷冻时间为24h,压力20Pa,解析温度为35℃,解析时间为12h。
步骤二中所述的将分离后的洗脱液II依次进行减压浓缩和真空冷冻干燥中的减压浓缩步骤为:将分离后的洗脱液II放入旋转蒸发瓶中,在压强为0.07MPa和水浴温度为60℃的条件下将洗脱液II压缩至原体积的20%,得浓缩液;
真空冷冻干燥的过程为:将浓缩液装入2mL的安瓿瓶中,将安瓿瓶置于真空冷冻干燥机中,设定冷冻干燥制品温度为-40℃,冷冻时间为24h,压力20Pa,解析温度为35℃,解析时间为12h。
表征检测:
一、烟薯粗多糖紫外光谱扫描:
对试验一步骤一制备的烟薯粗多糖在波长200-400nm区间进行紫外扫描,扫描图谱如图1所示,由光谱图可以看出,在260-280nm之间没有明显的特征峰,说明试验一步骤一制备的烟薯粗多糖中不含有核酸和蛋白质成分,脱蛋白完全,初步纯化后对试验一步骤一制备的烟薯粗多糖利用苯酚硫酸法检测计算得到多糖含量为70.73%。
二、试验一制备的具有α-1,3-葡聚糖链的烟薯多糖相对分子量的测定:
1、多糖相对分子质量标准曲线制作
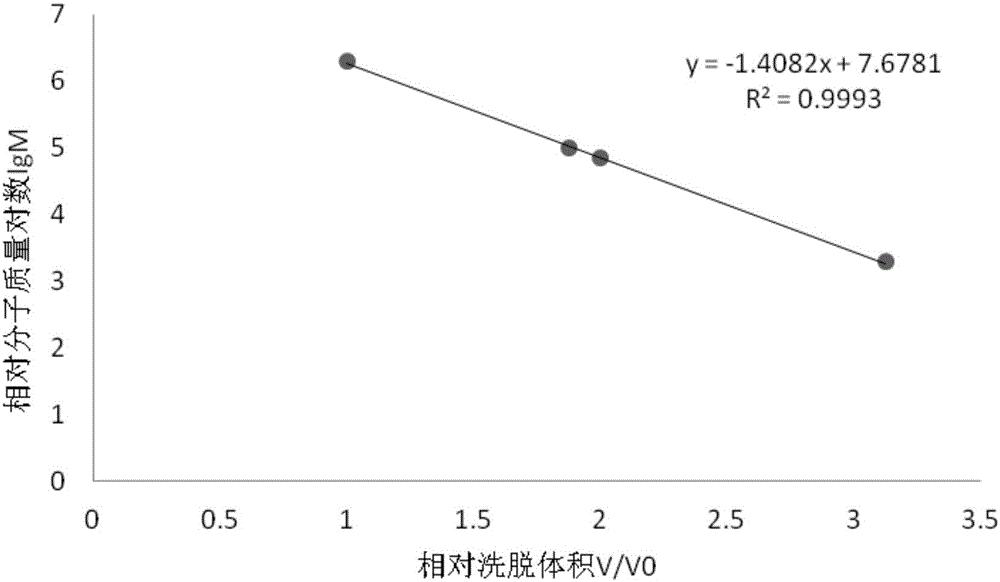
精密称取蓝色葡聚糖T20、T70、T100、T2000各50mg,分别定容于100mL容量瓶中,浓度均为0.5mg/mL,分别取1mL,上样于SephadexG-200层析柱,用恒流泵泵入单蒸水洗脱,用部分自动收集器每2mL/管收集,苯酚-硫酸跟踪检测,收集合并标准糖液完全洗脱时体积V。分别记为V1、V2、V3和V0。以V/V0为横坐标,相对分子质量对数lgM为纵坐标绘制葡聚糖凝胶色谱标准曲线,计算回归方程。
收集完全洗脱已知分子量的蓝色葡聚糖T20、T70、T100和T2000分别为25mL、16mL、15mL和8mL。纵坐标由已知分子量的蓝色葡聚糖lgM分别为3.30103、4.845098、5、6.30103。横坐标由V/V0分别为3.125、2、1.25、1。计算线性回归方程为y=-1.4082x+7.6781,相关系数R2=0.9993。
表1标准葡聚糖凝胶色谱数据测定
图2为标准葡聚糖凝胶色谱标准曲线。
2、样品相对分子质量测定
精密称取试验一制备的具有α-1,3-葡聚糖链的烟薯多糖50mg,定容于100mL容量瓶中,浓度为0.5mg/mL,按照步骤1的方法上样,洗脱,计算完全洗脱时体积V利用标准曲线分别计算对应的相对分子质量,得到洗脱体积分别为13mL,经回归方程计算验一制备的具有α-1,3-葡聚糖链的烟薯多糖的相对分子质量为2.45×105Da。
三、试验一制备的具有α-1,3-葡聚糖链的烟薯多糖红外光谱扫描
取1mg的试验一制备的具有α-1,3-葡聚糖链的烟薯多糖干燥粉末,与200mgKBr粉末混匀,在玛瑙研钵中研磨,小心将其置于滤纸上,用压片机压成薄片,然后上傅立叶红外光谱仪测定,在4000-400cm-1区间进行红外扫描,扫描图谱如图3。
由图3可知,在3200cm-1-2800cm-1和1400cm-1-1200cm-1,试验一制备的具有α-1,3-葡聚糖链的烟薯多糖有特征吸收峰,说明试验一制备的具有α-1,3-葡聚糖链的烟薯多糖具有糖类特征,在960cm-1-730cm-1为多糖特征吸收峰,3604cm-1有O-H伸缩振动的强吸收峰,1773cm-1是-CHO或C=O的伸缩振动峰,2860cm-1有C-H伸缩振动峰,在1033cm-1有特征吸收峰说明试验一制备的具有α-1,3-葡聚糖链的烟薯多糖为吡喃型糖环,在833cm-1有吸收峰,证明试验一制备的具有α-1,3-葡聚糖链的烟薯多糖糖苷键构型含有α-糖苷键。
四、试验一制备的具有α-1,3-葡聚糖链的烟薯多糖甲基化分析
取干燥的试验一制备的具有α-1,3-葡聚糖链的烟薯多糖0.1mg于反应管→溶于0.3mL无水DMSO→充入氮气,超声水浴30min→加入10mg氢氧化钠粉末→充入氮气,超声水浴20min→冰浴至样品溶液凝固→充入氮气,加0.1mL碘甲烷→封住反应1h→充入氮气→加单蒸水0.2mL→加氯仿萃取2次,每次1mL→合并氯仿液,加入无水硫酸钠,过夜→过滤除去无水硫酸钠,减压蒸干氯仿→得到甲基化产物→加入2mol/L三氟乙酸0.5mL,100℃反应2h→减压蒸干,加甲醇0.1mL,充入氮气→加入5mg硼氢化钠,2mL单蒸水,反应2h→滴加1mol/L乙酸中和→加入0.1mL甲醇,蒸干→加入无水吡啶和无水醋酸酐各0.5mL,反应2h→减压蒸干→加0.5mL氯仿溶解→进行GC-MS分析。
GC-MS分析条件:色谱柱为EC-1column,填充柱0.25mm×25m,程序升温100~250℃,载气为氮气,EI源70eV,进样量1μL。
图4为试验一制备的具有α-1,3-葡聚糖链的烟薯多糖的甲基化糖残基气相色谱图,可以看出有三个峰,分别对应着三个甲基化糖残基1、2和3,图5、6和7是三个甲基化糖残基的质谱图,可以看出三个糖残基碎片分别是甲基化糖残基1:2,3,4,6-Me4-Glc、甲基化糖残基2:2,4-Me2-Glc和甲基化糖残基3:2,4,6-Me3-Glc,推测出试验一制备的具有α-1,3-葡聚糖链的烟薯多糖的连接方式为1-Glc、1,3,6-Glc和1,3-Glc。
由图4可知,甲基化糖残基2和3的摩尔比为23.84和15.06可以推断出为试验一制备的具有α-1,3-葡聚糖链的烟薯多糖的的主链,而摩尔比4.58甲基化糖残基1值小为支链组成。
试验一制备的具有α-1,3-葡聚糖链的烟薯多糖的结构:主链由1→3和1→3→6两种α-葡聚糖交替构成,在主链部分6位上有支链,由1-Glc构成。
所以,试验一制备的具有α-1,3-葡聚糖链的烟薯多糖的结构式:
n为340,重复结构单元中含有1→3和1→6两种糖苷键,主链为1→3糖苷键,侧链由1→6糖苷键组成,糖残基为α构型,分支度为0.33。
表2甲基化分析结果
对试验一制备的具有α-1,3-葡聚糖链的烟薯多糖干预TBC致肝损伤的效果检测:
α-1,3-葡聚糖链的烟薯多糖干预TBC致肝损伤的体外喂养Wistar大鼠试验过程如下:
将体重为60g~70g的Wistar大鼠随机分成四组,每组20只,雌雄各半,四组分别记为阴性对照组、阳性对照组(TBC染毒组)、α-1,3-葡聚糖链的烟薯多糖低剂量干预组和α-1,3-葡聚糖链的烟薯多糖高剂量干预组,其中四组所做处理如下:
阴性对照组:每天饲喂普通饲料,自由摄食;
阳性对照组(TBC染毒组):每天以TBC灌胃进行染毒,TBC的剂量以大鼠体重计为0.625g/kg,饲喂普通饲料,自由摄食;
α-1,3-葡聚糖链的烟薯多糖低剂量干预组:每天先以TBC灌胃进行染毒,TBC的剂量以大鼠体重计为0.625g/kg,染毒后α-1,3-葡聚糖链的烟薯多糖的普通饲料,α-1,3-葡聚糖链的烟薯多糖的剂量每天以Wistar大鼠体重计为50mg/kg,自由摄食;
α-1,3-葡聚糖链的烟薯多糖高剂量干预组:每天先以TBC灌胃进行染毒,TBC的剂量以大鼠体重计为0.625g/kg,染毒后α-1,3-葡聚糖链的烟薯多糖的普通饲料,α-1,3-葡聚糖链的烟薯多糖的剂量每天以Wistar大鼠体重计为100mg/kg,自由摄食;试验过程中采 用用酪蛋白调整各组动物饲料中蛋白含量一致,试验连续三十天。
试验二:对生长情况的监测与结果:
在三十天的喂养过程中,每周测量一次体重,计算一次体重增重。
在饮食摄取量方面,称量洒食量和剩余量,计算一次摄食量。
得到如表3所示的喂养试验结果,从表3中可以看出TBC染毒组、试验二:低剂量干预组(50mg/kg·bw;body weight,bw)、α-1,3-葡聚糖链的烟薯多糖高剂量干预组(1000mg/kg·bw;body weight,bw)和阴性对照组的体重增长呈现出明显的梯度关系,雄性组和雌性组的两个剂量干预组都与TBC染毒组具有明显的差异,且存在统计学差异。
表3三十天喂养试验结果
注:﹡与对照组比较,p<0.05.
试验三:肝功能生化检测及结果:
三十天的喂养结束后,动物麻醉条件下腹主动脉取血分离血清,采用生化自动分析仪测定肝功能生化指标,得到如表4和表5所示的血液生化指标检测结果。
①表4给出了谷丙转氨酶、谷草转氨酶(包括中剂量组)、血清总蛋白、胆固醇及甘油三酯的检测结果,从表4可以看出,100mg/kg·bw的α-1,3-葡聚糖链的烟薯多糖干预组 雄性大鼠谷丙转氨酶、谷草转氨酶、血清总蛋白、胆固醇及甘油三酯均相对TBC染毒组有极大的改善,且存在统计学意义。α-1,3-葡聚糖链的烟薯多糖两个剂量的干预组雌性大鼠的谷草转氨酶及100mg/kg·bw的α-1,3-葡聚糖链的烟薯多糖干预组的血清总蛋白、血清白蛋白、尿素氮、肌酐、胆固醇及甘油三酯均相对TBC染毒组有极大的改善。
表4血液生化指标检测结果a
注:﹡与对照组比较,p<0.05;﹡﹡与对照组比较,p<0.01.
②表5给出了碱性磷酸酶(ALP),丙氨酸转氨酶(ALT),天冬氨酸转氨酶(AST),总蛋白(TP),白蛋白(ALB),总胆红素(TBIL),总胆汁酸(TBA),总胆固醇(TCHO),三酰甘油(TG),葡萄糖(GLU)的检测结果,从表5可以看出
表5血液生化指标检测结果b
注:﹡与对照组比较,p<0.05.
试验四:三十天的喂养试验结束后,动物各脏器称重,计算脏体比值,结果见表6,从表6可以看出,雄性大鼠和雌性大鼠染毒组的50mg/kg·bw和100mg/kg·bw的α-1,3-葡聚糖链的烟薯多糖干预组与对照组的肝/体比值比较TBC染毒组有明显的改善,存在统计学差异,且有剂量效应关系。
表6染毒四周后肝脏/体比结果
注:﹡与对照组比较,p<0.05.
试验五:三十天的喂养试验结束后,取部分肝脏备做病理组织学检测,得到如图8~11所示的肝组织病理学切片(x400)照片,从图8~11可以看出,结果发现染毒组和低剂量α-1,3-葡聚糖链的烟薯多糖干预组相对高剂量α-1,3-葡聚糖链的烟薯多糖干预组和对照组在病理组织学检查时发现肝脏出现空泡和炎细胞浸润,表明α-1,3-葡聚糖链的烟薯多糖干预组对肝脏有改善和保护作用。
试验六:三十天的喂养试验结束后,在低温条件下制备肝匀浆检测超氧化物歧化酶(SOD),过氧化氢酶(CAT),谷胱甘肽过氧化物酶(GSHPx),丙二醛(MDA)等指标,结果见表7,从表7可以看出,比较上述各项指标两组α-1,3-葡聚糖链的烟薯多糖干预组相比染毒组均有很大改善。
表7抗氧化指标检测结果
注:﹡与对照组比较,p<0.05;﹡﹡与对照组比较,p<0.01.
甘薯多糖干预TBC致肝损伤的体内HepG2细胞凋亡抑制试验过程如下:
以HepG2细胞为靶细胞,以TBC诱导HepG2细胞凋亡的剂量处理细胞后,再用不同剂量和不同处理时间来观察α-1,3-葡聚糖链的烟薯多糖对TBC致HepG2细胞凋亡的保护作用,阐明其具有剂量效应及时间效应关系。得到如表8所示的α-1,3-葡聚糖链的烟薯多糖干预对HepG-2细胞的凋亡率结果,从表8可以看出,α-1,3-葡聚糖链的烟薯多糖干预组的凋亡率比较TBC染毒组,其凋亡率有明显的降低。
表8流式细胞仪检测α-1,3-葡聚糖链的烟薯多糖干预对HepG-2细胞的凋亡率
注:﹡与对照组比较,p<0.05,﹡﹡与对照组比。
- 还没有人留言评论。精彩留言会获得点赞!