基于苯并二噻吩‑2,6‑二甲酸酯的D‑A型宽带隙聚合物光伏材料及其应用的制作方法
本发明涉及有机聚合物太阳能电池领域,特别涉及了一类基于苯并二噻吩-2,6-二甲酸酯受电子单元的D-A型宽带隙聚合物光伏材料的合成及其在聚合物太阳能电池器件中的应用。
技术背景
经济社会的发展离不开能源。当今在化石能源日益匮乏和环境亟待保护的双重制约下,能源和环境问题已成为全球迫切需要解决的重点和难点问题。由于太阳能具有取之不尽、用之不竭,安全、无污染、没有地域限制等无可比拟的优势,太阳能的开发与应用,已成为全球绿色新能源研究的热点。其中,将太阳能转换成电能的太阳能电池技术是近年来太阳能开发与应用的重点研究方向。
有机太阳能电池(OSCs)由于具有材料选择范围宽、结构易调节、制备工艺简单、器件易大面积柔性化等优点,已成为太阳能电池技术的主要发展方向,并获得快速的发展[1-6]。目前有机太阳能电池主要包括聚合物太阳能电池(PSCs)和有机小分子太阳能电池(SMs-OSCs)。其中,基于聚合物和小分子的本体异质结(BHJ)单层OSCs的能量转化效率分别达到了11.7%[7]和10.08%[8],基于聚合物和小分子的叠层OSCs的能量转化效率分别达到了11.83%[9]和10.1%[10]。纵观这些高效的有机太阳能电池,其光活性材料主要是采用窄带隙的共轭聚合物和小分子,以最大程度地吸收太阳光子,获得高的短路电流(Jsc)。相比于窄带隙(Eg<1.8eV)光伏材料,宽带隙(Eg>1.9eV)光伏材料的研究相对滞后,其太阳能电池的能量转化效率大都低于7%[11]。
叠层有机太阳能电池是利用两种或以上光伏供体材料对太阳能吸收的优势互补,构筑的高效太阳能电池。其中,宽带隙共轭聚合物是其重要的组成部分。因此,开发高效宽带隙聚合物光伏材料,是叠层有机太阳能电池实现高能量转换效率的关键和拟解决的关键瓶颈问题[12]。
附:主要参考文献
[1].C.W.Tang,Appl.Phys.Lett.,1986,48,183.
[2].B.O’Regan,M.Nature,1991,353,737.
[3].H.Kallmann,M.Pope,J.Chem.Phys.,1959,30,585.
[4].G.Yu,A.J.Heeger,Science,1995,270,1789.
[5].(a)W.Li,C.Du,F.Li,Y.Zhou,M.Fahlman,Z.Bo,F.Zhang,Chem.Mater.,2009,21,5327.(b)G.Zhao,G.Wu,C.He,F.-Q.Bai,H.Xi,H.-X.Zhang,Y.Li,J.Phys.Chem.C,2009,113,2636.(c)J.Zhang,W.Z.Cai,F.Huang,E.G.Wang,C.M.Zhong,S.J.Liu,M.Wang,C.H.Duan,Y.Cao,Macromolecules,2011,44,894.(d)J.Chen,Y,Cao.,Acc.Chem.Res.,2009,42,1709.(e)L.J.Huo,X.Guo,S.Q.Zhang,Y.F.Li,J.H.Hou,Macromolecules,2011,44,4035.(f)Z.F.Li,Q.F.Dong,B.Xu,W.D.Cheng,S.Y.Yao,X.Y.Zhang,S.P.Wen,H.Li,Y.J.Dong,W.J.Tian,Sol.Energ.Mat.Sol.Cells,2012,98,343.
[6].Y.M.Sun,G.C.Welch,W.L.Leong,C.J.Takacs,G.C.Bazan,A.J.Heeger,Nat.Mater.,2012,11,44.
[7].J.B.Zhao,Y.K.Li,G.F.Yang,K.Jiang,H.Lin,H.Ade,W.Ma,H.Yan,Nat.Energy,2016,1,15027.
[8].B.Kan,M.Li,Q.Zhang,F.Liu,X.Wan,Y.Wang,W.Ni,G.Long,X.Yang,H.Feng,Y.Zuo,M.Zhang,F.Huang,Y.Cao,T.P.Russell,Y.Chen,J.Am.Chem.Soc.,2015,137,3886-3893.
[9].A.R.M.Yusoff,D.Kim,H.P.Kim,F.K.Shneider,W.J.Silv,J.Janga,Energy Environ.Sci.,2015,8,303-316.
[10].Y.Liu,C.C.Chen,Z.Hong,J.Gao,Y.(M.)Yang,H.Zhou,L.Dou,G.Li,Y.Yang,Sci.Rep.,2013,3,3356-3356.
[11].(a)S.C.Price,A.C.Stuart,L.Yang,H.Zhou and W.You,J.Am.Chem.Soc.,2011,133,4625–4631.(b)J.Wolf,F.Cruciani,A.E.Labban and P.M.Beaujuge,Chem.Mater.,2015,27,4184–4187.(c)W.Gao,T.Liu,M.Hao,K.Wu,C.Zhang,Y.Sun,C.Yang,Chem.Sci.,2016,DOI:10.1039/c6sc01791f.
[12].(a)K.Li,Z.Li,K.Feng,X.Xu,L.Wang and Q.Peng,J.Am.Chem.Soc.,2013,135,13549–13557.(b)C.Duan,A.Furlan,J.J.V.Franeker,R.E.M.Willems,M.M.Wienk and R.A.J.Janssen,Adv.Mater.,2015,27,4461–4468.
技术实现要素:
针对目前宽带隙光伏材料品种少、能量转换效率偏低等问题,发明了一类新型的苯并二噻吩-2,6-二甲酸酯受电子(A)单元及其D-A型宽带隙聚合物光伏材料。该类材料的分子结构特点是以苯并二噻-2,6-二甲酸酯为受电子(A)单元,噻吩、苯并二噻吩衍生物为推电子(D)单元。利用这类D-A型聚合物光伏供体材料和富勒烯受体材料,通过溶液加工,制作了聚合物太阳能电池(PSCs),实现了宽带隙聚合物光伏材料在PSCs中的高效能量转换。
本发明的目的在于提供一类具有高能量转换效率的宽带隙D-A型聚合物光伏材料。该类材料具有较低的HOMO能级,较好的成膜性,在300-600nm波长范围具有较强的吸收和光谱响应。当与PC71BM共混时,其溶剂加工型本体异质结PSCs器件获得了高的能量转化效率(PCE)和开路电压(Voc)。
这类D-A型聚合物光伏材料的分子结构可以是下列分子的任何一种。
式一:PV-BDTC1
式二:PV-BDTC2
式三:PV-BDTC3T
式四:PV-BDTC3TO
上述D-A型宽带隙聚合物光伏材料,包括下面任何衍生物:
以苯并二噻吩-2,6-二甲酸酯(V-BDTC)为受电子基团,烷氧基取代的苯并二噻吩(BDT)为推电子基团,具有D-A结构的聚合物光伏材料PV-BDTC1。
以苯并二噻吩-2,6-二甲酸酯(V-BDTC)为受电子基团,烷基噻吩基取代的苯并二噻吩(BDTT)为推电子基团,具有D-A结构的聚合物光伏材料PV-BDTC2。
以苯并二噻吩-2,6-二甲酸酯(V-BDTC)为受电子基团,烷基噻吩衍生物(3T)为推电子基团,具有D-A结构的聚合物光伏材料PV-BDTC3T。
以苯并二噻吩-2,6-二甲酸酯(V-BDTC)为受电子基团,烷氧基噻吩衍生物(3TO)为推电子基团,具有D-A结构的聚合物光伏材料PV-BDTC3TO。
为了得到上述聚合物光伏材料,本发明的合成方案如下:
新型受体单元苯并二噻吩-2,6-二甲酸酯的合成:1,4-二溴-2,5-二甲苯在三氧化铬和浓硫酸的作用下,氧化成1,4-二溴-2,5-二苯甲醛;该二苯甲醛衍生物进一步与巯基乙酸乙酯缩合得到苯并二噻吩-4,6-二甲酸乙酯(V-BDTC);采用烷基醇与V-BDTC进行酯交换反应,得到不同烷基取代的苯并二噻吩-4,6-二甲酸酯。该二甲酸酯与Br2发生亲电取代反应,得到双溴取代的苯并二噻吩-4,6-二甲酸酯。经柱层析分离得到纯品;将双溴取代的苯并二噻吩-4,6-二甲酸酯先后与2-三丁基锡噻吩Still交叉偶联和NBS溴化得到4,8-二-(2-(5-溴噻吩基)苯并[1,2-b:4,5-b']二噻吩-2,6-二[甲酸(2-丁基)辛酯]。
一维D-A型聚合物光伏材料PV-BDTC1的合成:4,8-二-(2-(5-溴噻吩基)苯并[1,2-b:4,5-b']二噻吩-2,6-二[甲酸(2-丁基)辛酯]与双烷氧基苯并二噻吩三甲基锡取代物(BDTSnMe3)在三(二亚苄基丙酮)二钯催化下发生Still偶联聚合反应,合成得到聚合物PV-BDTC1粗产品,经过甲醇沉降,索氏提取洗涤,再沉降得到聚合物PV-BDTC1纯产品。
二维D-A型聚合物光伏材料PV-BDTC2的合成:含4,8-二-(2-(5-溴噻吩基)苯并[1,2-b:4,5-b']二噻吩-2,6-二[甲酸(2-丁基)辛酯]与双烷基噻吩基苯并二噻吩三甲基锡取代物(BDTTSnMe3)在三(二亚苄基丙酮)二钯催化下发生Still偶联聚合反应,合成得到聚合物PV-BDTC2粗产品,经过甲醇沉降,索氏提取洗涤,再沉降得到聚合物PV-BDTC2纯产品。
D-A型聚合物光伏材料PV-BDTC3T的合成:4,8-二溴苯并[1,2-b:4,5-b']二噻吩-2,6-二[甲酸(2-丁基辛酯]与烷基化连三噻吩三甲基锡取代物(3TSnMe3)在三(二亚苄基丙酮)二钯催化下发生Still偶联聚合反应,合成得到聚合物PV-BDTC3T粗产品,聚经甲醇沉降,索氏提取洗涤,再沉降得到聚合物PV-BDTC3T纯产品。
D-A型聚合物光伏材料PV-BDTC3TO的合成:4,8-二溴苯并[1,2-b:4,5-b']二噻吩-2,6-二[甲酸(2-丁基辛酯]与烷氧基化连三噻吩三甲基锡取代物(3TOSnMe3)在三(二亚苄基丙酮)二钯催化下发生Still偶联聚合反应,合成得到聚合物PV-BDTC3TO粗产品,经过甲醇沉降,索氏提取洗涤,再沉降得到聚合物PV-BDTC3TO纯产品。
本发明新型受电子单元4,8-二溴苯并二噻吩-2,6-二甲酸酯V-BDTC与已公开的大多数受电子单元相比,其特点是:(1)以4,8位的连接方式可以有效降低聚合物分子的HOMO能级,获得一个较大的开路电压;(2)2,6位二酯基的修饰能有效增加整个苯并二噻吩单元的受电子能力;(3)选择不同长度的烷基链可以有效调节聚合物分子的溶解性;(4)选择不同的推电子单元,分子中推受结构的存在,可调节分子的吸收光谱和电子轨道能级。因此,这类材料是一类很有发展前景的聚合物光伏材料。
本发明的应用在于:将设计的聚合物光伏材料作为光活性层给体材料,与PC71BM在不同比例下共混,制作聚合物太阳能电池器件,实现器件的高效光电转换。
所述的有机聚合物太阳能电池器件包括氧化锡铟(ITO)导电玻璃阳极、阳极修饰层、光活性层、阴极。其中阳极修饰层为聚二氧乙基噻吩、聚苯乙烯磺酸盐(PEDOT/PSS,30nm)涂层;阴极为Ca(10nm)/Al(100nm)的沉积层;活化层材料为本发明所述的聚合物光伏材料与PC71BM,其共混重量比为1:2。
附图说明
图1为本发明PV-BDTC1的热失重曲线
图2为本发明PV-BDTC1的示差扫描量热曲线
图3为本发明PV-BDTC1氯仿溶液的紫外-可见吸收光谱
图4为本发明PV-BDTC1固体膜的紫外-可见吸收光谱
图5为本发明PV-BDTC1固体膜的循环伏安曲线
图6为本发明PV-BDTC1/PC71BM聚合物太阳能电池器件的J-V曲线
图7为本发明PV-BDTC1/PC71BM聚合物太阳能电池器件的EQE曲线
图8为本发明PV-BDTC2的热失重曲线
图9为本发明PV-BDTC2的示差扫描量曲线
图10为本发明PV-BDTC2氯仿溶液的紫外-可见吸收光谱
图11为本发明PV-BDTC2固体膜的紫外-可见吸收光谱
图12为本发明PV-BDTC2固体膜的循环伏安曲线
图13为本发明在添加3%DIO下,PV-BDTC2/PC71BM聚合物太阳能电池器件的J-V曲线
图14为本发明在添加3%DIO下,PV-BDTC2/PC71BM聚合物太阳能电池器件的EQE曲线
图15为本发明PV-BDTC2/PC71BM单空穴传输器件的J-V曲线
图16为本发明PV-BDTC2/PC71BM单电子传输器件的J-V曲线
图17为本发明PV-BDTC2/PC71BM光活性层的TEM图
图18为本发明在添加3%DIO下,PV-BDTC2/PC71BM的光活性层的TEM图
图19为本发明PV-BDTC3T氯仿溶液的紫外-可见吸收光谱
图20为本发明PV-BDTC3T固体膜的紫外-可见吸收光谱
图21为本发明PV-BDTC3T固体膜的循环伏安曲线
图22为本发明PV-BDTC3TO氯仿溶液的紫外-可见吸收光谱
图23为本发明PV-BDTC3TO固体膜的紫外-可见吸收光谱
图24为本发明PV-BDTC3TO固体膜的循环伏安曲线
具体实施方式
下面通过具体实施例对本发明作进一步说明,但这些具体实施方案不以任何方式限制本发明的保护范围。
实施例1
4,8-二溴苯并[1,2-b:4,5-b']二噻吩-2,6-二[甲酸(2-丁基)辛酯]的合成
1.1 2,5-二溴苯-1,4-二甲醛的合成
在100mL单口瓶中,将2,5-二溴-1,4-二甲基苯(3.9g,15mmol)溶于20mL醋酸和40mL醋酸酐的混合溶液中,磁力搅拌,0℃下缓慢滴加浓硫酸(14mL)后,分批加入CrO3(6.0g),0℃下反应3h。待反应结束后,将反应液倒入100mL冰水中,析出大量白色固体,抽滤,水洗。将固体转移到100mL单口瓶中,加入20mL水、20mL乙醇和2mL浓硫酸,加热回流12h。自然冷却,抽滤,固体用水、甲醇交替洗涤多次。真空干燥,得到淡黄色固体(2.0g,48.0%)。1H NMR(400MHz,CDCl3)δ10.39(s,2H),8.20(s,2H).13C NMR(100MHz,CDCl3)δ10.39,8.20,7.31,1.66,0.04.
1.2 苯并[1,2-b:4,5-b']二噻吩-2,6-二(甲酸乙酯)的合成
在100mL单口瓶中,加入2,5-二溴苯-1,4-二甲醛(2.7g,9.3mmol)、巯基乙酸乙酯(3.0g,28mmol)、碳酸钾(4.1g,30mmol)、氧化铜(180mg,0.3mmol),N,N-二甲基甲酰胺(DMF)(100mL),在氮气氛围下,搅拌加热至80℃,反应24h,冷却至室温。反应混合物用三氯甲烷萃取(3×20mL),合并的有机层用稀盐酸水洗涤多次,无水硫酸镁干燥,蒸馏,剩余物以石油醚/二氯甲烷混合溶液为洗脱剂(v/v,1:1)进行柱层析分离,得淡黄色针状晶体1.2g,产率38.7%。1H NMR(400MHz,CDCl3)δ8.37(s,2H),8.10(s,2H),4.43(d,J=6.7Hz,4H),1.69–1.31(m,6H).13C NMR(100MHz,CDCl3)δ162.55,139.23,138.32,135.87,129.42,119.34,110.02,61.88,14.35.
1.3 苯并[1,2-b:4,5-b']二噻吩-2,6-二[甲酸(2-丁基)辛酯]的合成
在100mL单口瓶中,加入苯并[1,2-b:4,5-b']二噻吩-2,6-二(甲酸乙酯)(1.0g,3.0mmol),2-丁基辛醇(2.0g),甲苯(40mL),乙酰丙酮氧钛(40mg),回流反应,用水分分离器移出反应产生的乙醇。反应10h后,补加2-丁基辛醇(1.0g)和乙酰丙酮氧钛(160mg),继续反应4h。通过旋转蒸发器蒸馏除去溶剂,剩余物以石油醚/二氯甲烷混合溶液(v/v,2:1)为洗脱剂,进行柱层析分离,得浅黄色块状固体1.36g,产率74.1%。1H NMR(400MHz,CDCl3)δ8.38(s,2H),8.09(s,2H),4.28(d,J=5.6Hz,4H),1.80(d,J=5.6Hz,2H),1.47–1.12(m,32H),0.89(m,12H).13C NMR(100MHz,CDCl3)δ162.64,141.35,139.27,138.34,136.72,135.95,129.89,129.30,122.31,119.32,69.88,68.62,66.72,37.45,34.15,31.82,31.44,31.11,29.63,29.00,27.78,26.76,23.74,23.00,22.66,15.21,14.10,14.05.
1.4 4,8-二溴苯并[1,2-b:4,5-b']二噻吩-2,6-二[甲酸(2-丁基辛酯]的合成
在250mL单口瓶中,加入苯并[1,2-b:4,5-b']二噻吩-2,6-二[甲酸(2-丁基)辛酯](1.36g,2.2mmol),液溴(0.4mL,4.6mmol),FeCl3(150mg),三氯甲烷80mL,避光回流反应24h。自然冷却,加水淬灭反应,有机层用亚硫酸钠水溶液洗涤多次,干燥,通过旋转蒸发器蒸馏除去溶剂,剩余物以石油醚/二氯甲烷混合溶液(v/v,2:1)为洗脱剂,进行柱层析分离,淡黄色固体1.4g,产率82.0%。1H NMR(400MHz,CDCl3)δ8.27(s,2H),4.30(d,J=5.6Hz,4H),1.82(d,J=5.6Hz,2H),1.48–1.16(m,32H),0.91(dt,J=15.6,6.4Hz,12H).13C NMR(100MHz,CDCl3)δ161.99,141.20,137.68,136.93,129.74,111.46,69.08,37.39,31.84,31.42,31.09,29.62,29.01,26.76,23.00,22.68,14.14,14.09.
实施例2
4,8-二-(2-(5-溴噻吩基)苯并[1,2-b:4,5-b']二噻吩-2,6-二[甲酸(2-丁基)辛酯](M1)的合成
2.1 4,8-二-(2-噻吩基)苯并[1,2-b:4,5-b']二噻吩-2,6-二[甲酸(2-丁基)辛酯]的合成
在100mL单口瓶中,依次加入(4,8-二溴苯并[1,2-b:4,5-b']二噻吩-2,6-二[甲酸(2-丁基)辛酯](0.77g,1.0mmol),四(三苯基磷)钯(60mg),2-三丁基锡噻吩(1.12g,3.0mmol),30mL甲苯,体系氮气保护。控温100℃搅拌反应18h。停止反应,待反应物冷却至室温后,将其倒入100mL蒸馏水中,二氯甲烷萃取(3×30mL)。合并的有机相用无水硫酸镁干燥、过滤,滤液进行减压蒸馏除去溶剂,剩余物以石油醚:二氯甲烷混合溶液(v/v,2:1)为洗脱剂,进行柱层析分离,得720mg黄色固体,收率92.5%。1H NMR(400MHz,CDCl3)δ8.30(s,2H),7.59(d,J=4.9Hz,2H),7.51(d,J=3.0Hz,2H),7.34–7.27(m,2H),4.23(d,J=5.8Hz,4H),1.77(d,J=4.9Hz,2H),1.63(dd,J=15.6,8.2Hz,2H),1.47–1.09(m,32H),0.90(dt,J=15.2,7.0Hz,12H).13C NMR(100MHz,CDCl3)δ162.58,141.27,137.95,137.51,136.07,129.72,128.70,127.77,127.29,126.23,68.82,37.37,31.77,31.45,31.10,29.59,28.96,28.29,26.77,26.72,22.96,22.64,17.31,14.09,14.03,13.58.
2.2 4,8-二-(2-(5-溴噻吩基)苯并[1,2-b:4,5-b']二噻吩-2,6-二[甲酸(2-丁基)辛酯](M1)的合成
在100mL单口瓶中,4,8-二-(2-噻吩基)苯并[1,2-b:4,5-b']二噻吩-2,6-二[甲酸(2-丁基)辛酯](0.72g,0.93mmol),溶于干燥的四氢呋喃(THF)30mL,避光条件下,分批加入N-溴代丁二酰亚胺(NBS)(344mg,1.95mmol)。室温反应24h。停止反应,倒入100mL蒸馏水中,二氯甲烷萃取(3×30mL)。合并的有机相用无水硫酸镁干燥、过滤,滤液通过减压蒸馏除溶剂,剩余物以石油醚:二氯甲烷混合溶液(v/v,2:1)为洗脱剂,进行柱层析分离。最后用乙醇和四氢呋喃重结晶得700mg黄色固体,收率90%。1H NMR(400MHz,CDCl3)δ8.28(d,J=0.8Hz,2H),7.29(m,4H),4.27(d,J=5.8Hz,4H),1.82(s,2H),1.51–1.18(m,32H),0.91(dd,J=12.3,6.7Hz,12H).13C NMR(100MHz,CDCl3)δ162.36,141.13,139.25,137.37,136.42,130.68,129.25,129.17,125.46,114.53,68.99,37.31,31.80,31.41,31.08,29.61,28.96,26.72,23.00,22.68,14.15,14.10.
实施例3
聚合物PV-BDTC1的合成
在25mL两口瓶中,依次加入M1(154mg,0.2mmol),三甲基锡苯并二噻吩(187mg,0.2mmol),三(二亚苄基丙酮)二钯(3mg),三(邻甲苯基)磷(6mg),无氧甲苯6mL。在氮气流保护下,控温110℃反应24h。自然冷却,加入10mL甲苯稀释反应液,滴加到100mL甲醇中沉降。抽滤,聚合物固体物依次用甲醇、乙醚、三氯甲烷进行索氏提取,将三氯甲烷提取液浓缩,滴入甲醇中沉降。抽滤、收集固体物,真空干燥。得到红色固体200mg,产率90%。
实施例4
聚合物PV-BDTC2的合成
在25mL两口瓶中,依次加入M1(154mg,0.15mmol),4,8-二(2-(5-烷基噻吩基)苯并二噻吩三甲基锡(187mg,0.15mmol),三(二亚苄基丙酮)二钯(3mg),三(邻甲苯基)磷(6mg),无氧甲苯6mL。体系在氮气流保护下,控温110℃反应24h。自然冷却,加入10mL甲苯稀释反应液,滴加到100mL甲醇中沉降。抽滤,聚合物固体物依次用甲醇、乙醚、三氯甲烷进行索氏提取。将三氯甲烷提取液浓缩,滴入甲醇中沉降。抽滤、收集固体物,真空干燥。得到红色固体150mg,产率73%。
聚合物PV-BDTC3T的合成
在25mL两口瓶中,依次加入4,8-二溴苯并[1,2-b:4,5-b']二噻吩-2,6-二[甲酸(2-丁基)辛酯](154mg,0.2mmol),(3,3”-二辛基-[2,2':5',2”-三噻吩基]-5,5”二三甲基锡(160mg,0.2mmol),三(二亚苄基丙酮)二钯(3mg),三(邻甲苯基)磷(6mg),无氧甲苯6mL。体系在氮气流保护下,控温110℃反应24h。自然冷却,加入10mL甲苯稀释反应液,滴加到100mL甲醇中沉降。抽滤,聚合物固体物依次用甲醇、乙醚、三氯甲烷进行索氏提取。将三氯甲烷提取液浓缩,滴入甲醇中沉降。抽滤、收集固体物,真空干燥。得到橙红色固体125mg,产率72%。
聚合物PV-BDTC3TO的合成
在25mL两口瓶中,依次加入4,8-二溴苯并[1,2-b:4,5-b']二噻吩-2,6-二[甲酸(2-丁基)辛酯](154mg,0.2mmol),(3,3”-二己氧基-[2,2':5',2”-三噻吩基]-5,5”二三甲基锡(160mg,0.2mmol),三(二亚苄基丙酮)二钯(3mg),三(邻甲苯基)磷(6mg),无氧甲苯6mL。体系在氮气流保护下,控温110℃反应24h。自然冷却,加入10mL甲苯稀释反应液,滴加到100mL甲醇中沉降。抽滤,聚合物固体物依次用甲醇、乙醚、三氯甲烷进行索氏提取。将三氯甲烷提取液浓缩,滴入甲醇中沉降。抽滤、收集,真空干燥。得到黑色固体75mg,产率53%。
实施例5
含新型苯并二噻吩-2,6-二甲酸酯受体单元的D-A型宽带隙聚合物光伏材料的性能表征及其光伏光器件的制作和性能测试
新型受体单元以及合成过程的所有中间体的1H NMR和13C NMR光谱通过Bruker Dex-400NMR仪器测定,新型受体单元D-A型宽带隙聚合物光伏材料的紫外-可见吸收光谱通过HP-8453紫外-可见光谱仪测定。
基于D-A型宽带隙聚合物光伏材料的有机太阳能电池器件包括:氧化锡铟(ITO)导电玻璃阳极层、聚苯乙烯磺酸盐(PEDOT/PSS)阳极修饰层、光活性层和阴极。光活性层由所述聚合物光伏材料和PC71BM共混构成,其共混比例为1:2。阴极由Ca(10nm)/Al(100nm)层构成。
实施例6
PV-BDTC1的光物理性能及其聚合物太阳能电池器件性能
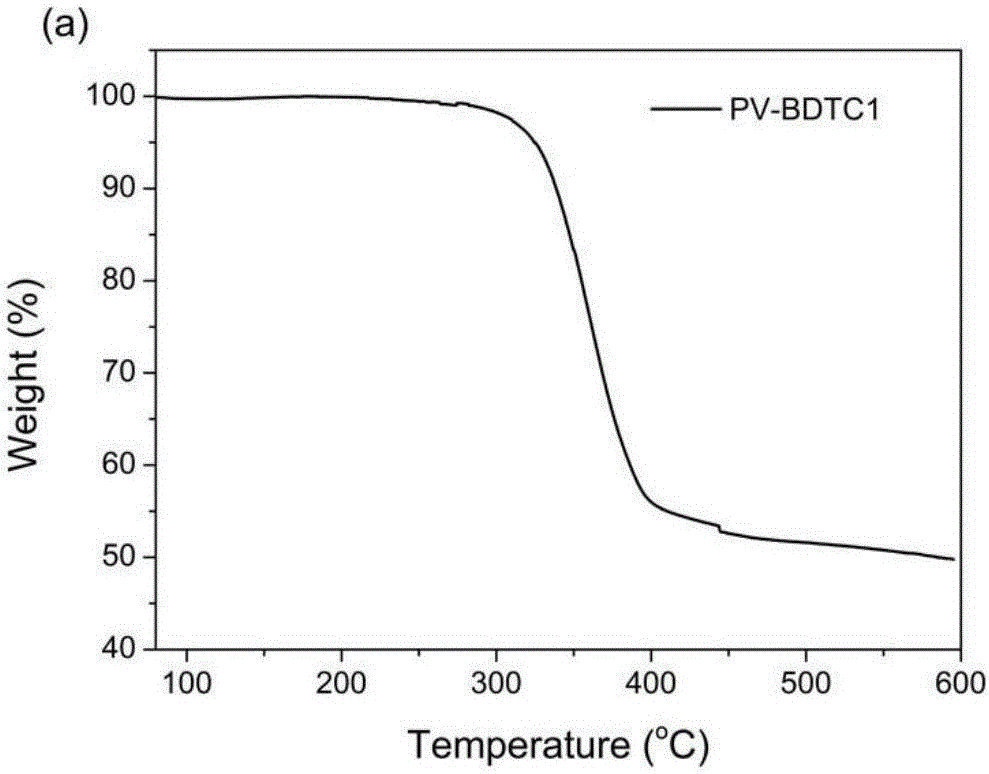
PV-BDTC1的热失重曲线如图1所示。其热失重5%时的热分解温度为326℃。
PV-BDTC1的示差扫描量曲线如图2所示。在50-300℃温度范围,升温和降温过程分别出现了熔融峰和结晶峰。
PV-BDTC1在氯仿溶液中的紫外吸收光谱如图3所示。该聚合物在250-550nm表现了强烈的吸收。483nm的吸收峰可归结于给体单元BDT到受体单元V-BDTC的电荷转移(ICT)跃迁吸收峰,此处的消光系数为35Lg-1cm-1。
PV-BDTC1在固体膜中的紫外吸收光谱如图4所示。与溶液的吸收光谱相比,光谱图大致相同,但吸收峰均有不同程度的红移,这是由于固体膜中分子堆积所致。由起峰位置计算出该材料的光学带隙为2.07eV。
PV-BDTC1在固体膜中的循环伏安曲线如图5所示。呈现了可逆的氧化峰,由此得出该材料的HOMO能级为-5.56eV。
在PV-BDTC1与PC71BM的掺杂比例为1:2(w/w,10mg/mL)的情况下,PV-BDTC1/PC71BM光伏器件的J-V曲线如图6所示。在该条件下,器件的短路电流为5.90mA/cm2,开路电压为0.93V,填充因子为59.39%,光伏效率为3.15%。
在PV-BDTC1与PC71BM的混合比例为1:2(w/w,10mg/mL)的情况下,光活性层的EQE曲线如图7所示。该图显示的EQE测试范围为300–600nm,在480nm处有最大EQE值,为51%。
实施例7
PV-BDTC2光物理性能及其聚合物光伏器件性能
PV-BDTC2的热失重曲线如图8所示。其热失重5%时的热分解温度为357℃。PV-BDTC2的示差扫描量曲线如图9所示。在50-300℃温度范围,升温和降温过程分别出现了熔融峰和结晶峰。
PV-BDTC2在氯仿溶液中的紫外吸收光谱如图10所示。该聚合物在250-550nm表现了强烈的吸收。其中350nm左右的吸收峰为分子的π-π*跃迁吸收峰,480nm左右的吸收峰为给体单元(BDT)到受体单元(V-BDTC)的电荷转移(ICT)跃迁吸收峰。
PV-BDTC2在固体膜中的紫外吸收光谱如图11所示。与溶液的吸收光谱相比,其峰形大致相同,但吸收峰均有不同程度的红移,这是由于固体膜中分子堆积所致。由起峰位置计算出该材料的带隙为2.09eV。
PV-BDTC2在固体膜中的循环伏安曲线如图12所示。呈现了可逆的氧化峰,由此得出该材料的HOMO能级为-5.67eV。
在PV-BDTC2与PC71BM的混合比例为1:2(w/w,10mg/mL)的情况下,PV-BDTC2/PC71BM光伏器件的J-V曲线如图13所示。在该条件下,器件的短路电流为10.37mA/cm2,开路电压为1.03V,填充因子为70.0%,光伏效率为7.49%。
在PV-BDTC2与PC71BM的混合比例为1:2(w/w,10mg/mL)情况下,光活性层的EQE曲线图如图14所示。该图显示的EQE测试范围为300–600nm,在500nm左右处有最大EQE值,为70%。
当PV-BDTC2与PC71BM的混合比例为1:2(w/w,16mg/mL)时,其单电子器件的J1/2-V曲线如图15所示,其最大的空穴迁移率为9.72×10-4cm2V-1s-1。
当PV-BDTC2与PC71BM的混合比例为1:2(w/w,16mg/mL)时,其单电子器件的J1/2-V曲线如图16所示,其最大的电子迁移率最大为2.32×10-3cm2V-1s-1。
当PV-BDTC2与PC71BM的混合比例为1:2(w/w,10mg/mL)时,其透射电镜(TEM)图如图17所示,聚合物和PCBM都表现出一定的聚集,相分离域比较大。
当PV-BDTC2与PC71BM的混合比例为1:2(w/w,10mg/mL)、且添加3%DIO时,其透射电镜TEM图如图18所示,聚合物和PCBM分散均匀,表现了很好的互穿网络结构。
实施例8
PV-BDTC3T光物理性能及其小分子光伏器件性能
PV-BDTC3T在二氯甲烷溶液中的紫外吸收光谱如图19所示。其中310nm左右的吸收峰为分子内的π-π*跃迁吸收峰,480nm左右的吸收峰为给体单元(3T)到受体单元(V-BDTC)的电荷转移(ICT)跃迁吸收峰。
PV-BDTC3T在固体膜中的紫外吸收光谱如图20所示。与溶液的吸收光谱相比,其光谱图形大致相同,但吸收峰有不同程度的红移,这是由于固体膜中分子堆积所致。由起峰位置计算出该材料的带隙为2.05eV。
PV-BDTC3T在固体膜中的循环伏安曲线如图21所示,呈现了可逆的氧化峰,由此得出该材料的HOMO能级为-5.60eV。
实施例9
PV-BDTC3TO光物理性能及其小分子光伏器件性能
PV-BDTC3TO在氯仿溶液中的紫外吸收光谱如图22所示。其中320nm左右的吸收峰为分子内的π-π*跃迁吸收峰,510nm左右的吸收峰为给体单元(3TO)到受体单元(V-BDTC)的电荷转移(ICT)跃迁吸收峰。
PV-BDTC3TO在固体膜中的紫外吸收光谱如图23所示。与溶液的吸收光谱相比,其吸收光谱图的峰形大致相同,但吸收峰均有不同程度的红移,这是由于固体膜中分子堆积所致。由起峰位置计算出该材料的带隙为1.80eV。
PV-BDTC3TO在固体膜中的循环伏安曲线如图24所示。呈现了可逆的氧化峰,由此得出该材料的HOMO能级为-5.23eV。
尽管结合了优选实施例对本发明进行了说明,但本发明并不局限于上述实施例,应当理解所附权利要求概括了本发明的范围。在本发明构思的指导下,本领域的技术人员应当意识到,对本发明的各实施例方案所进行的一定的改变,都将被本发明的权利要求书的精神和范围所覆盖。
- 还没有人留言评论。精彩留言会获得点赞!
- 6,7,8,9‑四氢‑5H‑苯并[7]轮烯‑2‑烷基胺类化合物及其用途的制造方法与工艺
- 用于PHOLED的具有氮杂‑二苯并噻吩或氮杂‑二苯并呋喃核的新材料的制造方法与工艺
- 多孔ZSM‑5沸石与γ‑Al2O3复合材料的合成及制备加氢脱硫催化剂的制造方法与工艺
- 一种含有氟噻虫砜和五氟虫腙的杀虫组合物的制造方法与工艺
- 苯并双(噻二唑)衍生物、包含其的油墨、以及使用了其的有机电子装置的制造方法
- 苯并噻二唑胺的制造方法与工艺
- 用于有机电致发光器件的材料的制造方法与工艺
- 用于有机电致发光器件的材料的制造方法与工艺
- 一种苯并噻咯类衍生物及其制备方法和有机发光器件与制造工艺
- 苯并噻吩并咔唑类衍生物及其制备方法和有机发光器件与制造工艺
- 一种噻吩并[3,2‑d]嘧啶类HIV‑1逆转录酶抑制剂及其制备方法和应用与流程
- 一类噻吩稠合苯并噁二唑衍生物及其合成方法与流程
- 一种可溶性苯并噻吩衍生物及其制备和应用的制作方法与工艺
- 含噻吩磺酰胺结构的苯并喹唑啉类酪氨酸激酶抑制剂、制备方法及用途与流程
- 一种含噻吩磺酰胺结构的乙氧苯并喹唑啉类酪氨酸激酶抑制剂、制备方法及用途与流程
- 一类含噻吩磺酰胺结构的苯并喹唑啉类酪氨酸激酶抑制剂及其用途的制作方法与工艺
- 一种含噻吩磺酰胺结构的乙氧苯并喹唑啉类酪氨酸激酶抑制剂及用途的制作方法与工艺
- 一种基于S,S‑二氧二苯并噻吩衍生物的给受体型交替共轭聚合物发光材料及其制备方法与应用与流程
- 一种三苯基硅基相连苯并噻吩衍生物及使用该衍生物的有机发光器件的制作方法与工艺
- 苯深度脱噻吩的镍基吸附剂及其制备方法和应用与流程