一种交联蛋白酶聚集体及在制备黑豆降压活性肽的应用的制作方法
本发明涉及一种交联蛋白酶聚集体及在制备黑豆降压活性肽的应用,属于酶固定化技术和食品营养领域。
背景技术:
黑豆是我国一种重要的大豆资源,其产量仅次于黄豆,位居第二。黑豆营养丰富,除了脂肪、维生素、微量元素和粗纤维等,尤其富含高质量的蛋白质,其蛋白质含量高达40%以上,位居豆类之首,等于牛肉、猪肉的两倍多、鸡蛋的3.38倍、牛奶的12倍。
黑豆活性肽是指黑豆蛋白经降解后产生的具有生物功能或生理作用的肽,其与蛋白相比具有很多优点,如:低粘度,高溶解性,高稳定性,高乳化性,此外保湿性和渗透性都较好,且由于具有特殊的分子量和氨基酸序列,多肽的吸收率和吸收速度比蛋白高,同时营养价值又比氨基酸高。此外活性肽具有很多有益健康的生理功能,包括抗氧化,抗病毒,抗肿瘤,免疫调节,降血压,降血糖等。黑豆活性肽较具有相关活性的化学合成药物具有安全,毒副作用小或者无毒副作用的优点,由于植源性的特点,黑豆活性肽不仅可以作为添加剂应用于功能食品,还可以应用于相关药物的研发中,因此黑豆活性肽日益成为研究热点。
酶解法是制备活性肽的一种重要方法,但是,关于酶解法制备活性肽现多采用游离单一或游离复合酶,单一载体固定单一酶,单一载体固定多种酶和复合载体固定单一酶或双酶等。游离酶水解蛋白后难以回收,使得后续产物分离困难,且在有机介质中容易失活,应用于实际工业生产中成本较高;载体固定酶为了不影响酶和底物的作用,载体为惰性载体,载体固定酶虽然解决了游离酶不能重复利用的问题,但是惰性载体的引入不仅增加了操作步骤,也会影响酶的空间催化效率。
交联酶聚集体技术,是一种新型的,无载体的,简单实用的酶固定化技术,相比于已有的酶固定化方法,其对所需进行沉淀及交联的酶的纯度要求不高,避免了结晶等复杂步骤,且酶的纯化、交联于一步完成,在避免引入惰性载体的同时,提高了酶的空间催化效率,简化了操作步骤,但是,目前还没有交联两种蛋白酶聚集体并将其应用于豆类活性肽的制备的报道。
中性蛋白酶,木瓜蛋白酶,菠萝蛋白酶,胰蛋白酶,风味蛋白酶,枯草杆菌蛋白酶等蛋白酶具有较高的酶活,广泛存在于有机体中,所以被普遍应用于食品,药品,畜牧,化妆,皮革及纺织工业中,但是它们作为游离酶使用的不可回收及低稳定性使其应用在一定程度上受到限制。
技术实现要素:
1
本发明的目的是克服现有技术的不足,提供一种交联蛋白酶聚集体。
本发明的第二个目的是提供交联蛋白酶聚集体在制备黑豆降压活性肽的应用。
本发明的技术方案概述如下:
一种交联蛋白酶聚集体,用下述方法制成:
(1)将蛋白酶以pH=6.5~7.5的磷酸缓冲液为溶剂配制3~6mg/mL的蛋白酶液,在室温,在搅拌下,将70~100体积份的无水乙醇加入到9~12份蛋白酶液中,放置15~40min,有沉淀生成,得悬浮液。
(2)向步骤(1)获得的悬浮液中加入0.6~1.8体积份的质量分数为25%~28%的戊二醛水溶液,混合均匀,室温交联反应2~8h,3000~5000r/min离心10~20min,沉淀用水洗涤3~5次,冷冻干燥,获得交联蛋白酶聚集体。
步骤(1)优选为:将蛋白酶以pH=7的磷酸缓冲液为溶剂配制5mg/mL的蛋白酶液,在室温,在搅拌下,将90体积份的无水乙醇加入到10份蛋白酶液中,放置30min,有沉淀生成,得悬浮液。
步骤(2)优选为:向步骤(1)获得的悬浮液中加入1体积份的质量分数为25%的戊二醛水溶液,混合均匀,室温交联反应4h,4000r/min离心15min,沉淀用水洗涤4次,冷冻干燥,获得交联蛋白酶聚集体。
蛋白酶优选:中性蛋白酶,木瓜蛋白酶,菠萝蛋白酶,胰蛋白酶,风味蛋白酶和枯草杆菌蛋白酶中的至少两种。
上述一种交联蛋白酶聚集体在制备黑豆降压活性肽的应用,包括如下步骤:
按质量比为1:10~30的比例,将黑豆粕加入水中,用NaOH水溶液调节pH至8~10,提取30~60min;3000~5000r/min离心10~15min,收集上清液,用HCI水溶液调节pH至4~6,3000~5000r/min离心10~15min,收集沉淀,将沉淀加入去离子水配成3~6g/100mL的蛋白悬浮液,向蛋白悬浮液中加入上述交联蛋白酶聚集体,蛋白悬浮液中沉淀与交联蛋白酶聚集体的质量比为100:4~7;用NaOH水溶液调节pH至7~9,在37~60℃,反应40~120min,85~100℃灭活5~10min,冷却至常温,3000~5000r/min离心10~15min,将上清液通过喷雾干燥或冷冻干燥,得黑豆降压活性肽。
优选的:一种交联蛋白酶聚集体在制备黑豆降压活性肽的应用,包括如下步骤:
按质量比为1:15的比例,将黑豆粕加入水中,用NaOH水溶液调节pH至9.5,提取40min;4000r/min离心10min,收集上清液,用HCI水溶液调节pH至4.5,4000r/min离心10min,收集沉淀,将沉淀加入去离子水配成5g/100mL的蛋白悬浮液,向蛋白悬浮液中加入上述交联蛋白酶聚集体,蛋白悬浮液中沉淀与交联蛋白酶聚集体的质量比为100:5;用NaOH水溶液调节pH至8,在50℃,反应60min,95℃灭活5min,冷却至常温,4000r/min离心10min,将上清液通过喷雾干燥或冷冻干燥,得黑豆降压活性肽。
本发明的优点:
(1)本发明在制备交联蛋白酶聚集体中采用了无水乙醇作为沉淀剂,与常规沉淀剂硫酸铵相比更加安全,无毒。同时交联两种蛋白酶不仅充分发挥两种酶复合的优势,提高酶解效率,同时固定化酶与底物极易分离,而且制备的交联蛋白酶聚集体热稳定性和pH稳定性都优于游离酶,且存储稳定性高。
(2)黑豆粕是生产黑豆油加工中的副产物,含有较高质量的蛋白及活性肽。本发明采用黑豆粕作为制备黑豆降压活性肽的原料,提高了黑豆资源的利用率。
(3)本发明的方法制备过程简便,无毒,安全,酶解效率高,用本发明的交联蛋白酶聚集体制备的黑豆降压活性肽水解度高,得率高,抗氧化活性和ACE抑制活性好。
附图说明
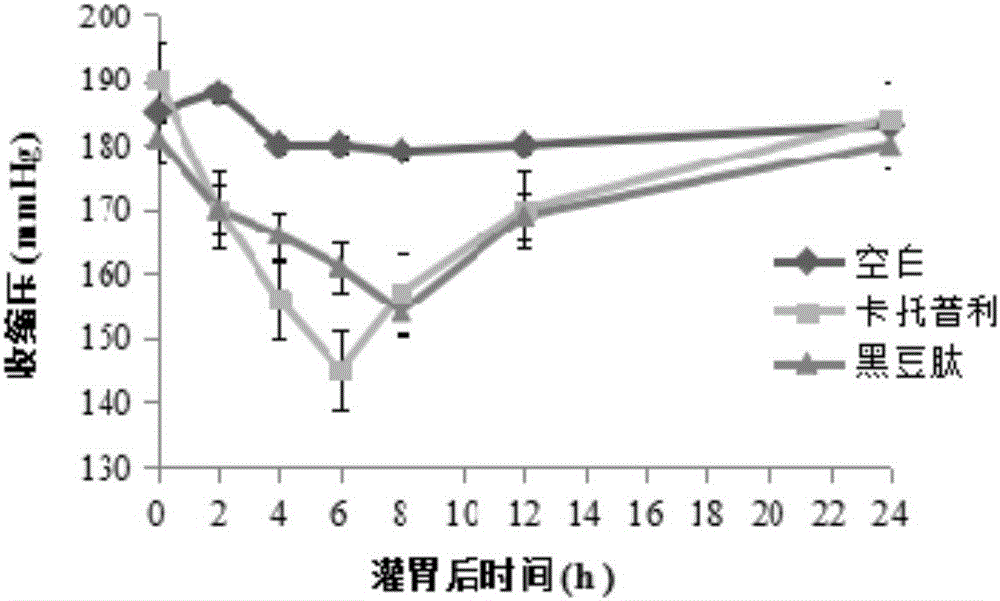
图1为黑豆降压活性肽对原发性高压大鼠收缩压的降低效果。
图2为黑豆降压活性肽对原发性高压大鼠舒张压的降低效果。
图3为交联蛋白酶聚集体与自由酶的扫描电镜图。A-1:交联蛋白酶聚集体放大400倍的电镜图;A-2:交联蛋白酶聚集体放大1300倍的电镜图。B-1:自由酶放大400倍的电镜图;B-2:自由酶放大1300倍的电镜图。
图4为交联蛋白酶聚集体与自由酶的相对酶活力随温度的变化。
图5为交联蛋白酶聚集体与自由酶的相对酶活力随pH的变化。
图6为交联蛋白酶聚集体对不同有机溶剂的耐受能力。
图7为交联蛋白酶聚集体的储存稳定性。
具体实施方式
下面结合具体实施例对本发明作进一步的说明。
本发明使用的所有原料均为商品:
黑豆粕购自山东枣庄;
无水乙醇:购于天津市江天化工技术有限公司;
戊二醛:购于天津市江天化工技术有限公司;
木瓜蛋白酶:购于天津诺奥科技发展有限公司;
中性蛋白酶:购于天津诺奥科技发展有限公司;
菠萝蛋白酶:购于天津诺奥科技发展有限公司;
胰蛋白酶:购于天津诺奥科技发展有限公司;
风味蛋白酶:购于天津诺奥科技发展有限公司;
枯草杆菌蛋白酶:购于天津诺奥科技发展有限公司;
马尿酸(HHL):购于美国Sigma公司;
血管紧张素转化酶(ACE):购于美国Sigma公司
上述原料的介绍是为了使本领域的技术人员能够更好地理解本发明,但并不对本发明作任何限制,凡与上述原料相似的原料都可以用于本发明。
实施例1
一种交联蛋白酶聚集体,用下述方法制成:
(1)将质量比为1:1的风味蛋白酶和枯草杆菌蛋白酶以pH=7的磷酸缓冲液为溶剂配制5mg/mL的蛋白酶液,在室温,在搅拌下,将90mL无水乙醇加入到10mL蛋白酶液中,放置30min,有沉淀生成,得悬浮液。
(2)向步骤(1)获得的悬浮液中加入1mL质量分数为25%的戊二醛水溶液,混合均匀,室温交联反应4h,4000r/min离心15min,沉淀用水洗涤4次,冷冻干燥,获得交联蛋白酶聚集体。
见图3,图3为交联蛋白酶聚集体与自由酶(未经沉淀和交联处理的质量比为1:1的风味蛋白酶和枯草杆菌蛋白酶混合物)的扫描电镜图。A-1:交联蛋白酶聚集体放大400倍的电镜图;A-2:交联蛋白酶聚集体放大1300倍的电镜图。B-1:自由酶放大400倍的电镜图;B-2:自由酶放大1300倍的电镜图。
从图中可以看出,交联蛋白酶聚集体具有紧密,均一的排列结构,其表面簇状和多孔结构有利于交联蛋白酶内部的活性中心伸展以及底物分子与活性部分的充分接触从而增大酶催化位点的表面积,提高催化效率。
实施例2
一种交联蛋白酶聚集体在制备黑豆降压活性肽的应用,包括如下步骤:
按质量比为1:15的比例,将黑豆粕加入水中,用0.l mol/L NaOH水溶液调节pH至9.5,提取40min;4000r/min离心10min,收集上清液,用0.l mol/L HCI水溶液调节pH至4.5,4000r/min离心10min,收集沉淀,将沉淀加入去离子水配成5g/100mL的蛋白悬浮液,向蛋白悬浮液中加入实施例1制备的交联蛋白酶聚集体,蛋白悬浮液中沉淀与交联蛋白酶聚集体的质量比为100:5;用0.l mol/L NaOH水溶液调节pH至8,在50℃,反应60min,95℃灭活5min,冷却至常温,4000r/min离心10min,上清液为黑豆降压活性肽溶液,根据消耗的氢氧化钠的量计算黑豆蛋白水解度为23.35%,将上清液通过喷雾干燥,得黑豆降压活性肽,得率为98.00%。
实施例3
一种交联蛋白酶聚集体,用下述方法制成:
(1)将质量比为1:1的胰蛋白酶和菠萝蛋白酶以pH=6.5的磷酸缓冲液为溶剂配制3mg/mL的蛋白酶液,在室温,在搅拌下,将70mL无水乙醇加入到9mL蛋白酶液中,放置15min,有沉淀生成,得悬浮液。
(2)向步骤(1)获得的悬浮液中加入0.6mL的质量分数为28%的戊二醛水溶液,混合均匀,室温交联反应2h,3000r/min离心20min,沉淀用水洗涤3次,冷冻干燥,获得交联蛋白酶聚集体。
实施例4
一种交联蛋白酶聚集体在制备黑豆降压活性肽的应用,包括如下步骤:
按质量比为1:10的比例,将黑豆粕加入水中,用0.l mol/L NaOH水溶液调节pH至8,提取30min;3000r/min离心15min,收集上清液,用0.l mol/L HCI水溶液调节pH至4.0,3000r/min离心15min,收集沉淀,将沉淀加入去离子水配成3g/100mL的蛋白悬浮液,向蛋白悬浮液中加入实施例3制备的交联蛋白酶聚集体,蛋白悬浮液中沉淀与交联蛋白酶聚集体的质量比为100:4;用0.l mol/L NaOH水溶液调节pH至7,在37℃,反应120min,85℃灭活10min,冷却至常温,3000r/min离心15min,上清液为黑豆降压活性肽溶液,根据消耗的氢氧化钠的量计算黑豆蛋白水解度为18.59%,将上清液通过喷雾干燥,得黑豆降压活性肽,得率为92.20%。
实施例5
一种交联蛋白酶聚集体,用下述方法制成:
(1)将质量比为1:1的中性蛋白酶和木瓜蛋白酶以pH=7.5的磷酸缓冲液为溶剂配制4mg/mL的蛋白酶液,在室温,在搅拌下,将80mL无水乙醇加入到10mL蛋白酶液中,放置25min,有沉淀生成,得悬浮液。
(2)向步骤(1)获得的悬浮液中加入1.4mL质量分数为26%的戊二醛水溶液,混合均匀,室温交联反应6h,5000r/min离心10min,沉淀用水洗涤5次,冷冻干燥,获得交联蛋白酶聚集体。
实施例6
一种交联蛋白酶聚集体在制备黑豆降压活性肽的应用,包括如下步骤:
按质量比为1:25的比例,将黑豆粕加入水中,用0.l mol/LNaOH水溶液调节pH至8.5,提取50min;3500r/min离心15min,收集上清液,用0.l mol/L HCI水溶液调节pH至5.0,3500r/min离心15min,收集沉淀,将沉淀加入去离子水配成4g/100mL的蛋白悬浮液,向蛋白悬浮液中加入实施例5制备的交联蛋白酶聚集体,蛋白悬浮液中沉淀与交联蛋白酶聚集体的质量比为100:6;用0.l mol/L NaOH水溶液调节pH至9,在45℃,反应90min,90℃灭活10min,冷却至常温,3500r/min离心15min,上清液为黑豆降压活性肽溶液,根据消耗的氢氧化钠的量计算黑豆蛋白水解度为20.59%,将上清液通过冷冻干燥,得黑豆降压活性肽,得率为94.25%。
实施例7
一种交联蛋白酶聚集体,用下述方法制成:
(1)将质量比为1:1的胰蛋白酶和木瓜蛋白酶以pH=7的磷酸缓冲液为溶剂配制6mg/mL的蛋白酶液,在室温,在搅拌下,将100mL无水乙醇加入到12mL蛋白酶液中,放置40min,有沉淀生成,得悬浮液。
(2)向步骤(1)获得的悬浮液中加入1.8mL质量分数为27%的戊二醛水溶液,混合均匀,室温交联反应8h,4500r/min离心10min,沉淀用水洗涤4次,冷冻干燥,获得交联蛋白酶聚集体。
实验证明用质量比为1:1:1的胰蛋白酶、木瓜蛋白酶和菠萝蛋白酶替代本实施例的质量比为1:1的胰蛋白酶和木瓜蛋白酶,其它同本实施例,制备出相应的交联蛋白酶聚集体。
实施例8
一种交联蛋白酶聚集体在制备黑豆降压活性肽的应用,包括如下步骤:
按质量比为1:30的比例,将黑豆粕加入水中,用0.l mol/L NaOH水溶液调节pH至10,提取60min;5000r/min离心10min,收集上清液,用0.l mol/L HCI水溶液调节pH至6.0,5000r/min离心10min,收集沉淀,将沉淀加入去离子水配成6g/100mL的蛋白悬浮液,向蛋白悬浮液中加入实施例7制备的交联蛋白酶聚集体,蛋白悬浮液中沉淀与交联蛋白酶聚集体的质量比为100:7;用0.l mol/L NaOH水溶液调节pH至8.5,在60℃,反应40min,100℃灭活5min,冷却至常温,5000r/min离心10min,上清液为黑豆降压活性肽溶液,根据消耗的氢氧化钠的量计算黑豆蛋白水解度为19.06%,将上清液通过冷冻干燥,得黑豆降压活性肽,得率为91.03%。
实施例9
本发明黑豆降压活性肽的体外抗氧化和降血压活性测定。
实验方法:
DPPH·自由基清除活性的测定:在100μL 5mg/mL黑豆降压活性肽水溶液(空白用100μL蒸馏水代替,其他试剂依次同下)中,加入2.9mL的20μM DPPH·乙醇溶液,充分混匀,在37℃水浴条件下反应30min,反应液于517nm测定吸光度值。DPPH·自由基清除率的计算公式如下:
I%=[(A空-A样)/A空]×100
A空为空白对照的吸光度,A样为样品的吸光度。
ACE(血管紧张素转化酶)抑制活性的测定:分别将80μL马尿酸(HHL)、30μL黑豆降压活性肽水溶液(5mg/mL)、30μL硼酸盐缓冲液(pH 8.3)混合,于37℃水浴5min后,加入10μL ACE,37℃水浴30min,最后加入150μL的1M HCl混匀终止反应。以硼酸缓冲液(pH 8.3)代替ACE抑制剂作为对照,其余操作相同。将反应液进行0.45μm滤膜过滤待高效液相分析。高效液相色谱系统:色谱柱:YMC ODS Cl8(4.0mm x 250mm,5μm);检测波长:228nm;柱温:30℃;流动相:MeOH:H2O=15:85(v/v);流速:0.4mL/min;进样量:20uL。ACE抑制率(IP)计算公式如下:
IP(%)=(A-A’)/A*100%
其中:IP为样品对ACE的抑制率(%);A为对照组中马尿酸的峰面积;A’为加入活性肽后马尿酸的峰面积。见表1.
表1.本发明所得黑豆降压活性肽的DPPH·自由基清除率和ACE抑制率
可以看出,用交联蛋白酶聚集体酶解黑豆蛋白,得到的黑豆降压活性肽,水解度高,所得黑豆降压活性肽不仅得率均高达90%以上,且有良好的体外DPPH·自由基清除活性和ACE抑制活性。
实施例10
本发明黑豆降压活性肽的体内ACE抑制活性的测定。
实验对象:实验对象为原发性高血压大鼠,其被单独饲养在钢笼中,室温保持在24℃并进行12小时明暗周期,用自来水和标准实验室饲料进行喂食。
实验方法:
本实验中共使用原发性高血压大鼠18只,每六只为一组,分别为空白对照组、阳性对照组(卡托普利)以及样品组(实施例8制备的黑豆降压活性肽)。
将黑豆降压活性肽溶于生理盐水配制样品溶液,并使用柔性探空仪以50mg/kg的剂量灌胃给药(每只鼠给药1毫升)。
空白对照组给予相同体积的生理盐水。
阳性对照组给予相同体积的卡托普利(10mg/kg)。
分别在0,2,4,6,8,12和24小时的时间点对大鼠的收缩压(SBP)和舒张压(DBP)进行测定,采用尾套法通过BP2010血压计进行血压测定。将黑豆降压活性肽对大鼠收缩压和舒张压的降低功效与卡托普利进行比较。
实验结果见图1和图2。
实验结果证明以实施例8获得的黑豆降压活性肽对原发性高血压大鼠具有明显的体内降血压作用。
以实施例1获得的交联蛋白酶聚集体进行稳定性研究,由图4和图5可以看出交联蛋白酶聚集体的热稳定性和pH稳定性明显优于自由酶(未经沉淀和交联处理的质量比为1:1的风味蛋白酶和枯草杆菌蛋白酶混合物);由图6可以看出,实施例1获得的交联蛋白酶聚集体在有机溶剂丙酮,乙酸乙酯,正己烷中仍然能保持较高的酶活。
由图7可以看出,实施例1获得的交联蛋白酶聚集体在4℃下保存6个月基本无酶活损失。
实验证明,实施例3、5、7制备的交联蛋白酶聚集体的热稳定性、pH稳定性与实施例1制备的交联蛋白酶聚集体相似。另外实施例3、5、7制备的交联蛋白酶聚集体有机溶剂耐受性好,存储稳定性好,用其制备的黑豆降压活性肽得率高,DPPH·自由基清除活性和ACE抑制活性好。
- 还没有人留言评论。精彩留言会获得点赞!