一个影响猪生长和PRRSV抗性的分子标记、检测方法及其应用与流程
本发明属于分子生物学领域,涉及一个影响猪生长和PRRSV抗性的分子标记、检测方法及其应用。
背景技术:
由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)引起的猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)是一种高度传染的病毒性疾病,主要以母猪繁殖障碍和仔猪的呼吸道疾病为特征,造成怀孕母猪的流产、死胎以及仔猪生长缓慢、高死亡率等。该病于20世纪80年代末在美国发现,随后在荷兰、西班牙、英国等养猪业发达国家相继爆发,造成了巨大的经济损失。1991年荷兰科学家Wensvoort博士第一次从感染的猪体内分离出这种病毒,并将其命名为Lelystad病毒(LV)。1992年美国科学家Collins等在CL2621细胞中分离到能够导致相似临床症状的病毒,并将其命名为VR-2332毒株。1992年,世界动物卫生组织正式将该病毒统一命名PRRSV。我国初次发生该病是在1995年,郭宝清等人在1996年首次分离到该病毒,命名为CH-1a株。2006年在我国爆发的猪高热病其主要病原即为高致病性PRRSV。目前,PRRS严重威胁着全球养猪业,并给养猪业带来了巨大的经济损失。由于PRRSV具有高度变异性、抗体依赖性病毒复制增强等特征,现有的疫苗并不能很好地控制该疾病的流行,通过遗传抗性的选择,培育PRRSV抗性猪新品种(系)成为重要的方向。抗病性状属于阈性状,生长性状属于数量性状,二者都是重要的经济性状,同时也是表型选择准确性差、遗传进展慢的性状,开发相应的分子标记,进行标记辅助选择,可以实现超早期选种,提高选择的准确性,加快育种进程。
猪白细胞抗原DRB1(Swine leukocyte antigen DRB1,SLA-DRB1),又名主要组织相容性抗原DRB1(MHC-DRB1)。SLA定位于7p12-q12,按其抗原结构和功能主要分为3大类,即I类、Ⅱ类和III类基因,其中Ⅱ类基因位于SLA-D区,主要包括DRA、DRB、DQA、DQB、DOB、DPA、TAP、LMP等,控制着机体的免疫应答与调控。其中,存在于DR亚区的DRB基因第2外显子编码区是SLA抗原分子最重要的功能区,即抗原结合区。SLA-DRB1与抗原递呈中Ia分子相关的不变链(Ia-associated invariant chain,Ii链)、伴侣分子SLA-DM及TCR一起完成抗原的递呈与识别。
研究显示,DRB基因第2外显子区具有高度多态性。如鞠慧萍等以藏猪为研究材料对SLA-DRB基因第2外显子多态性进行了研究,发现藏猪SLA-DRB基因外显子2存在着高度的多态性,在RsaⅠ-RFLP位点上存在7种基因型,以杂合子BC型居多,等位基因B的频率最高,这一结果与谈永松等研究五指山、二花脸和皮特兰猪的SLA-DRB基因外显子2多态性时仅检测到4种带型(AA,BB,AB和BD),且A为优势等位基因有一定的差异。徐如海(2004)采用直接测序法研究表明,SLA-DRB外显子2中的多态位点高达62个,SLA-DRB外显子2中位点29与仔猪大肠杆菌K88ad粘附表型存在显著的关联(p<0.01),位点29,149,170对0-28日龄仔猪血清IgG含量有显著影响(p<0.05);同时在SLA-DRB近端调控区发现了24个多态位点,但这些多态位点与仔猪大肠杆菌K88ab,K88ac,K88ad粘附表型没有显著的关联(p>0.05)。另外,有报道SLA-DRB1编码区多态性与免疫伪狂犬病毒疫苗产生的抗体滴度有关。但SLA-DRB1多态性与PRRSV抗性的关联尚未见报道。
技术实现要素:
本发明的目的在于克服猪育种中生长和PRRSV抗性表型选择准确性低,成本高,遗传进展慢的缺点,提供一个影响猪体重和PRRSV抗性的分子标记。
本发明的另一目的是提供一种猪生长性状和PRRSV抗性性状的SLA-DRB1基因启动子区分子标记选择方法,用于猪分子育种,可以提高猪生长性状和PRRSV抗性性状选择的准确性,降低育种成本,加快猪PRRSV抗性新品种(系)培育进程。
本发明的目的可通过如下技术方案实现:
一个影响猪体重和PRRSV抗性的分子标记,所述分子标记位于猪SLA-DRB1基因启动子区-58位点,且具有C/T多态性,CC型体重显著高于CT型和TT型,仔猪感染PRRSV后CC型猪血液中病毒载量低于CT型和TT型。
本发明所述的分子标记在猪分子育种中的应用。
一种用于检测本发明所述的分子标记的引物对,上游引物P1如序列表中SEQ ID NO:1所示,下游引物P2如序列表中SEQ ID NO:2所示。
本发明所述的引物对在猪分子育种中的应用。
一种检测本发明所述的分子标记的方法,包含PCR扩增猪基因组中含有本发明所述的分子标记的一段序列,对扩增产物进行测序,判读猪SLA-DRB1基因启动子区-58位点的C/T多态性。
一种检测权利要求1所述的分子标记的方法,包括利用本发明所述的引物对PCR扩增猪基因组中含有本发明所述的分子标记的一段序列,利用KpnⅠ限制性内切酶对所述的扩增产物进行酶切、电泳分型,获得216bp、31bp两个片段的定义为CC型,获得247bp、216bp、31bp三个片段的定义为CT型,获得247bp片段的定义为TT型。
一种筛选高生长性状和具有PRRSV抗性的猪品系的方法,包括检测猪SLA-DRB1基因启动子区-58位点的多态性,选择CC型个体留种。
本发明所述的方法,优选包括以下步骤:
1)提取猪基因组DNA;
2)利用本发明所述的引物对PCR扩增SLA-DRB1基因启动子区序列(序列NC_010449.4,20052~20298bp区域),得到247bp扩增产物;
3)利用KpnⅠ限制性内切酶对所述的扩增产物进行酶切、电泳分型,获得216bp、31bp两个片段的定义为CC型,获得247bp、216bp、31bp三个片段的定义为CT型,获得247bp片段的定义为TT型;
4)CC型体重显著高于CT型和TT型,仔猪感染PRRSV后CC型猪对PRRSV的抗性高于CT型和TT型,选择CC型个体留种。
其中,所述PCR扩增的反应总体系优选为20μL,模板DNA 15-100ng,5U/μL Taq聚合酶0.2μL,10mM的dNTP0.5μL,引物P1和P2各5pmol,25mM的MgCl2 1.2-1.6μL,10×缓冲液2μL,加灭菌双蒸水至20μL;所述PCR扩增的反应程序为:94℃预变性5min;94℃变性30s,60-65℃退火30s,72℃延伸30s,35个循环;72℃延伸7min。
所述酶切的反应体系优选为10-16μL,PCR产物3-5μL,10U/μL KpnⅠ酶0.2-0.5μL,10×缓冲液1.0-1.6μL,补充灭菌双蒸水至10-16μL;37℃酶切3-5h。
有益效果
猪的生长性状是一个重要的经济性状,属于数量性状,传统的表型选择准确性低,周期长,无法进行超早期选择,遗传进展缓慢。而常规的PRRSV抗性选择需要进行PRRSV攻毒实验,需要建立专门的试验场所,攻毒实验严重影响猪生长,部分攻毒猪死亡,代价很高,周期长,选择准确性低,遗传进展缓慢。本发明采用PCR-RFLP方法检测SLA-DRB1基因启动子区-58C/T KpnⅠ酶切位点的多态性,并将基因型与猪体重、猪对PRRSV的抗性进行关联分析,发现SLA-DRB1基因启动子区-58C/T位点的多态性与猪体重、猪对PRRSV的抗性相关,CC型猪群25、29、32、36、39、46、53、60、67日龄体重均极显著高于CT型和TT型,CC型猪群接种PRRSV后不同时间点血液中PRRSV相对量均低于CT型和TT型,并且在接种PRRSV后第4、7天CC型显著低于TT型,接种后第11天CC型显著低于CT型(p<0.05,表2),表明CC型猪对PRRSV具有更高的抗性。该多态位点可用于猪生长和PRRSV抗性的辅助选择,提高选择的准确性,同时可以在猪出生时就通过检测基因型进行选择,无需攻毒测试,加快育种进程,降低育种成本,对PRRSV抗性新品种(系)培育具有重要的价值。
附图说明
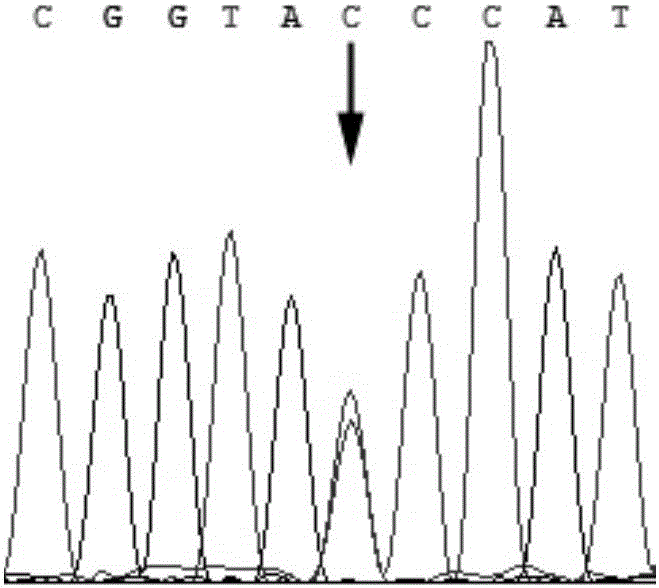
图1猪SLA-DRB1基因启动子区-58C/T突变位点测序图
图2猪SLA-DRB1基因启动子区-58C/T突变位点电泳分型图
如图所示:泳道M为DL500marker,CC、CT、TT分别表示猪SLA-DRB1基因启动子区PCR扩增产物经KpnⅠ酶切后分为CC、CT、TT基因型。
具体实施方式
下述实施例中提到的实验方法,如无特别说明均为常规方法,内切酶和荧光定量PCR试剂购自大连宝生物有限公司,高纯总RNA快速提取试剂盒购自北京百泰克生物技术有限公司,其余试剂购自南京生兴生物技术有限公司。
实施例1、猪生长和PRRSV抗性的SLA-DRB1基因启动子区-58C/T SNPs分子标记选择方法
材料与方法:
(一)猪群
88头健康的大白姜曲海杂交猪(不接种任何疫苗)来自江苏省农业科学院,经PCR检测血液中无PRRSV,经ELISA检测血液中无PRRSV抗体。
(二)方法
1、猪对PRRSV抗性的测试方法
25日龄仔猪测体温、称重、采血,每头猪耳根肌肉注射高致病性PRRSV NJGC株(TCID50为10-6.88/0.1mL)2mL,分别在29(接毒后4天)、32(接毒后7天)、36(接毒后11天)、39(接毒后14天)、46(接毒后21天)、53(接毒后28天)、60(接毒后35天)、67日龄(接毒后42天)测量体温、体重、采集血液(肝素钠抗凝)2mL,提取总RNA,以管家基因β‐actin为内参,实时荧光定量PCR测定PRRSV-N基因的绝对量或者相对量,本案例中以ln2-△△CT表示病毒载量。
2、DNA的提取
采用常规酚、氯仿法提取DNA,采用电泳及测定OD260/280检测DNA质量。
3、总RNA提取
本案例中以全血提取总RNA,采用北京百泰克生物技术有限公司高纯总RNA快速提取试剂盒。提取方法参照试剂盒使用手册,略作修改。200μL抗凝血加入600μL裂解液RL混匀,其余操作同试剂盒说明书。采用电泳及测定OD260/280检测RNA质量。
4、实时荧光定量PCR(Real-time PCR)
总RNA参照RT Master Mix(TAKARA公司)试剂盒说明书逆转录合成cDNA。根据GenBank中PRRSV NJGC株序列(EF534357)利用引物设计软件Primer5.0设计一对特异性引物(序列为P3:TCGCCCAACAAAACCAGT(SEQ ID NO.3),P4:TTACCCTCCCTGAATCTGACA(SEQ ID NO.4)),根据GenBank中β-actin序列(AY550069)设计一对特异性引物(序列为P5:CCAAAGCCAACCGTGAGAA(SEQ ID NO.5),P6:CCAGAGGCGTACAGGGACA(SEQ ID NO.6)),使用SYBR Premix Ex Taq II试剂盒(TAKARA公司),以管家基因β-actin为内参,进行实时荧光定量PCR,对PRRSV N基因的mRNA水平表达量进行检测。
在避光环境、冰上进行操作,20μL Real-time PCR反应体系为:10μL 2×SYBR Premix Ex Taq、0.8μL上游引物(10μM)、0.8μL下游引物(10μM)、0.4μLROX Reference Dye II(50×)、2μL cDNA模板、6μL ddH2O。每组设3个重复,反应程序为95℃预变性30s;95℃变性5s,60℃退火34s,40个循环;每个循环结束后收集荧光信号。每个样本三次重复取平均值,使用ln2-△△CT法计算PRRSV N基因的相对量作为病毒载量。
5、SLA-DRB1基因启动子区-58C/T位点序列的扩增
根据genebank序列NC_010449.4,利用Primer Primer 5设计一对特异性引物(序列为P1:TTCGGTATGTGGGTGGAGGAGGGCCACGGTA(SEQ ID NO.1),P2:TGGCAACTCCCCTCCTTCCCCACCC(SEQ ID NO.2)),PCR扩增SLA-DRB1基因启动子区序列(序列NC_010449.4,20052~20298bp区域)。
PCR反应总体系20μL,模板DNA 15-100ng,5U/μL Taq聚合酶0.2μL,10mM的dNTP0.5μL,引物P1和P2各5pmol,25mM的MgCl2 1.4μL,10×缓冲液2μL,加灭菌双蒸水至20μL;所述PCR扩增的反应程序为:94℃预变性5min;94℃变性30s,60-65℃退火30s,72℃延伸30s,35个循环;72℃延伸7min。
6、PCR扩增产物的KpnⅠ酶切分型。酶切的反应体系为10-16μL,PCR产物3-5μL,10U/μL KpnⅠ酶0.2-0.5μL,10×缓冲液1.0-1.6μL,补充灭菌双蒸水至10-16μL;37℃酶切3-5h。3%琼脂糖凝胶电泳检测酶切产物,EB染色,凝胶成像系统拍照。
7、SLA-DRB1基因启动子区-58C/T位点不同基因型猪群间体重、PRRSV抗性的差异显著性分析,采用SPSS 10中的One-way ANOVA方法进行。
(三)结果与分析
1、SLA-DRB1基因启动子区-58C/T位点KpnⅠ酶切多态性
88个样本的PCR扩增产物经KpnⅠ酶切出现3种基因型,获得216bp、31bp(图1,31bp片段由于分子量太小,电泳图未显示)两个片段的定义为CC型;获得247bp、216bp、31bp(同上)三个片段的定义为CT型,获得247bp片段的定义为TT型。
2、SLA-DRB1基因启动子区-58C/T位点不同基因型猪群间体重差异显著性分析
采用单因素方差分析比较不同基因型猪群间体重的差异发现,CC型猪群25、29、32、36、39、46、53、60、67日龄体重均极显著高于CT型和TT型(p<0.01,表1)。
表1 SLA-DRB1基因启动子区-58bp位点不同基因型杂交猪群体重变化
注:同行不同大写字母上标表示差异极显著(p<0.01)。
3、SLA-DRB1基因启动子区-58C/T位点不同基因型猪群间PRRSV抗性的差异显著性分析
采用单因素方差分析比较不同基因型猪群接毒后血液中PRRSV相对量的差异发现,CC型猪群接种PRRSV后不同时间点血液中PRRSV相对量均低于CT型和TT型,并且在接种PRRSV后第4、7天CC型显著低于TT型,接种后第11天CC型显著低于CT型(p<0.05,表2),表明CC型猪对PRRSV具有更高的抗性。
表2 SLA-DRB1基因启动子区-58bp位点不同基因型杂交猪群接毒后血液中PRRSV相对量
注:同行不同小写字母上标表示差异显著(p<0.05)。
综合分析以上结果可以看出,CC型猪在体重和对PRRSV的抗性方面均具有优势,可以作为猪生长和PRRSV抗性性状选择的分子标记,在留种时选择CC型个体。
- 还没有人留言评论。精彩留言会获得点赞!
- 诱导果实抗性控制病害的方法和所用制剂与流程
- 水稻白叶枯抗性基因Xa27的分子标记引物及其应用的制作方法与工艺
- 赋予对鞘翅目有害生物的抗性的核酸分子的制造方法与工艺
- 避免抗微生物剂抗性的抗腹泻制剂的制造方法与工艺
- 一种选育小麦条锈病持久抗性材料的方法与流程
- 一种产生PVY抗性的NteIF4E‑1基因突变体及其应用的制造方法与工艺
- 赋予鞘翅目和半翅目害虫抗性的COPI外被体GAMMA亚单位核酸分子的制造方法与工艺
- 赋予鞘翅目和半翅目害虫抗性的COPI外被体BETA亚单位核酸分子的制造方法与工艺
- 赋予鞘翅目和半翅目害虫抗性的COPI外被体ALPHA亚单位核酸分子的制造方法与工艺
- 赋予鞘翅目和半翅目害虫抗性的COPI外被体DELTA亚单位核酸分子的制造方法与工艺
- 一种选育小麦条锈病持久抗性材料的方法与流程
- 赋予鞘翅目和半翅目害虫抗性的COPI外被体GAMMA亚单位核酸分子的制造方法与工艺
- 赋予鞘翅目和半翅目害虫抗性的COPI外被体BETA亚单位核酸分子的制造方法与工艺
- 赋予鞘翅目和半翅目害虫抗性的COPI外被体ALPHA亚单位核酸分子的制造方法与工艺
- 赋予鞘翅目和半翅目害虫抗性的COPI外被体DELTA亚单位核酸分子的制造方法与工艺
- 一个影响猪生长和PRRSV抗性的SLA‑DRB1启动子区分子标记及其引物和应用的制造方法与工艺
- 一个影响猪生长和PRRSV抗性的分子标记、检测方法及其应用与制造工艺
- 赋予鞘翅目害虫抗性的DRE4核酸分子的制造方法与工艺
- 一种提高茶树抗性且肥效高的茶树肥料及其制备方法与制造工艺
- 抗穿透的复合件的制作方法