一种内皮细胞培养液的制作方法
本发明属于生物技术领域,尤其涉及一种内皮细胞培养液。
背景技术:
内皮细胞是一薄层上皮细胞,具有选择性屏障、止血、抗凝和运输等作用,并且能够参与机体的炎症反应。研究表明,内皮细胞与动脉粥样硬化的发生和发展有密切关系,其分泌的各种活性因子参与机体反应,维持生命体稳定状态。
近年来,对内皮细胞的研究日益增多,研究成果也在逐步走向临床应用,其中内皮细胞的体外扩增培养是研究及应用过程的重要环节。但是在通常条件下,内皮细胞在体外增殖能力较差,培养中不易融合,易发生老化和凋亡。并且原代内皮细胞分离过程中常常混有杂细胞,影响了内皮细胞纯度。这些问题限制了内皮细胞的进一步发展,所以寻找适合内皮细胞的培养体系,成为深入研究和应用内皮细胞的必要前提。
目前,内皮细胞的体外培养扩增体系主要是在基础培养基中添加一定浓度的胎牛血清或者非人源细胞裂解液,如专利200910016346.X中加入了牛角膜内皮细胞裂解液及10%的胎牛血清。这些物质中可能携带未知病原体,含有致病性的朊病毒蛋白质以及针对胎牛抗原的异种蛋白,输入人体后或引起过敏反应等;另外,为了使内皮细胞更快更好的生长,专利201310025943.5的体外培养扩增体系中加入大量促进内皮细胞生长的生长因子,不仅增加了培养液的成本,而且多种生长因子的引入不利于培养液批次之间的稳定性控制。
综上所述,亟需研究一种稳定新好,成本低的内皮细胞培养液。
技术实现要素:
针对现有技术的不足,本发明提供一种内皮细胞培养液。该内皮细胞培养液成分来源广泛,培养的内皮细胞纯度高,增殖快,迁移能力强,在体外能够促进管腔结构的形成,并且培养的内皮细胞可直接应用于临床研究。
为了实现上述目的,本发明提供的内皮细胞培养液,具体成分为:基础培养基DMEM、人血小板裂解液、L-谷氨酰胺、维生素C、层黏连蛋白10、层黏连蛋白11、纤粘连蛋白、青霉素和链霉素;所述的内皮细胞培养液pH值为6.8-7.0,渗透压为310 mOsm/kg。
所述的内皮细胞培养液中各成分含量优选为:人血小板裂解液100ml、L-谷氨酰胺292mg、50mg维生素C、30mg层黏连蛋白10、30mg层黏连蛋白11和40mg纤粘连蛋白、60mg青霉素、100mg链霉素、用基础培养基DMEM补至1L体积。
为了实现上述目的,本发明还提供一种内皮细胞培养液的制备方法。
步骤一:制备人血小板裂解液:取样、离心:取机采人血小板,置入离心瓶中离心处理;清洗:去上清,加入生理盐水洗血小板,离心后,用生理盐水悬起血小板;冷冻:置于-20℃冰箱中,冷冻过夜,然后置于室温下直至完全融化;重复上述冷冻操作三次,得血小板裂解液。
步骤二:按配比分别取步骤一制备的人血小板裂解液、青霉素、链霉素、L-谷氨酰胺、维生素C、层黏连蛋白10、层黏连蛋白11和纤粘连蛋白,混合均匀,然后用基础培养基DMEM补至1L体积,即得。
所述的步骤二中人血小板裂解液在使用前8000g离心处理10min,取上清。
所述人血小板裂解液可以在-20℃保存一个月时间。
所述步骤一制备的人血小板裂解液最终密度为1.5×1010/ml。
本发明的有益效果。
本发明提供一种内皮细胞培养液,利用人血小板裂解液代替传统培养中的胎牛血清,保证内皮细胞生长所需的同时,人血小板裂解液中的VEGF(血管内皮细胞生长因子),bFGF(碱性成纤维细胞生长因子),PDGF-AB(人血小板衍生生长因子AB),IGF-1(胰岛素样生长因子1),TGF-β1(转化生长因子β1)等因子会对内皮细胞的生长起到促进作用;人血小板裂解液含多种生长因子,不仅能够促进内皮细胞生长,而且不会引入异种蛋白,确保临床应用的可行性;层黏连蛋白10、11和纤粘连蛋白是内皮细胞外基质蛋白的主要成分,在培养体系中能够参与内皮细胞结构蛋白的形成和新生组织的调控,从而促进内皮细胞粘附和增殖,提供内皮细胞良好的生长微环境,促进内皮细胞的粘附和增殖;维生素C可刺激内皮细胞生长,同时能够抑制平滑肌细胞等杂细胞,可以提高内皮细胞的细胞纯度; L-谷氨酰胺有利于内皮细胞蛋白质和核酸的合成,保证内皮细胞的良好生长状态和速度。本发明培养的内皮细胞,其贴壁、增殖速度快,细胞纯度高,迁移能力强,管腔形成率高,同时能够抑制内皮细胞的侵袭作用,是理想的内皮细胞培养体系。
附图说明
图1为内皮细胞贴壁生长状态图。
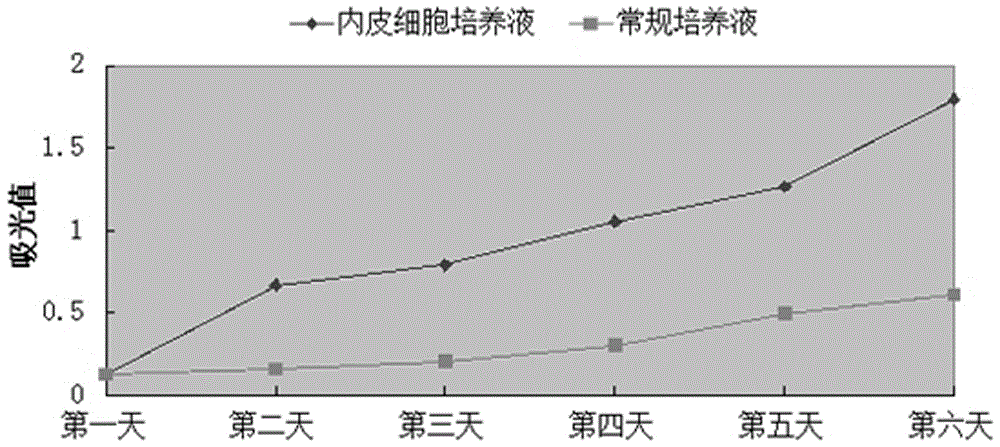
图2为内皮细胞增殖情况对比图。
图3为不同时间细胞粘附状态图;其中A为1小时,B为2小时,C为3小时。
图4为内皮细胞贴壁情况对比图。
图5为内皮细胞迁移状态对比图;其中A为常规培养液和内皮细胞培养液培养的内皮细胞在枪头划痕处的生长状态对比图,B为内皮细胞在常规培养液和内皮细胞培养液的迁移生长状态对比图。
图6为内皮细胞侵袭状态对比图;其中A为内皮细胞培养液6小时的状态图,B为内皮细胞培养液24小时的状态图,C为常规培养液6小时的状态图,D为常规培养液24小时的状态图。
图7为内皮细胞管腔形成状态图;其中A为内皮细胞培养液6小时的状态图,B为内皮细胞培养液24小时的状态图,C为内皮细胞培养液48小时的状态图,D为常规培养液6小时的状态图,E为常规培养液24小时的状态图,F为常规培养液48小时的状态图。
图8为内皮细胞管腔形成数目比较图。
具体实施方式
下面结合实施例对本发明作进一步的说明。
实施例1。
一、内皮细胞培养液的制备方法,具体步骤如下。
步骤一、制备人血小板裂解液:取2×1011 L-1的机采人血小板,加入250ml 离心瓶中,6000g 离心20min;去上清,加入生理盐水洗血小板,离心后用15ml生理盐水悬起;置于-20℃冰箱中冷冻过夜12h,后置于室温下融化;如此进行三个循环,得血小板裂解液。
步骤二、分别离心处理的100ml人血小板裂解液、60mg青霉素、100mg链霉素、292mg L-谷氨酰胺、50mg维生素C、30mg层黏连蛋白10、30mg层黏连蛋白11和40mg纤粘连蛋白混合,然后用基础培养基DMEM补至1L体积; pH值为6.8-7.0,渗透压为310 mOsm/kg,得内皮细胞培养液。
二、采用上述培养液对内皮细胞进行培养。
培养方法具体如下。
1、样本处理:无菌获取新生儿脐带,置于无菌的生理盐水中,洗去脐带外表面和静脉口的血迹,剪去有钳夹痕及血肿的部分;向脐静脉一端插入钝形针头,用一次性注射器吸取无菌PBS冲洗静脉腔,至流出液澄清,无血迹。
2、细胞消化处理:用止血钳夹住另一端,向静脉腔中灌注消化酶20ml(1 g /L胶原酶和2. 5 g /L胰蛋白酶的体积比1∶1),至脐静脉充盈,将脐带放在37℃摇床中处理8min;用注射器将消化酶抽出,将消化酶置于离心管,用无菌PBS 冲洗脐静脉腔2次;将冲洗液一同收集入消化酶离心管中,1000 r/min离心处理5 min,去上清。
3、细胞重悬:加入10 mL DMEM,用吸管吹打培养液,重悬细胞,再离心(1000r/m,5min)一次,弃上清液,得到原代人脐静脉内皮细胞。
4、细胞培养:用内皮细胞培养液15ml对提取的原代人脐静脉内皮细胞进行重悬培养,24 h 后弃培养液,用PBS 液洗内皮细胞一遍,加入新鲜内皮细胞培养液15ml,继续培养;待原代人脐静脉内皮细胞融合达到80%,0.25%胰酶消化脐静脉内皮细胞1min、加入15ml内皮细胞培养液中止消化,收集消化后的细胞于离心管中,1000r/m离心处理5min,按上一代细胞瓶数与下一代细胞瓶数比例为1:3,传代培养脐静脉内皮细胞。
5、细胞收集:传代后继续培养,每隔3天更换新鲜的培养液,待细胞融合率达到80%时,使用0.025%胰蛋白酶消化5min后,1000r/m离心处理5min,收集细胞。
三、内皮细胞的鉴定。
1、形态学鉴定。
待第三代内皮细胞融合达80%时,倒置显微镜下观察,见图1,所得细胞铺满培养瓶底部,边界清楚,胞浆丰富,呈现铺路石样外观,符合人脐静脉内皮细胞的形态学特征。
2、免疫组化鉴定。
鉴定采用DAB 免疫组织化学法。
在6孔培养板中放置载玻片,载玻片上植入2 ml含有1×106个/ml的内皮细胞悬液;待细胞贴壁后,取出载玻片,放入- 20 ℃的冷丙酮中,固定30 min,用PBS(0.01M)冲洗3 次,每次2min;滴加3% 体积分数的H2O2室温孵育10 min,PBS 冲洗3次,每次2 min,以消除内源性过氧化物酶的活性;滴加兔抗人Ⅷ因子多抗工作液,放入湿盒(95%湿度)内4℃过夜,同时另一盖玻片不加一抗作阴性对照;次日,用PBS 冲洗3次,每次2 min,滴加辣根酶标记的羊抗兔IgG,37 ℃孵育30 min,PBS冲洗3次,每次2 min;用DAB 底物混合工作液显色,显微镜下观察,待出现特异性染色后,终止显色,进行复染,脱水,透明,封片,显微镜下观察。显微镜下见细胞胞浆棕黄色颗粒,可见胞核外形,呈阳性反应。说明所提取细胞为内皮细胞。
3、表面标志物鉴定
分别用内皮细胞培养液和常规培养液对原代的内皮细胞进行培养传代,待传到第三代时,收集细胞,磷酸盐缓冲溶液洗涤2次(1000rpm离心处理5min),调整细胞浓度至5×106个/ml;加入细胞表面标志物对应的人源抗体后孵育30min,再次洗涤重选后即可上机(流式细胞仪FACSCalibur,BD公司)检测。所用抗体包括下列细胞表面分子的抗体:鼠抗人CD31、CD144、CD34和vWF为阳性标记,CD45为阴性标记,其结果见表1。
表1:人脐静脉内皮细胞表面标志物检测结果。
由表1可知,所提取细胞为脐静脉内皮细胞,并且内皮细胞液培养的内皮细胞表面标志物的阳性表达率明显高于常规培养液培养的内皮细胞,这说明内皮细胞培养液培养的内皮细胞纯度高于常规培养液,以此证明本发明具有提高内皮细胞纯度的作用。
三、内皮细胞功能验证。
1、增殖能力验证。
选取对数生长期的脐静脉内皮细胞,消化离心后,用DMEM重悬备用;经过细胞计数后,将脐静脉内皮细胞接种在6块相同的96孔板中,每板接种20孔,每孔接种1×103个细胞;把6块96孔板放入细胞培养箱中培养,观察,约6小时左右细胞完全贴壁;吸去上清液,每块96孔板中,10孔加入内皮细胞培养液,另外10孔加入常规培养液(即每种培养液设置10个复孔),放入细胞培养箱中继续培养;在之后的六天,每天取出1块96孔板,采用MTS法测定波长490nm处吸光度值,设置调零孔。两种培养液培养不同天数对应的吸光值比较,如表2。(注:吸光值最后取值为10个复孔吸光值的平均值)。
表2:两种培养液培养不同天数对应的吸光值比较。
由表2 可以看出,随着培养时间的增加,两种培养液对应的吸光值都呈现了上升趋势,根据MTS原理可知,这两组的细胞在数量上都有所增加。但是,内皮细胞培养液组对应的吸光值涨幅较大,见图2,在同种条件下,内皮细胞培养液对内皮细胞增殖的促进作用优于常规培养液。
2、内皮细胞粘附能力验证。
选取对数生长期的脐静脉内皮细胞,消化离心后,去上清,分别用内皮细胞培养液和常规培养液重悬;对重悬的细胞悬液进行计数,分别接种在3块96孔板上,每种每板接种10个孔(即每种培养液设置10个复孔),每孔接种5 ×103个细胞;将3块96孔板放入细胞培养箱中培养;培养1h,2h,3h,见图3,分别取1块96孔板,采用MTS法测定波长490 nm处吸光度值,设置调零孔。两种培养液培养不同小时数对应的吸光值比较,如表3所示(注:吸光值最后取值为10个复孔吸光值的平均值)。
表3:两种培养液培养不同小时数对应的吸光值比较。
以培养小时数为横轴,吸光值为纵轴绘制图4。
由图4可知,在短时间内,随着培养时间的增加,两种培养液对应的吸光值都呈现了上升趋势,结合MTS原理可知,这两组的贴壁细胞数量都有所增加。但是,内皮细胞培养液组的吸光值均大于对应的常规培养液组,说明,在同种条件下,内皮细胞培养液对内皮细胞粘附的促进作用优于常规培养液。
3、内皮细胞迁移能力验证。
选取对数生长期的脐静脉内皮细胞,消化离心后,去上清,用DMEM混匀,接种在24孔板中,每孔接种1.2×105个细胞,置于细胞培养箱中培养24小时;用20µl 枪头沿孔的横、纵轴划痕,镜下拍照,如图5 A(注:枪头划过的位置细胞被划起,形成无细胞的痕迹);弃各孔上清,再用PBS泡洗三次,后加入等量的内皮细胞培养液和常规培养液,放入细胞培养箱中培养;12小时后取出,龙胆紫染色,随机选择视野拍照,如图5B。
由图5可以看出,内皮细胞培养液培养的脐静脉内皮细胞其细胞迁移面积明显大于常规培养液,从而说明和常规培养液相比,内皮细胞培养液具有促进内皮细胞迁移的能力。
4、内皮细胞侵袭能力验证。
选取对数生长期的脐静脉内皮细胞,消化离心后,去上清,用DMEM混匀,接种在Transwell板的小室中,每个小室接种8×104个细胞,下室分别加入内皮细胞培养液和常规培养液,置于细胞培养箱中培养;36小时后取出小室,龙胆紫染色;100×显微镜下随机观察拍照,见图6,400×镜下随机选择5个视野计数侵袭细胞数。
表4:侵袭细胞数目比较。
结合表4和图6可知,内皮细胞培养液培养的内皮细胞其侵袭的
数量远远多于常规培养液,说明内皮细胞培养液能够促进内皮细胞的侵袭能力。
5、内皮细胞管腔形成能力验证。
在96孔板中,每孔加入Matrigel胶50ul,放入细胞培养箱凝固备用;取对数生长期的脐静脉内皮细胞,消化离心后,分别用内皮细胞培养液和常规培养液混匀;对上述培养所得内皮细胞悬液进行计数,接种在已铺好胶的孔中,每孔接种1.8×104个细胞;放入细胞培养箱中培养,3h后取出,显微镜下观察两组细胞形成的微管腔的形态,如图7,随机拍照记录每组5个视野中形成管腔的数目。
以两种培养液为横轴,管腔形成数目为纵轴,绘制图8。
由图7、8可知:内皮细胞培养液培养的脐静脉内皮细胞形成了较为完全的管腔结构,管腔的腔隙面积较大,管腔壁细胞呈明显的扁平型的功能状态;管腔形成的数量上,内皮细胞培养液培养的脐静脉内皮细胞形成了4个完整的管腔形态,常规培养液培养的脐静脉内皮细胞几乎无管腔形成。从而说明,相比常规培养液,内皮细胞培养液具有促进体外管腔形成的能力。
- 还没有人留言评论。精彩留言会获得点赞!