由干细胞制备心外膜细胞的方法与流程
本申请涉及由多能干细胞制备心外膜细胞的方法,并且还涉及由多能干细胞制备血管平滑肌细胞和心脏成纤维细胞的方法,以及通过上述方法制备的心外膜细胞、血管平滑肌细胞和心脏成纤维细胞及其用途如心外膜细胞用于心脏损伤修复与筛选治疗心脏损伤的新疗法,以及再分化为血管平滑肌细胞用于疾病和药物筛选模型,血管组织工程。
背景技术:
心外膜系细胞在胚胎心脏发育过程中是必需的。心外膜细胞的前体细胞:前心外膜细胞,源自脏壁中胚层,在心管的流入道处紧挨心房和静脉窦后部的位置发育。前心外膜细胞的精准来源位置并不十分清楚,然而遗传谱系追踪实验显示前心外膜细胞与心肌细胞共同来自一个心脏形成前体细胞库。在心脏发育的环化阶段,前心外膜细胞向心管方向迁移,并逐渐覆盖整个心脏的表面形成心外膜。此后,一部分的心外膜细胞经过上皮向间充质转化过程侵入到心肌层。这些心外膜来源的细胞进一步分化为血管平滑肌和心脏成纤维细胞。其中血管平滑肌参与构建心脏冠状血管,心脏成纤维细胞主要构建心脏结构。除此之外,心外膜细胞还能通过分泌视黄酸、FGF9、IGF2、FSTL1等因子来促进心肌的增殖、成熟或再生。
在成年哺乳动物心脏中,绝大部分的心外膜细胞不再表达胚胎期的分子标记基因TBX18和WT1。心梗或胸腺素β4注射能够激活这两个基因在成体心外膜和心外膜下层细胞中的再表达,使其活化并分化为平滑肌和成纤维细胞以促使心梗区新血管的生成。此外,有研究显示将人心外膜来源细胞移植到小鼠心梗模型中能够提高发生心梗的小鼠心脏机能和血管再生。除此之外,在小鼠和猪的心梗模型中证明心外膜所分泌的FSTL1能促进成体心肌细胞再生。这些实验表明心外膜细胞,尤其是表达TBX18和WT1的心外膜细胞是治疗心梗的潜在移植细胞来源。
最近世界上有两个利用细胞因子如:FGF2、BMP4、activin A、VEGF和WNT3A以及含动物源成分的培养基来分化WT1+心外膜细胞的方法报道。这两种方法成本高昂,操作复杂,其分化培养基中所含动物源成分不利于所分化心外膜细胞的临床使用和研究。这些缺点阻碍了心外膜细胞的大规模研究及使用。本发明解决了这几个缺点。
技术实现要素:
在一个实施方案中,本发明提出了利用一种由小分子化合物高效诱导的心肌前体细胞来诱导前心外膜细胞的方法。所述方法包括在干细胞的分化起始阶段利用WNT信号激动剂如CHIR99021来诱导中胚层细胞,而后利用WNT信号通路抑制剂如IWR1来促进心肌前体细胞的形成。在该种分化方法下能得到极高比例的心肌前体细胞。
在另一个实施方案中,本发明提供了利用小分子化合物高效诱导心肌前体细胞为前心外膜细胞的方法。所述方法包括利用视黄酸(RA)和WNT信号激动剂CHIR99021来协同诱导TBX18和WT1双阳性的前心外膜细胞。还提供了由上述方法产生的前心外膜细胞。进一步提供了包含已分化形成中胚层并经刺激视黄酸和WNT信号通路的外源性试剂处理的干细胞的组合物。
在另一个实施方案中,本发明提供了由多能干细胞生成心外膜细胞的方法。所述方法包括:1)将多能干细胞与试剂CHIR99021接触来诱导中胚层细胞分化;2)经所述试剂CHIR99021诱导的中胚层细胞与另一种试剂IWR1相接触以形成心肌前体细胞;3)已分化形成的心肌前体细胞经RA和CHIR99021处理,形成TBX18和WT1双阳性的前心外膜样的细胞。4)前心外膜细胞经过低密度传代获得典型的心外膜形态。还提供了由上述方法产生的前心外膜细胞和心外膜细胞。
在另一个实施方案中,本发明提供了将所分化的心外膜细胞再分化为功能性血管平滑肌和心脏成纤维细胞的方法。所述方法为利用细胞因子TGFβ1和bFGF诱导功能性血管平滑肌,利用bFGF和血清诱导心脏成纤维细胞。
在另一个实施方案中,本发明提供了将所分化的心外膜细胞再分化为功能性血管平滑肌的方法。所述方法包括:1)传代后一天的心外膜细胞利用TGFβ1处理四天;2)TGFβ1处理过的细胞利用bFGF再处理四天得到平滑肌样的细胞;3)再次使用TGFβ1处理所述平滑肌样的细胞六天,使其成熟。还提供了由上述方法产生的功能性平滑肌细胞。
在另一个实施方案中,本发明提供了将所分化的心外膜细胞再分化为心脏成纤维细胞的方法。所述方法包括:1)传代后一天的心外膜细胞利用bFGF处理八天;2)再次使用bFGF并补加胎牛血清处理上述细胞六天。还提供了由上述方法产生的心脏成纤维细胞。
在另一个实施方案中,本发明提供了了一种不需要细胞因子,利用化学成分已知、不含动物源成分的培养基来分化人心外膜细胞的方法。该方法只使用三种小分子化合物在15天内就能将80%的人多能干细胞分化为TBX18+/WT1+心外膜细胞。并且经过传代后这些细胞呈现典型的心外膜形态,并发生EMT分化为功能性平滑肌细胞和成纤维细胞。与前两种方法比较,该方法高效、稳定、成本低廉、分化过程不含免疫原成分,非常适合大规模分化及后期移植研究。
更具体地,本发明提供以下各项:
1.由多能干细胞制备心外膜细胞的方法,所述方法包括:1)通过激活WNT信号通路将所述多能干细胞诱导分化成中胚层细胞;2)通过抑制WNT信号通路使步骤1)中获得的中胚层细胞转化成心肌前体细胞;3)通过激活视黄酸信号通路和WNT信号通路使步骤2)中获得的心肌前体细胞转化成前心外膜细胞;以及4)由步骤3)中获得的前心外膜细胞制备心外膜细胞。
2.根据1所述的方法,其中所述多能干细胞是人多能干细胞,优选地,所述人多能干细胞是人胚胎干细胞或人诱导多能干细胞。
3.根据1所述的方法,其中步骤1)中的激活WNT信号通路是通过添加WNT信号通路配体如WNT3a,或添加GSK-3抑制剂如CHIR99021、BIO,或添加与Axin有关的激动剂如HLY78来实现的,优选地,是通过添加CHIR99021来实现的。
4.根据1所述的方法,其中步骤2)中的抑制WNT信号通路是通过添加内源性的WNT抑制因子如DKK1,或添加控制WNT信号和分泌的抑制剂如IWP2,或添加与β-catenin降解、Axin稳定相关的抑制剂如IWR1、XAV939来实现的,优选地,是通过添加IWR1来实现的。
5.根据1所述的方法,其中步骤3)中的激活WNT信号通路是通过添加WNT信号通路配体如WNT3a,或添加GSK-3抑制剂如CHIR99021、BIO,或添加与Axin有关的激动剂如HLY78来实现的,优选地,是通过添加CHIR99021来实现的。
6.根据1所述的方法,其中步骤3)中的激活视黄酸信号通路是通过添加视黄酸受体的配体如全反式视黄酸、9-顺式视黄酸,或添加视黄酸前体如视黄醇、维他命A来实现的,优选地,是通过添加全反式视黄酸来实现的。
7.根据1所述的方法,其中步骤3)中获得的前心外膜细胞是TBX18和WT1双阳性的前心外膜细胞。
8.根据1所述的方法,其中在步骤4)中,将步骤3)中获得的前心外膜细胞经过低密度传代来制备心外膜细胞。
9.通过1-8中任一项所述的方法制备的心外膜细胞。
10.根据9所述的心外膜细胞用于心脏损伤修复的用途。
11.制备血管平滑肌细胞的方法,所述方法包括:1)通过激活WNT信号通路将所述多能干细胞诱导分化成中胚层细胞;2)通过抑制WNT信号通路使步骤1)中获得的中胚层细胞转化成心肌前体细胞;3)通过激活视黄酸信号通路和WNT信号通路使步骤2)中获得的心肌前体细胞转化成前心外膜细胞;4)由步骤3)中获得的前心外膜细胞制备心外膜细胞;5)将步骤4)中获得的心外膜细胞用TGFβ1处理;6)将经过步骤5)的细胞用bFGF处理;以及7)将经过步骤6)的细胞再次用TGFβ1处理。
12.通过11所述的方法制备的血管平滑肌细胞。
13.制备心脏成纤维细胞的方法,所述方法包括:1)通过激活WNT信号通路将所述多能干细胞诱导分化成中胚层细胞;2)通过抑制WNT信号通路使步骤1)中获得的中胚层细胞转化成心肌前体细胞;3)通过激活视黄酸信号通路和WNT信号通路使步骤2)中获得的心肌前体细胞转化成前心外膜细胞;4)由步骤3)中获得的前心外膜细胞制备心外膜细胞;5)将步骤4)中获得的心外膜细胞用bFGF处理;以及6)将经过步骤5)的细胞用bFGF加胎牛血清处理。
14.通过13所述的方法制备的心脏成纤维细胞。
附图说明
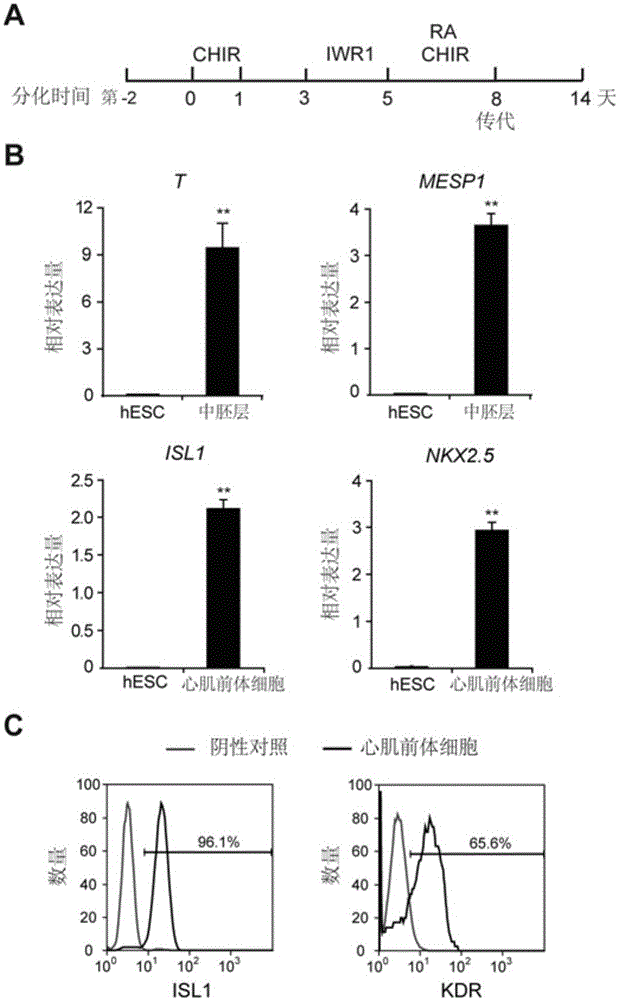
图1展示了人胚胎干细胞(hESC)向心肌前体细胞分化。(A)本发明所使用心外膜样细胞分化程序。(B)qRT-PCR分析中胚层分子标记T和MESP1在分化第2天以及心肌前体细胞分子标记ISL1和NKX2.5在分化第5天细胞中的表达水平。基因的相对表达以看家基因TBP作为基因标准。(C)流式检测分化第5天细胞中ISL1+和KDR+细胞比例。同型对照抗体作为阴性对照。
图2展示了WNT信号促进心肌前体细胞向WT1+/cTnT-非心肌细胞分化。(A)qRT-PCR分析心外膜基因TBX18和WT1在第14天细胞中的表达水平。基因的相对表达以看家基因TBP作为基因标准。(B)流式分析不同CHIR浓度处理组中WT1+细胞的比例。RA,1μM;IWR1,5μM;CHIR,0–12μM;—,DMSO。(C)qRT-PCR分析cTnT在RA和RA/CHIR处理组中的相对表达水平。以TBP作为看家基因比较。(D)流式检测分化第14天细胞中cTnT+细胞比例。一抗同型对照作为阴性对照,RA分化的心肌细胞作为阳性对照。(E)在RA和RA/CHIR处理组中免疫荧光共染WT1和cTnT,显示CHIR的添加改变了细胞命运。比例尺:100μm。统计数据:误差线,sem;(n=3);*p<0.05,**p<0.01,与单加RA组相比较。
图3展示了RA促进WT1+细胞中TBX18的表达。(A)qRT-PCR分析心外膜基因TBX18和WT1在第14天细胞中的相对表达水平。在CHIR浓度固定下,TBX18的表达水平随RA浓度的提高而增大,而WT1的表达水平不受影响。以TBP作为看家基因比较,统计数据:误差线,sem;(n=3);*p<0.05,**p<0.01,与单加CHIR相比较。(B)流式分析不同浓度RA处理组中WT1+细胞的比例。RA,0-5μM;BMS493,1μM;CHIR,5μM。(C)高内涵细胞成像分析TBX18+/WT1+细胞的比例。误差线,sem;(n=3);**p<0.01,与单加CHIR相比较。(D)免疫荧光共染TBX18和WT1。RA处理显著提高了TBX18+/WT1+细胞的比例。比例尺:100μm。
图4展示了体外分化的心外膜细胞的形态和分子特征。(A)CHIR单独处理和RA/CHIR处理细胞在不同天数内的明场图和免疫荧光图。注意两组细胞形态的不同以及ZO1表达的不同。比例尺:100μm。(B)EMT的两个分子标记VIM、ZEB1在不同天数的心外膜样细胞中相对表达变化。(C)qRT-PCR分析BNC1、UPK1B、ANXA8、GPM6A和FSTL1在不同细胞内的相对表达水平。以TBP作为看家基因比较。误差线,sem;(n=3);*p<0.05,**p<0.01。
图5展示了人诱导多能干细胞(hiPSC)向心外膜样细胞分化。(A)TBX18和WT1共染第14天hiPSC来源的前心外膜样细胞。绝大部分细胞是TBX18和WT1双阳性的细胞。(B)高内涵成像检测hiPSC分化成TBX18和WT1双阳性细胞的比例。(C)WT1和ZO1共染第15+2天hiPSC-EPL细胞。hiPSC-EPL细胞呈典型的心外膜样形态。比例尺:100μm。
图6展示了心外膜样(EPL)细胞向平滑肌分化的潜能。(A)EPL细胞向平滑肌细胞分化的程序示意图。(B)qRT-PCR分析ACTA2、CNN1、TAGLN和MYH11在不同处理组中的相对表达水平。以TBP作为看家基因比较。误差线,sem;(n=3);**p<0.01,与空白处理组相比较。(C)CNN1和TAGLN在TGFβ1+bFGF处理组和空白处理组中的免疫荧光共染。比例尺:100μm。(D)流式检测TGFβ1+bFGF处理组和空白处理组中CNN1+/TAGLN+平滑肌细胞比例。鼠和兔同型IgG作为阴性对照。
图7展示了EPL分化的平滑肌细胞经激动剂处理后的功能分析。(A)流式检测Fluo-4AM预染的各处理组细胞经卡巴胆碱处理后的相对平均荧光强度随时间变化曲线。以卡巴胆碱未处理前的平均荧光强度为标准比较。误差线,sem;(n=3);*p<0.05,**p<0.01,与空白处理组相比较。(B)去氧肾上腺素处理后空白处理组与TGFβ1+bFGF+TGFβ1组中有钙瞬变活动的细胞比例。误差线,sem;(n=3组);**p<0.01,与空白处理组相比较。(C)钙成像检测EPL分化的平滑肌对去氧肾上腺素处理的功能反应。F/F0为与基线值相比较的平均荧光强度。空白处理组与TGFβ1+bFGF+TGFβ1处理组各取5个有钙活动的细胞检测。(D)去氧肾上腺素处理后的钙瞬变振幅。(E)去氧肾上腺素处理后的钙瞬变持续时间。(F)Fluo-4AM预染的细胞在去氧肾上腺素处理前后细胞面积的变化。(G)去氧肾上腺素处理后空白处理组与TGFβ1+bFGF+TGFβ1组中有钙瞬变活动的细胞面积变化。每组各取10个细胞检测。
图8展示了EPL细胞向心脏成纤维细胞分化的潜能。(A)EPL细胞向心脏成纤维细胞分化的程序示意图。(B)qRT-PCR分析POSTN和FSP1在不同处理组和人包皮成纤维细胞中的相对表达水平。以空白处理组作为基准比较。误差线,sem;(n=3);**p<0.01,与空白处理组相比较。(C)流式分析空白处理组和bFGF+血清处理组中POSTN阳性细胞比例。(D)免疫荧光显示POSTN和COL1表达于bFGF+血清处理过的EPL细胞。比例尺:100μm。
具体实施方式
下面的实施例仅用于进一步阐释本发明的内容,而不意欲在任何方面限制本发明。本领域技术人员将领会,可对下述具体实施方式进行修饰而仍不偏离所附的权利要求所要求保护的本发明的范围、精神和主旨。
在下面的所有实施例中,如无特别声明,均采用本领域技术人员惯常所用的方法、仪器、试剂和实验方案等。分化基础培养基为RPMI 1640(Gibco),分化补充剂使用本实验室开发的S12(正申请专利)或商业化补充剂B27(Gibco)。以下所有实施例中,如无特别声明,均采用S12为分化补充剂。
本发明所涉及使用的人多能干细胞为商业化使用的、来自己建立的细胞系的人胚胎干细胞系,如H1、H7、H9(Wicell Research Institute,Madison,WI)等;以及体外各种方法(如OCT4、NANOG、KLF4、SOX2等转录因子表达或小分子化合物诱导)得到的人诱导多能干细胞系(hIPS)。
实验所用抗体如下:
流式一抗:ISL1(Santacruz,sc23590);cTnT(R&D,MAB1874);WT1(Abcam,ab89901);CNN1(Sigma,C2687);TAGLN(Abcam,ab14106);POSTN(Abcam,ab14041);Rabbit IgG(Abcam,ab199376)和mouse IgG1(Sigma,M5284)作为同型对照。荧光一抗:KDR-PE(R&D,FAB357P);c-KIT-APC(R&D,FAB332A)。
流式二抗:Alexa488donkey anti-goat IgG(Jackson,705-545-147);Alexa488goat anti-rabbit IgG(Jackson,111-545-003);Alexa488goat anti-mouse IgG(Jackson,115-545-003);PE goat anti-rabbit IgG(Sungene Biotech,GR200G-09C)。
荧光染色一抗:WT1(Abcam,ab89901);cTnT(R&D,MAB1874);TBX18(Santa Cruz,sc17869);ZO1(Invitrogen,339100);CNN1(Sigma,C2687);TAGLN(Abcam,ab14106);POSTN(Abcam,ab14041);COL1(Abcam,ab90395);CD31(Abcam,ab28364)。
荧光染色二抗:Alexa594goat anti-rabbit IgG(Jackson,111-585-003);Alexa488goat anti-mouse IgG(Jackson,115-545-003);Alexa488donkey anti-goat IgG(Jackson,705-545-147);Alexa594donkey anti-rabbit IgG(Jackson,711-585-152);Alexa488-goat anti-rabbit IgG(Jackson,111-545-003)。
目前所报道的心外膜细胞分化方法比较复杂,使用含动物源成分的分化系统使得培养的细胞含有免疫原成份,对后续的细胞移植的临床研究和治疗不利。除此之外,大量细胞因子的使用使得分化成本高昂、分化体系不稳定。这些都大大阻碍了心外膜细胞的应用前景。本文提出了一种将人多能干细胞在体外分化成前心外膜样细胞的新方法。此方法使用化学成分已知的培养基和小分子化合物,使分化的细胞中有约80%是TBX18+/WT1+双阳性的细胞。该研究还发现WNT信号的激活使心肌前体细胞的命运从心房肌细胞向WT1+非心肌细胞改变。而RA能够提高WT1+细胞中TBX18的表达而不影响WT1的表达。使用小分子化合物同时激活心肌前体细胞中的WNT和RA通路就能决定前心外膜细胞的分化命运。
这些前心外膜样的细胞经过低密度传代后呈现出典型的心外膜形态特征,表达上皮样细胞的分子标记ZO1,并能够自发发生上皮向间充质的转化。这些心外膜样的细胞还表达促心肌增殖因子FSTL1和心外膜特异基因BNC1、UPK1B、ANXA8和GPM6A。这些细胞发生EMT后能够部分(~40%)分化成平滑肌细胞,TGFβ1和bFGF的处理能显著提高平滑肌的分化比例(~90%)。流式检测钙活动和钙成像实验证实这些平滑肌具有正常的钙处理能力和收缩功能,并且TGFβ1和bFGF诱导的平滑肌相较于未处理组的平滑肌其钙处理能力和收缩能力更强。除此之外,小分子诱导产生的心外膜样细胞也具有向心脏成纤维细胞分化的潜能。bFGF和血清诱导使心外膜样细胞高表达心脏成纤维细胞分子标记POSTN,并分泌基质蛋白Collagen 1。
在SHH6期的鸡胚中,侧板中胚层前部分由前到后分布着生心中胚层(心区)、静脉窦前体细胞和前心外膜前体细胞。RALDH2(RA合成的限速酶)表达于侧板中胚层的后半部分细胞中。RALDH2的前缘与心区的后部相重合,而心区的后部将来发育成心房肌细胞。有实验已经证明RA决定心肌前体细胞向心房肌细胞的分化。因此,可以推测胚胎中位于心房前体细胞后方的静脉窦前体细胞和前心外膜的前体细胞的发育也都受到RA信号的影响。在同一时期,WNT-8c和WNT信号竞争性抑制剂Crescent分居胚胎首尾两端。将来发育成心房肌的心区后部细胞位于Crescent区域内,而前心外膜的前体细胞位于WNT信号区域。由于心肌前体细胞与前心外膜前体细胞可能来自于同一个生心中胚层细胞库,因此,可以假设心房肌和心外膜的发育都需要RA信号,而WNT信号诱导了心房肌细胞和前心外膜的命运分离。为了证明这一假设,发明人尝试在心房肌细胞分化的时间窗口上添加WNT通路激动剂CHIR用于心外膜细胞的分化。本文不仅揭示了心外膜分化的调控机制,而且还提供了将多能干细胞定向分化成相对均匀心外膜样细胞的方法。
人多能干细胞向心肌前体细胞分化。分化步骤:(1)分化前两天种板细胞,将人多能干细胞接种到用Vitronectin等基质包被的24孔板中,使细胞密度为2.5×105个/ml,加入10μM Y27632(sigma)防止细胞死亡。1ml/孔细胞悬液种板。5%CO2恒温培养箱(Thermo)中培养。(2)24孔板中的细胞长满后分化开始,记为第0天。吸弃培养基,加入含6μM CHIR99021(CHIR,Tocris)的分化培养基RPMI 1640(Gibco)+S12(不含insulin),1ml/孔。置于5%CO2恒温培养箱中培养24h。(3)第1天,吸弃旧培养基,加入新鲜的分化培养基(不含insulin),1ml/孔。放回5%CO2恒温培养箱中培养48小时。(4)第3天,吸弃旧培养基,加入含5μM IWR1(sigma)的分化培养基(不含insulin),1ml/孔。放回5%CO2恒温培养箱中培养48小时。(5)第5天,得到心肌前体细胞,可以进行继续分化。
在本文的心肌分化体系和方法下(图1.A),在分化第2天利用实时荧光定量PCR(qRT-PCR)检测了中胚层marker:T和MESP1的表达。相比较于未分化的胚胎干细胞(hESC),CHIR的处理显著提高了中胚层基因的表达(图1.B)。此后,结果也显示第5天时心肌前体细胞的marker:ISL1和NKX2.5高表达(图1.B)。流式结果显示90%以上的细胞呈ISL1阳性,60%以上的细胞呈KDR阳性(图1.C)。KDR是一个心肌与血管的前体细胞marker。这些结果证明在该分化系统下,第5天得到的细胞是心肌前体细胞。
WNT信号改变心肌前体细胞向心房肌细胞分化的命运。分化步骤:(1)分化的第5天,吸弃旧培养基,加入含1uM全反式RA(sigma)和0-12uM CHIR的分化培养基(此后分化培养基都含insulin),1ml/孔。放回5%CO2恒温培养箱中培养72小时。(2)第8天,分化的细胞传一次代(0.25%Trypsin-EDTA消化2min,胎牛血清中和),24孔板里的2孔细胞传到6孔板里的1孔里。加入含10μM Y27632的分化培养基,1mL/孔。放回5%CO2恒温培养箱中培养48小时。(3)第10-14天,每两天吸弃旧培养基,加入新鲜的分化培养基,1mL/孔。放回5%CO2恒温培养箱中培养48小时。
根据我们的假设,为了得到心外膜细胞,本研究在心房肌分化程序的第5天加入不同浓度的CHIR(1-12uM),检测第14天细胞的基因表达水平。结果显示,在加入RA的同时加入CHIR能显著提高心外膜特异性基因TBX18和WT1的表达水平。在CHIR浓度为5uM时(RA/CHIR 5),TBX18和WT1的表达水平达到最高值(图2.A)。然而,随着CHIR浓度进一步的提高,TBX18和WT1的表达水平也逐渐下降。说明WNT通路的激活需要维持在一定的范围内。流式分析的结果也显示RA/CHIR 5组的WT1+细胞最多,超过90%(图2.B)。除此之外,qRT-PCR的结果也显示RA/CHIR5处理(RA/CHIR)导致心肌特异基因cTnT表达水平的急剧降低(图2.C),暗示RA/CHIR处理的细胞不再是心肌细胞。流式结果确认在RA/CHIR处理的细胞中,只有不到3%的细胞是cTnT+心肌细胞(图2.D)。cTnT和WT1的免疫共染实验显示RA和RA/CHIR处理得到的细胞分别是WT1-/cTnT+心肌细胞和WT1+/cTnT-非心肌细胞(图2.E)。为了对RA分化的心肌细胞定型,对RA分化的心肌细胞进行膜片钳检测动作电位,结果显示超过90%的细胞呈现心房肌样的动作电位(结果未显示)。以上实验说明WNT信号通路能激活心肌前体细胞中WT1的表达,进而让原本心房肌分化的细胞命运向WT1+/cTnT-非心肌细胞方向转变。
RA协同WNT信号诱导心肌前体细胞向前心外膜样细胞分化。分化步骤:(1)分化的第5天,吸弃旧培养基,加入含5uM CHIR和0-5uM RA的分化培养基(此后分化培养基都含insulin),1ml/孔。放回5%CO2恒温培养箱中培养72小时。(2)第8天,分化的细胞传一次代(0.25%Trypsin-EDTA消化2min,胎牛血清中和),24孔板里的2孔细胞传到6孔板里的1孔里。加入含10μM Y27632的分化培养基,1mL/孔。放回5%CO2恒温培养箱中培养48小时。(3)第10-14天,每两天吸弃旧培养基,加入新鲜的分化培养基,1mL/孔。放回5%CO2恒温培养箱中培养48小时。
为了优化WT1+/cTnT-非心肌细胞分化过程中RA的浓度,在D14检测了固定CHIR浓度(5uM)下不同浓度RA对TBX18和WT1表达水平的影响。qRT-PCR结果显示在CHIR存在条件下,激活或抑制RA通路(BMS493,RA信号通路抑制剂)不会明显改变WT1的表达水平(图3.A)。流式分析的结果确认了各处理组都能分化出80%以上的WT1+细胞(图3.B)。然而有趣的是TBX18的表达水平随RA浓度的提高而增高,显示出RA浓度依赖的表达模式。在RA浓度为1或5uM时,TBX18的表达值达到最高,约为单加CHIR处理组的5倍(图3.A)。由于高浓度的RA容易导致细胞死亡,本研究以后的实验都选择1uM的RA和5uM的CHIR进行心外膜的分化。为了确认TBX18表达对RA的依赖性,本研究利用免疫荧光共染TBX18和WT1的方法估算了不同处理组中各种细胞的比例(图3.D)。尝试几支商业化的TBX18抗体做流式分析后发现然而没有合适做流式的抗体。因此,本研究通过高内涵成像分析的方法来估计。最后,通过三次独立的实验我们统计出RA/CHIR处理组的细胞中有83.5%的细胞是TBX18+/WT1+双阳性细胞;CHIR单独处理的细胞中有43.0%的细胞是TBX18+/WT1+双阳性细胞;而如果抑制RA信号(BMS493/CHIR组),仅有27.8%的细胞是TBX18+/WT1+双阳性细胞(图3.C)。这些实验说明了WNT信号能够激活心肌前体细胞中WT1的表达,而RA则提高了TBX18在这些WT1+细胞中的表达比例。由此,本发明把RA/CHIR处理得到的第14天TBX18+/WT1+细胞称为前心外膜样(proepicardium-like,pEPL)的细胞。综上所述,心肌前体细胞向心外膜细胞的分化需要RA信号和WNT信号的协同作用。
心外膜样细胞的形态和分子特征形成。实验步骤:(1)为了得到上皮样的心外膜细胞,在第14天时用0.25%Trypsin-EDTA在37℃将分化的细胞消化2min。(2)加入预热的分化培养基(含10%FBS)中和,用枪头吹打细胞使其完全形成单细胞悬液,转移到50ml离心管中,补加E8培养基到30ml,1000转/min离心5min。(3)去掉上清加入少量分化培养基重悬细胞,用血球计数板测量细胞密度。补加分化培养基,使细胞密度为20万/孔或4万/孔接种到用Vitronectin包被的6孔板或24孔板中。加入终浓度为10μM的Y27632,用移液器吹打均匀。(4)隔日(第15天)换新的分化培养基,此后每两天换一次分化培养基。
在胚胎和成年心脏中,心外膜是一层覆盖在心脏表面的上皮样细胞。这些细胞紧密相连,呈鹅卵石状镶嵌在一起,并在相接触的细胞膜上表达上皮紧密连接标记基因ZO1。然而,胚胎干细胞分化的第14天pEPL细胞在六孔板中呈细胞团存在。为了得到上皮样的心外膜细胞,将第14天pEPL细胞进行低密度(2.5×104cells/cm2)传代。传代后一天(第15天),这些细胞变圆、贴壁面积变大,但是细胞也变得很薄(图4.A)。这些形态特点很符合上皮细胞的特征。再经过两天(第15+2天)的增殖,这些细胞连成一片,形成鹅卵石镶嵌排列。WT1和ZO1的免疫荧光共染实验显示这些细胞的细胞膜连接处都表达ZO1。又两天后(第15+4天),WT1的表达持续降低,而ZO1的表达有所增强。然而,此后ZO1的表达急剧降低。在D15+8已经几乎看不到WT1和ZO1的表达(图4.A),细胞也不再紧密连接,VIM和ZEB1的qRT-PCR结果显示心外膜细胞发生了EMT(图4.B)。与pEPL细胞不同,CHIR单独处理得到的细胞以相同的密度传代后不能形成上皮样的形态。免疫荧光共染实验结果也证明这些细胞在第15+2天也只表达极少的ZO1(图4.A)。为了进一步验证传代后的pEPL细胞能够类比于心外膜细胞,利用qRT-PCR分析了心外膜分泌的心肌再生因子FSTL1和心外膜特异基因(BNC1、UPK1B、ANXA8和GPM6A)在心肌以及不同天数的pEPL细胞中的表达水平(图4.C)。在胚胎和成体阶段,FSTL1表达于心外膜而不是心肌层。BNC1、UPK1B、ANXA8和GPM6A相对高表达于成体小鼠的心外膜。结果显示,相较于心肌细胞,这些基因在pEPL细胞中提高了表达,尤其是在第15+8天的pEPL细胞中。由于第15+8天的pEPL细胞不再表达WT1,这些细胞像是发生了EMT的EDPCs细胞或者成体心外膜细胞。综上所述,pEPL细胞传代后呈现心外膜细胞的形态特征并表达心外膜特异的基因。本发明把第15天后经过传代的pEPL细胞称之为心外膜样(epicardium-like,EPL)细胞。
为了验证本文的分化方法对于多能干细胞具有普适性,通过使用与胚胎干细胞分化相同的程序在体外尝试把两株hiPSC-XVF细胞系也分化为心外膜细胞。统计三次独立实验的免疫荧光染色结果,RA/CHIR处理的细胞在第14天时平均有约78%的细胞是TBX18+/WT1+双阳性细胞(图5.A、B)。而经过传代后,这些细胞具有与hESC-EPL细胞相同的形态,共表达WT1和ZO1(图5.C)。因此,本文的分化方法也可以利用诱导多能干细胞来分化hiPSC-EPL细胞。这对于针对心梗病人的心外膜细胞移植治疗具有重要的意义。
心外膜样细胞向平滑肌细胞分化。分化步骤:(1)第15天的心外膜样细胞在6孔板或24孔板中用含5ng/mL TGFβ1的分化培养基处理4天,3ml/孔或1ml/孔,每2天换一次液。5%CO2恒温培养箱中培养。(2)第15+4天的心外膜样细胞用含10ng/mL bFGF的分化培养基处理4天,3ml/孔或1ml/孔,每2天换一次液。5%CO2恒温培养箱中培养。(3)第15+8天时用含5ng/mL TGFβ1的分化培养基继续处理6孔板或24孔板中的心外膜样细胞6天,每2天换一次液。5%CO2恒温培养箱中培养。
将分化(图6.A)八天后(第15+8天)的细胞进行qRT-PCR检测。结果显示,平滑肌特异基因(ACTA2、CNN1、TAGLN和MYH11)在TGFβ1+bFGF处理组的表达水平高于空白处理组约2.5倍,也远高于阴性对照hESCs细胞(图6.B)。免疫荧光实验也显示TGFβ1+bFGF处理组比未处理组表达更多的CNN1和TAGLN蛋白(图6.C)。流式分析显示TGFβ1+bFGF处理组中接近90%的细胞是CNN1+/TAGLN+细胞,而空白处理组只有40%的细胞是CNN1+/TAGLN+细胞(图6.D)。这些数据显示,TGFβ1+bFGF处理能促使EPL更高效率的向平滑肌方向分化。TGFβ1常用于体外促进平滑肌细胞成熟。为了促使分化的平滑肌细胞更加成熟,将第15+8天TGFβ1+bFGF处理过的细胞再用TGFβ1处理六天。qRT-PCR结果显示,相比于未额外处理组(第15+8+6天,TGFβ1+bFGF+空白处理),TGFβ1的再处理(第15+8+6天,TGFβ1+bFGF+TGFβ1)提高了这几个平滑肌特异基因的表达,尤其是MYH11(成熟平滑肌的marker),提高了约一倍(图6.B)。
随后,从功能上描述这些EPL来源细胞的特征。在血管中血压是通过血管平滑肌的舒张和收缩来调节的。血管平滑肌的收缩是由胞内Ca2+水平变化引起的。卡巴胆碱(carbachol)、去氧肾上腺素(phenylephrine)等激动剂能够促使平滑肌肌浆网内的钙释放,引起平滑肌收缩。这一过程可以被钙敏感的染料Fluo-4AM所追踪。为了检测EPL不同处理组细胞的钙活动,利用流式的方法检测在EPL来源细胞中预染的Fluo-4荧光值在卡巴胆碱加入前后的变化。HeLa细胞(阴性对照)在卡巴胆碱加入30秒后几乎没有明显的荧光值变化,显示细胞内未有钙流活动。空白处理组有一个较低的荧光值变化,而TGFβ1+bFGF处理过的细胞有一个较高的荧光值变化,并且TGFβ1+bFGF+TGFβ1组有着更高的荧光变化值(图7.A)。这说明TGFβ1+bFGF+TGFβ1处理过的细胞具有更强的钙活动,为了更直观、精确地揭示未处理组和TGFβ1+bFGF+TGFβ1处理组的平滑肌在钙活动上的区别,本研究利用钙成像检测去氧肾上腺素处理前后两组细胞的钙瞬变(图7B、C)。结果显示,空白处理组中约有40%细胞具有钙瞬变,而TGFβ1+bFGF+TGFβ1处理组中绝大部分细胞(>80%)具有钙瞬变(图7.B)。这一结果与流式检测平滑肌效率的结果相似。相较于空白处理组,TGFβ1+bFGF+TGFβ1处理组中能够发生钙瞬变细胞的钙活动振幅更高,持续时间更长(图7.D、E)。TGFβ1+bFGF+TGFβ1处理组的细胞在去氧肾上腺素处理后比空白处理组细胞发生更明显的收缩(图7.F、G)。综上所述,TGFβ1+bFGF+TGFβ1处理能够提高EPL细胞向功能性平滑肌细胞分化的比例,并通过增强细胞的钙处理能力来增加平滑肌对激动剂的反应能力。
心外膜样细胞向心脏成纤维细胞分化。分化步骤:(1)第15天的心外膜样细胞在6孔板或24孔板中用含10ng/mL bFGF的分化培养基处理8天,3ml/孔或1ml/孔,每2天换一次液。5%CO2恒温培养箱中培养。(2)第15+8天时用含10ng/mL bFGF和10%胎牛血清(bFGF+血清)的分化培养基继续处理6孔板和24孔板中的心外膜样细胞6天,每2天换一次液。5%CO2恒温培养箱中培养。
心脏中的成纤维细胞主要来自于心外膜细胞。为了检测EPL细胞向成纤维细胞分化的潜能,本研究利用qRT-PCR检测了EPL细胞经过bFGF处理十四天(图8.A)后胞内POSTN的表达水平。POSTN是心脏成纤维细胞胚胎时期表达的特异分子标记。分析结果显示bFGF处理明显提高了POSTN的表达水平(图8.B)。如果在bFGF处理的最后六天补加血清(bFGF+血清),结果显示细胞内POSTN的表达水平急剧上升,比人包皮成纤维细胞(human foreskin fibroblasts,HFFs)还要高17倍。相反的,FSP1,一个广泛的成纤维细胞分子标记但并不在胚胎心脏成纤维细胞中表达的基因,在bFGF+血清处理细胞中的表达水平要远远低于其在HFFs中的表达(图8.B)。流式结果分析表明,bFGF+血清处理的细胞中有近90%的细胞呈POSTN阳性(图8.C)。除此之外,免疫荧光实验显示,相较于未处理组,bFGF+S处理的细胞不仅表达POSTN,还产生一种由心脏成纤维细胞所分泌的基质蛋白—Collagen1(COL1)(图8.D)。以上结果显示,EPL细胞有向心脏成纤维细胞分化的潜能。
讨论
RA信号在Iyer的心外膜分化体系中起到决定性的作用。相反地,Witty在分化心外膜过程中没有加入外源性的RA。但也不能排除内源性的RA起到一定的作用,因为在他们的培养基中可能含有维生素A—RA的前体化合物。在他们的实验中没有TBX18蛋白表达水平的数据,因此无法与其比较所分化TBX18+/WT1+细胞比例的高低。本研究的实验证明去掉RA不改变WT1的表达水平,但能降低TBX18+/WT1+细胞的比例。与此实验现象相似,RALDH2—/—突变小鼠的前心外膜表观并无太大异常。这说明RA并不是心外膜命运决定的统治性信号。然而,在Iyer的实验中RA对心外膜基因的诱导表达起到了决定性的作用。这个结果可能的原因是在其分化程序中长时间地使用了高浓度的RA来处理细胞。他们得到了WT1和TCF21异质性表达的细胞群,只有60%的细胞是WT1+细胞。考虑到心外膜细胞来源的复杂性,他们得到的心外膜细胞跟我们得到的心外膜细胞可能是不同类别的心外膜细胞。本研究的实验证明,在心外膜分化过程中,RA起到协助WNT信号来决定心外膜细胞的命运、促进细胞的增殖和在传代后赋予细胞心外膜典型形态的作用。虽然TBX18和WT1同为心外膜的marker,但两者之间并未有相互调控的作用。因此,它们对RA的浓度产生不同的效应是可能的。在小鼠突变体中,TBX18-/-和RALDH2-/-的心外膜表型相似,损害较小。而WT1-/-的心外膜受到严重的损害。这暗示WT1并不受RA信号的调控,而TBX18可能是RA信号调控的下游基因。具体的机制尚不清楚。由于WNT和RA信号激活的时间窗口是在第5-8天,而TBX18和WT1上调的时间是在第10天以后,因此WNT和RA信号通路并不直接调控TBX18和WT1的表达。具体过程中间的调控基因和下游通路是什么并不清楚。难以通过其他实验(chip-seq,荧光素酶检测分析等)更好地证明WNT激活WT1,RA提高TBX18的表达比例。
在Witty和Iyer的干细胞培养及心外膜分化过程中使用了含动物源成份的培养基和大量的细胞因子。一方面,这些可能含有病原体和免疫原的细胞使得对心梗的细胞移植治疗面临巨大的风险。另一方面,由于细胞因子价格昂贵,批次稳定性差,保存不易等原因使得在体外成规模的分化心外膜细胞面临不小的困难。可喜的是,本文的分化系统解决了这两个难题。本文所使用的E8培养基和实验室自己开发的S12培养基成分明确,不含动物源成分,价格低廉。小分子化合物比细胞因子稳定性好,实验可重复性高,价格也低廉。因此,我们的分化系统为体外大量分化心外膜细胞用于心外膜相关研究和心脏组织修复的临床使用提供了良好的方法。
目前心脏损伤后的细胞移植治疗还很少用到心外膜细胞。心梗发生后,患者本身的心外膜细胞会被激活成“胚胎”状态,迅速增殖并分化,参与形成纤维化的疤痕组织。因此,虽然心外膜细胞也参与心梗后新血管的生成,但其对心脏的损伤修复作用并不太大。然而,FSTL1的发现让我们对心外膜细胞在心脏损伤修复中的潜能有了新的认识。心梗后的心外膜不再表达FSTL1,而动物心梗模型显示FSTL1具有促进原位心肌增殖的能力。因此,将体外分化得到的能够表达FSTL1的心外膜细胞移植到受损的心脏处可能有助于心肌的再生。此外,心外膜细胞还有促进心肌成熟的功能。而心肌成熟是心肌细胞移植治疗心脏损伤所面临的一个难题。因此,体外分化的心外膜细胞与心肌细胞的共同移植可能是细胞移植治疗心脏损伤中更具发展潜力的方法。
- 还没有人留言评论。精彩留言会获得点赞!
- 从人胎盘羊膜制备羊膜间充质干细胞的方法及其应用与流程
- 一种脐疗贴的制备方法及应用与流程
- 一种干细胞制剂及其在制备治疗慢性肾炎的药物中的应用的制作方法与工艺
- 脐带间充质干细胞在制备治疗角膜损伤的干细胞制剂中的应用的制作方法与工艺
- 脐带间充质干细胞联合黄芪多糖在制备治疗高血糖和糖尿病肾病药物中的应用的制作方法与工艺
- 由脐带间充质干细胞制备CD34阳性细胞的方法与流程
- 基因重组干细胞制剂的制备方法及其在皮肤损伤修复、瘢痕抑制中的应用与流程
- 一种大规模制备人脐带间充质干细胞因子用诱导分泌培养基的制作方法与工艺
- 一种人母乳干细胞的制备方法及其应用与流程
- 间充质干细胞联合维生素E在制备肾脏组织细胞修复药物中的应用的制作方法与工艺