一种维持小鼠上胚层干细胞自我更新状态的培养方法与流程
本发明属细胞培养领域,尤其涉及一种维持小鼠上胚层干细胞自我更新状态的培养方法。
背景技术:
干细胞是分离自早期胚胎的一类细胞,在体外培养条件下具有无限增殖(自我更新)的能力,同时还保持着分化为机体各种类型细胞的潜能(分化),现已成为研究基因功能、筛选药物和制造疾病动物模型的强有力工具之一,在再生医学领域具有巨大的应用前景。
目前研究得最为广泛的干细胞是小鼠胚胎干细胞(mouse Embryonic Stem Cells,mESCs),这也是第一株在体外成功建立的干细胞系。其后,人胚胎干细胞(human Embryonic Stem Cells,hESCs)系也得以成功构建。小鼠与人ESCs虽然拥有一些共同的特征,但二者的生物学特性却有诸多不同之处。值得关注的是,科学家们于2007年从小鼠着床后的囊胚中分离得到了一种新型的干细胞——上胚层干细胞(mouse Epiblast Stem Cells,mEpiSCs)。mEpiSCs与mESCs在生物学特性上存在较大差异,却与hESCs具有许多相似之处。由于人源性,hESCs无法进行嵌合体实验或其它涉及伦理道德问题的研究,而mEpiSCs则可充当相应空白领域的补充材料;对mEpiSCs的深入研究,可为hESCs提供有利的研究思路与方法,其本身也是对于整个干细胞领域探究深度与广度的扩充,因而具有重要的科研价值与学术意义,相关成果有助于未来对于干细胞的安全应用。
开展各类研究的前提是对于实验材料的获取与维持。早期分离得到的mEpiSCs被培养在人工合成培养基(chemically defined medium,CDM)中,并加入细胞因子激活素A(Activin A)和成纤维细胞生长因子2(fibroblast grow factors-2,FGF2)来维持细胞的生长与自我更新状态。在CDM/AF条件下培养的mEpiSCs虽然也能表达自我更新标志基因并维持40代以上,但细胞的生长速度比较缓慢,不能耐受单细胞消化,易凋亡,需使用手动切割的方法,以小团块形式进行传代,此种方法不仅对操作人员的要求较高,操作过程中也容易造成细胞的污染,因此,常规培养方法不仅耗时、费力,且传代后的细胞存活力低、容易分化,大大地限制了其基础和应用研究。
为了优化小鼠上胚层干细胞的培养条件,现安徽大学干细胞与转化医学研究中心的叶守东博士通过一个小分子化合物库,筛选出Wnt/β-catenin信号通路的一个小分子抑制剂IWR1能够有效地提高mEpiSCs的自我更新能力,大大地改善了目前mEpiSCs的培养状况。此外,通过查阅相关科研进展,发现ROCK激酶的抑制剂Y27632可以提高hESCs的存活率。鉴于hESCs与mEpiSCs之间生物学特征的相似性,遂也可以将Y27632应用于mEpiSCs的培养中。优化后的培养条件以10%FBS含量的DMEM培养基为基础,加入Activin A、bFGF、IWR1以及Y27632这四种细胞因子或小分子化合物。在此种培养条件下,细胞可耐受胶原酶IV的消化处理,存活能力显著提高,克隆形态均一,生长状况良好,可多次传代,不出现分化现象。
虽然优化后的Activin A+bFGF+IWR1+Y27632培养条件可以维持mEpiSCs的生长与自我更新状态,但由于所涉及的细胞因子种类过多,不利于后续对于细胞内相关信号通路与分子机制的深入探究,且培养成本高。本发明在此基础上,通过逐个递减与对不同排列组合的尝试,进一步改进与优化mEpiSCs的培养条件,优化后的条件仅使用两种小分子即可维持mEpiSCs的自我更新状态,达到与原培养条件相同的培养效果,具有省时、省力、省钱、利于后续研究等优点。
技术实现要素:
为了解决传统培养条件中出现的细胞状态不稳定、传代操作不方便以及现有培养条件成本高、作用因子复杂和不利于后续探究等问题,本发明提供了一种经济高效、操作便捷、效果稳定、利于开展后期研究的小鼠上胚层干细胞培养条件。
上述目的通过以下方案实现:
本发明的技术方案是在含10%FBS的DMEM培养基基础上,通过加入IWR1和Y27632两种小分子化合物来维持小鼠上胚层干细胞的自我更新状态。
一种维持小鼠上胚层干细胞自我更新状态的培养方法,其特征在于,包括以下步骤:
(1)小鼠上胚层干细胞的获取;
(2)小鼠上胚层干细胞在IWR1+Y27632条件下的传代和培养;
a、取1.4-1.6ml、0.09-0.11%浓度的明胶加入34-36mm BD Falcon细胞培养皿,置于36-38℃、4.5-5.5%CO2浓度的细胞培养箱内,包被0.8-1.2h;
b、取生长至70-80%密度的上胚层干细胞,弃培养液,用PBS洗涤细胞1次,以除去残留的培养液;
c、加入0.8-1.2ml 0.09-0.1%浓度的胶原酶Ⅳ消化细胞,4.5-5.5min左右,细胞边缘浮起,用移液器吹打,转移至14-16ml Eppendorf离心管中,加入2.8-3.2ml DMEM培养液,继续吹打,使之混匀而终止消化;
d、900-1100rpm离心2.8-3.2min后,吸去上清,加入2.8-3.2ml培养液重悬细胞;
e、重复步骤d;
f、900-1100rpm,离心2.8-3.2min,吸去上清后,加入适量培养液重悬细胞,在显微镜下利用血球计数板对悬液中的细胞进行计数,并以此计算出细胞的密度;
g、取步骤a已包被好的培养皿,弃明胶,向培养皿孔内加入1.8-2.2ml DMEM培养基,其中含有:9-11%FBS,0.9-1.1%MEM非必须氨基酸,1.9-2.1mM L-Glutamin,0.09-0.1Mmβ-巯基乙醇,0.9-1.1mM丙酮酸钠,90-110单位的青霉素和90-110μg的链霉素;
h、向培养基中加入1.9×104-2.1×104个细胞,水平十字形晃动,使细胞分布均匀;
i、依次添加3.9-4.1μM IWR1和0.9-1.1μM Y27632,水平十字形晃动,使其混合均匀;
j、将细胞培养皿置于36-38℃、4-6%CO2浓度的细胞培养箱内培养,即可。
所述的一种维持小鼠上胚层干细胞自我更新状态的培养方法,其特征在于:小鼠上胚层干细胞的获取方法,包括以下步骤:
1)具有繁殖能力的129品系小鼠雌、雄各一只合笼,每天早上7-9点钟检查雌鼠阴道部位阴道栓的形成情况,第一次看到时,记为交配完成第0.5天;
2)确认交配完成后的第5.5天,以解剖方式获得母鼠子宫内的胚胎,用玻璃针从胚外组织中分离得到上胚层组织;
3)取0.9-1.1ml、0.1%浓度的明胶加入Thermo NUNC 4孔细胞培养板中,置于36-38℃、4.9-5.1%CO2浓度的细胞培养箱内,包被0.8-1.2h;
4)弃明胶,向培养孔内加入0.48-0.52ml DMEM培养基,其中含有:9-11%FBS,0.8-1.2%MEM非必须氨基酸,1.9-2.1mM L-Glutamin,0.09-0.11mMβ-巯基乙醇,0.8-1.2mM丙酮酸钠,90-110单位的青霉素和90-110μg的链霉素;同时添加终浓度为3.8-4.2μM的IWR1和终浓度为0.8-1.2μM的Y27632两种小分子化合物;
5)将2)步中分离得到的小鼠上胚层组织置于4)步的条件下,36-38℃、4-6%CO2浓度培养一周后,胚胎组织向外生长,即可得到小鼠上胚层干细胞克隆集落。
所述的一种维持小鼠上胚层干细胞自我更新状态的培养方法,其特征在于:小鼠上胚层干细胞自我更新与细胞特性检测方法包括以下步骤:
1)形态观察:使用Leica DMIL倒置相差显微镜对IWR1+Y27632条件下、不同培养天数的小鼠上胚层干细胞进行观察,发现细胞逐渐形成扁平的克隆形态,细胞之间堆积紧密,集落边界清晰,符合自我更新的形态特征;
将细胞多次传代后,观察不同代数细胞的培养形态,均保持自我更新的特征;
2)实时荧光定量PCR检测自我更新标志基因Nanog、Oct4以及上胚层干细胞特性基因Fgf5的表达,具体方法如下:
取生长至70-80%密度的实验组与对照组细胞,采用Trizol法抽提细胞总RNA;实验组为IWR1+Y27632条件下培养的小鼠上胚层干细胞,对照组为保持在自我更新状态下的小鼠上胚层干细胞;
利用TransScript All-in-One First-Strand cDNA Synthesis SuperMix for qPCR(TransGen)试剂盒,完成第一链cDNA的合成;以合成好的cDNA为模板,参照TransStart Tip Green qPCR SuperMix(TransGen)试剂盒,在Thermo PikoReal 96实时荧光定量PCR仪上进行基因表达水平的检测;GAPDH基因为内参;
qRT-PCR结果显示,与对照组相比,实验组中Nanog、Oct4以及Fgf5三种基因均保持正常的表达水平,说明在转录水平上,实验组细胞处于未分化的状态;
3)免疫荧光染色检测自我更新标志蛋白Nanog和Oct4的表达,具体方法如下:
将小鼠上胚层干细胞在IWR1+Y27632条件下传代培养2天左右后,弃培养液,用PBS漂洗细胞1次,加入3.8-4.2%浓度的多聚甲醛,室温固定18-22min;
弃多聚甲醛,用PBS漂洗细胞1次,而后加入含4.5-5.5%浓度牛血清白蛋白、0.15-0.25%浓度Triton X-100的PBS封闭液,将细胞置于36-38℃温箱,孵育0.8-1.2h;
弃封闭液,用PBS漂洗细胞1次,而后分别向不同孔细胞内加入含有Nanog一抗的稀释液、含有Oct4一抗的稀释液,用于分别检测细胞内Nanog蛋白、Oct4蛋白的表达情况,3.5-4.5℃过夜;
次日,回收一抗,放置于3.5-4.5℃冰箱保存;用PBS漂洗细胞2-4次,每次1.5-2.5min,而后加入携带有荧光基团的二抗稀释液,注意,需同时向二抗稀释液内添加Hoechst染料,用于对细胞核进行染色,36-38℃避光孵育0.8-1.2h;
弃二抗稀释液,用PBS漂洗细胞2-4次,而后在Leica DMI3000B型倒置荧光显微镜下观察并拍照;
免疫荧光结果显示,Nanog和Oct4这两种蛋白均保持正常的表达水平,说明在蛋白水平上,细胞处于自我更新的状态。
所述的一种维持小鼠上胚层干细胞自我更新状态的培养方法,其特征在于:所述的含有Nanog一抗的稀释液中,Nanog的参数为1:200,Sigma;所述的含有Oct4一抗的稀释液中,Oct4参数为1:200,Sigma;上述的稀释液均指的是含4.5-5.5%浓度牛血清白蛋白,0.15-0.25%浓度Triton X-100,0.8-1.2%浓度叠氮化钠的PBS。
所述的一种维持小鼠上胚层干细胞自我更新状态的培养方法,其特征在于:所述的携带有荧光基团的二抗的稀释液中,携带有荧光基团的二抗的参数为:1:500,碧云天;Hoechst染料的参数为:1:5000,Invitrogen;上述的稀释液均指的是含4.5-5.5%浓度牛血清白蛋白,0.15-0.25%浓度Triton X-100的PBS。
本发明的具体操作,包括以下步骤:
(1)小鼠上胚层干细胞的获取
1)具有繁殖能力的129品系小鼠雌、雄各一只合笼,每天早上9点钟前检查雌鼠阴道部位阴道栓的形成情况,第一次看到时,记为交配完成第0.5天;
2)确认交配完成后的第5.5天,以解剖方式获得母鼠子宫内的胚胎,用玻璃针从胚外组织中分离得到上胚层组织;
3)取1ml 0.1%浓度的明胶加入Thermo NUNC 4孔细胞培养板中,置于37℃、5%CO2浓度的细胞培养箱内,包被1h;
4)弃明胶,向培养孔内加入0.5ml DMEM培养基,其中含有:10%FBS,1%MEM非必须氨基酸,2mM L-Glutamin,0.1mMβ-巯基乙醇,1mM丙酮酸钠,100单位的青霉素和100μg的链霉素;同时添加终浓度为4μM的IWR1和终浓度为1μM的Y27632两种小分子化合物。
5)将2)步中分离得到的小鼠上胚层组织置于4)步的条件下,37℃、5%CO2浓度培养一周后,胚胎组织向外生长,即可得到小鼠上胚层干细胞克隆集落。(2)小鼠上胚层干细胞在IWR1+Y27632条件下的传代和培养
1)取1.5ml 0.1%浓度的明胶加入35mm BD Falcon细胞培养皿,置于37℃、5%CO2浓度的细胞培养箱内,包被1h;
2)取生长至70%-80%密度的上胚层干细胞,弃培养液,用PBS洗涤细胞1次,以除去残留的培养液;
3)加入1ml 0.1%浓度的胶原酶Ⅳ消化细胞,5min左右,细胞边缘浮起,用移液器吹打,转移至15ml Eppendorf离心管中,加入3ml DMEM培养液,继续吹打,使之混匀而终止消化;
4)1000rpm,离心3min后,吸去上清,加入3ml培养液重悬细胞;
5)重复步骤4);
6)1000rpm,离心3min,吸去上清后,加入适量培养液重悬细胞,在显微镜下利用血球计数板对悬液中的细胞进行计数(对于压线细胞,采取计上不计下,计左不计右的原则进行计数),并以此计算出细胞的密度,细胞密度计算公式为ρ(个/ml)=(四角大方格细胞总数/4)×104;
7)取已包被好的培养皿,弃明胶,向培养皿孔内加入2ml DMEM培养基,其中含有:10%FBS,1%MEM非必须氨基酸,2mM L-Glutamin,0.1mMβ-巯基乙醇,1mM丙酮酸钠,100单位的青霉素和100μg的链霉素;
8)向培养基中加入2×104个细胞,水平十字形晃动,使细胞分布均匀;
9)依次添加4μM IWR1和1μM Y27632,水平十字形晃动,使其混合均匀;
10)将细胞培养皿置于37℃、5%CO2浓度的细胞培养箱内培养。
(3)自我更新与细胞特性检测
1)形态观察:使用Leica DMIL倒置相差显微镜对IWR1+Y27632条件下、不同培养天数的小鼠上胚层干细胞进行观察,发现细胞逐渐形成扁平的克隆形态,细胞之间堆积紧密,集落边界清晰,符合自我更新的形态特征;
将细胞多次传代后,观察不同代数细胞的培养形态,均保持自我更新的特征;
2)实时荧光定量PCR(qRT-PCR)检测自我更新标志基因Nanog、Oct4以及上胚层干细胞特性基因Fgf5的表达,具体方法如下:
取生长至70%-80%密度的实验组与对照组细胞,实验组为IWR1+Y27632条件下培养的小鼠上胚层干细胞;对照组分为正、负两组,正组为保持在自我更新状态下的小鼠上胚层干细胞,负组为分化后的小鼠上胚层干细胞;
采用Trizol法抽提细胞总RNA,方法为:弃培养液,用PBS洗涤细胞2次,加入500μl Trizol裂解细胞,用移液器反复吹打2min后,转移至1.5ml离心管中;向离心管中加入100μl三氯甲烷,用力摇晃15s,静置2min后4℃离心10min,12000rpm;将上清吸取到另一个干净的离心管中,注意不要吸到中间层;按1:1的比例向上清中加入异丙醇,轻摇使之混匀,静置10min后4℃离心10min;离心后可在管底看到少量白色沉淀,弃上清,向离心管中加入1ml 75%浓度的乙醇,上下倒转、摇晃、轻弹;4℃离心5min,弃上清,加入1ml 75%浓度的乙醇,4℃离心5min后,弃上清,将离心管倒立于干净的吸水纸上,待管底的白色沉淀变透明后,加入40-50μl ddH2O,置于4℃或-20℃保存;
获得待测细胞的总RNA后,利用TransScript All-in-One First-Strand cDNA Synthesis SuperMix for qPCR(TransGen)试剂盒,完成第一链cDNA的合成;以合成好的cDNA为模板,参照TransStart Tip Green qPCR SuperMix(TransGen)试剂盒,在Thermo PikoReal 96实时荧光定量PCR仪上进行基因表达水平的检测;
以GAPDH为内参基因,各引物序列如下:
qRT-PCR结果显示,与对照组相比,实验组中Nanog、Oct4以及Fgf5三种基因均保持正常的表达水平,说明在转录水平上,实验组细胞处于未分化的状态;
3)免疫荧光染色检测自我更新标志蛋白Nanog和Oct4的表达,具体方法如下:
设置实验组与对照组细胞,实验组为IWR1+Y27632条件下培养的小鼠上胚层干细胞;对照组分为正、负两组,正组为保持在自我更新状态下的小鼠上胚层干细胞,负组为分化后的小鼠上胚层干细胞;
将各组细胞传代培养2天后,弃培养液,用PBS漂洗1次,加入4%浓度的多聚甲醛,室温固定20min;
弃多聚甲醛,用PBS漂洗细胞1次,而后加入封闭液(含5%浓度牛血清白蛋白,0.2%浓度Triton X-100的PBS),将细胞置于37℃温箱,孵育1h;
弃封闭液,用PBS漂洗细胞1次,而后分别向不同孔细胞内加入含有Nanog(1:200,Sigma)一抗、含有Oct4(1:200,Sigma)一抗的稀释液(稀释液为含5%浓度牛血清白蛋白,0.2%浓度Triton X-100,1%浓度叠氮化钠的PBS),4℃过夜;
次日,回收一抗,放置于4℃冰箱保存;用PBS漂洗细胞3次,每次2min,而后分别加入携带有荧光基团的二抗(1:500,碧云天)的稀释液(含5%浓度牛血清白蛋白,0.2%浓度Triton X-100的PBS),稀释液中需同时加入Hoechst(1:5000,Invitrogen)染料,37℃避光孵育1h;
弃二抗稀释液,用PBS漂洗细胞3次,而后在Leica DMI3000B型倒置荧光显微镜下观察并拍照;
Nanog蛋白一抗为兔来源,Oct4蛋白一抗为鼠来源,二抗分别为带488荧光基团的羊抗兔、羊抗鼠抗体,在荧光显微镜下观察时呈现绿色荧光;Hoechst染料用于对细胞核进行染色,荧光显微镜下呈现蓝色荧光;
免疫荧光结果显示,Nanog和Oct4均保持正常的表达水平,说明在蛋白水平上,细胞处于自我更新的状态。
本发明具有如下优点:
(1)本发明采用在10%FBS含量的DMEM培养基中加入IWR1和Y27632两种小分子的方法来培养小鼠上胚层干细胞,在此种培养条件下,细胞生长情况良好,能够维持自我更新的状态,可多次传代,不出现分化现象。
(2)与传统CDM/AF的培养条件相比,本发明具有更加稳定的培养效果,可以使细胞维持在最佳的生长状态,易于使用单细胞裂解的方式进行传代,简化操作步骤和流程,省时省力,利于基础研究的开展。
(3)与现有的Activin A+bFGF+饲养层细胞培养条件相比,本发明具有更加经济高效的优点,可显著节省培养成本;同时,简化细胞因子的添加种类以及避免饲养层细胞的使用,利于后续对细胞内相关信号通路与分子调控机制展开深入探究。
(4)本发明所摸索出的培养条件,可以为改善目前人胚胎干细胞以及其他种类多能性干细胞的培养条件提供线索。
附图说明
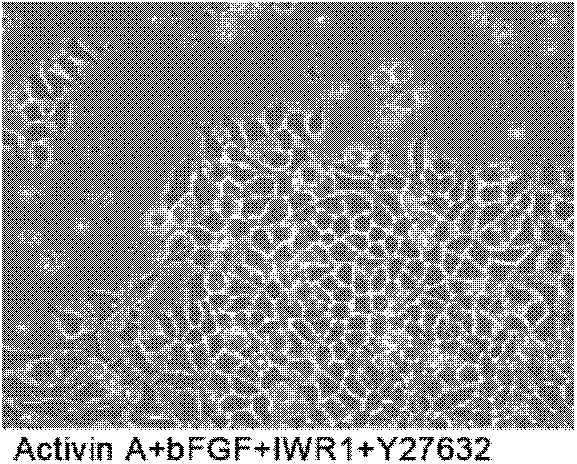
图1为三种条件下培养的P7代小鼠上胚层干细胞在相差显微镜下的形态图,其中,左侧为Activin A+bFGF+IWR1+Y27632条件下培养的细胞,处于自我更新的状态;中间为IWR1+Y27632条件下培养的细胞,符合自我更新状态的特征;右侧为不添加Activin A+bFGF+IWR1+Y27632培养的细胞,处于分化状态。
图2为三种条件下培养的P9代小鼠上胚层干细胞中自我更新标志基因以及特性基因的qRT-PCR检测结果,其中,“AbIY”代表Activin A+bFGF+IWR1+Y27632的培养条件,“IY”代表IWR1+Y27632的培养条件,“NT(No Treatment)”代表不加入Activin A+bFGF+IWR1+Y27632的培养条件。取Activin A+bFGF+IWR1+Y27632条件下培养的细胞内相应基因的表达量为参照值“1”,用GraphPad Prism 5软件绘制各基因相对表达量的直方图。
图3是对三种条件下培养的P10代小鼠上胚层干细胞进行自我更新标志蛋白的检测,所用的检测方法为免疫荧光染色。在荧光显微镜下观察时,Nanog与Oct4蛋白呈现绿色荧光;Hoechst染料用来显示细胞核的位置,荧光显微镜下呈现蓝色荧光。
图4为IWR1+Y27632条件下P13代的小鼠上胚层干细胞;视野里呈现出扁平的克隆形态,细胞之间堆积紧密,集落边界清晰,符合自我更新的形态特征。
图5为以对照组细胞中相应基因的表达量为参照值“1”,根据Ct值等参数信息、利用GraphPad Prism 5绘图软件绘制各基因相对表达量的直方图。
图6为免疫荧光染色图。
具体实施方式
实施例
(1)小鼠上胚层干细胞的获取
1)具有繁殖能力的129品系小鼠雌、雄各一只合笼,每天早上9点钟前检查雌鼠阴道部位阴道栓的形成情况,第一次看到时,记为交配完成第0.5天;
2)确认交配完成后的第5.5天,以解剖方式获得母鼠子宫内的胚胎,用玻璃针从胚外组织中分离得到上胚层组织;
3)取1ml 0.1%浓度的明胶加入Thermo NUNC 4孔细胞培养板中,置于37℃、5%CO2浓度的细胞培养箱内,包被1h;
4)弃明胶,向培养孔内加入0.5ml DMEM培养基,其中含有:10%FBS,1%MEM非必须氨基酸,2mM L-Glutamin,0.1mMβ-巯基乙醇,1mM丙酮酸钠,100单位的青霉素和100μg的链霉素;同时添加终浓度为4μM的IWR1和终浓度为1μM的Y27632两种小分子化合物。
5)将2)步中分离得到的小鼠上胚层组织置于4)步的条件下,37℃、5%CO2浓度培养一周后,胚胎组织向外生长,即可得到小鼠上胚层干细胞克隆集落。(2)小鼠上胚层干细胞在IWR1+Y27632条件下的传代和培养
1)取1.5ml 0.1%浓度的明胶加入35mm BD Falcon细胞培养皿,置于37℃、5%CO2浓度的细胞培养箱内,包被1h;
2)取覆盖密度达到80%的小鼠上胚层干细胞,弃培养液,用PBS洗涤1次,以除去残留的培养液;
3)加入1ml 0.1%浓度的胶原酶Ⅳ消化细胞,5min左右,观察到细胞边缘浮起后,用移液器吹打,转移至15ml Eppendorf离心管中,加入3ml DMEM培养液,继续吹打,使之混匀而终止消化;
4)1000rpm,离心3min后,吸去上清,加入3ml培养液重悬细胞;
5)重复步骤4);
6)1000rpm,离心3min,吸去上清后,加入1ml培养液重悬细胞,在显微镜下利用血球计数板对悬液中的细胞进行计数(对于压线细胞,采取计上不计下,计左不计右的原则进行计数),根据密度公式ρ(个/ml)=(四角大方格细胞总数/4)×104计算出1ml悬液中含有2×106个细胞;
7)取已包被好的培养皿,弃明胶,向培养皿孔内加入2ml DMEM培养基,其中含有:10%FBS,1%MEM非必须氨基酸,2mM L-Glutamin,0.1mMβ-巯基乙醇,1mM丙酮酸钠,100单位的青霉素和100μg的链霉素;
8)向培养基中加入10μl悬液(2×104个细胞),水平十字形晃动,使细胞分布均匀;
9)依次添加4μM IWR1和1μM Y27632,水平十字形晃动,使其混合均匀;
10)将细胞培养皿置于37℃、5%CO2浓度的细胞培养箱内培养。
(3)自我更新与细胞特性检测
1)形态观察:使用Leica DMIL倒置相差显微镜观察IWR1+Y27632条件下P13代的小鼠上胚层干细胞,视野里呈现出扁平的克隆形态,细胞之间堆积紧密,集落边界清晰,符合自我更新的形态特征,如图4所示;
2)实时荧光定量PCR(qRT-PCR):
设置实验组与对照组细胞,实验组为IWR1+Y27632条件下培养的P8代小鼠上胚层干细胞,对照组为保持在自我更新状态下的P8代小鼠上胚层干细胞;
利用Primer3Plus网站设计Nanog、Oct4、Fgf5以及GAPDH四种基因的引物序列,其中,Nanog、Oct4为自我更新标志基因,Fgf5为小鼠上胚层干细胞特性基因,GAPDH作为内参基因;引物设计完成后交由上海生工公司进行合成;
待实验组与对照组细胞生长到80%覆盖密度后,采用Trizol法分别抽提每组细胞的总RNA;
以每组细胞的总RNA为模板,利用TransScript All-in-One First-Strand cDNA Synthesis SuperMix for qPCR(TransGen)试剂盒,将总RNA逆转录成cDNA;
分别将cDNA与各引物稀释到所需浓度,参照TransStart Tip Green qPCR SuperMix(TransGen)试剂盒说明书提供的反应体系与扩增程序,在Thermo PikoReal 96实时荧光定量PCR仪上进行相关操作;
反应完成后,利用与荧光定量PCR仪配套的Piko Real Software 2.2软件,查看并导出熔解曲线、Ct值等关键参数;
以对照组细胞中相应基因的表达量为参照值“1”,根据Ct值等参数信息、利用GraphPad Prism 5绘图软件绘制各基因相对表达量的直方图,如图5;
qRT-PCR结果显示,与对照组相比,实验组中Nanog、Oct4以及Fgf5三种基因均保持正常的表达水平,说明在转录水平上,IWR1+Y27632条件下的P8代小鼠上胚层干细胞处于未分化状态。
3)免疫荧光染色:
取IWR1+Y27632条件下培养的P10代小鼠上胚层干细胞;弃培液,4%多聚甲醛室温固定20min;PBS漂洗后加入封闭液(含5%浓度牛血清白蛋白,0.2%浓度Triton X-100的PBS),37℃温箱孵育1h;弃封闭液,用PBS漂洗细胞1次,分别向不同孔细胞内加入含有Nanog(1:200,Sigma)一抗、含有Oct4(1:200,Sigma)一抗的稀释液,4℃过夜;次日PBS漂洗3次;根据每孔细胞所加入的一抗,相应添加携带488荧光基团的羊抗兔或羊抗鼠抗体的二抗(1:500,碧云天)稀释液,稀释液中需同时加入Hoechst(1:5000,Invitrogen)染料,37℃避光孵育1h;PBS漂洗后在荧光显微镜下观察拍照,结果如图6所示,Nanog、Oct4均保持正常表达水平,说明细胞处于自我更新状态。
基因名称 基因序列
GAPDH F: TGTGAGGGAGATGCTCAGTG
R: TGTTCCTACCCCCAATGTGT
Nanog F: AAGCAGAAGATGCGGACTGT
R: ATCTGCTGGAGGCTGAGGTA
Oct4 F: CCAATCAGCTTGGGCTAGAG
R: CTGGGAAAGGTGTCCCTGTA
Fgf5 F: GCGACGTTTTCTTCGTCTTC
R: GATGCCCACTCTGCAGTACA
- 还没有人留言评论。精彩留言会获得点赞!