体外肝细胞异质性培养装置及其培养方法与流程
本发明涉及生物医学技术领域,具体而言,本发明涉及一种体外肝细胞异质性培养装置及其培养方法。
背景技术:
在研究肝细胞在体外的生理功能方面,国内外众多学者采用了多种方法,比如三明治培养、球形聚集培养、微流控芯片培养以及3D打印培养等,无论何种方法其目的都是尽可能最大化地模拟体内肝细胞生长坏境,从而使体外培养的肝细胞具有更接近体内生长时的生理功能。已经证实各种三维培养和共培养研究明显优于普通平板培养和单培养,但是上述众多研究基本忽略体内肝细胞异质性这一基本生理特点。肝脏最小结构单位为肝小叶,每个肝小叶由众多条索状的肝板组成,每个肝板中靠近门静脉分支区域的肝细胞称为1区肝细胞,靠近中央静脉的肝细胞称为3区肝细胞,两者之间称为2区肝细胞。不同区域肝细胞在生理功能、代谢能力、对外来物质的敏感性等方面具有不同的特点,这被称为肝细胞异质性。其中,1区肝细胞在糖原分解、糖异生、尿素合成、胆固醇合成、Ⅱ相酶物质代谢方面更加高效,3区肝细胞在葡萄糖摄取、糖原储存、谷氨酰胺合成、酒精降解、Ⅰ相酶物质代谢方面更加高效。
所以基于仿生学思维,在体外构建模拟体内肝细胞异质性分布的的肝细胞体外培养方法具有重要意义。
技术实现要素:
本发明的首要目的旨在提供一种体外肝细胞异质性培养装置;
本发明的次要目的旨在提供一种体外肝细胞异质性培养方法。
为了实现上述目的,本发明提供以下技术方案:
第一方面,本发明提供一种体外肝细胞异质性培养装置,包括诱导芯片和与所述诱导芯片相连通的微量注射泵;所述诱导芯片包括用于形成浓度梯度的流体分流通道以及与所述流体分流通道相通的细胞诱导区域。
其中,所述诱导芯片利用光刻蚀技术铸模制备。
其中,所述诱导芯片采用聚二甲基硅氧烷制备。
其中,所述流体分流通道沿芯片纵长方向依次布设有呈对称分布的第一、第二培养基入口以及与所述培养基入口连接且相通的用于形成浓度梯度培养基的分流通道。
进一步地,所述分流通道至少包括依次连通的若干级分流通道,其中,第一级分流通道提供两个分别与第一、第二培养基入口连通以灌入不同浓度或不同成分的诱导液的一级入口,并形成三个一级出口;下一级分流通道的入口与上一级分流通道的出口一一对应连通,并且所述下一级分流通道的出口数量比所述上一级分流通道的出口数量多一个。
更进一步地,所述分流通道还包括第二级分流通道和第三级分流通道;所述第二级分流通道提供三个二级入口以分别与三个所述一级出口连通,并形成四个二级出口;所述第三级分流通道提供四个三级入口以分别与四个所述二级出口连通,并形成五个三级出口。
其中,五个所述三级出口并排设置并汇集到所述细胞诱导区域。
其中,所述第一培养基入口和第二培养基入口的直径分别为500μm。
其中,所述第一级分流通道、第二级分流通道、第三级分流通道的宽度以及深度均为100μm。
其中,所述细胞诱导区域呈十字形,其纵向通道顶端与所述分流通道的末端连接且相通,以通入诱导液;其纵向通道底端开设废弃液出口;其横向通道两侧对称各开设细胞悬液入口。
其中,所述纵向通道的宽度为1mm,长度为4mm;所述横向通道的宽度为1mm,长度为6.5mm。
其中,所述纵向通道底端废弃液出口直径为750μm。
第二方面,本发明提供一种体外肝细胞异质性培养方法,采用权利要求1至12任意一项所述的体外肝细胞异质性培养装置。
其中,包括以下步骤:
将肝细胞悬液加入到所述细胞诱导区域并等待所述肝细胞贴壁生长;从所述流体分流通道持续匀速通入不同浓度或不同成分的诱导液,以便诱导形成异质性分布的体外肝细胞。
进一步地,所述肝细胞来源于原代肝细胞。
其中,所述肝细胞的培养液配方包括DMEM基础培养基、10%胎牛血清、0.5U/ml胰岛素、7ng/ml胰高血糖素、20ng/ml上皮生长因子、7.5μg/ml氢化可的松、200U/ml青霉素、200μg/ml链霉素。
其中,所述肝细胞悬液的细胞浓度为1.5×107/ml。
进一步地,所述细胞诱导区域加入所述肝细胞悬液之前,在37℃条件下用50μg/ml的纤维连接蛋白溶液进行浸润。
优选地,所述浸润时间为45min。
其中,待肝细胞贴壁之后,将所述流体分流通道的入口关闭。
其中,所述诱导液包含WEB培养液,所述WEB培养液包括William’s E基础培养基、4mmol/l谷氨酰胺、200U/ml青霉素和200μg/ml链霉素。
进一步地,用于研究糖代谢和氨代谢的异质性肝细胞的诱导方法为:从所述第一培养基入口灌入含胰高血糖素100nmol/l的第一诱导液,并从所述第二培养基入口灌入含胰岛素100U/L的第二诱导液,诱导时间为24小时。
进一步地,用于研究酒精代谢和药物代谢的异质性肝细胞的诱导方法为:从所述第一培养基入口灌入所述WEB培养液,并从所述第二培养基入口灌入含2μmol/l的3-甲基胆蒽的第三诱导液,诱导时间为24小时。
其中,诱导形成异质性分布的肝细胞之后,还包括在所述体外肝细胞异质性培养装置中进行肝细胞生理功能的研究。
相比现有技术,本发明的方案具有以下优点:
(1)本发明提供了一种体外肝细胞异质性培养装置,其通过流体分流通道形成浓度梯度的由微量注射泵注入的诱导液后通入细胞诱导区域,模拟肝细胞异质性分布形成的内环境,其模拟的肝细胞异质性更符合肝细胞的生理状态。
(2)本发明提供的体外肝细胞异质性培养装置,异质性细胞诱导完成后,还可以继续进行生理研究,利用所述流体分流通道,使输入的诱导药物也形成梯度浓度分布,有利于进行药物浓度筛选。
(3)本发明还提供一种体外肝细胞异质性培养方法,其具体为肝细胞异质性培养方法,相比现有的其他肝细胞体外培养方法,本发明模拟了肝细胞在体外状态下肝细胞异质性的重要的生理特点,其可以在更接近体内状态下研究肝细胞的生理功能,如糖代谢、氨代谢、酒精代谢和药物代谢等,为肝细胞生理学、肝组织工程研究提供了新的思路。
本发明附加的方面和优点将在下面的描述中部分给出,这些将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
本发明上述的和/或附加的方面和优点从下面结合附图对实施例的描述中将变得明显和容易理解,其中:
图1为本发明的一种实施例用于体外肝细胞异质性培养的芯片设计图。
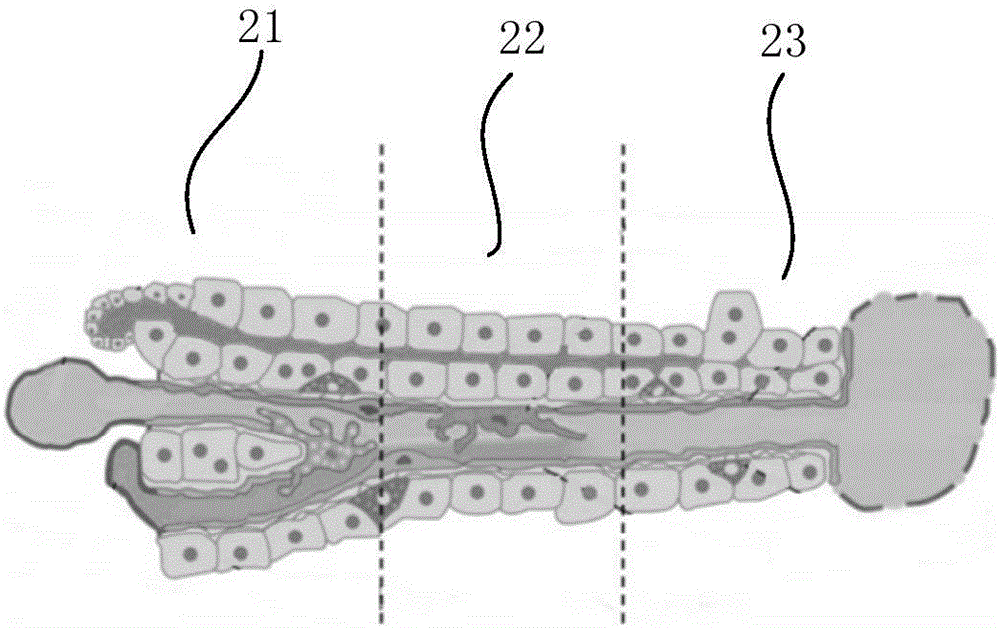
图2为体内肝细胞异质性分布示意图。
图3为本发明模拟连续浓度梯度诱导肝细胞异质性形成示意图。
具体实施方式
下面详细描述本发明的实施例,所述实施例的示例在附图中示出,其中自始至终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件。下面通过参考附图描述的实施例是示例性的,仅用于解释本发明,而不能解释为对本发明的限制。
实施例一
结合图1,对本发明用于体外肝细胞异质性培养的装置进行详细叙述。
本实施例中,体外肝细胞异质性培养装置包括诱导芯片1、与诱导芯片1相连通的微量注射泵(未图示)。
其中诱导芯片1包括流体分流通道11和与所述流体分流通道11连接且相通的细胞诱导区域12。
进一步地,所述流体分流通道11包括第一培养基入口1101、第二培养基入口1102以及用于形成浓度梯度培养液的分流通道111。其中,两个培养基入口与分流通道111沿所述诱导芯片1纵长方向依次布设。
更进一步地,所述第一培养基入口1101与第二培养基入口1102呈对称分布状,并分别与所述微量注射泵相连通,以便向所述分流通道111灌入诱导液。
更进一步地,所述分流通道111至少包括依次连通的若干级分流通道,其中,下一级分流通道的入口与上一级分流通道的出口一一对应连通,并且所述下一集分流通道的出口数量比所述上一级分流通道的出口数量多一个。具体如下,第一级分流通道1111提供两个一级入口(未标注)并形成三个一级出口(未标注),所述两个一级入口分别与第一、第二培养基入口1101、1102连通,以便灌入不同浓度或不同成分的诱导液。更优地,所述分流通道111还包括第二级分流通道1112和第三级分流通道1113;所述第二级分流通道1112提供三个二级入口(未标注),并形成四个二级出口(未标注),其中三个所述二级入口分别与三个所述一级出口连通;所述第三级分流通道1113提供四个三级入口(未标注),并形成五个三级出口(未标注),其中四个所述三级入口分别与四个所述二级出口连通,五个所述三级出口并排设置并汇集到所述细胞诱导区域12。
本实施例中,所述分流通道111优选设计三级分流通道,其主要根据需要形成的浓度梯度和诱导液的成分而定,当在不同需求下,按照本实施例对于所述分流通道111的设计方案可增加或减少分流通道的级数,分流通道的级数越多,所形成的浓度梯度的层次越多,相邻浓度值之间的差别越小。所述分流通道增设或减少级数的设计仍为本实施例包括的范围,由于情况过多不可列举,本实施例优选以三级为例说明。
优选地,本实施例中,所述分流通道111包括部分的尺寸如下:
第一培养基入口1101及第二培养基入口1102的直径均为500μm;
第一级分流通道1111、第二级分流通道1112、第三级分流通道1113的宽度以及深度均为100μm。
进一步地,所述细胞诱导区域12呈十字形,其纵向通道顶端与所述分流通道111的末端连接且相通,以便通入不同浓度梯度的诱导液(如图3);其纵向通道底端开设废弃液出口122,主要用于保持通入的培养液及诱导液新鲜度,使废弃液从出口排出;其横向通道两侧对称各开设细胞悬液入口121。
在本实施例中,所述细胞诱导区域12包括的部分的尺寸如下:
纵向通道的宽度为1mm,长度为4mm;
横向通道的宽度为1mm,长度为6.5mm;
纵向通道底端废弃液出口直径为750μm。
在本实施例中,体外肝细胞异质性培养装置采用光刻蚀和铸模技术制作而成,采用的材料为聚二甲基硅氧烷,该装置在体外肝细胞异质性培养前,需进行高压灭菌、消毒烤干的处理。
实施例二
参考图2,对本发明体外肝细胞异质性培养的方法做详细叙述:
肝脏最小结构单位为肝小叶,每个肝小叶由众多条索状的肝板组成,每个肝板中靠近门静脉分支区域的肝细胞称为1区肝细胞21,靠近中央静脉的肝细胞称为3区肝细胞23,两者之间称为2区肝细胞22。不同区域肝细胞在生理功能、代谢能力、对外来物质的敏感性等方面具有不同的特点,这被称为肝细胞异质性。
下面详细阐述利用实施例一的体外肝细胞异质性培养装置进行体外肝细胞异质性培养的方法。
本实施例需使用的器材包括:细胞消化用器材、微量注射泵、注射器、培养皿和玻璃棒,上述器材使用前均在超净台内由紫外照射消毒。
本实施例中,其细胞异质性培养方法具体如下:
将肝细胞悬液加入到所述细胞诱导区域12并等待所述肝细胞贴壁生长;其中,所述肝细胞来源于原代肝细胞。本实施例中,培养所述肝细胞的培养液配方包括DMEM基础培养基、10%胎牛血清、0.5U/ml胰岛素、7ng/ml胰高血糖素、20ng/ml上皮生长因子、7.5μg/ml氢化可的松、200U/ml青霉素、200μg/ml链霉素。其培养后调整所述肝细胞悬液的细胞浓度为1.5×107/ml。进一步地,在所述细胞诱导区域12加入所述肝细胞悬液之前,在37℃条件下用50μg/ml的纤维连接蛋白溶液进行对所述细胞诱导区域12的浸润,具体地,所述浸润时间为45min。进一步地,待肝细胞贴壁生长之后,将所述细胞诱导区域12加入所述肝细胞悬液的入口关闭,所述入口具体为两个所述细胞悬液入口121。
从所述流体分流通道11持续匀速通入不同浓度或不同成分的诱导液,以便诱导形成异质性分布的肝细胞;进一步地,所述诱导液包含WEB培养液,所述WEB培养液包括William’s E基础培养基、4mmol/l谷氨酰胺、200U/ml青霉素和200μg/ml链霉素。
由于肝细胞异质性分布的形成对在体外状态下研究其肝细胞生理功能有着重要的意义,而其中的生理功能主要包括糖代谢、氨代谢、酒精代谢、药物代谢等。下面对用于研究不同生理功能的肝细胞异质性培养所需要的诱导及研究方法进行详细叙述:
用于研究糖代谢和氨代谢的异质性肝细胞的诱导方法为:从所述第一培养基入口1101灌入含胰高血糖素100nmol/l的第一诱导液,并从所述第二培养基入口1102灌入含胰岛素100U/L的第二诱导液,诱导时间为24小时。所述第一诱导液、第二诱导液通过所述分流通道111后形成连续浓度梯度的诱导液(如图3)。
其研究方法为:将诱导后的肝细胞进行糖原染色或者氨甲基磷酸合成酶(CPS1)免疫荧光染色,观察芯片内从左至右肝细胞异质性对糖代谢和氨代谢的影响。
用于研究酒精代谢和药物代谢的异质性肝细胞的诱导方法为:从所述第一培养基入口1101灌入所述WEB培养液,并从所述第二培养基入口1102灌入含2μmol/l的3-甲基胆蒽的第三诱导液,诱导时间为24小时。所述第一培养基入口1101灌入的所述WEB培养液、第三诱导液通过所述分流通道111后形成连续浓度梯度的诱导液(如图3)。
其研究方法为:
(1)两个培养基入口停止通入液体后,吸去残余培养基后,再加入200μmol/l的烯丙醇作用2小时或者10mmol/l的对乙酰氨基酚作用4小时。
(2)检测诱导后的肝细胞四甲基罗丹明甲酯荧光信号观察芯片内从左至右肝细胞异质性对酒精代谢的影响;检测诱导后的肝细胞中的细胞色素氧化酶P450亚家族3A4(CYP3A4)等观察芯片内从左至右肝细胞异质性对药物代谢的影响。
综上所述,本发明的总体设计为,通过传统软光刻及再铸模技术制备聚二甲硅氧烷反应芯片,将使用培养液调整细胞悬液浓度后的肝细胞悬液注入诱导芯片内并房屋细胞培养箱3-4小时等到细胞贴壁后开始加入诱导液进行诱导。诱导液在微量注射泵的作用下,灌入诱导芯片后由于芯片对诱导液流通部分的分流设计,形成浓度梯度,而后持续灌入的诱导液从芯片出口自动导出。从细胞接种开始计时24小时,细胞则完成细胞异质性分布的生长,其后即可采用不用的研究方法对细胞不同的生理功能进行研究。
以上所述仅是本发明的部分实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!