用于快速检测ABCB1基因C3435T多态性的核酸、试剂盒及方法与流程
本发明属于生物技术领域,具体涉及一种用荧光定量PCR技术快速检测ABCB1基因C3435T多态性的核酸、试剂盒及方法。
背景技术:
冠状动脉性心脏病是我国常见的心血管疾病之一。经皮冠状动脉内支架介入治疗(PCI)作为心肌血流重建术中创伤最小的一种方法,能使冠心病人群的长期预后得到较大改善,目前已成为治疗冠心病的重要手段。然而PCI术后易在支架植入处形成血栓,造成不同程度的阻塞,从而导致不稳定心绞痛、急性心肌梗死、甚至猝死等一系列急性并发症。即使未植入支架的冠状动脉在其他病变部位也经常会因粥样硬化的进展引发血栓不良事件。
为预防血栓的形成,在急性冠状综合征(ACS)和PCI术后的病人中目前普遍采用氯吡格雷和阿司匹林双联用的标准抗血小板治疗,以降低心血管事件(死亡、中风、再发心梗)的发生率。然而由于个体对药物的反应存在差异,仍有一部分患者在服用了标准剂量的氯吡格雷之后,仍然发生血栓栓塞等不良的心血管事件,即氯吡格雷抵抗(CR)。
CR的发生是多种因素共同作用的结果,包括遗传变异、与其他药物的相互作用、药物剂量、个体依从性、血小板更新速度、旁路代谢等。氯吡格雷是一种前体药物,必需经过肠内吸收、肝脏代谢才能转变成有活性的药物成分,从而发挥其抗血小板聚集的作用。ABCB1基因编码肠道上皮细胞产生的P糖蛋白(P-gp),P-gp可以直接影响氯吡格雷从消化道进入血液,不同个体间P-gp的差异可能会引起氯吡格雷在不同个体间治疗效果的差异。
ABCB1基因在人类7号染色体上,包含28个外显子,编码一个长度为170KDa的跨膜糖蛋白P-gp。ABCB1基因的C3435T多态性位点,可通过密码子的改变而影响蛋白质的折叠结构,使其对调节分子或底物的亲和力发生变化,从而对药物的代谢产生影响。对氯吡格雷治疗患者的研究发现,ABCB1基因C3435T多态性位点的T等位基因携带者,与主要不良心血管事件(MACE)的发生风险密切相关。同样地,在Tabasson simon的研究中,氯吡格雷的血清浓度和有活性的代谢产物,在该位点的TT基因携带人群中减少。因此通过对ABCB1基因C3435T多态性位点的检测,将更好地为心血管病人提供个体化的抗血小板治疗方案,对预防不良心血管事件具有积极意义。
可用于ABCB1基因多态性检测的技术方法主要有测序法、液相芯片法、溶解曲线法等。DNA测序法虽然是基因分型的金标准,但检测灵敏度低、样品易污染,出现假阳性,实验操作复杂,费时、检测效率低。而熔解曲线法虽然快速简便,但假阳性率高。液相芯片法操作过程复杂,且容易污染,假阳性率高。
技术实现要素:
为克服现有技术检测能力的不足,本发明的目的是提供一组用于快速检测ABCB1基因C3435T多态性的核酸。本发明的另一个目的是提供一种用于快速检测ABCB1基因C3435T多态性的试剂盒及其检测方法。
为实现上述目的,本发明采用以下技术方案:
一组用于快速检测ABCB1基因C3435T多态性的核酸,该核酸包括检测引物和检测探针,其中,所述检测引物包括野生型下游引物、突变型下游引物和公用上游引物,所述野生型下游引物的核苷酸序列如SEQ ID No.1,所述突变型下游引物的核苷酸序列如SEQ ID No.2所示,所述公用上游引物的核苷酸序列如SEQ ID No.3所示,所述检测探针的核苷酸序列如SEQ ID No.4所示。
如上所述的核酸,优选地,所述核酸还包括内部质控,其包括质控引物对和质控探针,所述质控引物对的核苷酸序列如SEQ ID No.5和SEQ ID No.6所示,所述质控探针的核苷酸序列如SEQ ID No.7所示。
如上所述的核酸,优选地,所述核酸还包括野生型阳性对照物、突变型阳性对照物、和/或作为所述内部质控的质控阳性对照物,其中,所述野生型阳性对照物含有如SEQ ID No.8所示的核苷酸序列,所述突变型阳性对照物含有如SEQ ID No.9所示的核苷酸序列,所述质控阳性对照物含有如SEQ ID No.10所示的核苷酸序列。
一种用于快速检测ABCB1基因C3435T多态性的试剂盒,该试剂盒包括如上所述的核酸,其中,所述检测探针和质控探针的5'端连接荧光基团,3'端连接淬灭基团。
如上所述的试剂盒,优选地,所述荧光基团为FAM、JOE、CY3、HEX中任意一种,所述淬灭基团为MGB、BHQ1、TAMRA、BHQ2中任意一种。
如上所述的试剂盒,优选地,试剂盒还包括10×PCR缓冲液、DNA聚合酶、dNTPs、矿物油、阴性对照物:无核酸酶水。
一种快速检测ABCB1基因C3435T多态性的方法,该方法包括以下步骤:
(1)从样品中提取DNA;
(2)对提取的所述DNA,同时进行野生型反应体系和突变型反应体系的实时荧光PCR扩增;其中,在所述野生型反应体系中检测引物对的核苷酸序列如SEQ ID No.1和SEQ ID No.3所示,检测探针的核苷酸序列如SEQ ID No.4所示;在所述突变型反应体系中检测引物对的核苷酸序列如SEQ ID No.2和SEQ ID No.3所示,检测探针的核苷酸序列如SEQ ID No.4所示;所述检测探针的5'端连接荧光基团,3'端连接淬灭基团;
(3)数据采集和分析:将阈值线调整至背景信号及阴性扩增线以上,通过实时荧光PCR仪收集信号,计算所述野生型反应体系和突变型反应体系的△Ct值来确定所述样品DNA的基因型。
如上所述的方法,优选地,在步骤(2)中,所述野生型反应体系和所述突变型反应体系中还包括有作为内部质控的质控引物对和质控探针,所述质控引物对的核苷酸序列如SEQ ID No.5和SEQ ID No.6所示,所述质控探针的核苷酸序列如SEQ ID No.7所示,该质控探针的5'端连接有不同于所述检测探针的荧光基团,3'端连接有不同于所述检测探针的淬灭基团。
如上所述的方法,优选地,在步骤(2)中,在各自的所述野生型反应体系和所述突变型反应体系中,各条引物和各条探针的终浓度均为100-1000nmol/L;所述荧光基团为FAM、JOE、CY3、HEX中任意一种,所述淬灭基团为MGB、BHQ1、TAMRA、BHQ2中任意一种。
如上所述的方法,优选地,步骤(2)中,所述实时荧光PCR扩增的反应程序为:
第一阶段:95℃5min;
第二阶段:95℃5s,58℃30s,10个循环;
第三阶段:95℃5s,58℃30s,72℃30s,35个循环;
信号收集:第三阶段72℃时收集荧光信号。
如上所述的方法,优选地,在步骤(2)中,在各自所述野生型反应体系和所述突变型反应体系中,所述野生型引物对的终浓度均为200nmol/L,所述突变型引物对的终浓度均为200nmol/L,所述检测探针的终浓度为150nmol/L,所述质控引物对的终浓度均为150nmol/L,所述质控探针的终浓度为100nmol/L;所述检测探针的5'端连接FAM,3'端连接MGB,所述质控探针的5'端连接JOE,3'端连接BHQ1。
如上所述的方法,优选地,在所述步骤(3)中,检测样本的所述内部质控的JOE信号应达到设定阈值Ct值小于25,再确定所述样本DNA的基因型;否则应重新进行检测;
确定所述样品DNA的基因型,按照以下公式进行计算:
-2.5≤ΔCt=野生型Ct值-突变型Ct值≤2.5,判定为杂合型样本;
ΔCt=突变型Ct值-野生型Ct值>2.5,判定为野生型样本;
ΔCt=野生型Ct值-突变型Ct值>2.5,判定为突变型样本。
如上所述的方法,优选地,在步骤(2)中,还设有阳性对照和阴性对照,所述阳性对照为以含有如SEQ ID No.8核苷酸序列所示的野生型阳性对照物、含SEQ ID No.9核苷酸序列所示的突变型阳性对照物、和/或含有如SEQ ID No.10核苷酸序列所示的质控阳性对照物为模板,进行所述野生型反应体系和突变型反应体系的实时荧光PCR扩增;所述阴性对照为以水为模板,进行所述野生型反应体系和突变型反应体系的实时荧光PCR扩增;
在步骤(3)中,所述阳性对照的野生型反应体系和突变型反应体系的FAM均有明显的扩增曲线,和/或JOE有明显的扩增曲线且JOE信号的Ct值≤25,符合要求;所述阴性对照的野生型反应体系和突变型反应体系的FAM、JOE均没有明显的扩增曲线,符合要求;否则,应重新进行检测。
本发明提供了一组用于快速检测ABCB1基因C3435T位点多态性的核酸,同时建立了一种比较高效、灵敏的ABCB1基因C3435T多态性位点的检测试剂盒及快速检测方法。其检测试剂盒,使用方便,操作简便,自动化程度高,大大简化了操作过程,并减少了在操作过程的污染,检测效果好,具有高灵敏度、高特异性、高准确度、高精确度的特点。提供的检测方法采用完全闭管操作,操作简单、方便快捷、通过直接探测PCR过程中荧光信号值的获得检测的结果,不需要PCR后处理或电泳检测,克服了常规PCR技术的易污染、出现假阳性,能有效避免非特异性扩增难题,并且适合大批量样本的检测。
本发明提供的检测试剂盒及方法,用于检测ABCB1基因C3435T多态性位点时,为了避免漏检、及初步判断样本DNA量是否在允许范围内,设有内部质控,为了判断检测体系是否正常,还设有阴性对照和检测引物的阳性对照;为了避免假阴性及漏检,设有野生型、突变型和内部质控的阳性对照,其阳性对照检测呈阳性结果,说明检测体系没有问题,不会出现假阴性结果及漏检,如阳性对照检测呈阴性结果,说明检测体系有问题,或试剂已经失效,应重新配置体系进行检测;为了避免假阳性及漏检,设有阴性对照,其阴性对照检测呈阴性结果,说明检测体系没有问题,不会出现假阳性结果及漏检,如阴性对照检测呈阳性结果,说明检测体系有问题,已被污染,应重新配置体系进行检测;本发明提供检测试剂盒及方法设计严谨,有效避免漏检、错检的可能。
与现有技术相比,本发明运用ARMS引物区分野生型和突变型基因,进而设计的引物、探针及由其构成的试剂盒,还有如下有益效果和显著进步:
(1)灵敏度高,可以准确检出低至10copies/μL基因的稳定检出,检测结果可信。
(2)特异性强,对于高至200ng的基因组DNA不会出现非特异性的结果,可以减少稀释样本的过程。
(3)成本低,ARMS分型法相对于Taqman探针分型法,不仅能保留Taqman的高灵敏度和高特异性,而且还能节约成本,ARMS引物合成快速简单,合成成本低,扩增效果更佳。
(4)检测速度快,整个检测过程只需要90分钟。
(5)应用Fast master Premix预混在反应体系中,减少了酶与样本混合的步骤,减少了样本的污染,操作更简单,一步加样,避免了气溶胶污染引起的假阳性。
(6)安全:整个试剂盒不包含有毒有害物质,对操作人员和环境无危害。
总之,本发明涉及的ABCB1基因多态性检测试剂盒适用于临床多种样本类型选择,具有特异性强,灵敏度高,实验周期短,操作简单,安全无毒,成本低等显著优点。
附图说明
图1为本发明优选地试剂盒中野生型体系检测灵敏度的扩增曲线。
图2为本发明优选地试剂盒中突变型体系检测灵敏度的扩增曲线。
图3为本发明优选地试剂盒对实施例6中DTA抗凝的全血提取的ABCB1C3435T突变型基因组DNA样本的扩增曲线。
图4为本发明优选地试剂盒对实施例6中DTA抗凝的全血提取的ABCB1C3435T杂合型基因组DNA样本的扩增曲线。
图5为本发明优选地试剂盒对实施例6中DTA抗凝的全血提取的ABCB1C3435T野生型基因组DNA样本的扩增曲线。
图6为本发明优选地试剂盒中A1和A2体系的杂合样本上样量扩增曲线。其中,图1-5中W表示野生型,M表示突变型,WM表示杂合型。
具体实施方式
以下结合具体实例对本发明做进一步详细说明,并非对本发明的限定,本发明的实施方式并不限于此,本发明提供的核苷酸序列的互补序列也可实现本发明,如无特殊说明,所用试剂为常规试剂,因此凡依照本公开内容所作出的本领域的等同替换,均属于本发明的保护范围。
实施例1引物、探针、验证模板设计
本发明所选的引物针和探针针对ABCB1基因C3435T位SNP位点设计。引物及探针使用的具体原理是:针对突变位点分别设计野生型和突变型ARMS引物和Taqman探针,结合荧光定量PCR反应,对从人外周血细胞提取的基因组DNA进行检测,通过实时荧光PCR仪上收集信号,计算野生型和突变型的△Ct值来确定样本DNA的基因型。
经过试验验证,最终确定检测ABCB1基因C3435T多态性位点的特异性检测引物包括野生型下游引物(ABCB1-RW)、突变型下游引物(ABCB1-RM)、公用上游引物(ABCB1-F)和公用检测探针(ABCB1-P),核苷酸序列如下:
ABCB1-RW(SEQ ID No.1):
5’-TCCTTTGCTGCCCTCTCG-3’;
ABCB1-RM(SEQ ID No.2):
5’-CCTCCTTTGCTGCCCTCATA-3’;
ABCB1-F(SEQ ID No.3):
5’-TCGTGTCCCAGGAGCCC-3’;
ABCB1-P(SEQ ID No.4):
5’-CCTGTGACACCACCC-3’。
野生型下游引物与公用上游引物扩增的PCR产物可作为野生型阳性模板,其核苷酸序列如SEQ ID No.8所示的序列,而包含如SEQ ID No.8所示的序列即可作为野生型阳性对照物;突变型下游引物与公用上游引物扩增的PCR产物可作为突变型阳性模板,其核苷酸序列如SEQ ID No.9所示的序列,而包含如SEQ ID No.9所示的序列即可作为突变型阳性对照物,序列如下:
SEQ ID No.8:
5’-TCGTGTCCCAGGAGCCCATCCTGTTTGACTGCAGCATTGCTGAGAACATTGCCTATGGAGACAACAGCCGGGTGGTGTCACAGGAAGAGATTGTGAGGGCAGCAAAGGA-3’;
SEQ ID No.9:
5’-TCGTGTCCCAGGAGCCCATCCTGTTTGACTGCAGCATTGCTGAGAACATTGCCTATGGAGACAACAGCCGGGTGGTGTCACAGGAAGAGATCGTGAGGGCAGCAAAGGAGG-3’。
进一步,为了对实时荧光PCR反应体系和实验操作过程进行内部质控,同时检测样本的质量,避免漏加检测样本,本发明选用的内部质控为NCBI数据库中基因序列编号NM_000927.4第3578到3775位进行设计引物与探针,这段序列是ABCB1基因第25外显子上的一段序列,与目的基因是同一个基因,不仅可以作为试剂盒的质控,还可以作为样本DNA的质控,保证提取出来的DNA包含ABCB1基因,可以排除其他序列的非特异交叉反应,同时它也不会对目的基因产生交叉反应,确保试剂盒的准确性通过对内部质控的质控引物对、质控探针的筛选和体系优化,建立了实时荧光PCR内部质控检测体系,优选地,质控引物对(IC-F、IC-R)、质控探针(IC-P)如下:
IC-F(SEQ ID No.5):5’-ACTGAGCCTGGAGGTGAAGAAG-3’;
IC-R(SEQ ID No.6):5’-CCTGCCAAGGGGTCGTAGA-3’;
IC-P(SEQ ID No.7):5’-CTGTGGGAAGAGCACAGTGGTCCAGC-3’。
作为内部质控的质控引物对进行PCR扩增时,其扩增序列的大小为111bp,将扩增序列作为内部质控阳性对照物,即包含如SEQ ID No.10所示序列,作为验证是否漏加检测样品的质控阳性对照物,SEQ ID No.10:
5’-ACTGAGCCTGGAGGTGAAGAAGGGCCAGACGCTGGCTCTGGTGGGCAGCAGTGGCTGTGGGAAGAGCACAGTGGTCCAGCTCCTGGAGCGGTTCTACGACCCCTTGGCAGG-3’。
实施例2采用实时荧光PCR检测ABCB1基因C3435T多态性位点的方法
根据实施例1筛选设计的野生型上游引物、突变型上游引物、公用下游引物和公用检测探针进行合成,可在公用检测探针的5'端连接荧光基团,3'端连接淬灭基团,其中,荧光基团为FAM、JOE、CY3、HEX中任意一种,所述淬灭基团为MGB、BHQ1、TAMRA、BHQ2中任意一种。
应用本发明设计的野生型引物对、突变型引物对及公用检测探针,对检测样品的DNA模板,进行ABCB1基因C3435T多态性位点的实时荧光PCR扩增检测,采用野生型反应体系和突变型反应体系,均用40μL反应体系,其中30μL的反应体系如表1配置,再加入10μL待测样品DNA后,进行实时荧光PCR扩增;
表1 PCR反应液配置
应用Fast master premix预混在反应体系中,一步加样,无需将样本与酶混合,减少了酶与样本混合的步骤,减少了样本的污染,操作更简单。
第一阶段:95℃5min;
第二阶段:95℃5s,58℃30s,10个循环;
第三阶段:95℃5s,58℃30s,72℃30s,35个循环;
第三阶段:35个循环时,收集荧光信号。
结果分析:将阈值线调整至背景信号及阴性扩增线以上,再根据荧光定量PCR仪器,得到样本的突变型Ct值和野生型Ct值,通过差值判断检测样品的基因型。
将ABCB1基因的C3435T位点的野生型阳性对照物和突变型阳性对照物进行上述实时荧光PCR扩增反应时,结果显示,所设计的检测引物及反应体系可有效扩增出ABCB1基因的C3435T位点的野生型和突变型。
对样品进行检测时,避免漏检,如避免有的反应孔中未加检测样本的情况出现,在每个反应孔中设置有内部质控,应当注意的是公用检测探针与质控探针荧光基团标记为不同检测模式的荧光基团。具体的实时荧光PCR扩增反应体系组成按表1配置。对于人血液样品或咽拭子样品的DNA检测时,质控探针的信号有明显的扩增曲线。
其中,在探针合成时,探针与荧光和淬灭基团相连,检测探针的荧光-淬灭基团为优选为FAM-MGB,质控探针的荧光-淬灭基团优选为JOE-BHQ1,此时,FAM是检测信号,用于检测样本的基因多态性,通过反应体系的突变型和野生型FAM信号的荧光强度差异来判断检测结果;JOE是内控信号,用于检测体系是否正常,样本是否漏加及初步判断样本DNA量是否在允许范围内,JOE信号应达到设定阈值(Ct值小于25);在内控信号达到要求后,以SNP位点的突变型和野生型FAM信号达到设定阈值所需的循环次数Ct值的差值作为判断标准。具体如下:△Ct=|野生型Ct值-突变型Ct值|≤2.5为杂合型样本,△Ct=野生型Ct值-突变型Ct值>2.5为突变型样本,△Ct=突变型Ct值-野生型Ct值>2.5为野生型样本。
当然,检测探针和质控探针采用其它荧光-淬灭基团组合也同样适用,比如,HEX-BHQ1、HEX-TAMRA、FAM-TAMRA、FAM-BHQ1、CY3-BHQ1、CY3-BHQ2等,检测时选择相应的荧光检测模式。
上述实时荧光PCR反应可使用的仪器包括ABI实时PCR系统(例如7000,7300,7500,7900等);BioRad实时PCR检测系统、Stratagene定量多聚酶链反应仪(例如MX4000,MX3000,MX3005)。
实施例3用于检测ABCB1基因C3435T多态性位点的试剂盒
用于快速检测ABCB1基因C3435T多态性位点的实时荧光PCR试剂盒包括以下成分:
野生型下游引物:核苷酸序列如SEQ ID No.1所示;
突变型下游引物:核苷酸序列如SEQ ID No.2所示;
公用上游引物:核苷酸序列如SEQ ID No.3所示
公用检测探针:核苷酸序列如SEQ ID No.4所示,所述公用检测探针的5'端连接荧光基团,3'端连接淬灭基团;
野生型阳性对照物:含有如SEQ ID No.8所示的核苷酸序列;
突变型阳性对照物:含有如SEQ ID No.9所示的核苷酸序列。
为了避免漏检,错检,还包括:作为内部质控的质控引物对、质控探针和质控阳性对照物,
其中,质控引物对的核苷酸序列如SEQ ID No.5和SEQ ID No.6所示,质控探针的核苷酸序列如SEQ ID No.7所示,该质控探针的5'端连接有不同于所述公用检测探针的荧光基团,3'端连接有不同于所述公用检测探针的淬灭基团,质控阳性对照物含有如SEQ ID No.10所示的核苷酸序列。
为了防止反应体系在PCR扩增过程中挥发,影响检测效果,试剂盒还包括有矿物油。
为了便于反应体系的配置,试剂盒还包括10×PCR缓冲液、DNA聚合酶、dNTPs、阴性对照物:无核酸酶水。其中DNA聚合酶可采用Fast master premix,采用ABI(美国应用生物系统公司);10×PCRbuffer(Mg2+Plus)采用TaKaRa宝生物工程(大连)有限公司,也可应用市场上其他公司的缓冲液与DNA聚合酶。
实施例4检测试剂盒的制备
本实施例的试剂盒是在实施例3的基础上,制备成可以直接加入检测样品后,进行检测的试剂盒。该试剂盒有ABCB1 8联PCR反应条以及ABCB1阳性对照物组成,各成分如表2所示,反应液的配置见表3。每条ABCB1 8联PCR反应条的奇数管(1/3/5/7或A/C/E/G)对应检测体系为A1反应液,检测ABCB1C3435T野生型;偶数管(2/4/6/8或B/D/F/H)对应的检测体系为A2反应液,检测ABCB1C3435T突变型。每管主要成分为特异性引物、荧光探针和PCR反应液等,其中公共检测探针的5'端连接FAM,3'端连接MGB,则检测样品信号类型为FAM信号和内部质控的质控探针5'端连接JOE,3'端连接BHQ1,内部质控为JOE信号(内控作为对试剂盒、DNA质量以及操作本身的质控);检测引物、公用检测探针、质控引物对和质控探针可委托上海英俊生物技术有限公司合成。
表2试剂盒组成
表3各PCR反应液配置
在本实施例中Fast master premix,购自ABI(美国应用生物系统公司);该mix中已经含有DNA聚合酶,试剂盒的组份中由于采用这种mix,使用时不再需要先将酶和样本混合后再加入体系,而只需要加入待测样本,操作更简单快捷,省时的同时避免了样本长时间操作而导致的气溶胶污染。10×PCR buffer(Mg2+Plus)购自TaKaRa宝生物工程(大连)有限公司。实施例5:检测实施例4中制备的试剂盒的灵敏度、精密度和特异性
(1)灵敏度实验
ABCB1重组质粒购自南京金斯瑞生物科技有限公司,以现有基因工程技术人工合成的ABCB1基因C3435T多态性位点含有SEQ ID NO.8所示序列为野生型质粒,含有SEQ ID NO.9所示序列为突变型质粒,人工合成含有SEQ ID NO.10所示序列为内控质粒。各质粒干粉用TE(10mmol/L,PH8.0)复溶,定量后稀释。
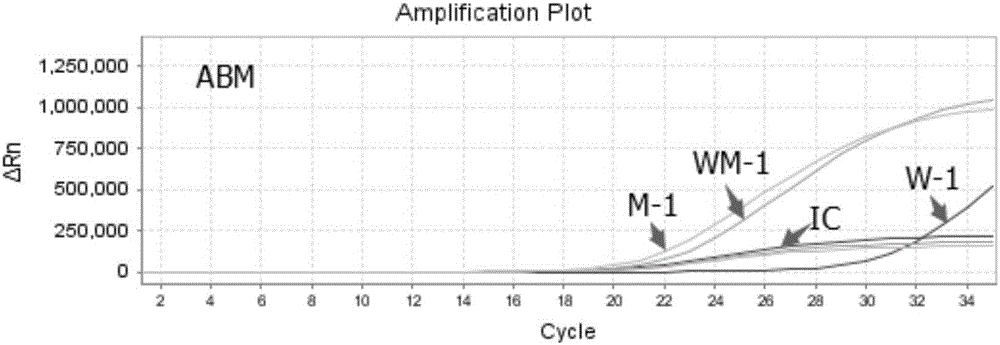
取2×101copies/μL的野生型质粒(W)和内控质粒(M)1:1混合,配置成终浓度为10copies/μL的ABW-1参考品;取2×101copies/μL的突变型质粒和内控质粒1:1混合,配置成终浓度为10copies/μL的ABM-1参考品;取2×101copies/μL的野生型质粒、突变型质粒、内控质粒(IC)1:1:2体积比混合,配置成终浓度为10copies/μL的ABWM-1杂合参考品,以这三种参考品为模板,在实施例4中制备A1(ABW)和A2(ABM)体系中分别进行实时荧光PCR扩增反应。扩增反应的程序采用实施例2中方法,具体结果见图1和图2所示。检测结果表明,本发明的荧光PCR方法灵敏度高,10copies/μL浓度的三种基因型DNA在两种体系中均可检出,能有效避免假阴性。
实施例6:用本发明制备的试剂盒检测临床样本中的ABCB1的C3435T多态性
本实施例是从湖北省人民医院采集的临床样本84例EDTA抗凝血中提取基因组DNA,并对其进行定量,作为PCR检测的模板。采用天根(QIAGEN)公司的血液基因组DNA提取试剂盒,具体操作详见说明书。最后将提取的DNA用紫外分光光度计进行定量,稀释DNA浓度到2ng/μL。
采用实施例4制备的试剂盒,具体检测方法如下:
(1)每次PCR反应中,同时进行非模板对照(NoTemplate Control;NTC,本实施例用超纯水)、阳性对照和待测样本的检测。
(2)将阳性对照取出解冻后震荡混匀,并离心30s。
(3)将8联PCR反应条取出解冻后离心30s,防止反应液在开盖时溅出。
(4)将超纯水(NTC)、待测样本、阳性对照分别加入A1反应液和A2反应液中,每孔10μL。
(5)将以上8联PCR反应条盖好管盖于离心机上离心30S,确保管壁上不沾有液滴。
(6)将8联PCR反应条放于实时PCR仪器中。
反应条件的设置:
第一阶段:95℃5min;
第二阶段:95℃5s,58℃30s,10个循环;
第三阶段:95℃5s,58℃30s,72℃30s,35个循环;
信号收集:第三阶段72℃时收集FAM和JOE信号。
检测结果时,先判断阳性对照的野生型反应体系和突变型反应体系的FAM均有明显的扩增曲线,JOE有明显的扩增曲线且JOE信号的Ct值≤25,符合要求;所述阴性对照的野生型反应体系和突变型反应体系的FAM、JOE均没有明显的扩增曲线,符合要求;否则,应重新进行检测。对于检测样本时,FAM是检测信号,用于检测样本的基因多态性,通过反应体系的突变型和野生型FAM信号的荧光强度差异来判断检测结果;JOE是内控信号,用于检测体系是否正常,样本是否漏加及初步判断样本DNA量是否在允许范围内,JOE信号应达到设定阈值(CT值小于25);在内控信号达到要求后,以SNP位点的突变型和野生型FAM信号达到设定阈值所需的循环次数CT值的差值作为判断标准。△Ct=|野生型CT值-突变型CT值|≤2.5为杂合型样本,△Ct=野生型CT值-突变型CT值>2.5为突变型样本,△Ct=突变型CT值-野生型CT值>2.5为野生型样本,样本结果判定具体见表4。
表4 ABCB1基因多态性检测结果判定
利用本发明方法对湖北省人民医院采集的临床84例样本提取的DNA进行检测,其检测结果如下表5,样本的扩增曲线图此处不再全部例出,仅例出代表的三个样品的扩增曲线图,具体如图3、图4、图5所示。
表5 84例样本的DNA ABCB1C3435T多态性检测结果
同时将84例样本DNA采用Sanger金标准(武汉艾康健公司测序)进行测序检测,将两者的检测能力进行比较,结果见表6。EDTA抗凝血提取的基因组DNA用本发明的试剂盒检测的结果和“金标准”sanger测序的结果完全一致,说明本发明制备的试剂盒准确度高,操作简单、耗时短。
表6本发明检测结果和sanger测序金标准比较
实施例7本发明试剂盒及方法对样本上样量的检测
本实施例为采用本发明所提供的引物、探针扩增实施例6所提取的湖北省人民医院的临床血液DNA样品,根据定量结果将样本分别稀释到20ng/μL、10ng/μL、1ng/μL、0.1ng/μL,按照实施例2中的方法进行实时荧光PCR扩增反应。杂合样本在A1和A2体系中上样总量分别为200ng、100ng、10ng、1ng时的扩增曲线见图6。结果说明对于高至200ng的基因组DNA不会出现非特异性的结果,可以减少稀释样本的过程。
以上所述实施例仅是为充分说明本发明而所举的较佳的实施例,本发明的保护范围不限于此。本技术领域的技术人员在本发明基础上所作的等同替代或变换,均在本发明的保护范围之内。
SEQUENCE LISTING
<110> 武汉海吉力生物科技有限公司
<120> 用于快速检测ABCB1基因C3435T多态性的核酸、试剂盒及方法
<130>
<160> 10
<170> PatentIn version 3.5
<210> 1
<211> 18
<212> DNA
<213> 人工合成
<400> 1
tcctttgctg ccctctcg 18
<210> 2
<211> 20
<212> DNA
<213> 人工合成
<400> 2
cctcctttgc tgccctcata 20
<210> 3
<211> 17
<212> DNA
<213> 人工合成
<400> 3
tcgtgtccca ggagccc 17
<210> 4
<211> 15
<212> DNA
<213> 人工合成
<400> 4
cctgtgacac caccc 15
<210> 5
<211> 22
<212> DNA
<213> 人工合成
<400> 5
actgagcctg gaggtgaaga ag 22
<210> 6
<211> 19
<212> DNA
<213> 人工合成
<400> 6
cctgccaagg ggtcgtaga 19
<210> 7
<211> 26
<212> DNA
<213> 人工合成
<400> 7
ctgtgggaag agcacagtgg tccagc 26
<210> 8
<211> 109
<212> DNA
<213> 人工合成
<400> 8
tcgtgtccca ggagcccatc ctgtttgact gcagcattgc tgagaacatt gcctatggag 60
acaacagccg ggtggtgtca caggaagaga ttgtgagggc agcaaagga 109
<210> 9
<211> 111
<212> DNA
<213> 人工合成
<400> 9
tcgtgtccca ggagcccatc ctgtttgact gcagcattgc tgagaacatt gcctatggag 60
acaacagccg ggtggtgtca caggaagaga tcgtgagggc agcaaaggag g 111
<210> 10
<211> 111
<212> DNA
<213> 人工合成
<400> 10
actgagcctg gaggtgaaga agggccagac gctggctctg gtgggcagca gtggctgtgg 60
gaagagcaca gtggtccagc tcctggagcg gttctacgac cccttggcag g 111
- 还没有人留言评论。精彩留言会获得点赞!