具有溶菌酶活性的多肽和编码所述多肽的多核苷酸的制作方法
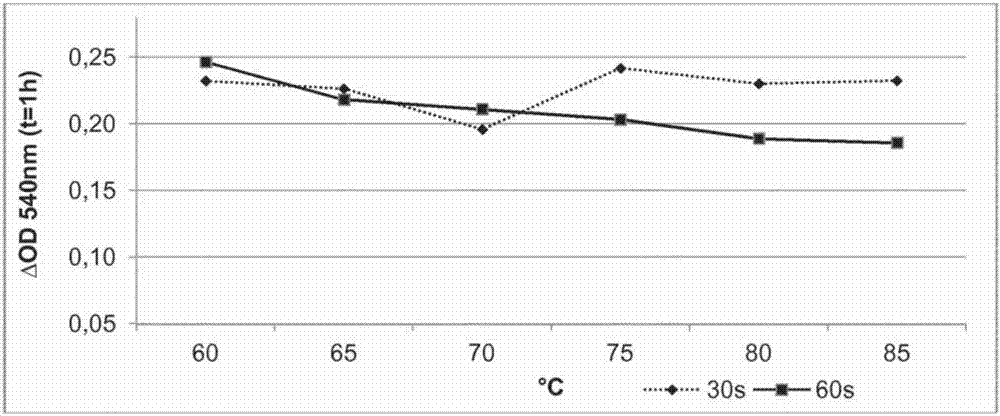
本申请是2014年5月26日提交到中华人民共和国国家知识产权局的发明名称为“具有溶菌酶活性的多肽和编码所述多肽的多核苷酸”、申请号为“201280058088.1”的发明专利申请的分案申请。参考序列表本申请包含一个计算机可读形式的序列表,将其通过引用结合在此。原子坐标的引用本申请将acremoniumalkalophilumcbs114.92溶菌酶的三维结构的原子坐标列于图6中。发明背景发明领域本发明涉及具有溶菌酶活性的多肽、催化结构域以及编码这些多肽和催化结构域的多核苷酸。本发明还涉及核酸构建体、载体以及包括这些多核苷酸的宿主细胞连同生产和使用这些多肽和催化结构域的方法。相关技术说明溶菌酶是一种由许多生物作为对抗细菌的防御性机制而产生的o-糖基水解酶。该酶通过裂解肽聚糖的糖苷键来水解细菌的细胞壁;肽聚糖是细菌中的一种重要的结构分子。在细菌的细胞壁被溶菌酶作用弱化后,由渗透压导致细菌细胞溶解。溶菌酶出现在许多生物中,例如病毒、植物、昆虫、鸟类、爬行类以及哺乳类。在哺乳类中,已经从鼻腔分泌物、唾液、眼泪、肠、尿和乳中分离到溶菌酶。该酶裂解n-乙酰胞壁酸的1号碳与n-乙酰-d-葡糖胺的4号碳之间的糖苷键。在体内,这两种碳水化合物聚合以形成细胞壁多糖。在溶菌酶作为抗微生物剂的潜力方面的兴趣日益增加。例如,已经显示溶菌酶活性对抗病原体,如肺炎链球菌、炭疽杆菌、屎肠球菌、嗜热脂肪芽孢杆菌、肉毒杆菌、丁酸梭菌、产气荚膜梭菌、生孢梭菌(clostridiumsporogenes)、酪丁酸梭菌、以及单核细胞增生利斯特菌。已经将溶菌酶分类为五种不同的糖苷水解酶(gh)家族(cazy,www.cazy.org):母鸡蛋白溶菌酶(gh22),鹅蛋白溶菌酶(gh23),噬菌体t4溶菌酶(gh24),鞘氨醇单胞菌鞭毛蛋白(gh73)以及chalaropsis溶菌酶(gh25)。来自家族gh23和gh24的溶菌酶主要从噬菌体中已知并且还未在真菌中鉴别。已经发现溶菌酶家族gh25与其他溶菌酶家族在结构上是不相关的。已经提出了溶菌酶在动物饲料(参见例如wo00/21381和wo04/026334),在乳酪生产(参见例如wo05/080559)、食品保藏(hughey(休伊)和johnson(约翰逊)(1987)applenvironmicrobiol(《应用与环境微生物学》)53:2165)、洗涤剂(参见例如us5,041,236和ep0425016),在口腔护理(参见例如us4,355,022、wo04/017988和wo08/124764)、美容和皮肤学、避孕、泌尿学、以及妇科(参见例如wo08/124764)中的用途。已经从拟鞘孢属(chalaropsis)报道了一种gh25溶菌酶(felsch(费什)jw,ingagami(英戈米)t,和hash(哈什)jh.(1975),“then,o-diacetylmuramidaseofchalaropsisspecies;vthecompleteaminoacidsequence(chalaropsis物种的n,o-二乙酰胞壁质酶;v,完整氨基酸序列),j.biol.chem.(《生物化学杂志》)250(10):3713-3720)。作为在商业市场可获得的主要产品的母鸡蛋白溶菌酶不裂解例如金黄色葡萄球菌细胞壁中的n,6-o-二乙酰胞壁质酶并且因此尤其不能溶解这一重要的人类病原体(masschalck(马斯克)b,deckers(德克斯)d,michiels(米盖尔思)cw(2002),“lyticandnonlyticmechanismofinactivationofgram-positivebacteriabylysozymeunderatmosphericandhighhydrostaticpressure(在大气压和高流体静力压下由溶菌酶灭活革兰氏阳性细菌的溶解和非溶解机制)”,jfoodprot.(《食品保护杂志》)65(12):1916-23)。已经观察到不同的溶菌酶针对不同微生物具有不同的特异性。所以,令人希望的是使得若干溶菌酶可得,以便能够针对每种具体的应用选择适合的酶。所以,具有溶菌酶活性的新的多肽是令人希望的。发明概述本发明涉及属于gh25家族并且具有溶菌酶活性的分离的真菌多肽。本发明进一步涉及具有溶菌酶活性的分离的多肽,这些多肽选自下组,该组由以下各项组成:(a)与seqidno:4的成熟多肽或与seqidno:8的成熟多肽具有至少80%序列一致性的一种多肽;(b)由以下一种多核苷酸编码的一种多肽,该多核苷酸与seqidno:3的成熟多肽编码序列或与seqidno:7的成熟多肽编码序列具有至少80%序列一致性;(c)由以下一种多核苷酸编码的一种多肽,该多核苷酸在中-高严谨度条件下与seqidno:3或seqidno:7的成熟多肽编码序列、或其全长互补体杂交;(d)seqidno:4或seqidno:8的成熟多肽的一种变体,该变体在一个或多个(例如,若干个)位置处包括取代、缺失和/或插入;以及(e)具有溶菌酶活性的(a)、(b)、(c)、或(d)的多肽的一个片段。本发明还涉及编码本发明的多肽的分离的多核苷酸;核酸构建体;重组表达载体;包括这些多核苷酸的重组宿主细胞;以及产生这些多肽的方法。此外,本发明涉及包括本发明的多肽的组合物,例如洗涤剂组合物、动物饲料组合物以及细菌的基因组dna提取组合物。本发明还涉及具有抗微生物活性的本发明的多肽以及将本发明的这些多肽用作生物膜形成的抑制剂,在洗涤剂、在牙齿护理、在动物饲料中使用并且用于分解细菌的细胞壁的方法。本发明还涉及一种编码信号肽的多核苷酸,该信号肽包括seqidno:4的氨基酸1至19或seqidno:8的氨基酸-23至-1或由其组成,该多核苷酸被可操作地连接至编码一种蛋白质的基因;涉及核酸构建体、表达载体、以及包括这些多核苷酸的重组宿主细胞;以及涉及产生一种蛋白质的方法。序列表综述seqidno:1是如从acremoniumalkalophilumcbs114.92中分离的p244a7gh24基因的dna序列。seqidno:2是如从seqidno:1推导的氨基酸序列。seqidno:3是如从acremoniumalkalophilumcbs114.92中分离的p242m9gh25基因的dna序列。seqidno:4是如从seqidno:3推导的氨基酸序列。seqidno:5是正向引物f-p242m9。seqidno:6是反向引物r-p242m9。seqidno:7是合成地优化的gh25基因的dna序列。seqidno:8是如从seqidno:7推导的氨基酸序列。seqidno:9是正向引物bamhi。seqidno:10是反向引物ecori。附图简要说明图1示出了acremoniumalcalophilumgh24溶菌酶(exp03890,seqidno:2)、acremoniumalcalophilumgh25溶菌酶(exp03864,seqidno:4)以及一种来自烟曲霉gh25的参考溶菌酶在肉葡萄球菌和大肠杆菌上的径向扩散测定(radialdiffusionassays)。图2示出了acremoniumalcalophilumgh25溶菌酶p242m9(seqidno:4)在30或60秒钟后在60℃、76℃、70℃、75℃、80℃以及85℃下的温度稳定性,如在540nm在分光光度计中所测量的重悬滕黄微球菌attcno.4698的溶液的光密度下降。图3示出了gh25溶菌酶p242m9(seqidno:4)在50mm乙酸钠(ph4.5)、50mm乙酸钠(ph5.5)以及50mmmes(2-(n-吗啉代)乙磺酸)(ph6.5)中如使用差示扫描量热法(dsc)所确定的热稳定性。图4示出了4个浓度的gh25溶菌酶p242m9(seqidno:4)、合成gh25溶菌酶(seqidno:8)以及seqidno:8的11个变体的溶菌酶活性,如通过重悬产气荚膜梭菌nn01260的溶液的光密度下降所确定的。图5示出了4个浓度的gh25溶菌酶p242m9(seqidno:4)、合成gh25溶菌酶(seqidno:8)以及seqidno:8的11个变体的溶菌酶活性,如通过重悬产气荚膜梭菌临床分离株的溶液的光密度下降所确定的。图6列出了acremoniumalkalophilumcbs114.92gh25溶菌酶的三维结构的原子坐标。这些原子坐标可以协助生成描绘acremoniumalkalophilumcbs114.92gh25溶菌酶的结构的三维模型以及同源结构(例如上述溶菌酶的变体)的三维模型。定义溶菌酶:在此将术语“溶菌酶”活性定义为一种催化两个或更多个碳水化合物之间、或碳水化合物与非碳水化合物部分之间的糖苷键的水解的o-糖基水解酶。溶菌酶裂解细菌细胞壁的黏多糖和黏肽中的某些残基之间的糖苷键,例如在肽聚糖中的n-乙酰胞壁酸与n-乙酰-d-葡糖胺残基之间以及在壳糊精中的n-乙酰-d-葡糖胺残基之间的1,4-β-键,这导致溶菌作用。溶菌酶属于ec3.2.1.17酶类。出于本发明的目的,根据描述于实例4中的浊度测定确定溶菌酶活性。在一个方面中,本发明的多肽具有至少20%,例如至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、或至少100%的seqidno:4或seqidno:8的成熟多肽的溶菌酶活性。等位变体:术语“等位变体”是指占据同一染色体基因座的基因的两种或更多种可变形式中的任何。等位基因变异由突变天然产生,并且可以导致群体内的多态性。基因突变可以是沉默的(编码的多肽中无改变),或可以编码出具有改变的氨基酸序列的多肽。多肽的等位变体是由基因的等位变体编码的多肽。抗微生物活性:在此将术语“抗微生物活性”定义为一种杀死微生物或抑制微生物的生长的活性,这些微生物是例如藻类、古细菌、细菌、真菌和/或原生动物。抗微生物活性可以是例如意在杀死细菌的杀菌的或意在阻止细菌的生长的抑菌的。抗微生物活性可以包括催化在肽聚糖中的n-乙酰胞壁酸与n-乙酰-d-葡糖胺残基之间以及在壳糊精中的n-乙酰-d-葡糖胺残基之间的1,4-β-键的水解。抗微生物活性还可以包括溶菌酶结合在微生物的表面并抑制其生长。抗微生物作用还可以包括通过抑制或减少细菌毒素并且通过噬菌素作用使用本发明的溶菌酶作为免疫刺激剂激活细菌自溶素。出于本发明的目的,根据描述于实例10中的抗微生物测定确定抗微生物活性。改变的/修饰的特性:在此将“改变的/修饰的特性”定义为与相对于亲本溶菌酶或鉴别的参考序列相比被改变或修饰的变体相关的特征。除非另行说明,改变的或修饰的特性可以是一种与相对于另一种参考溶菌酶或亲本溶菌酶被改进的变体相关的特征。下面给出了可以被改变/修饰或改进的特性的实例。热稳定性:术语“热稳定性”是指相对于亲本或鉴别的参考序列在升高的温度下,在缓冲液中或在例如在产品储存/运输过程中存在的那些条件下或类似于在工业使用该变体的过程中存在的那些条件下,在一段孵育期后的溶菌酶活性。变体可以或可以不展示出相对于亲本的改变的热活性曲线。在一个方面中,在选定的温度下,具有溶菌酶活性的变体的热稳定性是亲本或参考序列热稳定性的至少1.0倍,例如至少1.1倍、至少1.5倍、至少1.8倍、至少2倍、至少5倍、至少10倍、至少15倍、至少20倍、以及至少25倍。优选地,使用描述于“材料与方法”部分中的溶菌酶浊度活性测定测试该活性。温度曲线/温度稳定性:术语“温度曲线/温度稳定性”是指与亲本或鉴别的参考序列相比,该变体酶显示出改变的温度曲线,其中将该温度曲线确定为作为温度的函数的溶菌酶活性。优选地,将在每一温度下的活性表示为标准化至在最适温度下的值的相对活性(以%)。最适温度是在被测试温度(即具有5℃-10℃跳跃的那些)内该活性最高的温度。ph稳定性:术语“ph稳定性”是指在超出该酶在其中有活性的ph范围(ph活性范围)的ph下,在一段孵育期后,变体酶展示出相对于亲本或鉴别的参考序列的结构稳定性。这样的一种变体可以或可以不展示出相对于亲本的改变的ph活性曲线。例如,该变体在增加的或降低的ph下可以是没活性的,但是能够保持其三维结构并且然后一旦它被回复到ph活性范围便恢复活性。可替代地,在增加的或降低的ph下孵育后,该变体可以具有相对于亲本的改进的复性能力。在一个方面中,ph稳定性曲线被改变,这样使得溶菌酶变体在酸性ph下具有改进的稳定性。如在此使用,酸性ph意指从ph2至5.5,优选是从2.5至5.25,更优选是从3至5,甚至更优选是从3.5至4。优选地,当在给定的ph下孵育1小时后,当与已经在ph6.5下维持相同的时间的变体相比时,该变体溶菌酶维持至少40%,优选是至少50%、60%、70%或80%,更优选是至少90%,甚至更优选是至少95%的残余活性。优选地,该变体溶菌酶的残余活性比已经在相同条件下处理的亲本溶菌酶或鉴别的参考序列的残余活性高至少1.1倍、至少1.3倍、至少1.5倍,优选是至少2倍,更优选是至少5倍,最优选是至少7倍,并且甚至最优选是至少10倍。优选地,使用描述于“材料与方法”部分中的溶菌酶浊度活性测定测试该活性。ph活性:在此将术语“ph活性”定义为当与亲本溶菌酶或鉴别的参考序列的ph活性曲线相比时,变体溶菌酶展示出ph依赖性活性曲线的改变。ph活性曲线提供了在给定的条件(例如温度和溶剂成分)下,在ph范围内该酶在阻止微生物生长、消除微生物细胞和/或催化水解反应中的效率的量度。溶菌酶具有特定的ph范围,在该范围内该多肽是稳定的并且保留其酶活性,超出这一范围,该溶菌酶变得不具有活性并且可能也不稳定。在该ph范围内通常存在该溶菌酶显示出最高活性的ph最佳值。在碱性ph(例如从ph7.5至12,优选是从8至11,更优选是从8.5至10,甚至更优选是从9至9.5)下具有改进的活性的溶菌酶变体将能够在更具碱性的环境(例如洗涤剂)中起作用。在酸性ph(例如从ph2至6.5,优选是从2.5至6,更优选是从3至5.5,甚至更优选是从3.5至5)下具有改进的活性的变体将能够在更具酸性的条件(例如在某些食物中的防腐剂)下起作用。在中性或弱酸性ph(如从ph4至7.0,优选是从4.5至6.5,更优选是从5至6.5)下具有改进的活性的变体将能够在弱酸性或中性条件下起作用,例如用于饲料中的益生分子,来稳定动物的健康微生物菌落或通过抑制动物的gi道中的病毒性病原体、寄生虫病原体或细菌性病原体的生长/肠道定植(intestinalcolonization)。在一个方面中,ph活性曲线被改变,这样使得溶菌酶变体在更具碱性的ph下具有改进的活性。优选地,在高至少0.5个单位、优选高至少1.0ph单位、更优选高至少1.5ph单位、甚至更优选的高至少2.0ph单位的ph下,该溶菌酶变体的活性比亲本酶或鉴别的参考序列的活性高至少1.1倍、优选是至少1.5倍、更优选是至少2倍、甚至更优选是至少5倍并且最优选是至少10倍。优选地,该溶菌酶变体在相同时间维持亲本溶菌酶或鉴别的参考序列在其ph最佳值下展示出的至少40%,优选是至少50%、60%、70%或80%、或90%,更优选是至少95%,甚至更优选是至少100%的活性。优选地,使用描述于“材料与方法”部分中的溶菌酶浊度活性测定测试该活性。在另一个方面中,ph活性曲线被改变,这样使得溶菌酶变体在更具酸性的ph下具有改进的活性。优选地,在低至少0.5个单位、优选低至少1.0ph单位、更优选低至少1.5ph单位、甚至更优选的低至少2.0ph单位的ph下,该溶菌酶变体的活性比亲本酶或鉴别的参考序列的活性高至少1.1倍、优选是至少1.5倍、更优选是至少2倍、甚至更优选是至少5倍并且最优选是至少10倍。优选地,该溶菌酶变体在相同时间维持亲本溶菌酶或鉴别的参考序列在其ph最佳值下展示出的至少40%,优选是至少50%、60%、70%或80%、或90%,更优选是至少95%,甚至更优选是至少100%的活性。优选地,使用描述于“材料与方法”部分中的溶菌酶浊度活性测定测试该活性。底物特异性:术语“底物特异性”是指对于该溶菌酶可以杀死/抑制的细菌的类型和/或关于模型溶菌酶底物(例如p-np-(nag-nam)n或p-np-(nag)m寡聚体)的该溶菌酶的特异性。通过修饰该溶菌酶的底物特异性,可以改变该溶菌酶可以杀死和/或抑制的细菌的类型。在一个方面中,将该溶菌酶的底物特异性拓宽,由此允许杀死和/或抑制除了野生型溶菌酶可以杀死和/或抑制的细菌以外的其他类型的细菌。糖化作用敏感性:非酶的糖化作用是一种自发的翻译后过程,其中还原糖共价地结合至主要在赖氨酸(k)残基上的蛋白质中的游离氨基基团。糖化作用可以影响溶菌酶的活性。根据本发明,可以通过指定的氨基酸改变来减少溶菌酶对非酶的糖化作用的敏感性。改进的特性还可以包括热特性,例如造粒稳定性、蒸汽稳定性、更宽的温度活性曲线。另外的改进的特性可以包括蛋白酶灵敏度、和/或糖基化模式。优选地,关于所希望的应用条件评估改进。催化结构域:术语“催化结构域”是指含有酶的催化机构的酶的区域。cdna:术语“cdna”是指可以通过得自真核或原核细胞的成熟的、剪接的mrna分子的反转录而制备的dna分子。cdna缺乏可以存在于对应基因组dna中的内含子序列。早先的初始rna转录本是mrna的前体,其在呈现为成熟的剪接的mrna之前要经一系列的步骤进行加工,包括剪接。编码序列:术语“编码序列”是指多核苷酸,其直接明确多肽的氨基酸序列。编码序列的边界通常由开放读码框确定,其以起始密码子例如atg、gtg或ttg开始,并以终止密码子例如taa、tag或tga结束。编码序列可以是基因组dna、cdna、合成dna或其组合。控制序列:术语“控制序列”是指表达编码本发明的成熟多肽的多核苷酸所必需的核酸序列。各个控制序列可以相对于编码多肽的多核苷酸是原生的(native)(即,来自相同基因)或外源的(即,来自不同基因),或相对于彼此是原生的或外源的。这样的控制序列包括但不局限于前导子,聚腺苷酸化序列,前肽序列,启动子,信号肽序列,和转录终止子。至少,控制序列包括启动子,以及转录和翻译终止信号。可以为这些控制序列提供为了特定限制性位点引入的接头,从而促进这些控制序列与编码多肽的多核苷酸编码区连接。表达:术语“表达”包括产生多肽涉及的任何步骤,包括但不局限于:转录、转录后修饰、翻译、翻译后修饰、和分泌。表达载体:术语“表达载体”是指包括编码多肽的多核苷酸并且可操作地与提供了其表达的控制序列相连接的线性或环状dna分子。片段:术语“片段”意指具有从成熟多肽或结构域的氨基和/或羧基端缺失的一个或多个(例如,若干个)氨基酸的多肽或催化结构域;其中,该片段具有溶菌酶活性。在一个方面中,片段包含至少184个氨基酸残基(例如,seqidno:4的氨基酸25至208)、或至少195个氨基酸残基(例如,seqidno:4的氨基酸22至216)。在另外的方面中,片段包含至少184个氨基酸残基(例如,seqidno:8的氨基酸10至193)、或至少195个氨基酸残基(例如,seqidno:8的氨基酸5至199)。宿主细胞:术语“宿主细胞”是指对转化、转染、转导等敏感的任何细胞类型,其具有包含本发明的多核苷酸的核酸构建体或表达载体。术语“宿主细胞”涵盖由于复制期间发生的突变与亲本细胞不同的亲本细胞的任何后代。分离的:术语“分离的”是指处于非天然出现的形式或环境中的物质。分离的物质的非限制性实例包括(1)任何非天然出现的物质,(2)任何物质,包括但不限于从与其性质上相关的一种或多种或所有天然发生的组分至少部分地移除的任何酶、变体、核酸、蛋白质、肽或辅因子;(3)相对于自然中发现的物质,由人手工修饰的物质;或(4)通过相对于与其天然相关的其他组分,增加物质的量而修饰的任何物质(例如编码该物质的基因的多个拷贝;使用比与编码该物质的基因天然相关的启动子更强的启动子)。分离的物质可以存在于发酵液样品中。成熟多肽:术语“成熟多肽”意指在翻译和任何翻译后修饰(例如n-末端加工、c-末端截短、糖基化、磷酸化等)之后处于其最终形式的多肽。在一个方面中,基于预测seqidno:4的氨基酸1至19和seqidno:8的氨基酸-40至-18是信号肽的signalp程序(nielsen(尼尔森)等人,1997,proteinengineering(蛋白质工程)10:1-6),该成熟多肽是seqidno:4的氨基酸20至227或seqidno:8的氨基酸1至208。本领域已知,宿主细胞可以产生由相同多核苷酸表达的两种或更多种不同的成熟多肽的混合物(即,具有不同的c末端和/或n末端氨基酸)。成熟多肽编码序列:术语“成熟多肽编码序列”意指编码具有溶菌酶活性的成熟多肽的多核苷酸。在一个方面中,基于预测seqidno:3的核苷酸1至57和seqidno:7的核苷酸1至69编码信号肽的signalp程序(尼尔森等人,1997,同上),该成熟多肽编码序列是seqidno:3的核苷酸58至147和核苷酸302至835与seqidno:7的核苷酸121至744的结合序列。核酸构建体:术语“核酸构建体”意指从天然存在的基因中分离的、或以自然中不会另外出现的方式被修饰成包含核酸区段的、或合成的单链亦或双链的核酸分子,它包含一个或多个控制序列。可操作地连接:术语“可操作地连接”是指一种配置,其中控制序列位于相对于多核苷酸的编码序列的适当位置处,这样使得该控制序列指导该编码序列的表达。序列一致性:用参数“序列一致性”来描述两个氨基酸序列之间或两个核苷酸序列之间的相关性。出于本发明的目的,使用尼德曼-翁施(needleman-wunsch)算法(尼德曼和翁施,1970,j.mol.biol.(《分子生物学杂志》)48:443-453)来确定两个氨基酸序列之间的序列一致性,该算法如emboss软件包(emboss:theeuropeanmolecularbiologyopensoftwaresuite(欧洲分子生物学开放软件套件),rice(赖斯)等人,2000,trendsgenet.(《遗传学趋势》)16:276-277)(优选5.0.0版或更新版本)的needle程序所实施的。使用的这些参数是空位开放罚分10、空位延伸罚分0.5,以及eblosum62(blosum62的emboss版本)取代矩阵。标记为“最长一致性”的needle(尼德尔)的输出(使用-nobrief选项获得)被用作百分比一致性并且被计算如下:(一致的残基×100)/(比对长度-比对中的空位总数)出于本发明的目的,使用尼德曼-翁施算法(尼德曼和翁施,1970,同上)确定两个脱氧核糖核苷酸序列之间的序列一致性,该算法如emboss软件包(emboss:theeuropeanmolecularbiologyopensoftwaresuite(欧洲分子生物学开放软件套件),赖斯等人,2000,同上)(优选5.0.0版或更新版本)的needle程序所实施的。使用的这些参数是空位开放罚分10、空位延伸罚分0.5,以及ednafull(ncbinuc4.4的emboss版本)取代矩阵。标记为“最长一致性”的needle(尼德尔)的输出(使用–nobrief选项获得)被用作百分比一致性并且被计算如下:(一致的脱氧核糖核酸×100)/(比对长度-比对中的空位总数)。严谨度条件:如下定义不同的严谨度条件。术语“非常低严谨度条件”是指对于长度为至少100个核苷酸的探针而言,遵循标准dna印迹程序,在42℃下在5xsspe、0.3%sds、200毫克/ml剪切并变性的鲑鱼精子dna和25%甲酰胺中预杂交和杂交12至24小时。载体材料最终使用2xssc、0.2%sds,在45℃下洗涤三次,每次15分钟。术语“低严谨度条件”是指对于长度为至少100个核苷酸的探针而言,遵循标准dna印迹程序,在42℃下在5xsspe、0.3%sds、200毫克/ml剪切并变性的鲑鱼精子dna和25%甲酰胺中预杂交和杂交12至24小时。载体材料最终使用2xssc、0.2%sds,在50℃下洗涤三次,每次15分钟。术语“中严谨度条件”意指对于至少100个核苷酸长度的探针而言,遵循标准dna印迹程序,在42℃在5xsspe、0.3%sds、200微克/ml剪切和变性的鲑精dna和35%甲酰胺中预杂交和杂交12至24小时。载体材料最终使用2xssc、0.2%sds,在55℃下洗涤三次,每次15分钟。术语“中-高严谨度条件”是指对于长度为至少100个核苷酸的探针而言,遵循标准dna印迹程序,在42℃下在5xsspe、0.3%sds、200毫克/ml剪切并变性的鲑鱼精子dna和35%甲酰胺中预杂交和杂交12至24小时。载体材料最终使用2xssc、0.2%sds,在60℃下洗涤三次,每次15分钟。术语“高严谨度条件”是指对于长度为至少100个核苷酸的探针而言,遵循标准dna印迹(southernblotting)程序,在42℃下在5xsspe、0.3%sds、200毫克/ml剪切并变性的鲑鱼精子dna和50%甲酰胺中预杂交和杂交12至24小时。载体材料最终使用2xssc、0.2%sds,在65℃下洗涤三次,每次15分钟。术语“非常高严谨度条件”是指对于长度为至少100个核苷酸的探针而言,遵循标准dna印迹程序,在42℃下在5xsspe、0.3%sds、200毫克/ml剪切并变性的鲑鱼精子dna和50%甲酰胺中预杂交和杂交12至24小时。载体材料最终使用2xssc、0.2%sds,在70℃下洗涤三次,每次15分钟。子序列:术语“子序列”是指具有从成熟多肽编码序列的5’和/或3’端缺失的一个或多个(例如,若干个)核苷酸的多核苷酸;其中子序列编码具有溶菌酶活性的片段。在一个方面中,一个子序列包含至少552个核苷酸(例如,seqidno:3的核苷酸73至147和核苷酸302至778的连接序列),或至少585个核苷酸(例如,seqidno:3的核苷酸64至147和核苷酸302至802的连接序列)。在一个另外的方面中,一个子序列包含至少552个核苷酸(例如,seqidno:7的核苷酸148至699的序列),或至少585个核苷酸(例如,seqidno:7的核苷酸133至717的序列)。基本上纯的多核苷酸:术语“基本上纯的多核苷酸”意指不含其他外来的或不需要的核苷酸的多核苷酸制剂,并且处于适合在基因工程多肽生产系统内使用的形式。因此,基本上纯的多核苷酸包含按重量计至多10%、至多8%、至多6%、至多5%、至多4%、至多3%、至多2%、至多1%、以及至多0.5%的其他该多核苷酸与其天然地或重组地相关的多核苷酸材料。然而,基本上纯的多核苷酸可以包括天然存在的5’和3’非翻译区,例如启动子和终止子。优选地,该多核苷酸按重量计至少90%纯,例如至少92%纯、至少94%纯、至少95%纯、至少96%纯、至少97%纯、至少98%纯、至少99%纯、以及至少99.5%纯。优选的是本发明的多核苷酸以实质上纯的形式存在。基本上纯的多肽:术语“基本上纯的多肽”意指包含按重量计至多10%、至多8%、至多6%、至多5%、至多4%、至多3%、至多2%、至多1%、以及至多0.5%的其他该多肽与其天然地或重组地相关的多肽材料的多肽。优选地,该多肽按存在于该制剂中的总的多肽材料的重量计至少92%纯,例如至少94%纯、至少95%纯、至少96%纯、至少97%纯、至少98%纯、至少99%、至少99.5%纯、以及100%纯。优选的是本发明的多肽以基本上纯的形式存在。例如,这可以通过采用众所周知的重组方法或采用经典的纯化方法制备多肽来完成。变体:术语“变体”意指在一个或多个(例如,若干个)位置处包括一个或多个(若干个)氨基酸残基的改变(即,取代、插入、和/或缺失)的具有溶菌酶活性的一个多肽。取代意指占据一个位置的氨基酸被一个不同的氨基酸替代;缺失意指占据一个位置的氨基酸的移除;并且插入意指邻近于并且紧跟着占据位置的氨基酸之后添加1个、2个或3个氨基酸。根据本发明的变体可以包括从1个至5个;从1个至10个;从1个至15个;从1个至20个;从1个至25个;从1个至30个;从1个至35个;从1个至40个;从1个至45个;从即1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个、31个、32个、33个、34个、35个、36个、37个、38个、39个、40个、41个、42个、43个、44个或45个改变。本发明的这些变体具有至少一个选自下组的改变/修饰,该组由以下位置编号组成:6、10、11、28、30、33、37、39、59、60、61、62、63、92、93、94、96、98、99、100、101、106、133、134、135、136、137、139、140、142、143、158、161、162、178、183和/或190,其中该位置对应于在seqidno:8的成熟序列中的位置。该变体多肽序列优选是一种在自然界中未发现的多肽。野生型溶菌酶:术语“野生型”溶菌酶意指由天然存在的微生物(例如在自然界中发现的细菌、酵母或丝状真菌)表达的一种溶菌酶。用于变体命名的规则出于本发明的目的,使用在seqidno:8中披露的成熟多肽来确定另一种溶菌酶中的相应氨基酸残基。将另一种溶菌酶的氨基酸序列与seqidno:8中披露的成熟多肽进行比对,并且基于该比对,使用尼德曼-翁施算法(尼德曼和翁施,1970,《分子生物学杂志》48:443-453)来确定与seqidno:8中披露的成熟多肽的任何氨基酸残基相对应的氨基酸位置编号,该算法如emboss软件包(emboss:欧洲分子生物学开放软件套件,赖斯等人,2000,《遗传学趋势》16:276-277)(优选5.0.0版或更新版本)的needle程序所实施的。使用的这些参数是空位开放罚分10、空位延伸罚分0.5,以及eblosum62(blosum62的emboss版本)取代矩阵。标记为“最长一致性“的needle(尼德尔)的输出(使用–nobrief选项获得)被用作百分比一致性并且被计算如下:(一致的残基×100)/(比对长度-比对中的空位总数)。将尼德曼-翁施算法用于序列比较并且用于计算序列一致性。可以使用若干计算机程序通过多种多肽序列的比对来确定在另一种溶菌酶中的对应氨基酸残基的识别,这些计算机程序包括,但不限于:muscle(multiplesequencecomparisonbylog‐expectation(基于日志-期望值的多序列比较);版本3.5或更新版本;edgar(埃德加),2004,nucleicacidsresearch(《核酸研究》)32:1792-1797),mafft(版本6.857或更新版本;katoh(卡托赫)和kuma(库玛),2002,nucleicacidsresearch(《核酸研究》)30:3059-3066;katoh(卡托赫)等人,2005,nucleicacidsresearch(《核酸研究》)33:511-518;katoh(卡托赫)和toh(都),2007,bioinformatics(《生物信息学》)23:372-374;katoh(卡托赫)等人,2009,methodsinmolecularbiology(《分子生物学方法》)537:39-64;katoh(卡托赫)和toh(都),2010,bioinformatics(《生物信息学》)26:1899-1900),以及利用clustalw的embossemma(1.83或更新版本;thompson(汤普森)等人,1994,nucleicacidsresearch(《核酸研究》)22:4673-4680),使用它们各自的缺省参数。当其他酶与seqidno:8的成熟多肽分歧,使得传统基于序列的比较不能检测其关系(lindahl(林达尔)和elofsson(埃洛弗松),2000,j.mol.biol.(《分子生物学杂志》)295:613-615)时,可以使用其他成对序列比较算法。在基于序列的搜索中的更大灵敏度可以使用搜索程序来获得,这些搜索程序利用多肽家族的概率表示(特征曲线)来搜索数据库。例如,psi-blast程序通过一个迭代数据库搜索过程来产生多个轮廓并且能够检测远距离同源物(atschul(阿特休尔)等人,1997,《核酸研究》25:3389-3402)。如果多肽的家族或超家族在蛋白结构数据库中具有一个或多个代表,则可以实现甚至更大的灵敏度。程序(例如genthreader)(jones(琼斯),1999,《分子生物学杂志》287:797-815;mcguffi(麦谷芬)和琼斯,2003,《生物信息学》19:874-881)利用来自多种来源(psi-blast,二级结构预测、结构比对轮廓、以及溶剂化可能性)的信息作为预测查询序列的结构折叠的神经网络的输入。类似地,gough(高夫)等人,2000,《分子生物学杂志》313:903-919的方法可以用于比对未知结构的序列与存在于scop数据库中的超家族模型。这些比对进而可以用于产生多肽的同源性模型,并且使用出于该目的而开发的多种工具可以评定这类模型的准确度。对于已知结构的蛋白,若干工具和资源可用于检索并产生结构比对。例如,蛋白的scop超家族已经在结构上进行比对,并且那些比对是可访问的并且可下载的。使用多种算法(例如距离比对矩阵(holm(赫尔姆)和sander(桑德尔),1998,proteins(《蛋白杂志》)33:88-96)或者组合扩展(shindyalov(辛迪亚洛夫)和bourne(伯恩),1998,《蛋白质工程》11:739-747))可以比对两个或更多个蛋白结构,并且可以额外利用这些算法的实施来随所感兴趣的结构查询结构数据库以便发现可能的结构同源物(例如,赫尔姆和park(帕克),2000,《生物信息学》16:566-567)。在描述本发明的变体中,以下所述的命名法适于引用方便。采用了已接受的iupac单个字母和三字母的氨基酸缩写。取代:对于氨基酸取代,使用了以下命名法:原始氨基酸、位置、取代的氨基酸。因此,在位置226处的苏氨酸被丙氨酸取代被表示为“thr226ala”或者“t226a”。多个突变由加号(“+”)分开,例如“gly205arg+ser411phe”或者“g205r+s411f”代表分别在位置205和位置411上甘氨酸(g)被精氨酸(r)并且丝氨酸(s)被苯丙氨酸(f)取代。缺失:对于氨基酸缺失,使用了以下命名法。原始氨基酸、位置、*。因此,在位置195上的甘氨酸缺失被表示为“gly195*”或者“g195*”。多个缺失由加号(“+”)分开,例如“gly195*+ser411*”或“g195*+s411*”。插入:对于氨基酸插入,使用了以下命名法:原始氨基酸、位置、原始氨基酸、插入的氨基酸。因此,在位置195上的甘氨酸之后插入赖氨酸被表示为“gly195glylys”或者“g195gk”。多个氨基酸的插入被表示为[原始氨基酸、位置、原始氨基酸、插入的氨基酸#1、插入的氨基酸#2;等]。例如,在位置195上的甘氨酸之后插入赖氨酸和丙氨酸被表示为“gly195glylysala”或者“g195gka”。在这类情况下,通过将小写字母添加到在所插入的一个或多个氨基酸残基之前的氨基酸残基的位置编号中来对所插入的一个或多个氨基酸残基进行编号。在以上实例中,该序列因此将是:亲本变体195195195a195bgg-k-a多种变化:包含多种变化的变体由加号(“+”)分开,例如“arg170tyr+gly195glu”或者“r170y+g195e”代表在位置170和位置195上的精氨酸和甘氨酸分别被酪氨酸和谷氨酸取代。不同变化:可以在一个位置上引入不同的变化时,这些不同的变化由一个逗号分开,例如“arg170tyr,glu”代表在位置170上的精氨酸被酪氨酸或谷氨酸取代。因此,“tyr167gly,ala+arg170gly,ala”表示以下变体:“tyr167gly+arg170gly”、“tyr167gly+arg170ala”、“tyr167ala+arg170gly”、以及“tyr167ala+arg170ala”。发明详细说明具有溶菌酶活性的多肽在一个实施例中,本发明涉及与seqidno:4的成熟多肽具有至少80%序列一致性的具有溶菌酶活性的分离的多肽。在一个实施例中,本发明涉及与seqidno:4的成熟多肽具有至少85%序列一致性的具有溶菌酶活性的分离的多肽。在一个实施例中,本发明涉及与seqidno:4的成熟多肽具有至少90%序列一致性的具有溶菌酶活性的分离的多肽。在一个实施例中,本发明涉及与seqidno:4的成熟多肽具有至少91%序列一致性的具有溶菌酶活性的分离的多肽。在一个实施例中,本发明涉及与seqidno:4的成熟多肽具有至少92%序列一致性的具有溶菌酶活性的分离的多肽。在一个实施例中,本发明涉及与seqidno:4的成熟多肽具有至少93%序列一致性的具有溶菌酶活性的分离的多肽。在一个实施例中,本发明涉及与seqidno:4的成熟多肽具有至少94%序列一致性的具有溶菌酶活性的分离的多肽。在一个实施例中,本发明涉及与seqidno:4的成熟多肽具有至少95%序列一致性的具有溶菌酶活性的分离的多肽。在一个实施例中,本发明涉及与seqidno:4的成熟多肽具有至少96%序列一致性的具有溶菌酶活性的分离的多肽。在一个实施例中,本发明涉及与seqidno:4的成熟多肽具有至少97%序列一致性的具有溶菌酶活性的分离的多肽。在一个实施例中,本发明涉及与seqidno:4的成熟多肽具有至少98%序列一致性的具有溶菌酶活性的分离的多肽。在一个实施例中,本发明涉及与seqidno:4的成熟多肽具有至少99%序列一致性的具有溶菌酶活性的分离的多肽。在一个方面中,这些多肽与seqidno:4的成熟多肽的区别不超过45个氨基酸,例如1个、2个、3个、4个、5个、6个、7个、4个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个、31个、32个、33个、34个、35个、36个、37个、38个、39个、40个、41个、42个、43个、或44个。本发明的多肽优选地包括seqidno:4的氨基酸序列或其等位变体或由它们组成;或为它们的具有溶菌酶活性的片段。在另一个方面中,该多肽包括seqidno:4的成熟多肽或由其组成。在另一个方面中,该多肽包括seqidno:4的氨基酸20至227或由其组成。在一个实施例中,本发明涉及与seqidno:8的成熟多肽具有至少80%序列一致性的具有溶菌酶活性的分离的多肽。在一个实施例中,本发明涉及与seqidno:8的成熟多肽具有至少85%序列一致性的具有溶菌酶活性的分离的多肽。在一个实施例中,本发明涉及与seqidno:8的成熟多肽具有至少90%序列一致性的具有溶菌酶活性的分离的多肽。在一个实施例中,本发明涉及与seqidno:8的成熟多肽具有至少91%序列一致性的具有溶菌酶活性的分离的多肽。在一个实施例中,本发明涉及与seqidno:8的成熟多肽具有至少92%序列一致性的具有溶菌酶活性的分离的多肽。在一个实施例中,本发明涉及与seqidno:8的成熟多肽具有至少93%序列一致性的具有溶菌酶活性的分离的多肽。在一个实施例中,本发明涉及与seqidno:8的成熟多肽具有至少94%序列一致性的具有溶菌酶活性的分离的多肽。在一个实施例中,本发明涉及与seqidno:8的成熟多肽具有至少95%序列一致性的具有溶菌酶活性的分离的多肽。在一个实施例中,本发明涉及与seqidno:8的成熟多肽具有至少96%序列一致性的具有溶菌酶活性的分离的多肽。在一个实施例中,本发明涉及与seqidno:8的成熟多肽具有至少97%序列一致性的具有溶菌酶活性的分离的多肽。在一个实施例中,本发明涉及与seqidno:8的成熟多肽具有至少98%序列一致性的具有溶菌酶活性的分离的多肽。在一个实施例中,本发明涉及与seqidno:8的成熟多肽具有至少99%序列一致性的具有溶菌酶活性的分离的多肽。在一个方面中,这些多肽与seqidno:8的成熟多肽的区别不超过45个氨基酸,例如1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个、31个、32个、33个、34个、35个、36个、37个、38个、39个、40个、41个、42个、43个、或44个。本发明的多肽优选地包括seqidno:8的氨基酸序列或其等位变体或由它们组成;或为它们的具有溶菌酶活性的片段。在另一个方面中,该多肽包括seqidno:8的成熟多肽或由其组成。在另一个方面中,该多肽包括seqidno:8的氨基酸20至227或由其组成。在另一个实施例中,本发明涉及一种具有溶菌酶活性的分离的多肽,该分离的多肽是由在中严谨度条件、中-高严谨度条件、高严谨度条件、或非常高严谨度条件下与(i)seqidno:3或seqidno:7、(ii)其cdna序列、或(iii)(i)或(ii)的全长互补体的成熟多肽编码序列杂交的一种多核苷酸所编码(萨姆布鲁克等人,1989,《分子克隆实验指南》,第2版,冷泉港,纽约)。seqidno:3或seqidno:7的多核苷酸或其子序列,连同seqidno:4或seqidno:8的多肽或其片段,可以用于设计核酸探针,用以根据本领域中众所周知的方法从不同属或种类的菌株中鉴别并且克隆编码具有溶菌酶活性的多肽的dna。具体地说,可以使用此类探针,遵循标准dna印迹程序,与感兴趣细胞的基因组dna或cdna杂交,以便鉴定并分离其中对应的基因。这样的探针可以大大短于整个序列,但是长度应该至少为15个,例如至少25个、至少35个、或至少70个核苷酸。优选地,核酸探针的长度为至少100个核苷酸,例如长度为至少200个核苷酸、至少300个核苷酸、至少400个核苷酸、至少500个核苷酸、至少600个核苷酸、至少700个核苷酸、至少800个核苷酸、或至少900个核苷酸。dna和rna探针都可使用。典型地将探针进行标记,用于检测相应的基因(例如,用32p、3h、35s、生物素、或抗生物素蛋白)。本发明涵盖此类探针。可以针对与以上描述的探针杂交并且编码具有溶菌酶活性的多肽的dna对由这类其他菌株制备的基因组dna或cdna库进行筛选。来自这类其他菌株的基因组dna或其他dna可以通过琼脂糖或聚丙烯酰胺凝胶电泳,或其他分离技术来分离。来自文库的dna或分离的dna可转移到并固定在硝酸纤维素或其他适合的载体材料上。为了鉴定与seqidno:3或seqidno:7或其子序列杂交的克隆或dna,将该载体材料用于dna印迹中。出于本发明的目的,杂交指示该多核苷酸在中等到非常高严谨度条件下与对应于以下各项的经过标记的核酸探针杂交:(i)seqidno:3或seqidno:7;(ii)seqidno:3或seqidno:7的成熟多肽编码序列;(iii)其cdna序列;(iv)其全长互补体;或(v)其子序列。在这些条件下与该核酸探针杂交的分子可以使用例如x射线薄膜或本领域中已知的任何其他检测手段进行检测。在一个方面中,该核酸探针是seqidno:3的核苷酸58至147或核苷酸302至835,或seqidno:7的核苷酸121至744。在另一个方面中,该核酸探针是编码seqidno:4或seqidno:8的多肽;其成熟多肽;或其片段的多核苷酸。在另一个方面中,该核酸探针是seqidno:3或seqidno:7或其cdna序列。在另一个实施例中,本发明涉及一种具有溶菌酶活性的分离的多肽,该分离的多肽由与seqidno:3的成熟多肽编码序列或其cdna序列具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列一致性的多核苷酸所编码。在一个另外的实施例中,本发明涉及一种具有溶菌酶活性的分离的多肽,该分离的多肽由与seqidno:7的成熟多肽编码序列或其cdna序列具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列一致性的多核苷酸所编码。在一个优选实施例中,本发明涉及在一个或多个(例如若干个)位置处包括取代、缺失、和/或插入的seqidno:4的成熟多肽的变体。在一个实施例中,向seqidno:4的成熟多肽中引入的氨基酸取代、缺失和/或插入的数目不超过45个,例如1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个、31个、32个、33个、34个、35个、36个、37个、38个、39个、40个、41个、42个、43个、44个或45个。在一个优选实施例中,本发明涉及在一个或多个(例如若干个)位置处包括取代、缺失、和/或插入的seqidno:8的成熟多肽的变体。在一个实施例中,向seqidno:8的成熟多肽中引入的氨基酸取代、缺失和/或插入的数目不超过45个,例如1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个、31个、32个、33个、34个、35个、36个、37个、38个、39个、40个、41个、42个、43个、44个或45个。这些氨基酸变化可以具有微小性质,即,不会显著地影响蛋白质的折叠和/或活性的保守氨基酸取代或插入;典型地1-30个氨基酸的较小缺失;氨基或羧基末端的较小延伸,如氨基末端的甲硫氨酸残基;多至20-25个残基的较小接头肽;或便于通过改变净电荷或另一种功能来纯化的较小延伸,如聚组氨酸序列(tract)、抗原表位或结合结构域。保守取代的实例是在下组的范围内:碱性氨基酸(精氨酸、赖氨酸及组氨酸)、酸性氨基酸(谷氨酸和天冬氨酸)、极性氨基酸(谷氨酰胺和天冬酰胺)、疏水性氨基酸(亮氨酸、异亮氨酸及缬氨酸)、芳香族氨基酸(苯丙氨酸、色氨酸及酪氨酸)及小氨基酸(甘氨酸、丙氨酸、丝氨酸、苏氨酸及甲硫氨酸)。总体上不会改变特异性活性的氨基酸取代是本领域已知的,并且例如由h.neurath(诺伊拉特)和r.l.hill(希尔)1979年描述于theproteins(《蛋白质》)中,academicpress(学术出版社),纽约。常见取代是ala/ser、val/ile、asp/glu、thr/ser、ala/gly、ala/thr、ser/asn、ala/val、ser/gly、tyr/phe、ala/pro、lys/arg、asp/asn、leu/ile、leu/val、ala/glu、和asp/gly。可替代地,氨基酸改变本质是多肽的物理化学特性的改变。例如,氨基酸变化可以改进多肽的热稳定性、改变底物特异性、改变ph最佳值等。可以根据本领域已知程序来鉴定多肽中的必需氨基酸,例如定点诱变或丙氨酸扫描诱变(cunningham(坎宁安)和wells(威尔斯),1989,science(《科学》)244:1081-1085)。在后一种技术中,在分子中的每个残基处引入单一丙氨酸突变,并且测试所得突变分子的溶菌酶活性以识别对分子的活性关键的氨基酸残基。还参见hilton(希尔顿)等人,1996,j.biol.chem.(《生物化学杂志》),271:4699-4708。酶的活性位点或其他生物学相互作用也可以通过对结构进行物理学分析来确定,如通过此类技术如核磁共振、结晶学、电子衍射、或光亲和标记,与假定接触位点氨基酸的突变相结合所确定的。参见例如devos(德福斯)等人,《科学》255:306-312;smith(史密斯)等人,1992,j.mol.biol.(《分子生物学杂志》)224:899-904;wlodaver(沃勒达尔)等人,1992,febslett.(《欧洲生物化学学会联盟通讯》)309:59-64。还可以从与相关多肽的比对推断来鉴别必需氨基酸。使用已知的诱变、重组和/或改组方法、随后进行一个相关的筛选程序可以做出单一或多氨基酸取代、缺失和/或插入并对其进行测试,这些相关的筛选程序例如由reidhaar-olson(瑞德哈尔-奥尔森)和sauer(萨奥尔),1988,《科学》241:53-57;bowie(鲍依)和萨奥尔,1989,proc.natl.acad.sci.usa(《美国国家科学院院刊》)86:2152-2156;wo95/17413;或者wo95/22625所描述的那些。可以使用的其他方法包括:易错pcr、噬菌体展示(例如,lowman(洛曼)等人,1991,生物化学30:10832-10837;美国专利号5,223,409;wo92/06204)以及定区诱变(derbyshire(德比希尔)等人,1986,gene(《基因》)46:145;ner(内尔)等人,1988,dna7:127)。可以结合诱变/改组方法与高通量自动化筛选方法来检测由宿主细胞表达的克隆的、诱变的多肽的活性(ness(内斯)等人,1999,naturebiotechnology(《自然生物技术》)17:893-896)。编码活性多肽的诱变的dna分子可以回收自宿主细胞,并且使用本领域的标准方法对其进行迅速测序。这些方法允许迅速确定多肽中单个氨基酸残基的重要性。多肽可以是杂合多肽,其中一个多肽的区域融合在另一多肽的区域的n末端或c末端。多肽还可以是融合多肽或可切割的融合多肽,其中另一多肽融合在本发明的多肽的n-末端或c-末端。通过将编码另一多肽的多核苷酸融合到本发明的多核苷酸而产生融合多肽。用于产生融合多肽的技术在本领域是已知的,并包括连接编码多肽的编码序列,这样使得它们在框内并且融合多肽的表达处于相同的一个或多个启动子和终止子的控制下。还可以使用内含肽技术构建融合多肽,其中在翻译后产生融合多肽(cooper(库珀)等人,1993,emboj.(《欧洲分子生物学学会杂志》)12:2575-2583;dawson(道森)等人,1994,《科学》266:776-779)。融合多肽可以进一步包括两个多肽之间的一个切割位点。在分泌融合蛋白时,该位点被裂解,从而释放这两个多肽。裂解位点的实例包括但不限于以下各项中披露的位点:martin(马丁)等人,2003,j.ind.microbiol.biotechnol.(《工业微生物学与生物技术杂志》)3:568-576;svetina(斯韦蒂纳)等人,2000,j.biotechnol.(《生物技术杂志》)76:245-251;rasmussen(拉斯马森)-wilson(威尔逊)等人,1997,appl.environ.microbiol.(《应用环境微生物学》)63:3488-3493;ward(华德)等人,1995,biotechnology(《生物技术》)13:498-503;以及contreras(孔特拉斯)等人,1991,biotechnology(《生物技术》)9:378-381;eaton(伊顿)等人,1986,biochemistry(《生物化学》)25:505-512;collins(柯林斯)-racie(莱斯)等人,1995,biotechnology(《生物技术》)13:982-987;carter(卡特)等人,1989,proteins:structure,function,andgenetics(蛋白质:结构、功能和遗传学)6:240-248;以及stevens(史蒂文斯),2003,drugdiscoveryworld(《世界药物发现》)4:35-48。在的分辨率下解决了acremoniumalkalophilumcbs114.92溶菌酶的晶体结构。这一结构的原子坐标示于图6中。这些原子坐标可以用来生成描绘acremoniumalkalophilumcbs114.92溶菌酶的结构或同源结构(例如本发明的这些变体)的三维模型。acremoniumalkalophilumcbs114.92溶菌酶属于被指定为e.c:编号3.2.1.17的gh25水解酶家族。相信该催化机制是经典的科什兰保留机制(koshlandretainingmechanism),其中在异头碳周围确认净保留构型(netretentionconfiguration)。这通常通过涉及一种共价的糖基-酶中间体的两步双置换机制(doubledisplacementmechanism)实现。该反应伴随酸/碱以及由两个氨基酸侧链提供的亲核援助而发生。在第一步(通常被称为糖基化步骤)中,一个氨基酸残基(d95)扮演攻击异头中心的亲核体的角色以置换糖苷配基并形成糖基酶中间体。同时,第二个氨基酸残基(e97)作为酸催化剂而起作用并且当键裂解时使糖苷氧质子化。在第二步(通常被称作去糖基化步骤)中,该糖基-酶中间体被水水解,此时第二个氨基酸残基(e97)作为一种使进入的水分子去质子化的碱催化剂。相信在催化过程中,酸/碱基团的pka值在高值与低值之间循环,以在催化的每个步骤处使其作用最佳化。使用x射线结构,已经将氨基酸残基d95和e97(使用seqidno:8用于编号)鉴别为催化性残基。在本发明的实施例(除了在此列举的一种或多种改变之外)中,对对应于本发明的溶菌酶变体的e97和d95(使用seqidno:8用于编号)的氨基酸未作出改变。从若干溶菌酶分子中已知亲核体的突变可以导致保留一些催化活性的一种酶,因为水(也许处于oh-的形式)在催化机制的第一步中可以作为亲核体而起作用(malcolm(马尔科姆),b.a.等人,(1989),“site-directedmutagenesisofthecatalyticresiduesasp-52andglu-35ofchickeneggwhitelysozyme(鸡蛋白溶菌酶的催化性残基asp-52和glu-35的定点诱变)”,《美国国家科学院院刊》86(1),133-137)。具有溶菌酶活性的变体本发明的溶菌酶变体在对应于seqidno:8的成熟多肽的位置6、10、11、28、30、33、37、39、59、60、61、62、63、92、93、94、96、98、99、100、101、106、133、134、135、136、137、139、140、142、143、158、161、162、178、183和/或190中的一个或多个(例如,若干个)位置处包括改变或由其组成,其中每个改变独立地是取代、插入或缺失并且该变体具有抗微生物和/或溶菌酶活性。在一个实施例中,这种改变是取代。在另一个实施例中,这种改变是插入。在一个另外的实施例中,这种改变是缺失。本发明的溶菌酶变体包括以下多肽或由其组成,该多肽包括一个与seqidno:4的成熟多肽具有至少80%、至少85%、至少90%、至少93%、至少95%、至少96%、至少97%、至少98%或至少99%一致性的氨基酸序列。本发明的溶菌酶变体包括以下多肽或由其组成,该多肽包括一个与seqidno:8的成熟多肽具有至少80%、至少85%、至少90%、至少93%、至少95%、至少96%、至少97%、至少98%或至少99%一致性的氨基酸序列。本发明的溶菌酶变体包括以下多肽或由其组成,该多肽包括一个与seqidno:8的成熟多肽具有至少85%一致性的氨基酸序列。本发明的溶菌酶变体包括以下多肽或由其组成,该多肽包括一个与seqidno:8的成熟多肽具有至少90%一致性的氨基酸序列。本发明的溶菌酶变体包括以下多肽或由其组成,该多肽包括一个与seqidno:8的成熟多肽具有至少93%一致性的氨基酸序列。本发明的溶菌酶变体包括以下多肽或由其组成,该多肽包括一个与seqidno:8的成熟多肽具有至少95%一致性的氨基酸序列。本发明的溶菌酶变体包括以下多肽或由其组成,该多肽包括一个与seqidno:8的成熟多肽具有至少96%一致性的氨基酸序列。本发明的溶菌酶变体包括以下多肽或由其组成,该多肽包括一个与seqidno:8的成熟多肽具有至少97%一致性的氨基酸序列。本发明的溶菌酶变体包括以下多肽或由其组成,该多肽包括一个与seqidno:8的成熟多肽具有至少98%一致性的氨基酸序列。本发明的溶菌酶变体包括以下多肽或由其组成,该多肽包括一个与seqidno:8的成熟多肽具有至少99%一致性的氨基酸序列。在一个方面中,本发明的变体中的改变的数目是1-45个,例如1-40个、1-35个、1-30个、1-25个、1-20个、1-15个、1-10个以及1-5个,如1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个、31个、32个、33个、34个、35个、36个、37个、38个、39个、40个、41个、42个、43个、44个或45个改变。在另一个方面中,变体在对应于seqidno:8的成熟多肽的位置6、10、11、28、30、33、37、39、59、60、61、62、63、92、93、94、96、98、99、100、101、106、133、134、135、136、137、139、140、142、143、158、161、162、178、183以及190中的一个或多个(例如,若干个)位置处包括改变,例如取代、插入或缺失。在另一个方面中,变体在对应于seqidno:8的成熟多肽的任何位置6、10、11、28、30、33、37、39、59、60、61、62、63、92、93、94、96、98、99、100、101、106、133、134、135、136、137、139、140、142、143、158、161、162、178、183以及190中的两个位置处包括改变。在另一个方面中,变体在对应于seqidno:8的成熟多肽的任何位置6、10、11、28、30、33、37、39、59、60、61、62、63、92、93、94、96、98、99、100、101、106、133、134、135、136、137、139、140、142、143、158、161、162、178、183以及190中的三个位置处包括改变。在另一个方面中,变体在对应于seqidno:8的成熟多肽的位置6、10、11、28、30、33、37、39、59、60、61、62、63、92、93、94、96、98、99、100、101、106、133、134、135、136、137、139、140、142、143、158、161、162、178、183以及190中的每个位置处包括改变。本发明的一个实施例是改变该溶菌酶的ph活性曲线同时保留溶菌酶活性和/或抗微生物活性。本发明的一个优选实施例是该溶菌酶在更具碱性的ph下具有改进的活性;即,峰值抗微生物或溶菌酶活性的ph增加/变得更具碱性。在一个实施例中,本发明的分离的变体在位置10(使用seqidno:8用于编号)处包括改变或由其组成。在一个方面中,这种改变包括在位置10(使用seqidno:8用于编号)处包括氨基酸的取代或由其组成,这种改变改变该溶菌酶的ph活性曲线。在另一个实施例中,这种改变包括取代w10h或由其组成,这种改变增加峰值抗微生物活性的ph。在一个实施例中,本发明的分离的变体在位置39(使用seqidno:8用于编号)处包括改变或由其组成。在一个方面中,这种改变包括在位置39(使用seqidno:8用于编号)处包括氨基酸的取代或由其组成,这种改变改变该溶菌酶的ph活性曲线。在另一个实施例中,这种改变包括取代s39d或由其组成,这种改变增加峰值抗微生物活性的ph。在另一个实施例中,本发明的分离的变体由在位置10(使用seqidno:8用于编号)处的改变连同一个或多个以下位置中的改变组成:6、11、28、30、33、37、39、59、60、61、62、63、92、93、94、96、98、99、100、101、106、133、134、135、136、137、139、140、142、143、158、161、162、178、183和/或190。一个优选实施例是取代w10h连同一个或多个以下位置中的改变:6、11、28、30、33、37、39、59、60、61、62、63、92、93、94、96、98、99、100、101、106、133、134、135、136、137、139、140、142、143、158、161、162、178、183和/或190。在一个实施例中,本发明的分离的变体由在位置39(使用seqidno:8用于编号)处的改变连同一个或多个以下位置中的改变组成:6、10、11、28、30、33、37、59、60、61、62、63、92、93、94、96、98、99、100、101、106、133、134、135、136、137、139、140、142、143、158、161、162、178、183和/或190。一个优选实施例是取代s39d连同一个或多个以下位置中的改变:6、10、11、28、30、33、37、59、60、61、62、63、92、93、94、96、98、99、100、101、106、133、134、135、136、137、139、140、142、143、158、161、162、178、183和/或190。在一个另外的实施例中,本发明的分离的变体由在位置10和39(使用seqidno:8用于编号)处的一个改变组成。一个优选实施例由取代w10h和s39d组成。在一个另外的实施例中,本发明的分离的变体由在位置10和39(使用seqidno:8用于编号)处的改变连同一个或多个以下位置中的改变组成:6、11、28、30、33、37、59、60、61、62、63、92、93、94、96、98、99、100、101、106、133、134、135、136、137、139、140、142、143、158、161、162、178、183和/或190。一个优选实施例是取代w10h和s39d连同一个或多个以下位置中的改变:6、11、28、30、33、37、59、60、61、62、63、92、93、94、96、98、99、100、101、106、133、134、135、136、137、139、140、142、143、158、161、162、178、183和/或190。在一个实施例中,本发明的分离的变体在位置6(使用seqidno:8用于编号)处包括改变或由其组成。在一个方面中,这种改变包括在位置6(使用seqidno:8用于编号)处包括氨基酸的取代或由其组成,这种改变改变该溶菌酶的底物特异性。在一个实施例中,本发明的分离的变体在位置11(使用seqidno:8用于编号)处包括改变或由其组成。在一个方面中,这种改变包括在位置11(使用seqidno:8用于编号)处包括氨基酸的取代或由其组成,这种改变改变该溶菌酶的底物特异性。在一个实施例中,本发明的分离的变体在位置30(使用seqidno:8用于编号)处包括改变或由其组成。在一个方面中,这种改变包括在位置30(使用seqidno:8用于编号)处包括氨基酸的取代或由其组成,这种改变改变该溶菌酶的底物特异性。在一个实施例中,本发明的分离的变体在位置33(使用seqidno:8用于编号)处包括改变或由其组成。在一个方面中,这种改变包括在位置33(使用seqidno:8用于编号)处包括氨基酸的取代或由其组成,这种改变改变该溶菌酶的底物特异性。在一个实施例中,本发明的分离的变体在位置37(使用seqidno:8用于编号)处包括改变或由其组成。在一个方面中,这种改变包括在位置37(使用seqidno:8用于编号)处包括氨基酸的取代或由其组成,这种改变改变该溶菌酶的底物特异性。在一个实施例中,本发明的分离的变体在位置101(使用seqidno:8用于编号)处包括改变或由其组成。在一个方面中,这种改变包括在位置101(使用seqidno:8用于编号)处包括氨基酸的取代或由其组成,这种改变改变该溶菌酶的底物特异性。在一个实施例中,本发明的分离的变体在位置139(使用seqidno:8用于编号)处包括改变或由其组成。在一个方面中,这种改变包括在位置139(使用seqidno:8用于编号)处包括氨基酸的取代或由其组成,这种改变改变该溶菌酶的底物特异性。在一个实施例中,本发明的分离的变体在位置161(使用seqidno:8用于编号)处包括改变或由其组成。在一个方面中,这种改变包括在位置161(使用seqidno:8用于编号)处包括氨基酸的取代或由其组成,这种改变改变该溶菌酶的底物特异性。在一个实施例中,本发明的分离的变体在位置162(使用seqidno:8用于编号)处包括改变或由其组成。在一个方面中,这种改变包括在位置162(使用seqidno:8用于编号)处包括氨基酸的取代或由其组成,这种改变改变该溶菌酶的底物特异性。在一个实施例中,本发明的分离的变体在位置183(使用seqidno:8用于编号)处包括改变或由其组成。在一个方面中,这种改变包括在位置183(使用seqidno:8用于编号)处包括氨基酸的取代或由其组成,这种改变改变该溶菌酶的底物特异性。在一个实施例中,本发明的分离的变体在位置190(使用seqidno:8用于编号)处包括改变或由其组成。在一个方面中,这种改变包括在位置190(使用seqidno:8用于编号)处包括氨基酸的取代或由其组成,这种改变改变该溶菌酶的底物特异性。具有溶菌酶活性的多肽的来源本发明的具有溶菌酶活性的多肽可以从任何属的微生物获得。为了本发明的目标,结合给定来源,如在此使用,术语“获得自”应指由该来源或由其中已经插入来自该来源的多核苷酸的菌株产生的多核苷酸编码的多肽。在一个方面,获得自给定来源的多肽被分泌到细胞外。该多肽可以是一种真菌多肽。例如,该多肽可以是一种丝状真菌多肽,例如支顶孢属、曲霉属、金孢子菌属、镰孢霉属、腐质霉属、青霉属、梭孢壳菌属或木霉属多肽。在另一个方面中,该多肽是解纤维枝顶孢霉、棘孢曲霉、泡盛曲霉、臭曲霉、烟曲霉、日本曲霉、构巢曲霉、黑曲霉、米曲霉、弱光金孢子菌(chrysosporiuminops)、嗜角质金孢子菌、chrysosporiumlucknowense、chrysosporiummerdarium、毡金孢子菌、chrysosporiumqueenslandicum、热带金孢子菌、层状金孢子菌(chrysosporiumzonatum)、杆孢状镰孢、禾谷镰孢、库威镰孢、黄色镰刀菌、禾谷镰刀菌、禾赤镰孢、异孢镰孢、合欢木镰孢、尖孢镰刀菌、多枝镰孢、粉红镰孢菌、接骨木镰孢、肤色镰孢、拟分枝孢镰刀菌、硫色镰孢、圆镰孢、拟丝孢镰刀菌、镶片镰孢菌、灰腐质霉、特异腐质霉、疏棉状腐质霉、白囊耙齿菌、米黑毛霉、嗜热毁丝霉、粗糙脉孢菌、绳状青霉菌、产紫青霉、黄孢原毛平革菌、无色梭孢壳、thielaviaalbomyces、白柔梭孢壳thielaviaalbopilosa、澳洲梭孢壳、thielaviafimeti、小孢梭孢壳、卵孢梭孢壳、秘鲁梭孢壳(thielaviaperuviana)、毛梭孢壳、瘤孢梭孢壳、耐热梭孢壳、太瑞斯梭孢壳霉、哈茨木霉、康宁木霉、长枝木霉、里氏木霉、或绿色木霉多肽。在另一个方面中,该多肽是一种acremoniumalcalophilum多肽,例如从acremoniumalcalophilumcbs114.92中获得的一种多肽。将理解的是,对于上述种类而言,本发明涵盖完全状态和不完全状态两者、以及其他分类学等效物,例如无性型,而忽略它们被已知的种类名称。本领域普通技术人员将容易地识别鉴定适当等效物。公众在许多培养物保藏中心易于可获得这些种类的菌株,如美国典型培养物保藏中心(atcc)、德国微生物菌种保藏中心(deutschesammlungvonmikroorganismenundzellkulturengmbh,dsmz)、荷兰菌种保藏中心(centraalbureauvoorschimmelcultures,cbs)及美国农业研究菌种保藏中心南方地区研究中心(nrrl)。该多肽可以从其他来源鉴别并获得,这些其他来源包括从自然界(例如,土壤、堆肥、水等)分离的微生物或者使用上述探针直接从天然材料(例如,土壤、堆肥、水等)获得的dna样品。用于直接地从天然生活环境分离微生物和dna的技术是本领域中众所周知的。然后,可通过类似地对另一种微生物的基因组dna或cdna库,或混合的dna样品进行筛选来获得编码该多肽的多核苷酸。一旦已经用一个或多个探针检测到编码一个多肽的一种多核苷酸,则可以通过利用对本领域的普通技术人员来说已知的技术来分离或克隆该多核苷酸(参见,例如萨拉布鲁克等人,1989,同上)。多核苷酸本发明还涉及编码本发明的多肽的分离的多核苷酸,如在此所述。用于分离或克隆多核苷酸的技术是本领域中已知的并且包括从基因组dna或cdna,或其组合进行分离。来自基因组dna的多核苷酸的克隆可以通过以下来实现:例如使用熟知的聚合酶链式反应(pcr)或表达文库的抗体筛选,以检测具有共享的结构特征的克隆dna片段。参见例如innis(英尼斯)等人,1990,pcr:aguidetomethodsandapplication(pcr:方法和应用的指导),academicpress(学术出版社),纽约。可以使用其他核酸扩增程序,如连接酶链反应(lcr)、连接活化的转录(lat)及基于多核苷酸的扩增(nasba)。这些多核苷酸可以克隆自曲霉属或支顶孢属菌株、或相关有机体,并且因此,例如可以是该多核苷酸多肽编码区的等位变体或物种的变体。编码本发明的多肽的多核苷酸的修饰对于合成实质上类似于该多肽的多肽可以是必需的。术语“基本上类似于”该多肽是指该多肽的非天然发生的形式。这些多肽在一些工程化方式方面可以不同于从其天然来源分离的多肽,例如具体活性、热稳定性、ph最佳值等方面不同的变体。这些变体可以基于以seqidno:3、seqidno:7的成熟多肽编码序列、或其cdna序列(例如其子序列)形式呈现的多核苷酸,和/或通过引入不会改变该多肽的氨基酸序列,但对应于预定用于产生该酶的宿主有机体的密码子用法的核苷酸取代,或通过引入可以产生不同氨基酸序列的核苷酸取代来构建。对于核苷酸取代的一般描述,参见例如ford(福特)等人,1991,proteinexpressionandpurification(《蛋白表达与纯化》)2:95-107。核酸构建体本发明还涉及核酸构建体,这些核酸构建体包括可操作地连接至一个或多个控制序列的本发明的多核苷酸,在与这些控制序列兼容的条件下,这些控制序列指导编码序列在适合的宿主细胞中的表达。可以按多种方式操纵多核苷酸,以提供多肽的表达。取决于表达载体,在其插入载体以前操纵多核苷酸可以是希望的或必需的。用于利用重组dna方法修饰多核苷酸的技术是本领域熟知的。该控制序列可以是一个启动子,即,被宿主细胞识别以对编码本发明多肽的多核苷酸进行表达的一种多核苷酸。该启动子包含转录控制序列,这些序列介导了该多肽的表达。该启动子可以是在宿主细胞中显示出转录活性的任何多核苷酸,包括突变的、截短的及杂合启动子,并且可以是由编码与该宿主细胞同源或异源的细胞外或细胞内多肽的基因获得。在细菌宿主细胞中,适合指导本发明的核酸构建体转录的启动子的实例是获得自以下各项的启动子:解淀粉芽孢杆菌α-淀粉酶基因(amyq)、地衣芽孢杆菌α-淀粉酶基因(amyl)、地衣芽孢杆菌青霉素酶基因(penp)、嗜热脂肪芽孢杆菌麦芽淀粉酶基因(amym)、枯草芽孢杆菌果聚糖蔗糖酶基因(sacb)、枯草芽孢杆菌xyla和xylb基因、苏芸金芽孢杆菌cryiiia基因(agaisse(阿盖斯)和lereclus(里瑞克拉斯),1994,molecularmicrobiology(《分子微生物学》)13:97-107)、大肠杆菌lac操纵子、大肠杆菌trc启动子(egon(埃贡)等人,1988,gene(《基因》)69:301-315),天蓝色链霉菌琼脂酶基因(daga)、和原核β-内酰胺酶基因(villa(维拉)-kamaroff(卡玛诺夫)等人,1978,《美国国家科学院院刊》75:3727-3731),连同tac启动子(deboer(德波尔)等人,1983,《美国国家科学院院刊》80:21-25)。另外的启动子描述于“usefulproteinsfromrecombinantbacteria(来自重组细菌的有用蛋白)”,gilbert(吉尔伯特)等人,1980,scientificamerican(科学美国人),242:74-94;以及萨姆布鲁克等人,1989,同上。串联启动子的实例披露在wo99/43835中。在丝状真菌宿主细胞中,用于指导本发明的核酸构建体的转录的合适启动子的实例是获得自以下各项的基因的启动子:构巢曲霉乙酰胺酶、黑曲霉中性α-淀粉酶、黑曲霉酸稳定性α-淀粉酶、黑曲霉或泡盛曲霉葡萄糖淀粉酶(glaa)、米曲霉taka淀粉酶、米曲霉碱性蛋白酶、米曲霉丙糖磷酸异构酶、尖孢镰刀菌胰蛋白酶–样蛋白酶(wo96/00787)、镶片镰孢菌淀粉葡糖苷酶(wo00/56900)、镶片镰孢菌daria(达莉亚)(wo00/56900)、镶片镰孢菌quinn(奎恩)(wo00/56900)、米黑根毛霉脂肪酶、米黑根毛霉天冬氨酸蛋白酶、里氏木霉β-葡糖苷酶、里氏木霉纤维二糖水解酶i、里氏木霉纤维二糖水解酶ii、里氏木霉葡聚糖内切酶i、里氏木霉葡聚糖内切酶ii、里氏木霉葡聚糖内切酶iii、里氏木霉葡聚糖内切酶iv、里氏木霉葡聚糖内切酶v、里氏木霉木聚糖酶i、里氏木霉木聚糖酶ii、里氏木霉β-木糖苷酶,连同na2tpi启动子(来自编码中性α-淀粉酶的曲霉属基因的修饰的启动子,其中已经用来自编码丙糖磷酸异构酶的曲霉属基因的未翻译的前导子替换未翻译的前导子;非限制性实例包括来自编码中性α-淀粉酶的黑曲霉基因的修饰的启动子,其中已经用来自编码丙糖磷酸异构酶的构巢曲霉或米曲霉基因的未翻译的前导子替换未翻译的前导子);及其突变的、截短的、和杂合的启动子。在酵母宿主中,有用的启动子获得自以下各项的基因:酿酒酵母烯醇酶(eno1)、酿酒酵母半乳糖激酶(gal1)、酿酒酵母醇去氢酶/甘油醛-3磷酸去氢酶(adh1、adh2/gap)、酿酒酵母丙糖磷酸异构酶(tpi)、酿酒酵母金属硫蛋白(cup1)、以及酿酒酵母3磷酸甘油酸激酶。romanos(罗马诺斯)等人,1992,yeast(《酵母》)8:423-488描述了酵母宿主细胞的其他有用的启动子。控制序列也可以是转录终止子,它被宿主细胞识别以终止转录。该终止子可操作地连接到编码该多肽的多核苷酸的3'末端。在该宿主细胞中起作用的任何终止子都可以用于本发明中。用于细菌宿主细胞的优选终止子获得自克劳氏芽孢杆菌碱性蛋白酶(aprh)、地衣芽孢杆菌α-淀粉酶(amyl)、以及大肠杆菌核糖体rna(rrnb)的基因。丝状真菌宿主细胞的优选终止子是从以下各项的基因中获得的:构巢曲霉邻氨基苯甲酸合酶、黑曲霉葡糖淀粉酶、黑曲霉α-葡糖苷酶、米曲霉taka淀粉酶、以及尖孢镰刀菌胰蛋白酶样蛋白酶。酵母宿主细胞的优选终止子是从以下各项的基因中获得的:酿酒酵母烯醇酶、酿酒酵母细胞色素c(cyc1)、以及酿酒酵母甘油醛-3磷酸去氢酶。romanos(罗马诺斯)等人,1992,同上,描述了酵母宿主细胞的其他有用的终止子。该控制序列还可以是在启动子下游并且在基因编码序列上游的mrna稳定区,它增加该基因的表达。适合的mrna稳定区的实例是从以下获得的:苏云金芽孢杆菌cryiiia基因(wo94/25612)和枯草芽孢杆菌sp82基因(hue(化)等人,1995,journalofbacteriology(《细菌学杂志》)177:3465-3471)。该控制序列还可以是一个前导子,即一种对宿主细胞翻译重要的mrna的非翻译区。该前导子可操作地连接到编码该多肽的多核苷酸的5'末端。在宿主细胞中起作用的任何前导子都可以使用。丝状真菌宿主细胞的优选前导子是从以下各项的基因中获得的:米曲霉taka淀粉酶和构巢曲霉丙糖磷酸异构酶。酵母宿主细胞的适合的前导子是从以下各项的基因中获得的:酿酒酵母烯醇酶(eno1)、酿酒酵母3磷酸甘油酸激酶、酿酒酵母α-因子、和酿酒酵母醇去氢酶/甘油醛-3磷酸去氢酶(adh2/gap)。控制序列还可以是一种多腺苷酸化序列,可操作地连接至该多核苷酸的3’末端并且当转录时由宿主细胞识别为将多腺苷酸残基添加至所转录的mrna的信号的序列。可以使用在宿主细胞中起作用的任何多腺苷酸化序列。用于丝状真菌宿主细胞的优选多腺苷酸化序列是从以下各项的基因中获得的:构巢曲霉邻氨基苯甲酸合酶、黑曲霉葡糖淀粉酶、黑曲霉α-葡糖苷酶、米曲霉taka淀粉酶、以及尖孢镰刀菌胰蛋白酶样蛋白酶。可用于酵母宿主细胞的多腺苷酸化序列在guo(郭)和sherman(谢尔曼),1995,mol.cellularbiol.(《分子细胞生物学》)15:5983-5990中有过描述。控制序列还可以是编码连接至多肽的n末端的信号肽并指导该多肽进入细胞的分泌途径的信号肽编码区域。该多核苷酸的编码序列的5’端可以固有地包含在翻译读码框内与编码该多肽的编码序列的区段天然地连接的信号肽编码序列。可替代地,编码序列的5’端可以包含对编码序列是外源的信号肽编码序列。该编码序列不天然地包含信号肽编码序列时,可以需要外源信号肽编码序列。可替代地,外源信号肽编码序列可简单地替换天然的信号肽编码序列以便增强该多肽的分泌。然而,指导所表达的多肽进入宿主细胞的分泌路径中的任何信号肽编码序列都可以使用。细菌宿主细胞的有效信号肽编码序列是从以下各项的基因中获得的信号肽编码序列:芽孢杆菌ncib11837麦芽淀粉酶、地衣芽孢杆菌枯草杆菌蛋白酶、地衣芽孢杆菌β-内酰胺酶、嗜热脂肪芽孢杆菌α-淀粉酶、嗜热脂肪芽孢杆菌中性蛋白酶(nprt、nprs、nprm)、以及枯草芽孢杆菌prsa。simonen(西蒙纳)和palva(帕尔瓦),1993,microbiologicalreviews(《微生物学评论》)57:109-137描述了另外的信号肽。丝状真菌宿主细胞的有效信号肽编码序列是从以下各项的基因中获得的信号肽编码序列:黑曲霉中性淀粉酶、黑曲霉葡糖淀粉酶、米曲霉taka淀粉酶、特异腐质霉纤维素酶、特异腐质霉内切葡聚糖酶v、疏棉状腐质霉脂肪酶、以及米黑根毛霉天冬氨酸蛋白酶。酵母宿主细胞有用的信号肽是从以下各项的基因中获得的:酿酒酵母α-因子和酿酒酵母转化酶。romanos(罗马诺斯)等人,1992,同上,描述了其他有用的信号肽编码序列。控制序列还可以是编码位于多肽的n末端的前肽的前肽编码序列。生成的多肽被称为前体酶(proenzyme)或多肽原(或者在一些情况下被称为酶原(zymogen))。多肽原一般是无活性的并且可以通过从该多肽原上催化切割或自动催化切割前肽而被转化成一种活性多肽。前肽编码序列可以从以下各项的基因中获得:枯草芽孢杆菌碱性蛋白酶(apre)、枯草芽孢杆菌中性蛋白酶(nprt)、嗜热毁丝霉漆酶(wo95/33836)、米黑根毛霉天冬氨酸蛋白酶、以及酿酒酵母α-因子。在信号肽和前肽序列两者都存在的情况下,该前肽序列是紧接多肽的n-末端定位,并且该信号肽序列是紧接该前肽序列的n-末端定位。还可以希望添加调节序列,这些调节序列相对于宿主细胞的生长来调控多肽的表达。调节系统的实例是响应于化学或物理刺激而引起基因的表达开启或关闭的那些,包括调控化合物的存在。在原核系统中的调节系统包括lac、tac、以及trp操纵基因系统。在酵母中,可以使用adh2系统或gal1系统。在丝状真菌中,可以使用黑曲霉葡糖淀粉酶启动子、米曲霉takaα-淀粉酶启动子、以及米曲霉葡糖淀粉酶启动子。调节序列的其他实例是允许基因扩增的那些。在真核系统中,这些调节序列包括在氨甲蝶呤存在下被扩增的二氢叶酸还原酶基因以及用重金属扩增的金属硫蛋白基因。在这些情况下,编码该多肽的多核苷酸将与调节序列可操作地连接。表达载体本发明还涉及包含本发明的多核苷酸、启动子、以及转录和翻译终止信号的重组表达载体。不同的核苷酸和控制序列可以接合在一起以产生一个重组表达载体,这一重组表达载体可以包括一个或多个便利的限制酶切位点以允许在这类位点处插入或取代编码该多肽的多核苷酸。可替代地,该多核苷酸可以通过将该多核苷酸或包括该多核苷酸的核酸构建体插入供表达的适当载体中来进行表达。在产生该表达载体时,该编码序列是位于该载体中,这样使得该编码序列与该供表达的适当控制序列可操作地连接。重组表达载体可以是可以便利地经受重组dna程序并且可引起多核苷酸表达的任何载体(例如,质粒或病毒)。载体的选择将典型地取决于该载体与有待引入该载体的宿主细胞的相容性。该载体可以是一种线性的或闭合的环状质粒。该载体可以是一种自主复制载体,即,作为染色体外实体存在的载体,该载体的复制与染色体复制无关,例如质粒、染色体外元件、微型染色体、或人工染色体。该载体可以包含用于确保自我复制任何工具。可替代地,该载体可以是这样一种载体,当它被引入该宿主细胞中时,被整合到基因组中并且与其中已整合了它的一个或多个染色体一起复制。此外,可以使用单一载体或质粒、或两个或更多个载体或质粒(这些载体或质粒共同包含了有待引入到宿主细胞的基因组中的总dna)、或转座子。该载体优选包含允许容易选择转化细胞、转染细胞、转导细胞或类似细胞的一个或多个选择性标记。选择性标记是一种基因,该基因的产物提供了杀生物剂抗性或病毒抗性、重金属抗性、营养缺陷型的原养型、等。细菌选择性标记的实例是地衣芽孢杆菌或枯草芽孢杆菌dal基因、或赋予抗生素抗性(例如氨苄青霉素、氯霉素、卡那霉素、新霉素、大观霉素、或四环素抗性)的标记。用于酵母宿主细胞的适合的标记包括,但不限于ade2、his3、leu2、lys2、met3、trp1、以及ura3。用于在丝状真菌宿主细胞中使用的选择性标记包括但不限于amds(乙酰胺酶)、argb(鸟氨酸氨甲酰基转移酶)、bar(草丁膦乙酰转移酶)、hph(潮霉素磷酸转移酶)、niad(硝酸还原酶)、pyrg(乳清酸核苷-5'磷酸脱羧酶)、sc(硫酸腺苷基转移酶)、以及trpc(邻氨基苯甲酸合酶)、连同其等效物。优选在曲霉细胞中使用的是构巢曲霉或米曲霉amds和pyrg基因以及吸水链霉菌bar基因。该载体优选包含允许将该载体整合到宿主细胞基因组中或者该载体在细胞中不依赖该基因组而自主复制的一种或多种元件。对于整合到该宿主细胞基因组中,该载体可以依靠编码该多肽的多核苷酸序列或者通过同源或非同源重组整合到该基因组中的该载体的任何其他元件。可替代地,该载体可以包含用于指导通过同源重组而整合到宿主细胞基因组中的一个或多个染色体中的一个或多个精确位置处的另外的多核苷酸。为了增加在精确位置处整合的可能性,这些整合的元件应该包含足够数量的核酸,例如100至10,000个碱基对、400至10,000个碱基对、以及800至10,000个碱基对,这些碱基对与对应的靶序列具有高度的序列一致性以提高同源重组的可能性。这些整合元件可以是与宿主细胞的基因组内的靶序列同源的任何序列。此外,这些整合元件可以是非编码多核苷酸或编码多核苷酸。另一方面,通过非同源重组可以将该载体整合到该宿主细胞的基因组内。对于自主复制,该载体可以进一步包含使该载体能够在所讨论的宿主细胞内进行自主复制的复制起点。复制起点可以是在细胞内起作用的介导自主复制的任何质粒复制因子。术语“复制起点”或“质粒复制因子”是指使质粒或载体能够在体内复制的多核苷酸。细菌的复制起点的实例是允许在大肠杆菌内进行复制的质粒pbr322、puc19、pacyc177、以及pacyc184以及允许在芽孢杆菌内进行复制的pub110、pe194、pta1060、以及pamβ1的复制起点。用于在酵母宿主细胞内使用的复制起点的实例是2微米(2micron)的复制起点、ars1、ars4、ars1与cen3的组合、以及ars4与cen6的组合。在丝状真菌细胞中有用的复制起点的实例是ama1和ans1(gems(格姆斯)等人,1991,gene(《基因》)98:61-67;cullen(卡伦)等人,1987,《核酸研究》15:9163-9175;wo00/24883)。根据wo00/24883中披露的方法可以实现ama1基因的分离和包含该基因的质粒或载体的构建。可以将本发明的多核苷酸的多于一个的拷贝插入到宿主细胞中以增加多肽的产生。通过将序列的至少一个另外的拷贝整合到宿主细胞基因组中或者通过包含伴随该多核苷酸的可扩增的选择性标记基因可以获得增加的多核苷酸拷贝数目,其中通过在适当选择性试剂存在下培养细胞可以选择包含扩增的选择性标记基因拷贝和由此另外的多核苷酸拷贝的细胞。用于连接上文所述的元件以构建本发明的重组表达载体的程序对于本领域普通技术人员来说是熟知的(参见,例如sambrook(萨拉布鲁克)等人,1989,同上)。信号肽本发明还涉及一种编码信号肽的分离的多核苷酸,该信号肽包括以下氨基酸:seqidno:4的氨基酸1至19、或seqidno:4的氨基酸-40至-18或由其组成。这些多核苷酸可以另外包含编码蛋白质的基因,该蛋白质可操作地连接到该信号肽。该蛋白质优选地对于该信号肽来说是异源的。在一个方面中,编码该信号肽的多核苷酸是seqidno:3的核苷酸1至57或seqidno:7的核苷酸1至69。本发明还涉及包含这些多核苷酸的核酸构建体、表达载体及重组宿主细胞。本发明还涉及产生蛋白质的方法,包括(a)对包含这种多核苷酸的重组宿主细胞进行培养;并且(b)回收该蛋白质。该蛋白质对于宿主细胞来说可以是天然的或异源的。术语“蛋白质”在此不意图是指一种特定长度的编码产物,并且因此涵盖肽、寡肽及多肽。术语“蛋白质”还涵盖组合形成编码的产物的两个或更多个多肽。这些蛋白质还包括杂合多肽和融合多肽。优选地,该蛋白质是一种激素、酶、受体或其部分、抗体或其部分,或报告子。例如,该蛋白质可以是一种水解酶、异构酶、连接酶、裂解酶、氧化还原酶或转移酶,例如氨肽酶、淀粉酶、碳水化合物酶、羧肽酶、过氧化氢酶、纤维二糖水解酶、纤维素酶、壳多糖酶、角质酶、环糊精糖基转移酶、脱氧核糖核酸酶、内切葡聚糖酶、酯酶、α-半乳糖苷酶、β-半乳糖苷酶、葡糖淀粉酶、α-葡糖苷酶、β-葡糖苷酶、转化酶、漆酶、脂酶、甘露糖苷酶、变构水解酶、氧化酶、果胶分解酶、过氧化物酶、植酸酶、多酚氧化酶、蛋白水解酶、核糖核酸酶、转谷氨酰胺酶、木聚糖酶或β-木糖苷酶。该基因可以从任何原核、真核或其他来源获得。宿主细胞本发明还涉及重组宿主细胞,这些重组宿主细胞包含本发明的多核苷酸,该多核苷酸可操作地连接至一个或多个控制序列,该一个或多个控制序列指导本发明的多肽的产生。将包含多核苷酸的构建体或载体引入到宿主细胞中,这样使得该构建体或载体被维持作为染色体整合体或作为自主复制的染色体外载体,如早先所述。术语“宿主细胞”涵盖由于复制期间发生的突变与亲本细胞不同的亲本细胞的任何后代。宿主细胞的选择在很大程度上取决于编码该多肽的基因及其来源。该宿主细胞可以是有用于重组产生本发明的多肽的任何细胞,例如原核细胞或真核细胞。原核宿主细胞可以是任何革兰氏阳性或革兰氏阴性细菌。革兰氏阳性细菌包括,但不限于芽孢杆菌属、梭菌属、肠球菌属、土芽孢杆菌属、乳杆菌属、乳球菌属、海洋芽孢杆菌属、葡萄球菌属、链球菌属和链霉菌属。革兰氏阴性细菌包括,但不限于弯曲杆菌属、大肠杆菌、黄杆菌属、梭杆菌属、螺杆菌属、泥杆菌属、奈瑟球菌属、假单胞菌属、沙门菌属和脲原体属。细菌宿主细胞可以是任何芽孢杆菌细胞,包括(但不限于)嗜碱芽孢杆菌(bacillusalkalophilus)、解淀粉芽孢杆菌、短芽孢杆菌(bacillusbrevis)、环状芽孢杆菌(bacilluscirculans)、克劳氏芽孢杆菌(bacillusclausii)、凝结芽孢杆菌(bacilluscoagulans)、坚强芽孢杆菌(bacillusfirmus)、灿烂芽胞杆菌(bacilluslautus)、迟缓芽孢杆菌(bacilluslentus)、地衣芽孢杆菌、巨大芽孢杆菌(bacillusmegaterium)、短小芽胞杆菌(bacilluspumilus)、嗜热脂肪芽胞杆菌、枯草芽孢杆菌、以及苏云金芽孢杆菌细胞。细菌宿主细胞还可以是任何链球菌属细胞,包括但不限于似马链球菌、化脓链球菌、乳房链球菌、以及马链球菌兽疫亚种细胞。该细菌宿主细胞还可以是任何链霉菌细胞,包括但不限于,不产色链霉菌(streptomycesachromogenes)、阿维链霉菌(streptomycesavermitilis)、天蓝链霉菌、灰色链霉菌(streptomycesgriseus)及变铅青链霉菌(streptomyceslividans)细胞。将dna引入芽孢杆菌细胞中可通过以下来实现:原生质体转化(参见例如,chang(张)和cohen(科恩),1979,mol.gen.genet.(《分子遗传学与基因组学》)168:111-115)、感受态细胞转化(参见,例如,young(杨格)和spizizen(斯皮宰曾),1961,j.bacteriol.(《细菌学杂志》)81:823-829;或dubnau(杜拜努)以及davidoff-abelson(大卫杜夫-阿贝尔森),1971,《分子生物学杂志》56:209-221)、电穿孔(参见,例如,shigekawa(茂川)和dower(道尔),1988,biotechniques(《生物技术》)6:742-751)、或者接合(参见,例如koehler(克勒)和thorne(索恩),1987,j.bacteriol.(《细菌学杂志》)169:5271-5278)。将dna引入大肠杆菌细胞中可通过以下来实现:原生质体转化(参见例如,hanahan(哈纳汗),1983,j.mol.biol.(《分子生物学杂志》)166:557-580)或电穿孔(参见例如,dower(道尔)等人,1988,《核酸研究》16:6127-6145)。将dna引入链霉菌属细胞中可通过以下来实现:原生质体转化、电穿孔(参见例如gong(贡)等人,2004,foliamicrobiol.(《folia微生物学》)(praha(布拉格))49:399-405)、接合(参见例如,mazodier(马佐迪耶)等人,1989,j.bacteriol.(《细菌学杂志》)171:3583-3585)、或转导(参见例如,burke(伯克)等人,2001,《美国国家科学院院刊》98:6289-6294)。将dna引入假单胞菌细胞中可通过以下来实现:电穿孔(参见例如,choi(蔡)等人,2006,j.microbiol.methods(《微生物学方法杂志》)64:391-397)或接合(参见例如,pinedo(皮内多)和smets(斯梅茨),2005,appl.environ.microbiol.(《应用环境微生物学》)71:51-57)。将dna引入链球菌细胞中可通过以下来实现:天然感应(参见例如,perry(佩里)和kuramitsu(藏满),1981,infect.immun.(《感染与免疫》)32:1295-1297)、原生质体转化(参见,例如,catt(凯特)和jollick(乔力克),1991,microbios(《微生物学》)68:189-207)、电穿孔(参见,例如,buckley(巴克利)等人,1999,appl.environ.microbiol.(《应用环境微生物学》)65:3800-3804)、或者接合(参见,例如,clewell(克莱威尔),1981,microbiol.rev.(《微生物学评论》)45:409-436)。然而,可以使用在本领域已知的任何方法将dna引入到宿主细胞中。该宿主细胞还可以是真核细胞,例如哺乳动物、昆虫、植物、或真菌细胞。该宿主细胞可以是真菌细胞。如在此使用,“真菌”包括子囊菌门(ascomycota)、担子菌门(basidiomycota)、壶菌门(chytridiomycota)、以及接合菌门(zygomycota)、连同卵菌门(oomycota)和全部有丝分裂孢子真菌(如由hawksworth(霍克斯沃思)等人在安斯沃思和拜斯比真菌词典(ainsworthandbisby’sdictionaryofthefungi),第8版,1995,国际应用生物科学中心(cabinternational),大学出版社(universitypress),英国剑桥(cambridge,uk)中进行定义的)。该真菌宿主细胞可以是酵母细胞。如在此使用,“酵母”包括产子囊孢子酵母(内孢霉目)、产担子酵母,以及属于半知菌(芽生菌)的酵母。由于酵母的分类未来可能改变,故出于本发明的目的,酵母应当如biologyandactivitiesofyeast(《酵母生物学与活性》)(斯金纳(skinner),帕斯莫(passmore)及达文波特(davenport)编辑,soc.app.bacteriol.symposium(应用细菌学学会),第9辑,1980)中所描述进行定义。酵母宿主细胞可以是假丝酵母(candida)、汉逊酵母(hansenula)、克鲁维酵母(kluyveromyces)、毕赤酵母(pichia)、酵母属(saccharomyces)、裂殖酵母(schizosaccharomyces)、或者亚罗酵母(yarrowia)细胞,例如乳酸克鲁维酵母(kluyveromyceslactis)、卡尔斯伯酵母(saccharomycescarlsbergensis)、酿酒酵母、糖化酵母(saccharomycesdiastaticus)、道格拉氏酵母(saccharomycesdouglasii)、克鲁维氏酵母(saccharomyceskluyveri)、诺地酵母(saccharomycesnorbensis)、卵形酵母(saccharomycesoviformis)、或解脂耶氏酵母(yarrowialipolytica)细胞。真菌宿主细胞可以是丝状真菌细胞。“丝状真菌”包括所有丝状形式的细分真菌门和卵菌门(如由hawksworth(霍克斯沃思)等人,1995,同上所定义)。丝状真菌的特征一般在于由甲壳素、纤维素、葡聚糖、壳聚糖、甘露聚糖、以及其他复合多糖组成的菌丝体壁。营养生长是通过菌丝伸长来进行的并且碳分解代谢是专性需氧的。相比之下,酵母(例如酿酒酵母)的营养生长是通过单细胞菌体的出芽而进行的,并且碳分解代谢可以是发酵的。丝状真菌宿主细胞可以是枝顶孢属(acremonium)、曲霉菌属、短梗霉属(aureobasidium)、烟管菌属(bjerkandera)、拟蜡菌属(ceriporiopsis)、金孢子菌属(chrysosporium)、鬼伞属(coprinus)、革盖菌属(coriolus)、隐球菌属(cryptococcus)、网孢菌属(filibasidium)、镰刀菌属(fusarium)、腐质霉属(humicola)、稻瘟病菌属(magnaporthe)、毛霉菌(mucor)、毁丝霉属(myceliophthora)、新美鞭菌属(neocallimastix)、脉孢菌属(neurospora)、拟青霉属(paecilomyces)、青霉菌属(penicillium)、平革菌属(phanerochaete)、白腐菌属(phlebia)、梨囊鞭菌属(piromyces)、侧耳属(pleurotus)、裂褶菌属(schizophyllum)、踝节菌属(talaromyces)、嗜热子囊菌属(thermoascus)、梭孢壳属(thielavia)、弯颈霉属(tolypocladium)、栓菌属(trametes)、或木霉属(trichoderma)细胞。例如,丝状真菌宿主细胞可以是泡盛曲霉(aspergillusawamori)、臭曲霉(aspergillusfoetidus)、烟曲霉(aspergillusfumigatus)、日本曲霉(aspergillusjaponicus)、构巢曲霉(aspergillusnidulans)、黑曲霉(aspergillusniger)、米曲霉(aspergillusoryzae)、黑刺烟管菌(bjerkanderaadusta)、干拟蜡菌(ceriporiopsisaneirina)、卡内基拟蜡菌(ceriporiopsiscaregiea)、点拟蜡菌(ceriporiopsisgilvescens)、ceriporiopsispannocinta、环带拟蜡菌(ceriporiopsisrivulosa)、盔拟蜡菌(ceriporiopsissubrufa)、虫拟腊菌(ceriporiopsissubvermispora)、弱光金孢子菌(chrysosporiuminops)、嗜角质金孢子菌(chrysosporiumkeratinophilum)、chrysosporiumlucknowense、chrysosporiummerdarium、毡金孢子菌(chrysosporiumpannicola)、chrysosporiumqueenslandicum、热带金孢子菌(chrysosporiumtropicum)、层状金孢子菌(chrysosporiumzonatum)、灰盖鬼伞(coprinuscinereus)、毛革盖菌(coriolushirsutus)、杆孢状镰孢(fusariumbactridioides)、禾谷镰孢(fusariumcerealis)、库威镰孢(fusariumcrookwellense)、大刀镰孢(fusariumculmorum)、禾本科镰孢(fusariumgraminearum)、禾赤镰孢(fusariumgraminum)、异孢镰孢(fusariumheterosporum)、合欢木镰孢(fusariumnegundi)、尖镰孢(fusariumoxysporum)、多枝镰孢(fusariumreticulatum)、粉红镰孢(fusariumroseum)、接骨木镰孢(fusariumsambucinum)、肤色镰孢(fusariumsarcochroum)、拟分枝孢镰孢(fusariumsporotrichioides)、硫色镰孢(fusariumsulphureum)、圆镰孢(fusariumtorulosum)、拟丝孢镰孢(fusariumtrichothecioides)、镶片镰孢(fusariumvenenatum)、特异腐质霉(humicolainsolens)、疏棉状腐质霉(humicolalanuginosa)、米黑毛霉(mucormiehei)、嗜热毁丝霉(myceliophthorathermophila)、粗糙链孢霉(neurosporacrassa)、产紫青霉(penicilliumpurpurogenum)、黄孢平革菌(phanerochaetechrysosporium)、福射射脉菌(phlebiaradiata)、刺芹侧耳(pleurotuseryngii)、土生梭孢霉(thielaviaterrestris)、长绒毛栓菌(trametesvillosa)、变色栓菌(trametesversicolor)、哈茨木霉(trichodermaharzianum)、康宁木霉(trichodermakoningii)、长枝木霉(trichodermalongibrachiatum)、里氏木霉(trichodermareesei)或绿色木霉(trichodermaviride)细胞。可以通过涉及原生质体形成、原生质体转化以及本身已知的一种方式进行细胞壁再生的一个过程来转化真菌细胞。用于转化曲霉和木霉宿主细胞的合适程序描述于ep238023,yelton(约尔顿)等人,1984,《美国国家科学院院刊》81:1470-1474,以及christensen(克里斯滕森)等人,1988,bio/technology(生物/技术)6:1419-1422中。malardier(马拉迪耶)等人,1989,gene(《基因》)78:147-156和wo96/00787描述了用于转化镰刀菌物种的适合的方法。可以使用becker(贝克尔)和guarente(瓜伦特)在abelson,j.n.(阿贝尔森)和simon,m.i.(西蒙)编辑,guidetoyeastgeneticsandmolecularbiology(对酵母遗传学和分子生物学的指导),methodsinenzymology(《酶学方法》),第194卷,pp182-187,academicpress,inc.(学院出版社有限公司),纽约;ito(伊藤)等人,1983,j.bacteriol.(《细菌学杂志》)153:163;以及hinnen(希南)等人,1978,《美国国家科学院院刊》75:1920中描述的程序来转化酵母。生产方法本发明还涉及产生本发明的多肽的方法,包括(a)在有益于产生该多肽的条件下培养细胞,该细胞以其野生型形式产生该多肽;并且(b)回收该多肽。在一个优选方面中,该细胞是支顶孢属细胞。在一个更优选的方面中,该细胞是acremoniumalcalophilum细胞。在一个最优选的方面中,该细胞是acremoniumalcalophilumcbs114.92。本发明还涉及产生本发明的多肽的方法,包括(a)在有益于产生该多肽的条件下培养本发明的重组宿主细胞;并且(b)回收该多肽。这些宿主细胞是在适合于使用本领域中已知的方法产生该多肽的一种营养培养基中培养的。例如,可以通过摇瓶培养,或者在一种适合的培养基中并在允许该多肽表达和/或分离的条件下在实验室或工业发酵罐中进行小规模或大规模发酵(包括连续发酵、分批发酵、分批给料发酵或固态发酵)来培养该细胞。该培养是使用本领域中已知的程序,在一种适合的营养培养基中发生的,该培养基包括碳源和氮源及无机盐。适合的培养基从商业供应商处可获得,或者可以根据公开的组成(例如,在美国模式培养物保藏所目录中)来制备。如果多肽分泌到培养基中,那么可直接从培养基中直接回收多肽。如果多肽不分泌,那么其可从细胞裂解液中进行回收。该多肽可以使用本领域中已知的特定用于这些多肽的方法进行检测,例如如下所述的溶菌酶斑点测定。这些检测方法包括但不限于,特异性抗体的使用、酶产物的形成或酶底物的消失。例如,可以使用一种酶测定来确定该多肽的活性。可以使用本领域已知的方法来回收多肽。例如,该多肽可以通过常规程序,包括但不限于,收集、离心、过滤、萃取、喷雾干燥、蒸发或沉淀,从该营养培养基回收。可以通过本领域中已知的多种程序来纯化该多肽,以获得大致上纯的多肽,这些程序包括,但不限于色谱法(例如,离子交换色谱、亲和色谱、疏水作用色谱、色谱聚焦、以及尺寸排阻色谱)、电泳程序(例如,制备型等电点聚焦)、有差别的溶解(例如,硫酸铵沉淀)、sds-page、或萃取(参见,例如proteinpurification(《蛋白纯化》),janson(詹森)和ryden(赖登)编辑,vch出版社(vchpublishers),纽约,1989)。在一个替代性方面中,该多肽未被回收,而是使用表达该多肽的本发明的宿主细胞作为该多肽来源。植物本发明还涉及分离的植物,例如转基因植物、植物部分或植物细胞,该分离的植物包含本发明的多核苷酸,以用来按可回收的量表达并且产生多肽或结构域。多肽或结构域可从植物或植物部分回收。可替代地,可以像这样使用含有多肽或结构域的植物或植物部分:用以改善食品或饲料的质量,例如改善营养价值,适口性和流变性质,或破坏抗营养因子。转基因植物可以是双子叶的(双子叶植物)或单子叶的(单子叶植物)。单子叶植物的实例是草,例如草甸草(蓝草,早熟禾属);饲草例如羊茅属(festuca)、黑麦草属(lolium);温带草例如剪股颖属(agrostis)和谷物例如小麦、燕麦、黑麦、大麦、水稻、高粱、和玉蜀黍(玉米)。双子叶植物的实例是烟草,豆类,例如羽扇豆、马铃薯、甜菜、豌豆、菜豆和大豆,以及十字花的植物(十字花科)、例如花椰菜、油菜籽,以及紧密相关的模式生物拟南芥。植物部分的实例是茎、愈伤组织、叶、根、果实、种子、以及块茎连同包含这些部分的单个组织,例如表皮、叶肉、薄壁组织、维管组织、分生组织。特定的植物细胞区室,例如叶绿体、质外体、线粒体、液泡、过氧化物酶体和细胞质也被认为是植物部分。此外,任何植物细胞,无论组织来源,也被认为是植物部分。同样,植物部分,例如分离以促进本发明的利用的特定组织和细胞也被认为是植物部分,例如胚、胚乳、糊粉和种皮。还包括在本发明的范围内的是这类植物、植物部分、和植物细胞的后代。可以根据本领域已知方法构建表达该多肽或结构域的转基因植物或植物细胞。简而言之,通过将编码该多肽或结构域的一个或多个表达构建体结合到植物宿主基因组或叶绿体基因组中并且将所得改性植物或植物细胞繁殖成转基因的植物或植物细胞构建植物或植物细胞。表达构建体方便地是核酸构建体,它包含编码多肽或结构域的多核苷酸,该多核苷酸可操作地与选择的植物或植物部分中表达该多核苷酸所需的适当调节序列连接。此外,该表达构建体可以包括一种适用于对已经整合该表达构建体的植物细胞进行鉴别的选择性标记,及将该构建体引入所讨论的植物中必需的dna序列(后者取决于待使用的dna引入方法)。调节序列(如启动子和终止子序列及可任选的信号或转运序列)的选择例如基于何时、在何处并且如何表达所希望的多肽或结构域来决定。例如编码多肽或结构域的基因的表达可以是组成性的或可诱导的,或者可以是发育、阶段或组织特异性的,并且基因产物可以被靶向至特定组织或植物部分,例如种子或叶。例如,由tague(塔格)等人,1988,plantphysiology(《植物生理学》)86:506描述的调节序列。对于组成性表达,可以使用35s-camv、玉蜀黍泛素1、或水稻肌动蛋白1启动子(franck(弗兰克)等人,1980,cell(《细胞》)21:285-294;christensen(克里斯滕森)等人,1992,plantmol.biol.(《植物分子生物学》)18:675-689;zhang(张)等人,1991,plantcell(《植物细胞》)3:1155-1165)。器官特异性启动子可以是以下各项的启动子,例如来自贮藏库组织(例如种子、马铃薯块茎、和果实)(edwards(爱德华兹)和coruzzi(科鲁兹),1990,ann.rev.genet.(《遗传学年鉴》)24:275-303),或来自代谢库组织(例如分生组织)(ito(伊藤)等人,1994,plantmol.biol.(《植物分子生物学》)24:863-878),种子特异性启动子,例如来自水稻的谷蛋白,醇溶谷蛋白,球蛋白,或白蛋白启动子(wu(吴)等人,1998,plantcellphysiol.(《植物与细胞生理学》)39:885-889),来自豆球蛋白b4的蚕豆启动子和来自蚕豆的未知种子蛋白基因(conrad(康拉德)等人,1998,j.plantphysiol.(《植物生理学杂志》)152:708-711),来自种子油体蛋白的启动子(chen(陈)等人,1998,plantcellphysiol.(《植物与细胞生理学》)39:935-941),来自欧洲油菜的贮藏蛋白napa启动子,或本领域已知的任何其他种子特异性启动子,例如,如在wo91/14772中所述的。此外,启动子可以是叶特异性启动子,例如来自水稻或番茄的rbcs启动子(kyozuka(京冢)等人,1993,plantphysiol.(《植物生理学》)),102:991-1000),小球藻病毒腺嘌呤甲基转移酶基因启动子(mitra(密特拉)和higgins(希金斯,1994,plantmol.biol.(《植物分子生物学》)26:85-93),来自水稻的aldp基因启动子(kagaya(加贺)等人,1995,mol.gen.genet.(《分子和普通遗传学》)248:668-674),或伤口可诱导的启动子,例如马铃薯pin2启动子(xu(徐)等人,1993,plantmol.biol.(《植物分子生物学》)22:573-588)。同样,启动子可通过非生物处理,例如温度、干旱、或盐度变化来诱导,或通过外源施加激活启动子的物质,例如乙醇,雌激素,植物激素例如乙烯、脱落酸、和赤霉酸、以及重金属来诱导。还可使用启动子增强子元件,从而在植物中达到多肽或结构域的更高表达。例如,启动子增强子元件可以是位于启动子和编码多肽或结构域的多核苷酸序列之间的内含子。例如xu(徐)等人,1993,同上,披露了使用水稻肌动蛋白1基因的第一内含子来增强表达。该选择性标记基因及该表达构建体的任何其他部分可以选自本领域中可用的那些。可以根据本领域中已知的常规技术将核酸构建体结合到植物基因组中,这些常规技术包括土壤杆菌介导的转化、病毒介导的转化、微注射、粒子轰击、生物射弹转化、以及电穿孔(gasser(加塞尔)等人,1990,science(《科学》)244:1293;potrykus(波特里库斯),1990,bio/technology(《生物/技术》)8:535;shimamoto(岛本)等人,1989,nature(《自然》)338:274)。根癌土壤杆菌介导的基因转移是一种用于产生转基因双子叶植物(有关评述,参看霍伊卡(hooykas)和斯查珀特(schilperoort),1992,《植物分子生物学》19:15-38)和用于转化单子叶植物的方法,尽管其他转化方法也可以用于这些植物。一种用于产生转基因单子叶植物的方法是胚性愈伤组织或发育的胚的粒子轰击(用转化dna包衣的微观金或钨颗粒)(christou(克里斯托),1992,plantj.(《植物杂志》)2:275-281;shimamoto(岛本),1994,curr.opin.biotechnol.(《生物技术新见》)5:158-162;vasil(瓦西尔)等人,1992,bio/technology(《生物/技术》)10:667-674)。如omirulleh(奥米如列)等人,1993,plantmolecularbiology(《植物分子生物学》)21:415-428中所述,单子叶植物转化的替代方法基于原生质体转化。另外的转化方法包括美国专利号6,395,966和7,151,204(两者都通过引用以其全文结合于此)中所描述的那些。在转化后,根据本领域熟知的方法选出已掺入了表达构建体的转化体,并使其再生成为完整植林。通常转化程序被设计成通过使用例如用两种分开的t-dna构建体共转化或通过特异性重组酶进行的选择基因的位点特异性切除,在再生期间或在后代中选择性清除选择基因。除了用本发明的构建体直接转化具体的植物基因型之外,可以通过将具有构建体的植物与缺乏构建体的第二植物杂交来制成转基因植物。例如,可以通过杂交,而不需要曾经直接转化给定品种的植物,将编码多肽或结构域的构建体引入到具体的那一植物品种中。因此,本发明不仅涵盖了从根据本发明已经转化的细胞直接再生的植物,而且还涵盖了这类植物的后代。如在此使用的,后代可以是指根据本发明制备的亲本植物的任何代的后代。此类后代可以包含根据本发明制备的dna构建体。杂交导致通过供体植物系与起始系交叉授粉,将转基因引入植物系。此类步骤的非限制性实例描述于美国专利号7,151,204中。可以通过回交转换过程产生植物。例如,植物包括被称为回交转换的基因型、系、近交、或杂交的植物。遗传标记可以用于协助将本发明的一种或多种转基因从一种遗传背景渗入到另一种遗传背景中。相对于常规育种,标记辅助选择提供了很多优点,其中它可以用于避免由表型变异引起的错误。此外,遗传标记可以提供关于具体杂交的个体后代中的精英种质的相对程度的数据。例如,当具有希望的性状(否则会具有非农艺学上希望的遗传背景)的植物与精英亲本杂交时,遗传标记可以用于选择不仅拥有感兴趣的性状、而且还具有较大比例的希望的种质的后代。以此方式,将一个或多个性状渗入具体的遗传背景所需的世代数被最小化。本发明还涉及产生本发明的多肽或结构域的方法,这些方法包括(a)在有益于产生该多肽或结构域的条件下培养转基因植物或植物细胞,该转基因植物或植物细胞包含编码该多肽或结构域的多核苷酸;并且(b)回收该多肽或结构域。应用下面给出了本发明的溶菌酶或其组合物的优选应用的实例。该溶菌酶的剂量以及使用该溶菌酶的其他条件可以基于本领域中已知的方法进行确定。本发明的这些多肽典型地有用于经受细菌、真菌、酶母或藻类污染的任何位点。典型地,位点是在例如冷却水系统、衣物沖洗水的含水系统,例如切削油、润滑剂、油田等的油系统中,其中所希望的是杀死微生物需或至少控制其生长。然而,本发明也可以用于已知溶菌酶组合物对其有用的所有应用中,例如木材保护、橡胶、粘合剂、胶水、纸张、纸板、织物、皮革、塑料、压缝和饲料。本发明的溶菌酶或其组合物可以用于若干应用中,以通过用该溶菌酶或其组合物处理包括肽聚糖或壳糊精的材料来降解该材料(参见例如proctor(普罗克特)和cunningham(坎宁汉),(1988)criticalreviewsinfoodscienceandnutrition(《食品科学与营养评论》)26:359-395;carini(卡里尼)等人(1985)microbiol.alimen.nutr.3:299-320;休伊和约翰逊(1987)《应用环境微生物学》53:2165-2170;坎宁汉等人(1991)world'spoultrysciencejournal(《世界家禽科学杂志》)47:141-163)。本发明的溶菌酶用于清洁和/或洗涤剂的应用优选地,将本发明的溶菌酶掺入和/或与如下面描述的洗涤剂组合物一起使用。当在低于60℃的温度下重复洗涤时,在洗衣机(洗衣以及洗碗)以及在机器中洗涤的纺织品或物品上恶臭的风险会增加。这种恶臭似乎是由微生物(例如细菌、真菌、藻类或其他单细胞生物)在洗衣机中的生长造成的。此外,本发明涉及一种用于洗涤织物的工艺,该工艺包括用一种洗涤溶液处理织物,该洗涤溶液包含一种洗涤剂组合物以及一种本发明的溶菌酶或溶菌酶组合物。洗涤处理能以例如机器洗涤方法或以手动洗涤方法的形式进行。该洗涤溶液可以是例如一种含水洗涤溶液,该溶液包含该洗涤剂组合物并且具有在3与12之间的ph。经受本发明的方法的织物可以是常规的可洗涤的衣物,例如家居衣物。优选地,大部分的衣物是成衣和织物,包括由棉、棉混合物或天然或人造纤维素(例如来源于木浆)或其混合物制成的编织物、纺织物、斜纹粗布工装裤、纱和毛巾料。混合物的实例是棉或人造纤维/粘胶与一种或几种伴随材料的混合物,这些伴随材料是例如羊毛、合成纤维(如聚酰胺纤维、丙烯酸纤维、聚酯纤维、聚乙烯醇纤维、聚氯乙烯纤维、聚氨酯纤维、聚脲纤维、芳族聚酰胺纤维)和含纤维素的纤维(例如人造纤维/粘胶、苎麻、亚麻/亚麻布、黄麻、乙酸纤维素纤维、莱赛尔纤维(lyocell))。本发明提供了一种通过用本发明的溶菌酶或溶菌酶组合物处理受微生物污染的表面来减少例如纺织品成衣的表面或例如洗衣机或洗碗机中的金属、塑料或橡胶部分、浴室瓷砖、地板、桌面、排水管、水槽以及脸盆的硬表面上的微生物污染的方法。还预期这样的一种处理减少在纺织品以及包含微生物污染的硬表面上的恶臭。微生物污染的减少能以若干方式进行评估,例如与没用溶菌酶的处理相比,通过让一个面板评估作为处理的结果的味道是否降低;可替代地,可以从该表面取一个样品并培养以评估作为处理的结果的微生物的计数是否减少。本发明的溶菌酶在动物饲料中的应用本发明的溶菌酶还可以在动物饲料中使用。在一个实施例中,本发明提供了一种用于制备动物饲料组合物的方法,该方法包括将本发明的溶菌酶添加至一种或多种动物饲料成分中。使用本发明的溶菌酶稳定动物的健康微生物菌落,特别是家畜例如但不限于绵羊、山羊、牛(包括但不限于肉牛、奶牛、以及幼犊牛)、鹿、小猪或猪(包括但不限于仔猪、生长猪、以及母猪),家禽(包括但不限于鹅,火鸡,鸭和鸡(例如肉鸡、雏鸡以及蛋鸡));马、驼鹿以及兔,但是还在鱼(包括但不限于鲑鱼,鳟鱼,罗非鱼,鲶鱼和鲤鱼;以及甲壳类(包括但不限于小虾及对虾))中的健康微生物区系:病毒性病原体(例如冠状病毒、猪繁殖与呼吸综合征病毒(prrsv)、导致牛病毒性腹泻病毒的佩尔西病毒(persiviruscoursingbovinvirusdiarre)等);寄生虫病原体(球虫原生动物、巨型艾美球虫(eimeriamaxima)、缓艾美球虫(eimeriamitis));或细菌性病原体,例如产气荚膜梭菌、大肠杆菌、结肠弯曲菌、豚肠弯曲菌(c.hyointestinalis)以及空肠弯曲菌(c.jejuni),耶尔森氏菌属,猪密螺旋体(treponemasuis),猪痢疾短螺旋体(brachyspirahyodysenteriae),胞内劳森氏菌(lawsoniaintracellularis)以及沙门氏菌,例如肠道沙门氏菌、鼠伤寒沙门氏菌(salmonellatyphimurium)以及姆班达卡沙门氏菌(salmonellambandaka)。在一个优选实施例中,一种溶菌酶应用于鸡并且具有对抗产气荚膜梭菌的抗微生物活性。在一个另外的实施例中,将本发明的溶菌酶用作一种饲料添加剂,在其中它对鸡消化道的微生物平衡可以提供积极作用并且以此方式改善动物生产性能。根据wo00/21381和wo04/026334,还可以将本发明的溶菌酶在动物饲料中用作改善饲料可消化性以增加其利用效率的增强酶。在一个另外的实施例中,可以将本发明的溶菌酶用作一种饲料添加剂,在其中它对动物消化道可以提供积极作用并且以此方式根据体重增加、饲料转化率(fcr)改善动物生产性能,或改善动物健康,例如降低的死亡率。将fcr计算为相对于以g/动物计的的体重增加的以g/动物计的饲料摄入。本发明的溶菌酶在作为抗微生物剂的应用可以将本发明的溶菌酶用作抗微生物剂。本发明的一个方面是用于减少微生物污染的方法,包括用一种本发明的溶菌酶处理微生物污染的表面。为了评估本发明的溶菌酶是否能够作为抗微生物剂,可以在浊度测定中对其进行测试。在这一测定中,当与仅用缓冲液处理的微生物悬浮液相比时,对其是否能够降解微生物细胞,例如溶解于缓冲液或洗涤剂中的波浪微小杆菌(exiguobacteriumundae)细胞(分离自臭短袜)或滕黄微球菌细胞的干燥的底物,并且由此减少例如在540nm处的光密度(od)进行测试。本发明的溶菌酶用于消毒或用作消毒剂的应用根据美国专利号6,777,223,本发明的溶菌酶可以用作消毒剂或用于消毒,例如用于处理眼睛或口中的感染,或用于清洁接触镜并对其消毒,以及用于预防或除去表面上的生物膜。本发明的溶菌酶还可以在口腔护理中使用。例如,可以在牙膏或其他口腔护理产品中单独使用溶菌酶或与其他酶或甚至抗微生物肽组合使用。可以向口腔中引入多肽或将其施用至将被引入进口腔中的物品。参见例如wo08/124764。通常认为本发明的多肽可以用于任何表面上的清洁、消毒或抑制微生物生长。可以与本发明的多肽有利接触的表面的实例是例如乳品厂、化学或药物加工厂、水源卫生系统、油处理厂、纸浆处理厂、水处理厂和冷却塔使用的加工设备的表面。本发明的多肽应以能在所讨论的表面上有效清洁、消毒或抑制微生物生长的量使用。另外地,本发明的多肽可以用于食品加工厂以及在例如医院、养老院以及餐馆制备或供应食物的任何区域中的清洁表面和烹饪器具。本发明的溶菌酶在食物应用中的用途本发明的溶菌酶还可以用来选择性地抑制在乳酪成熟过程中的酪丁酸梭菌的不受控生长,尤其是由压熟凝乳制作的那些,例如瑞士乳酪、帕玛森(parmesan)、艾登(edam)、豪达(gouda)、切达(cheddar)、以及许多其他乳酪。本发明的溶菌酶还可以用于酿酒中,用来控制或抑制微生物污染。本发明的溶菌酶用作治疗的应用本发明的溶菌酶还可以用于皮肤和软组织的营养不良的以及炎性的损害的局部治疗。参见例如palmieri(帕尔米耶里)和boraldi(波拉蒂)(1977)arch.sci.med.(《医学档案》)(托里诺(torino))134:481-485。本发明的溶菌酶还可以在皮肤护理中使用。例如,将该多肽施用至患有皮肤感染(例如痤疮)的患者的皮肤。还可以将该溶菌酶在施用至受伤的皮肤的创伤敷料中使用,以协助创伤的愈合。参见例如美国申请号20080254079。还可以将本发明的溶菌酶用于唇膏、润唇膏、护唇蜜、或唇彩中。例如,此类产品可以用于治疗局部的唇感染,例如唇疱疹。参见例如美国申请号20080254079。本发明的溶菌酶还可以用于治疗支气管肺疾病。本发明的溶菌酶还可以用作消化酶或消化助手(aid)。还可以使用本发明的溶菌酶来改进死菌/活菌用作食物来源的用途,例如通过控制不希望的微生物污染物。还可以将本发明的溶菌酶在人类或其他动物中用作一种治疗剂,例如用来控制或抑制患有疾病(例如胰腺疾病)的人或免疫功能低下的患者的肠中的细菌的过度生长。本发明的溶菌酶用于提取细菌基因组dna的应用本发明的溶菌酶还可以用来协助从纯培养物和包含多种细菌物种的环境样品中提取细菌基因组dna。为了能够测序细菌dna,需要将细菌的细胞壁分解以分离其中的dna。母鸡蛋白溶菌酶是用于从革兰氏阳性细菌中分离dna的标准酶并且通过水解存在于细胞壁中的肽聚糖链由此协助细胞壁的降解而工作。然而,一些革兰氏阳性细胞壁不被母鸡蛋白溶菌酶降解。例如,如由pitcher(皮彻)和saunders(桑德斯)(1989),《应用环境微生物学》56(3):782-787所描述的,建议将来自例如金黄色葡萄球菌的细胞用溶葡球菌酶溶解。然而,这些方法并不对所有类型的革兰氏阳性细菌起作用并且因此新颖的溶菌酶潜在地提供对不能用商业化的溶菌酶溶液分离的新颖的基因组的获得。添加一种或多种本发明的溶菌酶,任选地与溶葡球菌酶或母鸡蛋白溶菌酶一起分解来自细菌(优选是革兰氏阳性细菌)的细胞壁,这使用目前的商业化溶液时不可能的。在一个实施例中,该溶菌酶是一种具有seqidno:4、seqidno:8的gh25溶菌酶或其变体。在一个另外的实施例中,该溶菌酶有效分解来自以下细菌的细菌的细胞壁,例如芽孢杆菌属、微球菌属、周氏菌属(zobellia)、噬纤维菌属(cellulophaga)以及链霉菌属。一个另外的实施例是以下细菌,例如枯草芽孢杆菌、滕黄微球菌、zobelliauliginosa、溶解噬纤维菌(cellulophagalytica)以及茂源链霉菌(streptomycesmobaraensis)。在另一个实施例中,与母鸡蛋白溶菌酶组合的溶菌酶有效分解以下细菌的细胞壁,例如芽孢杆菌属、微球菌属、周氏菌属、噬纤维菌属以及链霉菌属,例如枯草芽孢杆菌、滕黄微球菌、zobelliauliginosa、溶解噬纤维菌以及茂源链霉菌。一个具体实施例是分解来自茂源链霉菌的细菌的细胞壁。本发明的溶菌酶可以在用于分解来自细菌的细胞壁的组合物或试剂盒中使用,任选地与溶葡球菌酶或母鸡蛋白溶菌酶一起。该溶菌酶组分可以是一种本发明的gh25溶菌酶或一种具有seqidno:4、seqidno:8的gh25溶菌酶或其变体。本发明的溶菌酶的其他应用本发明的溶菌酶还可以用来控制发酵过程中的微生物生长,例如在由生物质制造乙醇或其他产品中。参见例如wo2007/109750。因此,该溶菌酶可以用于例如用于生产一种发酵产物的工艺中,该工艺包括(a)液化和/或糖化一种碳水化合物材料并且(b)使用一种发酵生物发酵,其中以足够杀死和/或抑制细菌细胞的生长的浓度在发酵前、发酵过程中和/或发酵后施加一种本发明的溶菌酶。本发明的溶菌酶还可以用于控制鱼场或虾场中的微生物生长。其他用途包括食品、饮料、化妆品的保存,例如洗液、乳膏、凝胶、油膏、肥皂、洗发剂、护发剂、止汗剂、除臭剂、酶配制品或食物成分。组合物在一个仍另外的方面中,本发明涉及包括具有抗微生物和/或溶菌酶活性的本发明的多肽的组合物。该组合物可以包括本发明的多肽作为主要酶组分,例如单组分组合物。可替代地,该组合物可以包含多种酶活性,如氨肽酶、淀粉酶、碳水化合物酶、羧肽酶、过氧化氢酶、纤维素酶、壳多糖酶、角质酶、环糊精糖基转移酶、脱氧核糖核酸酶、酯酶、α-半乳糖苷酶、β-半乳糖苷酶、葡糖淀粉酶、α-葡糖苷酶、β-葡糖苷酶、卤素过氧化物酶、转化酶、漆酶、脂酶、甘露糖苷酶、氧化酶、果胶分解酶、肽谷氨酰胺酶、过氧化物酶、植酸酶、多酚氧化酶、蛋白水解酶、核糖核酸酶、转谷氨酰胺酶或木聚糖酶。组合物可根据本领域公知的方法制备并且可以是液体或干燥组合物的形式。例如,该多肽组合物可以呈颗粒或微粒的形式。包括在该组合物中的多肽可以根据本领域中已知的方法稳定化。下面给出了本发明的多肽组合物的优选应用的实例。本发明的多肽组合物的剂量以及使用该组合物的其他条件可以基于本领域中已知的方法进行确定。细菌的基因组dna提取组合物本发明的溶菌酶可以添加至一种组合物中并且因此成为它的一种成分,以用来从细菌中提取基因组dna。另外地,该溶菌酶可以与一种或多种另外的溶菌酶组合使用,例如但不限于溶葡球菌酶、变溶菌素或母鸡蛋白溶菌酶。该组合物可以形成一个试剂盒的一部分,根据一组用于从细菌中提取基因组dna的说明可以将其混合在一起。该试剂盒可以包含缓冲液,一种或多种金属离子粘合剂(例如edta),蛋白酶(例如蛋白酶k),洗涤剂(例如sds或曲通x(tritonx))以及一种或多种溶菌酶(例如本发明的gh25溶菌酶、溶葡球菌酶、变溶菌素或母鸡蛋白溶菌酶)。可以从纯培养物和包含多种细菌物种的环境样品中提取细菌基因组dna。一个优选实施例是一种具有seqidno:4、seqidno:8的gh25溶菌酶或其变体。动物饲料组合物本发明还针对用于在动物饲料中使用具有溶菌酶活性的本发明的多肽的方法,以及包括本发明的溶菌酶的饲料组合物和饲料添加剂。术语动物包括所有动物,包括人类。动物的实例为非反刍动物,和反刍动物。反刍动物包括例如,如绵羊、山羊、和牛,例如肉牛和奶牛。在一个具体实施例中,该动物是一种非反刍动物。非反刍动物包括单胃动物,例如小猪或猪(包括但不限于仔猪、生长猪、以及母猪);家禽,如火鸡、鹅、鸭以及鸡(包括但不限于肉鸡、雏鸡以及蛋鸡);马(包括但不限于热血马(hotblood)、冷血马(coldblood)以及温血马(warmblood)),小牛;和鱼(包括但不限于鲑鱼、鳟鱼、罗非鱼、鲶鱼和鲤鱼);以及甲壳类(包括但不限于小虾和对虾)。术语饲料或饲料组合物意指适于或意在由动物摄入的任何化合物、制剂、混合物或组合物。在根据本发明的用途中,可以在饮食之前,之后或同时给动物饲喂该溶菌酶。后者是优选的。此类溶菌酶组合物当然可以与其他酶混合。可以将处于任何形式的溶菌酶添加至饲料中,如其作为相对纯的溶菌酶,或与意在添加至动物饲料的其他组分的混合物,即处于动物饲料添加剂的形式,例如所谓的动物饲料预混物。在一个另外的方面中,本发明涉及用于在动物饲料中使用的组合物,例如动物饲料和动物饲料添加剂,如预混物。除本发明的溶菌酶以外,本发明的动物饲料添加剂包含至少一种脂溶性维生素、和/或至少一种水溶性维生素、和/或至少一种微量矿物质、和/或至少一种大量矿物质。进一步地,任选的饲料添加剂成分是着色剂,例如类胡萝卜素(如β-胡萝卜素)、虾青素、以及叶黄素;稳定剂;改善生长添加剂和香气化合物/调味剂,例如甲氧甲酚、茴香脑、十碳内酯、十一碳内酯和/或十二碳内酯、紫罗酮、鸢尾酮、姜辣素、哌啶、亚丙基苯酞、亚丁基苯酞、辣椒素和/或鞣酸;多不饱和脂肪酸(pufas);产生活性氧的种类;并且,还可以使用以下支持物,该支持物可以包含例如按重量计40%-50%的木质纤维、按重量计8%-10%的硬脂酸、按重量计4%-5%的姜黄粉、按重量计4%-58%的迷迭香粉、按重量计22%-28%的石灰石、按重量计1%-3%的胶质(如阿拉伯胶)、按重量计5%-50%的糖和/或淀粉以及按重量计5%-15%的水。本发明的饲料或饲料添加剂还可以包括至少一种选自以下之中的其他酶:植酸酶(ec3.1.3.8或3.1.3.26);木聚糖酶(ec3.2.1.8);半乳聚糖酶(ec3.2.1.89);α-半乳糖苷酶(ec3.2.1.22);蛋白酶(ec3.4)、磷脂酶a1(ec3.1.1.32);磷脂酶a2(ec3.1.1.4);溶血磷脂酶(ec3.1.1.5);磷脂酶c(3.1.4.3);磷脂酶d(ec3.1.4.4);淀粉酶,例如像α-淀粉酶(ec3.2.1.1);和/或β-葡聚糖酶(ec3.2.1.4或ec3.2.1.6)。多不饱和脂肪酸的实例是c18、c20和c22多不饱和脂肪酸,例如花生四烯酸、二十二碳六烯酸(docosohexaenoicacid)、二十碳五烯酸以及γ-亚油酸。产生活性氧的种类的实例是以下化学品,例如过硼酸盐、过硫酸盐、或过碳酸钠;以及以下酶,例如氧化酶、氧合酶或合成酶。通常,脂-和水-溶性维生素,以及微量矿物质形成意在添加至饲料的所谓的预混物的一部分,而大量矿物质通常单独添加至饲料中。当富含本发明的蛋白酶时,这些组合物的每种类型都是本发明的动物饲料添加剂。在一个具体实施例中,本发明的动物饲料添加剂旨在以0.1ppm至1000ppm、优选是0.5ppm至200ppm并且更优选是1ppm至100ppm的水平被包括(或规定为必须包括在内)在动物饮食或动物饲料中。上述给予水平也可以用于预混物。本发明的动物饲料组合物可以包含至少一种植物蛋白质,例如来源于一种植物或由其产生的植物蛋白质,包括修饰的蛋白质以及蛋白质衍生物。植物蛋白质可以来源于植物蛋白质来源,如豆类和谷类,例如来自蝶形花科(leguminosae)、十字花科、藜科、以及早熟禾科植物的材料,如大豆粉、羽扇豆粉和油菜籽粉。可替代地,植物蛋白质来源是来自藜科的一种或多种植物的材料,如甜菜、糖甜菜、菠菜或奎奴亚藜。植物蛋白质来源的其他实例是油菜籽、葵花籽、棉籽、和甘蓝、以及谷类,如大麦、小麦、黑麦、燕麦、玉蜀黍(玉米)、稻、黑小麦和高粱。本发明的动物饲料组合物还可以包含动物蛋白质,如肉骨粉、羽毛粉、和/或鱼粉,典型地处于0%-25%的量。本发明的动物饲料组合物还可以包括玉米酒糟粕(ddgs),典型地处于0%-30%的量。在更另外的具体的实施例中,本发明的动物饲料组合物包含0%-80%玉米;和/或0%-80%高粱;和/或0%-70%小麦;和/或0%-70%大麦;和/或0%-30%燕麦;和/或0%-40%大豆粉;和/或0%-25%鱼粉;和/或0%-25%肉骨粉;和/或0%-20%乳清。可以将动物饮食制备成例如糊状饲料(非粒状)或粒状饲料。典型地,混合碾磨的饲料并且根据关于所讨论的种类的说明添加足够量的必需维生素和矿物质。以固体或液体酶配制品的形式添加酶。例如,对于糊状饲料而言,可以在混合成分步骤之前或过程中添加固体或液体酶配制品。对于粒状饲料而言,也可以在饲料成分步骤之前或过程中添加该(液体或固体)溶菌酶/酶制剂。典型地,在造粒步骤之后添加液体溶菌酶/酶制剂。也可以将该酶掺入饲料添加剂或预混物中。饮食中的最终的酶浓度在0.01-200mg酶蛋白质/kg饮食的范围内,例如0.5-25mg酶蛋白质/kg动物饮食的范围内。清洁或洗涤剂组合物本发明的溶菌酶可以添加至一种洗涤剂组合物中并且因此成为它的一种成分,特别是在具有7或更低的ph的液体洗涤剂中。例如,可以将本发明的洗涤剂组合物配制成手洗或机洗清洁剂组合物,包括适于预处理带有污渍的织物的洗衣用添加剂组合物和漂洗中添加的织物软化剂组合物,或配制成用于在一般性的家居硬表面的清洁操作中使用的洗涤剂组合物,或配制成在手或机洗碗操作中使用的洗涤剂组合物。在一个具体的方面中,本发明提供了一种包括本发明的溶菌酶的洗涤剂添加剂。洗涤剂添加剂以及洗涤剂组合物可以包括一种或多种其他酶,例如一种蛋白酶、脂肪酶、角质酶、淀粉酶、碳水化合物分解酶、纤维素酶、果胶酶、甘露聚糖酶、阿拉伯糖酶、半乳聚糖酶、木聚糖酶、氧化酶如漆酶和/或过氧化物酶。一般说来,所选择的一种或多种酶的特性应该与选定的洗涤剂相容(即ph最佳值,与其他酶的和非酶的成分的相容性等),并且这一种或多种酶应该以有效量存在。在一个实施例中,本发明针对清洁或洗涤剂组合物,这些清洁或洗涤剂组合物包括与一种或多种另外的清洁组分组合的本发明的酶。另外的清洁组分的选择在业内人士的技术内并且包括常规成分,包括以下列出的示例性的非限制性组分。组分的选择可以包括(用于纺织品保养)考虑有待清洁的纺织品的类型、污物的类型和/或程度、进行清洁时的温度、以及洗涤剂产品的配制。尽管根据一种具体的功能将以下提及的组分进行了分类,但是由于该组分可能具有一种或多种熟练的业内人士将领会的另外的功能,因此不应该将这理解为限制。该清洁或洗涤剂组合物可以适于洗涤纺织品,例如像织物、衣服或亚麻布,或用于清洁硬表面,例如像地板、桌子、或洗碗盘。本发明还涉及编码这些多肽的多核苷酸、核酸构建体、载体以及包括这些多核苷酸的宿主细胞连同生产和使用这些多肽的方法。表面活性剂洗涤剂组合物可以包括一种或多种表面活性剂,它们可以是阴离子的和/或阳离子的和/或非离子的和/或半极性的和/或兼性离子的,或其混合物。在一个具体实施例中,洗涤剂组合物包括一种或多种非离子型表面活性剂和一种或多种阴离子表面活性剂的混合物。这种或这些表面活性剂典型地以按重量计从约0.1%至60%的水平存在,例如约1%至约40%、或约3%至约20%、或约3%至约10%。基于所希望的清洁应用来选择这种或这些表面活性剂,并且这种或这些表面活性剂包括本领域中已知的任何一种或多种常规表面活性剂。可以利用本领域中已知的用于在洗涤剂中使用的任何表面活性剂。当被包括在其中时,洗涤剂将通常包含按重量计从约1%至约40%,例如从约5%至约30%(包括从约5%至约15%)、或从约20%至约25%的阴离子表面活性剂。阴离子表面活性剂的非限制性实例包括硫酸盐和磺酸盐,具体地,直链烷基苯磺酸盐(las),las的异构体,支链烷基苯磺酸盐(babs),苯基链烷磺酸盐,α-烯烃磺酸盐(aos),烯烃磺酸盐,链烯烃磺酸盐,链烷-2,3-二基双(硫酸盐),羟基链烷磺酸盐以及二磺酸盐,烷基硫酸盐(as)(例如十二烷基硫酸钠(sds)),脂肪醇硫酸盐(fas),伯醇硫酸盐(pas),醇醚硫酸盐(aes或aeos或fes,也被称为醇乙氧基硫酸盐或脂肪醇醚硫酸盐),仲链烷磺酸盐(sas),石蜡烃磺酸盐(ps),酯磺酸盐,磺化的脂肪酸甘油酯,α-磺酸基脂肪酸甲酯(α-sfme或ses)(包括甲酯磺酸盐(mes)),烷基琥珀酸或烯基琥珀酸,十二烯基/十四烯基琥珀酸(dtsa),氨基酸的脂肪酸衍生物,磺酸基琥珀酸或皂的二酯和单酯,及其组合。当被包括在其中时,洗涤剂将通常包含按重量计从约0%至约10%的阳离子表面活性剂。阳离子表面活性剂的非限制性实例包括烷基二甲基乙醇季胺(admeaq)、十六烷基三甲基溴化铵(ctab)、二甲基二硬脂酰氯化铵(dsdmac)、以及烷基苄基二甲基铵、烷基季铵化合物、烷氧基化季铵(aqa)化合物、及其组合。当被包括在其中时,洗涤剂将通常包含按重量计从约0.2%至约40%的非离子型表面活性剂,例如从约0.5%至约30%,特别是从约1%至约20%、从约3%至约10%,例如从约3%至约5%、或从约8%至约12%。非离子型表面活性剂的非限制性实例包括醇乙氧基化物(ae或aeo)、醇丙氧基化物、丙氧基化的脂肪醇(pfa),烷氧基化的脂肪酸烷基酯(例如乙氧基化的和/或丙氧基化的脂肪酸烷基酯),烷基酚乙氧基化物(ape),壬基酚乙氧基化物(npe),烷基多糖苷(apg),烷氧基化胺,脂肪酸单乙醇酰胺(fam),脂肪酸二乙醇酰胺(fada),乙氧基化的脂肪酸单乙醇酰胺(efam),丙氧基化的脂肪酸单乙醇酰胺(pfam),多羟基烷基脂肪酸酰胺,或葡萄糖胺的n-酰基n-烷基衍生物(葡糖酰胺(ga),或脂肪酸葡糖酰胺(faga)),连同在span和tween商品名下可获得的产品,及其组合。当被包括在其中时,洗涤剂将通常包含按重量计从约0%至约10%的半极化表面活性剂。半极化表面活性剂的非限制性实例包括氧化胺(ao),例如烷基二甲胺氧化物、n-(椰油基烷基)-n,n-二甲胺氧化物和n-(牛油-烷基)-n,n-双(2-羟乙基)胺氧化物、脂肪酸链烷醇酰胺和乙氧基化的脂肪酸链烷醇酰胺,及其组合。当被包括在其中时,洗涤剂将通常包含按重量计从约0%至约10%的兼性离子表面活性剂。兼性离子表面活性剂的非限制性实例包括甜菜碱、烷基二甲基甜菜碱、磺基甜菜碱、及其组合。助水溶剂助水溶剂是一种化合物,该化合物在水溶液中溶解疏水化合物(或相反地,在非极性环境中的极性物质)。典型地,助水溶剂同时具有亲水的和疏水的特征(如从表面活性剂已知的所谓两亲特性),然而助水溶剂的分子结构一般并不有利于自发自聚集,参见例如hodgdon(霍奇登)和kaler(卡勒)(2007)的综述,currentopinionincolloid&interfacescience(胶体&界面科学新见),12:121-128。助水溶剂并不显示一个临界浓度,高于该浓度就会发生如对表面活性剂和脂质形成胶束、薄层或其他很好地定义的中间相而言所发现的自聚集。很多助水溶剂反而示出一个连续型聚集过程,其中聚集的大小随着浓度增加而增长。然而,很多助水溶剂改变了包含极性和非极性特征的物质的系统(包括水、油、表面活性剂、和聚合物的混合物)的相状态、稳定性、和胶体特性。经典地从制药、个人护理、食品跨行业至技术应用使用助水溶剂。洗涤剂组合物中助水溶剂的使用允许例如更浓的表面活性剂配制品(如在通过除去水而压缩液体洗涤剂的过程中)而不引起不希望的现象,例如相分离或高黏度。洗涤剂可以包含按重量计0%-5%,例如约0.5%至约5%、或约3%至约5%的助水溶剂。可以利用本领域中已知的用于在洗涤剂中使用的任何助水溶剂。助水溶剂的非限制性实例包括苯磺酸钠、对甲苯磺酸钠(sts)、二甲苯磺酸钠(sxs)、枯烯磺酸钠(scs)、伞花烃磺酸钠、氧化胺、醇和聚乙二醇醚、羟基萘甲酸钠、羟基萘磺酸钠、乙基己基磺酸钠、及其组合。助洗剂和共助洗剂洗涤剂组合物可以包含按重量计约0%-65%,例如约5%至约45%的洗涤剂助洗剂或共助洗剂、或其混合物。在洗涤餐具洗涤剂中,助洗剂的水平典型地是40%-65%,特别是50%-65%。助洗剂和/或共助洗剂可以具体是形成具有ca和mg的水溶性复合物的螫合剂。可以利用本领域中已知的用于在衣物洗涤剂中使用的任何助洗剂和/或共助洗剂。助洗剂的非限制性实例包括沸石、二磷酸盐(焦磷酸盐)、三磷酸三磷酸盐例如三磷酸钠(stp或stpp)、碳酸盐例如碳酸钠、可溶性硅酸盐例如硅酸钠、层状硅酸盐(例如来自hoechst(赫斯特公司)的sks-6)、乙醇胺例如2-氨基乙-1-醇(mea)、二乙醇胺(dea,也称为亚氨基二乙醇)、三乙醇胺(tea,也称为2,2’,2”-次氨基三乙醇)、以及羧甲基菊粉(cmi)、及其组合。洗涤剂组合物还可以包含按重量计0%-20%,例如约5%至约10%的洗涤剂共助洗剂、或其混合物。洗涤剂组合物可以单独地包括一种共助洗剂,或与一种助洗剂,例如沸石助洗剂组合。共助洗剂的非限制性实例包括聚丙烯酸酯的均聚物或其共聚物,例如聚(丙烯酸)(paa)或共聚(丙烯酸/马来酸)(paa/pma)。另外的非限制性实例包括柠檬酸盐,螯合剂,例如氨基羧酸盐、氨基多羧酸盐和膦酸盐,以及烷基-或链烯基琥珀酸。另外的具体实例包括2,2’,2”-次氨基三乙酸(nta)、乙二胺四乙酸(edta)、二亚乙基三胺五乙酸(dtpa)、亚氨基二丁二酸(ids)、乙二胺-n,n’-二丁二酸(edds)、甲基甘氨酸二乙酸(mgda)、谷氨酸-n,n-二乙酸(glda)、1-羟基乙烷-1,1-二膦酸(hedp)、乙二胺四-(亚甲基膦酸)(edtmpa)、二亚乙基三胺五(亚甲基膦酸)(dtpmpa或dtmpa)、n-(2-羟乙基)亚氨基二乙酸(edg)、天冬氨酸-n-单乙酸(asma)、天冬氨酸-n,n-二乙酸(asda)、天冬氨酸-n-单丙酸(asmp)、亚氨基二丁二酸(iminodisuccinicacid)(ida)、n-(2-磺甲基)-天冬氨酸(smas)、n-(2-磺乙基)-天冬氨酸(seas)、n-(2-磺甲基)-谷氨酸(smgl)、n-(2-磺乙基)-谷氨酸(segl)、n-甲基亚氨基二乙酸(mida)、α-丙氨酸-n,n-二乙酸(α-alda)、丝氨酸-n,n-二乙酸(seda)、异丝氨酸-n,n-二乙酸(isda)、苯丙氨酸-n,n-二乙酸(phda)、邻氨基苯甲酸-n,n-二乙酸(anda)、磺胺酸-n,n-二乙酸(slda)、牛磺酸-n,n-二乙酸(tuda)以及磺甲基-n,n-二乙酸(smda)、n-(2-羟乙基)-亚乙基二胺-n,n’,n’-三乙酸盐(hedta)、二乙醇甘氨酸(deg)、二亚乙基三胺五(亚甲基膦酸)(dtpmp)、氨基三(亚甲基膦酸)(atmp)、及其组合和盐。另外的示例性助洗剂和/或共助洗剂描述于例如wo09/102854、us5977053中。漂白系统该洗涤剂可以包含按重量计0%-50%,例如约0.1%至约25%的漂白系统。可以利用本领域中已知的用于在衣物洗涤剂中使用的任何漂白系统。适合的漂白系统组分包括漂白催化剂、光漂白剂(photobleach)、漂白活化剂、过氧化氢源(例如过碳酸钠和过硼酸钠)、预成型的过酸及其混合物。适合的预成型过酸包括,但不限于:过氧羧酸及盐,过碳酸及盐,过白啶酸(perimidicacid)及盐,过氧单硫酸及盐(例如过硫酸氢钾(oxone(r)),及其混合物。漂白系统的非限制性实例包括基于过氧化物的漂白系统,该系统可以包括例如一种与过酸形成漂白活化剂组合的无机盐,包括碱金属盐,例如过硼酸盐(通常是单水合物或四水合物)、过碳酸盐、过硫酸盐、过磷酸盐、过硅酸盐的钠盐。术语漂白活化剂在此意指一种与过氧化物漂白剂(像过氧化氢)反应以形成过酸的化合物。以此方式形成的过酸构成活化的漂白剂。有待在此使用的适合的漂白活化剂包括属于酯类、酰胺类、酰亚胺类或酸酐类的那些。适合的实例是四乙酰基乙二胺(taed)、4-[(3,5,5-三甲基己酰)氧基]苯磺酸钠(isonobs)、二过氧月桂酸、4-(十二酰基氧基)苯磺酸盐(lobs)、4-(癸酰基氧基)苯磺酸盐、4-(癸酰基氧基)苯甲酸盐(dobs)、4-(壬酰基氧基)-苯磺酸盐(nobs)、和/或披露于wo98/17767中的那些。感兴趣的漂白活化剂的具体家族披露于ep624154中,并且在那个家族中特别优选的是乙酰柠檬酸三乙酯(atc)。atc或短链甘油三酸酯(像三醋汀)具有以下优点,它是环境友好的,因为它最终降解为柠檬酸和醇。此外,乙酰柠檬酸三乙酯和三醋汀在存储时在产品中具有良好的水解稳定性,并且它是一种有效的漂白活化剂。最后,atc为洗衣添加剂提供一种良好的助洗能力。可替代地,漂白系统可以包括例如酰胺、亚胺、或砜型的过氧酸。漂白系统还可以包括过酸,例如6-(苯二甲酰亚氨基)过己酸(pap)。漂白系统还可以包括一种漂白催化剂。在一些实施例中,漂白组分可以是选自下组的有机催化剂,该组由以下各项组成:具有下式的有机催化剂:(iii)及其混合物;其中每个r1独立地是包含从9至24个碳的支链烷基基团或包含从11至24个碳的直链烷基基团,优选地,每个r1独立地是包含从9至18个碳的支链烷基基团或包含从11至18个碳的直链烷基基团,更优选地,每个r1独立地选自下组,该组由以下各项组成:2-丙基庚基、2-丁基辛基、2-戊基壬基、2-己基癸基、正-十二烷基、正-十四烷基、正-十六烷基、正-十八烷基、异-壬基、异-癸基、异-十三基和异-十五烷基。其他示例性漂白系统描述于例如wo2007/087258、wo2007/087244、wo2007/087259以及wo2007/087242中。适合的光漂白剂可以例如是磺化的酞菁锌。聚合物该洗涤剂可以包含按重量计0%-10%,例如0.5%-5%、2%-5%、0.5%-2%或0.2%-1%的聚合物。可以利用本领域中已知的用于在洗涤剂中使用的任何聚合物。聚合物的功能可以是如以上提到的共助洗剂,或可以提供抗再沉积、纤维保护、污物释放、染料转移抑制、油污清洁和/或抗发泡特性。一些聚合物可以具有多于一种的上述特性和/或多于一种的下述基元(motif)。示例性聚合物包括(羧甲基)纤维素(cmc)、聚(乙烯醇)(pva)、聚(乙烯吡咯烷酮)(pvp)、聚(乙二醇)或聚(环氧乙烷)(peg)、乙氧基化的聚(亚乙基亚胺)、羧甲基菊粉(cmi)、和聚羧化物,例如paa、paa/pma、聚-天冬氨酸、和甲基丙烯酸月桂酯/丙烯酸共聚物、疏水改性cmc(hm-cmc)和硅酮、对苯二甲酸和低聚乙二醇的共聚物、聚(对苯二甲酸乙二酯)和聚(氧乙烯对苯二甲酸乙二酯)的共聚物(pet-poet)、pvp、聚(乙烯基咪唑)(pvi)、聚(乙烯吡啶-n-氧化物)(pvpo或pvpno)以及聚乙烯吡咯烷酮-乙烯基咪唑(pvpvi)。另外的示例性聚合物包括磺化的聚羧酸酯、聚环氧乙烷和聚环氧丙烷(peo-ppo)以及乙氧基磺酸二季铵盐。其他示例性聚合物披露于例如wo2006/130575中。也考虑了上述聚合物的盐。织物调色剂本发明的洗涤剂组合物还可以包括织物调色剂,例如染料或色素,当配制在洗涤剂组合物中时,当所述织物与一种洗液接触时织物调色剂可以沉积在织物上,该洗液包括所述洗涤剂组合物,并且因此通过可见光的吸收/反射改变所述织物的色彩。荧光增白剂发射至少一些可见光。相比之下,因为它们吸收至少一部分可见光光谱,所以织物调色剂改变表面的色彩。适合的织物调色剂包括染料和染料-黏土轭合物,并且还可以包括色素。适合的染料包括小分子染料和聚合物染料。适合的小分子染料包括选自下组的小分子染料,该组由落入颜色索引(colourindex)(c.i.)分类的以下染料组成:直接蓝、直接红、直接紫、酸性蓝、酸性红、酸性紫、碱性蓝、碱性紫和碱性红、或其混合物,例如描述于wo2005/03274、wo2005/03275、wo2005/03276和ep1876226中(将其通过引用结合在此)。洗涤剂组合物优选包括从约0.00003wt%至约0.2wt%、从约0.00008wt%至约0.05wt%、或甚至从约0.0001wt%至约0.04wt%的织物调色剂。该组合物可以包括从0.0001wt%至0.2wt%的织物调色剂,当该组合物处于单位剂量袋的形式时,这可以是尤其优选的。适合的调色剂还披露于例如wo2007/087257和wo2007/087243中。另外的酶在一个方面中,本发明提供了一种包括本发明的溶菌酶的洗涤剂添加剂。洗涤剂添加剂连同洗涤剂组合物可以包括一种或多种[另外的]酶,例如蛋白酶、脂肪酶、角质酶、淀粉酶、碳水化合物分解酶、纤维素酶、果胶酶、甘露聚糖酶、阿拉伯糖酶、半乳聚糖酶、木聚糖酶、氧化酶,例如漆酶、和/或过氧化物酶。一般说来,所选择的一种或多种酶的特性应与所选择的清洁剂相容(即最佳ph,与其他酶的和非酶的成分的相容性等),并且这一种或多种酶应以有效量存在。纤维素酶:适合的纤维素酶包括细菌或真菌来源的那些。包括化学修饰的或蛋白工程化的突变体。适合的纤维素酶包括来自芽孢杆菌属、假单胞菌属、腐质霉属、镰刀菌属、梭孢壳菌属、支顶孢属的纤维素酶,例如披露于us4,435,307、us5,648,263、us5,691,178、us5,776,757以及wo89/09259中的由特异腐质霉、嗜热毁丝霉和尖孢镰刀菌产生的真菌纤维素酶。尤其适合的纤维素酶是具有颜色保护益处的碱性或中性纤维素酶。此类纤维素酶的实例是描述于ep0495257、ep0531372、wo96/11262、wo96/29397、wo98/08940中的纤维素酶。其他实例是纤维素酶变体,例如描述于wo94/07998、ep0531315、us5,457,046、us5,686,593、us5,763,254、wo95/24471、wo98/12307和pct/dk98/00299中的那些。可商购的纤维素酶包括可商购的纤维素酶包括celluzyme、和carezyme(novozymesa/s(诺维信公司))、clazinase、和puradaxha(genencorinternationalinc.(杰能科国际公司))、以及kac-500(b)tm(kaocorporation(花王株式会社)。蛋白酶:适合的蛋白酶包括动物、植物或微生物来源的那些。优选微生物来源。包括化学修饰的或蛋白工程化的突变体。蛋白酶可以是丝氨酸蛋白酶或金属蛋白酶,优选碱性微生物蛋白酶或胰蛋白酶样蛋白酶。碱性蛋白酶的实例是枯草杆菌蛋白酶,尤其是衍生自芽孢杆菌的那些,例如枯草杆菌蛋白酶novo、枯草杆菌蛋白酶carlsberg、枯草杆菌蛋白酶309、枯草杆菌蛋白酶147和枯草杆菌蛋白酶168(描述于wo89/06279中)。胰蛋白酶样蛋白酶的实例是胰蛋白酶(例如猪或牛来源的)和描述于wo89/06270与wo94/25583中的镰刀菌蛋白酶。有用的蛋白酶的实例是如wo92/19729,wo98/20115,wo98/20116和wo98/34946所描述的变体,特别是在一个或多个下述位置发生取代的变体:27、36、57、76、87、97、101、104、120、123、167、170、194、206、218、222、224、235、以及274。优选的可商购蛋白酶包括alcalasetm、savinasetm、primasetm、duralasetm、esperasetm、和kannasetm(novozymesa/s(诺维信公司)),maxatasetm、maxacaltm、maxapemtm、properasetm、purafecttm、purafectoxptm、fn2tm、和fn3tm(genencorinternationalinc.(杰能科国际公司))。脂肪酶和角质酶:适合的脂肪酶和角质酶包括细菌或真菌来源的那些。包括化学修饰的或蛋白工程化的突变体酶。实例包括来自嗜热真菌属的脂肪酶,例如如描述于ep258068和ep305216中的来自疏绵状嗜热丝孢菌(早先命名为疏棉状腐质霉);来自腐质霉属的角质酶,例如特异腐质霉(wo96/13580);来自假单胞菌属的菌株的脂肪酶(这些中的一些现在改名为伯克霍尔氏菌属),例如产碱假单胞菌或类产碱假单胞菌(ep218272)、洋葱假单胞菌(ep331376)、假单胞菌属菌株sd705(wo95/06720&wo96/27002)、p.wisconsinensis(wo96/12012),gdsl-型链霉菌属脂肪酶(wo10/065455);来自稻瘟病菌的角质酶(wo10/107560);来自门多萨假单胞菌的角质酶(us5,389,536);来自褐色嗜热裂孢菌(thermobifidafusca)的脂肪酶(wo11/084412);嗜热脂肪土芽孢杆菌脂肪酶(wo11/084417);来自枯草芽孢杆菌的脂肪酶(wo11/084599);以及来自灰色链霉菌(wo11/150157)和s.pristinaespiralis的脂肪酶(wo12/137147)。其他实例是脂肪酶变体,例如描述于ep407225、wo92/05249、wo94/01541、wo94/25578、wo95/14783、wo95/30744、wo95/35381、wo95/22615、wo96/00292、wo97/04079、wo97/07202、wo00/34450、wo00/60063、wo01/92502、wo07/87508以及wo09/109500中的那些。优选的商业化脂肪酶产品包括lipolasetm、lipextm;lipolextm以及lipocleantm(诺维信)、lumafast(来自杰能科公司(genencor))以及lipomax(来自吉斯特公司(gist-brocades))。仍其他的实例是有时被称为酰基转移酶或过水解酶(perhydrolase)的脂肪酶,例如与南极假丝酵母脂肪酶a具有同源性的酰基转移酶(wo10/111143)、来自耻垢分枝杆菌的酰基转移酶(wo05/56782)、来自ce7家族的过水解酶(wo09/67279)、以及耻垢分枝杆菌过水解酶的变体,特别是用于在来自亨斯迈纺织染化私人有限公司(huntsmantextileeffectspteltd)的商业化产品gentlepowerbleach中使用的s54v变体(wo10/100028)。淀粉酶:适合的淀粉酶(α和/或β)包括细菌或真菌来源的那些。包括化学修饰的或蛋白工程化的突变体。淀粉酶包括例如获得自芽孢杆菌,例如地衣芽孢杆菌的特定菌株的-淀粉酶,更加详细地描述于gb1,296,839中。有用的淀粉酶的实例是描述于wo94/02597、w094/18314、wo96/23837、以及wo97/43424中的变体,尤其是在以下一个或多个位置处具有取代的变体:15、23、105、106、124、128、133、154、156、181、188、190、197、202、208、209、243、264、304、305、391、408、以及444。可商购的淀粉酶是duramyltm、termamyltm、fungamyltm、stainzymetm、natalasetmandbantm(诺维信)、rapidasetm以及purastartm(来自杰能科国际公司)。过氧化物酶/氧化酶:适合的过氧化物酶/氧化酶包括植物、细菌或真菌来源的那些。包括化学修饰的或蛋白工程化的突变体。有用的过氧化物酶的实例包括来自鬼伞菌,例如灰盖鬼伞的过氧化物酶及其变体,如描述于wo93/24618、wo95/10602、和wo98/15257中的那些。可商购的过氧化物酶包括guardzymetm(novozymesa/s(诺维信公司))。这一种或多种洗涤剂酶可以通过添加包含一种或多种酶的独立添加剂,或通过添加包含所有这些酶的组合添加剂而被包含于洗涤剂组合物中。本发明的洗涤剂添加剂,即独立添加剂或组合添加剂,可以被配制为,如粒料、液体、浆料等。优选的洗涤剂添加剂配制品为粒料,尤其是非尘(non-dusting)粒料;液体,特别是稳定的液体;或浆料。可以产生非尘粒料,例如像在us4,106,991和4,661,452中所披露的,并且可以任选地通过本领域已知方法进行包被。蜡质包被材料的实例是具有1000至20000的平均分子量的聚(环氧乙烷)产物;具有从16至50个环氧乙烷单元的乙氧基化的壬基酚;乙氧基化的脂肪醇,其中醇包含从12至20个碳原子并且其中存在15至80个环氧乙烷单元;脂肪醇;脂肪酸;以及脂肪酸的单和二以及三酸甘油酯。gb1483591中给出了适于通过流化床技术而应用的成膜包被材料的实例。例如,液体酶制剂可根据既定方法通过添加多元醇例如丙二醇,糖或糖醇、丙醇酸或硼酸来稳定。受保护的酶可根据ep238,216中披露的方法制备。辅料还可以利用本领域中已知的用于在衣物洗涤剂中使用的任何洗涤剂组分。其他任选的洗涤剂组分包括防腐剂、防缩剂、抗污物再沉积剂、抗皱剂、杀细菌剂、粘合剂、腐蚀抑制剂、崩解剂(disintegrant)/崩解剂(disintegrationagent)、染料、酶稳定剂(包括硼酸、硼酸盐、cmc、和/或多元醇例如丙二醇)、织物整理剂包括黏土、填充剂/加工助剂、荧光剂增白剂/光增亮剂、泡沫促进剂、泡沫(泡)调节剂、香料、污物助悬剂、软化剂、抑泡剂、晦暗抑制剂、和芯吸剂,单独亦或组合使用。可以利用本领域中已知的用于在衣物洗涤剂中使用的任何成分。此类成分的选择很好地在业内人士的技术内。分散剂:本发明的洗涤剂组合物还可以包含分散剂。具体地粉状洗涤剂可以包括分散剂。适合的水溶性有机材料包括均聚合或共聚合的酸或其盐,其中多羧酸包含至少两个羧基,这两个羧基被不超过两个碳原子彼此分开。例如适合的分散剂描述于powdereddetergents,surfactantscienceseries(粉状洗涤剂,表面活性剂科学系列)71卷中,marceldekker,inc.(马塞尔·德克尔公司)。染料转移抑制剂:本发明的洗涤剂组合物还可以包括一种或多种染料转移抑制剂。适合的聚合物染料转移抑制剂包括但不局限于聚乙烯吡咯酮聚合物、多胺n-氧化物聚合物、n-乙烯吡咯烷酮和n-乙烯基咪唑的共聚物、聚乙烯噁唑烷酮和聚乙烯咪唑或其混合物。当存在于主题组合物中时,按组合物重量计,染料转移抑制剂可以按以下水平存在:从约0.0001%至约10%、从约0.01%至约5%或甚至从约0.1%至约3%。荧光增白剂:本发明的洗涤剂组合物将优选地还包含另外的组分,这些组分可以给正在清洁的物品着色,例如荧光增白剂或光增亮剂。其中增亮剂优选以约0.01%至约0.5%的水平存在。在本发明的组合物中可以使用适合用于在衣物洗涤剂组合物中使用的任何荧光增白剂。最常用的荧光增白剂是属于以下类别的那些:二氨芪-磺酸衍生物、二芳基吡唑啉衍生物和二苯基-联苯乙烯基衍生物。荧光增白剂的二氨芪-磺酸衍生物型的实例包括以下各项的钠盐:4,4'-双-(2-二乙醇氨基-4-苯胺基-s-三嗪-6-基氨基)芪-2,2'-二磺酸盐;4,4'-双-(2,4-二苯胺基-s-三嗪-6-基氨基)芪-2.2'-二磺酸盐;4,4'-双-(2-苯胺基-4(n-甲基-n-2-羟基-乙氨基)-s-三嗪-6-基氨基)芪-2,2'-二磺酸盐,4,4'-双-(4-苯基-2,1,3-三唑-2-基)芪-2,2'-二磺酸盐;4,4'-双-(2-苯胺基-4(1-甲基-2-羟基-乙氨基)-s-三嗪-6-基氨基)芪-2,2'-二磺酸盐和2-(二苯乙烯基-4"-萘-1.,2':4,5)-1,2,3-三唑-2"-磺酸盐。优选的荧光增白剂是tinopal(天来宝)dms和tinopal(天来宝)cbs,从ciba-geigyag(汽巴–嘉基股份有限公司),巴塞尔,瑞士可得。tinopal(天来宝)dms是4,4'-双-(2-吗啉代-4苯胺基-s-三嗪-6-基氨基)芪二磺酸盐的二钠盐。tinopal(天来宝)cbs是2,2'-双-(苯基-苯乙烯基)二磺酸盐的二钠盐。还优选的是,荧光增白剂是可商购的parawhitekx,由paramountmineralsandchemicals(派拉蒙矿物和化学品公司),孟买,印度供应。适合用于本发明的其他荧光剂包括1-3-二芳基吡唑啉和7-氨烷基香豆素。适合的荧光增白剂水平包括从约0.01wt%、从0.05wt%、从约0.1wt%或甚至从约0.2wt%的较低水平至0.5wt%或甚至0.75wt%的较高水平。污物释放聚合物:本发明的洗涤剂组合物还可以包括一种或多种污物释放聚合物,这些污物释放聚合物有助于从织物,例如棉的或聚酯基织物上除去污物,特别是从聚酯基织物上除去疏水污物。例如污物释放聚合物可以是非离子的或阴离子的对苯二酸酯基聚合物、聚乙烯基己内酰胺和相关共聚物、乙烯基接枝共聚物、聚酯聚酰胺,参见例如powdereddetergents,surfactantscienceseries(粉状洗涤剂,表面活性剂科学系列)71卷中,第7章,marceldekker,inc.(马塞尔·德克尔公司)。污物释放聚合物的另一类型是两亲烷氧基化的油污清洁聚合物,该聚合物包括芯结构和多个附接至该芯结构的烷氧基化基团。芯结构可以包括聚烷基亚胺结构或聚烷醇胺结构,如详述于wo2009/087523中(将其通过引用结合在此)。此外,随机接枝共聚物是适合的污物释放聚合物。适合的接枝共聚物更详细地描述于wo2007/138054、wo2006/108856和wo2006/113314中(将其通过引用结合在此)。其他污物释放聚合物是取代的多糖结构,尤其是取代的纤维素结构,例如改性纤维素衍生物,例如描述于ep1867808或wo2003/040279中的那些(将这二者都通过引用结合在此)。适合的纤维素聚合物包括纤维素、纤维素醚、纤维素酯、纤维素酰胺及其混合物。适合的纤维素聚合物包括阴离子改性的纤维素、非离子改性的纤维素、阳离子改性的纤维素、兼性离子改性的纤维素、及其混合物。适合的纤维素聚合物包括甲基纤维素、羧甲基纤维素、乙基纤维素、羟乙基纤维素、羟丙基甲基纤维素、酯羧甲基纤维素、及其混合物。抗再沉积剂:本发明的洗涤剂组合物还可以包括一种或多种抗再沉积剂,例如羧甲基纤维素(cmc)、聚乙烯醇(pva)、聚乙烯吡咯酮(pvp)、聚环氧乙烷和/或聚乙二醇(peg)、丙烯酸的均聚物、丙烯酸和马来酸的共聚物、和乙氧基化的聚乙亚胺。以上在污物释放聚合物下描述的基于纤维素的聚合物的功能还可以是抗再沉积剂。其他适合的辅料包括但不局限于防缩剂、抗皱剂、杀细菌剂、粘合剂、载体、染料、酶稳定剂、织物软化剂、填充剂、泡沫调节剂、助水溶剂、香料、色素、抑泡剂、溶剂、和用于液体清洁剂的结构剂和/或结构弹性剂。生物膜与当在常规的悬浮液培养中生长的相同的微生物相比,在生物膜中生长的微生物对所有类型的抗微生物剂变得较不敏感。熟知的是饥饿的细菌对多种抗微生物激发可以较不敏感得多。例如,多种经典的抗生素(例如青霉素)在缓慢或非分裂的细菌中表现不佳。因为溶菌酶不管细菌的生长状态而攻击并破坏肽聚糖层,所以它保持有效。生物膜控制;实例牙齿水线(dentalwaterline):仅举几例,在牙齿水线内形成的生物膜可以包含由铜绿假单胞菌、奇异变形杆菌、军团杆菌属组成的生物膜。作为抗回缩瓣膜故障的结果,通常在口腔中发现的物种也可能定植在该系统中。当涉及免疫功能低下的患者时,当然交叉感染的风险变得甚至更加是一个潜在的风险,并且在今天这个时代在这一分类中的患者的数目继续稳步增长。对有效控制细菌生物膜在牙齿水线的累积存在需要。生物膜的评论可以发现于:watnick(瓦特尼克)p和kolter(卡尔特拉)r(2000),“biofilm,cityofmicrobes(生物膜,微生物的城市)”,jbacteriol.(《细菌学杂志》);182(10):2675-9中。一种商业化的咽喉锭剂产品的典型实例是由法国勃林格殷格翰公司(boehringeringelheimfrance)生产的lysopaine有效成分:杆菌肽200u.i.(至65iu/mg)木瓜蛋白酶2mg至30nk/mg溶菌酶盐酸盐5mg至26000ufip/mg:单位,通过测量悬浮于缓冲液中的细菌的溶解的od动力学来确定的。通过由悬浮在缓冲液中的细菌培养物的裂解诱导的浊度的变化测量单位确定。非活性成分:糖精赋形剂硬脂酸镁赋形剂薄荷脑调味剂(aromatisant)山梨糖醇赋形剂对于点感染的局部治疗而言,将其限制在口咽的颊膜。警告,如果一般性的细菌感染的临床指征是明显的,那么建议抗菌素治疗。牙膏:溶菌酶可以单独使用或与其他酶或甚至抗微生物肽组合使用。其他酶的实例是葡萄糖氧化酶和乳过氧化物酶。一种包括溶菌酶的典型牙膏组合物是拉克利德公司(laclede,inc.),2030大学东路(eastuniversitydrive),牧场多明格斯(ranchodomiguez),加州90220,美国的“百特能(biotene)”。有效成分包含:乳过氧化物酶(100gm)无活性的成分葡萄糖氧化酶、溶菌酶、单氟磷酸钠、山梨糖醇、甘油、焦磷酸钙、水合硅石、木糖醇、纤维素胶、调味剂、苯甲酸钠、β-d-葡萄糖、硫氰酸钾以下实例进一步描述本发明,这些实例不应当解释为限制本发明的范围。实例菌株米曲霉mt3568菌株用于编码gh25酶的acremoniumalkalophilum基因的表达。米曲霉mt3568是米曲霉jal355的amds(乙酰胺酶)破坏的基因衍生物(wo2002/40694),其中通过用pyrg基因破坏米曲霉乙酰胺酶(amds)修复pyrg营养缺陷体。根据vorschnimmelkulture中央局(centralbureauvorschnimmelkulture),由a.yoneda(米田)在1984年从日本的津久井湖(tsukuilake)附近的猪粪便堆肥的污泥中分离出acremoniumalkalophilumcbs114.92。米曲霉toc1512用于编码gh25酶(seqid:7)以及变体的acremoniumalkalophilum基因的表达。米曲霉是一种可以被pyrg基因转化的pyrg缺陷型菌株并且通过其在不存在尿苷的情况下的生长能力来选择转化株。培养基和溶液yp培养基由10g的酵母提取物、20g的细菌用蛋白胨、以及加至1升的去离子水组成。lb培养基由10g的胰蛋白胨、5g的酵母提取物、5g的氯化钠、以及加至1升的去离子水组成。mdu-2bp培养基由每升45g麦芽糖-1h2o、7g酵母提取物、12gkh2po4、1gmgso4-7h2o、2gk2so4、5g尿素、1gnacl、0.5mlamg痕量金属溶液(ph5.0)组成。g2-gly培养基由18g的酵母提取物、24g的甘油(86%-88%)、1mldowfax63n10以及加至1升的去离子水组成。堀越(horikoshi)琼脂培养基由以下各项组成:1%(w/v)右旋糖、1%可溶性淀粉、0.5%(w/v)蛋白胨、0.5%(w/v)酵母提取物、0.02%(w/v)mgso4·7h2o、0.1%(w/v)k2hpo4、以及15g(w/v)的细菌用琼脂(bacto-agar)。在灭菌后分开添加1%(w/v)na2co3。细菌用琼脂板由lb培养基和每升15g的细菌用琼脂组成。pda琼脂板由马铃薯浸出液(马铃薯浸出液是通过将300g切片的(经过洗涤但未削皮)的马铃薯在水中煮沸30分钟,并且然后将该培养液倾析或滤过粗滤布而制成)组成。然后添加蒸馏水,直到悬浮液的总体积为一升,随后添加20g(w/v)的右旋糖和20g(w/v)的琼脂粉。该培养基通过在15psi下高压杀菌15分钟来进行灭菌(《细菌学分析手册》,第8版,修订a,1998)。cove蔗糖板由342g的蔗糖、20g的琼脂粉、20ml的cove盐溶液以及加至1升的去离子水组成。该培养基通过在15psi下高压杀菌15分钟来进行灭菌(《细菌学分析手册》,第8版,修订a,1998)。将该培养基冷却至60℃并且添加10mm的乙酰胺、15mm的cscl以及曲通x-100(50μl/500ml)。nano3蔗糖板由20mlcove盐溶液、20g的琼脂粉、342g蔗糖以及加至1升的去离子水组成。该培养基通过在15psi下高压杀菌15分钟来进行灭菌(《细菌学分析手册》,第8版,修订a,1998)。将该培养基冷却至60℃并且添加10mm的nano3以及曲通x-100(50μl/500ml)。lb琼脂板由37g的琼脂和加至1升的去离子水组成。cove盐溶液由26g的mgso4·7h2o、26g的kcl、26g的kh2po4、50ml的cove痕量金属溶液、以及加至1升的去离子水组成。cove痕量金属溶液由0.04g的na2b4o7·10h2o、0.4g的cuso4·5h2o、1.2g的feso4·7h2o、0.7g的mnso4·h2o、0.8g的na2moo4·2h2o、10g的znso4·7h2o以及加至1升的去离子水组成。amg痕量金属由每升14.3gznso4-7h2o、2.5gcuso4-5h2o、0.5gnicl2、13.8gfeso4、8.5gmnso4、3.0g柠檬酸组成。coven-gly斜面由10g的100%甘油、50ml的cove盐溶液、218g山梨糖醇、2.02gkno3、25g琼脂、以及加至1升的去离子水组成。实例1:溶菌酶测定野油菜黄单胞菌是所有黄原胶生产的产生生物。从高粘性黄原胶溶液中分离黄单胞菌细胞在工业生产中是一种成本密集型的工艺(homma(豪马)等人,ep690072,murofushi(木劳夫什)等人,ep718311,us5702927)。当今,从发酵液中回收黄原胶的受喜爱的方法是在巴氏灭菌以破坏细菌细胞和酶之后用醇沉淀,主要是异丙醇(cottrell(科特雷尔),w.i.;kang(康),s.k.dev(戴伍),(1978),“xanthangum:auniquebacterialpolysaccharideforfoodapplications(黄原胶:一种用于食物应用的独特的细菌多醣)”,ind.microbiol(《工业微生物学杂志》),19:177)。随后地,将黄原胶/细胞碎片沉淀物喷雾干燥并碾磨为粉末。通过蒸馏回收醇。因为在一些商业化的黄原胶制剂中存在显著量的黄单胞菌细胞壁碎片,并且这一碎片是富肽聚糖的黄单胞菌细胞壁材料,所以可以将该胶质用作肽聚糖降解活性的便利的测定。固体板测定:将商业上制备的黄原胶(西格玛(sigma)#g-1253)在0.7%的琼脂糖的存在下溶解于缓冲液或细菌生长培养基中,至0.5%w/v并且然后进行高压灭菌。将酶制剂、上清液或全生物存放在从细菌用琼脂平板剪切的孔中或直接存放在该培养基的表面。这些制备在平板上能够形成透明区(clearingzone)。这些透明区可以指示细菌细胞壁材料的降解。液体清理测定:将商业上制备的黄原胶在或不在氯化钠的存在下溶解于缓冲液中。将该溶解高压灭菌并且用于黄原胶清理研究。向该测定培养基中添加酶制剂、上清液或全生物并且进行孵育。在分光光度计中测量所得处理,以确定该溶液的od。典型地,使用600nm的波长。实例2:来自acremonioumalkalophilum的溶菌酶编码基因(seqidno:4)的克隆与表征由美国能源部联合基因组研究所(jgi)部门生成基因组的序列信息。根据vorschnimmelkulture中央局,由a.yoneda(米田)在1984年从日本的津久井湖(tsukuilake)附近的猪粪便堆肥的污泥中分离出acremoniumalkalophilumcbs114.92。从jgi下载基因组的初步装配并且使用pedant-protm序列分析套件(pedant-protmsequenceanalysissuite)(百玛士资讯公司(biomaxinformaticsag),马丁雷德,德国)进行分析。将由软件构建的基因模型用作检测基因组中的gh25同系物的起始点。使用多个作为向导的已知的gh25蛋白质序列构建更精确的基因模型。使acremoniumalkalophilumcbs114.92在30℃下,在堀越琼脂(ph9)上繁殖7天。直接从平板上收获菌丝体并且根据用于土壤的fastdnaspin试剂盒(fastdnaspinkitforsoil)(www.mpbio.com)分离dna。将dna在100ul10mmtris缓冲液、0.1mmedta(ph7.5)中进行洗脱并且在4℃下存储直到使用。设计在下表1中所示的合成寡核苷酸引物对来pcr扩增来自a.alkalophilum基因组dna的a.alkalophilumcbs114.92p242m9gh25基因。使用in-fusiontm克隆试剂盒(克罗泰克公司(clontech),山景,加州,美国)将该片段直接克隆进表达载体pdau109中(wo2005/042735)。表1:用于gh25pcr扩增的引物粗体字母代表编码序列。加下划线的序列与pdau109的插入位点是同源的。pcr反应(25μl)由12.5μl的2xiprooftmhfmastermix、0.5μl的引物f-p242m9(100μm)、0.5μl的引物r-p242m9(100μm)、0.5μl的基因组(100ng/μl)、以及11μl的去离子水组成。pcr反应(25μl)由phusion高保真dna聚合酶(phusionhigh-fidelitydnapolymerase)(目录号f-530s,赛默科技公司(thermoscientific),美国)、5ul5xpfusion缓冲液、0.5ul10mmdntp、0.5μl的引物f-p242m9(100μm)、0.5μl的引物r-p242m9(100μm)、0.5μl的基因组(100ng/μl)、以及18μl的去离子水组成。将pcr反应在dual-block热循环仪(dual-blockthermalcycler)(mj研究公司(mjresearchinc.),沃尔萨姆,马萨诸塞州,美国)中进行孵育,编程为95℃、2分钟,1个循环;98℃、10秒钟,72℃、2分钟,以及72℃、30秒钟,35个循环;以及72℃、10分钟,1个循环。在去除之前将样品冷却至12℃并且进一步处理。使用tae缓冲液通过1%琼脂糖凝胶电泳对五μl的pcr反应进行分析,其中观察到大约874bp产物带。根据制造商的说明,使用illustratmgfxtmpcrdna和凝胶带纯化试剂盒(illustratmgfxtmpcrdnaandgelbandpurificationkit)纯化剩余的pcr反应。然后使用in-fusiontm克隆试剂盒将该片段克隆进hindiii和bamhi消化的pdau109中,生成质粒pp242m9。将p242m9基因克隆进hindiii-bamhi消化的pdau109中导致棘孢曲霉p242m9基因在na2-tpi双启动子的控制下进行转录。na2-tpi是来自编码黑曲霉中性α-淀粉酶的基因的修饰的启动子,其中已经用来自编码构巢曲霉磷酸丙糖异构酶的基因的未翻译的前导子替换了未翻译的前导子。根据产生p242m9gh25构建体的in-fusiontm克隆试剂盒的说明进行克隆方案。根据制造商的方案,将处理的质粒和插入片段转化进fusionbluetm大肠杆菌细胞(克罗泰克公司,山景,加州,美国)中,并且将其铺板在补充有50μg的氨比西林/ml的lb板上。在37℃下孵育过夜后,看到菌落在lb氨比西林板上在选择下生长。根据制造商的说明,将十个用p242m9gh25构建体转化的菌落在补充有50μg的氨比西林/ml的lb培养基中进行培养并且使用来自5prime(5primegmbh,国王大街4a,22767汉堡,德国)的fast质粒迷你试剂盒(fastplasmidminikit)分离质粒。用载体引物对分离的质粒进行序列并且以便确定不含pcr错误的代表性质粒表达克隆。用应用生物系统公司3730xl型全自动dna测序仪(appliedbiosystemsmodel3730xlautomateddnasequencer),使用版本3.1big-dyetm终止子化学(应用生物系统公司(appliedbiosystems,inc.),福斯特城,加州,美国)和引物步移策略进行acremoniumalkalophilumcbs114.92gh25基因组克隆的dna测序。仔细检查核苷酸序列数据的质量,并且借助phred/phrap软件(华盛顿大学,西雅图,华盛顿州,美国)将所有序列互相比较。获得的序列与来自jgi的序列相同。acremoniumalkalophilump242m9gh25基因的核苷酸序列和推导的氨基酸序列分别示于seqidno:3和seqidno:4中。编码序列(包括终止密码子)是838bp并且被一个154bp(核苷酸148至301)的内含子中断。编码的预测蛋白质是227个氨基酸。使用signalp程序(nielsen(尼尔森)等人,1997,proteinengineering(《蛋白质工程》)10:1-6)预测出19个残基的信号肽。预测的成熟蛋白包含207个氨基酸。将米曲霉菌株mt3568用于所有的实验。米曲霉mt3568是米曲霉jal355的amds(乙酰胺酶)破坏的衍生物(wo2002/40694),其中在敲除米曲霉amds基因的过程中修复pyrg营养缺陷型。根据欧洲专利ep0238023,第14-15页的方法制备的米曲霉mt3568原生质体。制备新鲜的米曲霉mt3568原生质体并用pp242m9gh25质粒进行转化。使用上面的迷你制备程序(miniprepprocedure)的质粒dna用来转化米曲霉mt3568。将包含约3.0μg总dna的六ul用于转化。将dna轻轻地添加至100μl的米曲霉mt3568原生质体和250μl的60%peg4000(西格玛奥德里奇(sigma-aldrich)目录号95904)中。以下面的方式制备60%(w/v)peg4000:将peg4000粉末溶解于重蒸馏的h2o中并且然后在微波炉中、在800瓦特下加热10-20秒钟,直到溶解。将溶解的溶液冷却至室温并且然后用cacl2溶液和tris-hcl溶液(ph7.5)进行调节,每种溶液的终浓度为10mm。在添加60%peg4000溶液后,将试管进行轻轻混合并在37℃下孵育30分钟。将混合液添加至6ml具有10mm乙酰胺的顶层琼脂中并且将其铺板在具有10mm乙酰胺的cove-山梨糖醇板上。将这些板在37℃下孵育3天或更多天并且然后将其移至26℃,持续两天。通过首先将白色的10μl接种针(nunca/s公司,丹麦)浸泡在0.1%80溶液中,使形成孢子的菌落接触选择板,并且用该针在包含10mm乙酰胺的新鲜的cove山梨糖醇板上再划痕来从4个单独的菌落中挑取孢子。在26℃下5天后,使用来自再划痕的菌落的孢子接种96孔深碟板(nunc,目录号260251,赛默科技公司,美国)。深碟板的这些孔包含500ul的yp+2%葡萄糖或yp+2%麦芽糊精培养基。将接种的板用气体可渗透的胶带密封(89009-656,vwr.com)。将板在30℃下固定孵育5天。通过使用10%bis-tris凝胶(英杰公司(invitrogen),卡尔斯巴德,加州,美国)在sds-page上分析20ul的收获的培养液以及考马斯蓝染色对表达进行证实。选择一个转化体用于进一步的工作并且将其指定为米曲霉exp03864。将exp03864的孢子接种进dap-4c-1培养基(在具有挡板的500ml锥形摇瓶中的100ml)中。将这些培养物在26℃和150rpm下孵育3天并且如果必要的话孵育4天。使sds凝胶如上地跑胶,以测试蛋白量。用于溶菌酶活性的平板测试如在溶菌酶平板测定部分中所描述,在ph5、7和8下,用黄原胶进行斑点测定。在以下缓冲液中制备1.5%琼脂糖(英杰公司目录15510-027,电泳等级)溶液:ph~5-在水中ph~7-在0.02m磷酸钾(ph7)中ph~8-在0.02m磷酸钾(ph8)中将琼脂糖在121℃下高压灭菌20分钟。将0.5%黄原胶(西格玛g1253)溶解于融化的1.5%琼脂糖中并且将该混合物倾倒进皮氏平板(petriplate)中。当放置了这些平板时,用附接至真空线的p-1000吸管端(切断至3mm直径)制备样品应用孔。将20ul的exp03899培养液存放在应用孔中并且在37℃下孵育过夜。通过透明区观察具有溶菌酶活性的样品,在透明区中在黄原胶中观察到细胞碎片。来自exp03864的培养液展示出这样一个透明区,而米曲霉未转化的转化宿主mt3568未产生显而易见的透明区。将剩余的exp03899培养液通过具有0.22μm截留的fastpesbottletop过滤器过滤并且等分地存储在-20℃下,直到进一步使用。实例3:rda(径向扩散测定)最初,如早先由lehrer(莱勒)等人(莱勒ri,rosenman(罗森曼)m,harwig(哈文格)ss等人(1991),“ultrasensitiveassaysforendogenousantimicrobialpolypeptides(用于内源性抗微生物多肽的超灵敏测定)”,jimmunolmethods(《免疫学方法杂志》),137:167–73)所描述的,使用具有若干修饰的rda确认包含重组表达的溶菌酶的培养上清液和纯化的部分的抗微生物活性。简言之,将30ml具有1%琼脂糖的融化的1/10米勒-辛顿肉汤(mueller–hintonbroth)(mhb)(萨姆布鲁克j,fritsch(弗里奇)ef,maniatis(马尼亚蒂斯)t.《分子克隆实验指南》,冷泉港:冷泉港实验室出版社,1989)冷却至42℃,用肉葡萄球菌atcc51365或大肠杆菌dsm682(atcc10536)补充至5.0×105cfu/ml并且将其倾倒进单孔omnitray(nunc)板中。将omnitray板由tsp板(nunc)覆盖并且留待固化。1h后,除去tsp板;留下96个1-mm孔,在其中可以测试10μl的感兴趣的化合物。用10μl的测试溶液在每对孔上点斑并且将这些平板在37℃下孵育o/n。第二天,透明区指示测试细菌不生长并且由此指示抗微生物活性。通过用mtt(3-(4,5-二甲基噻唑-2-基)-2,5-二苯基溴化四氮唑,一种黄色的四唑)着色将透明区可视化,mtt在活细胞中被还原为紫色的甲臜(mosmann(莫斯曼)),tim(蒂姆)(1983),“rapidcolorimetricassayforcellulargrowthandsurvival:applicationtoproliferationandcytotoxicityassays(用于细胞生长和存活的快速比色测定:对增殖和细胞毒性分析的应用)”,journalofimmunologicalmethods(《免疫学方法杂志》)65(1–2):55–63)。这一着色为活细胞提供黑色着色并且不为没有活细胞的透明区提供着色。烟曲霉gh25溶菌酶(如披露于korczynska(考新斯卡)等人,actacryst.(《晶体学报》)(2010)f66,973-977中的进行制备)作为参照被包括在该测试中。已经在rda测定中对下表2中所示的纯化样品进行了测试。表2:gh24和gh25溶菌酶的径向扩散测定透明区的测量一式三份地进行该实验,所有都产生相同的被测透明区/抑制区(zoneofinhibition),参见图1。下面的表3示出了以mm为单位的透明区。表3:gh25溶菌酶针对肉葡萄球菌和大肠杆菌的抗微生物透明区。纯化的溶菌酶a.alcalophilumgh24(seqidno:4)显示出针对革兰氏阳性细菌肉葡萄球菌和革兰氏阴性细菌大肠杆菌的活细胞的抗微生物活性。在来自未转化的曲霉属生产宿主的培养上清液中不存在抗微生物活性(结果未示出)。在a.alcalophilumgh24(seqidno:2)的应用区(applicationzone)周围观察到具有不明确的边界的大的透明区。该实验指示a.alcalophilum溶菌酶(seqidno:2)和烟曲霉gh25参考溶菌酶针对在这一实例中的两种被测试的细菌具有不同的活性和特异性。实例4:浊度测定通过在分光光度计中测量被测的重悬溶壁微球菌(micrococcuslysodeikticus)attcno.4698(西格玛奥德里奇m3770)或不死微小杆菌(exiguobacteriumundea)(exiguobacteriumundea)的溶液在540nm下的吸光度/光密度的减少(下降)确定溶菌酶的活性。溶壁微球菌底物的制备在使用前,将这些细胞重悬在柠檬酸–磷酸盐缓冲液(ph6.5)中,至0.5mg细胞/ml的浓度并且在540nm下测量光密度(od)。然后调节细胞悬液,这样使得细胞浓度等同于od540=1.0。然后在使用之前将调节的细胞悬液冷冻存储。在4小时内使用重悬的细胞。柠檬酸–磷酸盐缓冲液(ph6.5)的制备将29ml0.1m柠檬酸与61ml0.2mna2hpo4混合,并且用hcl或naoh将ph调节至ph6.5。不死微小杆菌的干细胞的制备(底物)使不死微小杆菌(dsm14481)的培养物在500ml摇瓶中,在30℃、250rpm下,在100mllb培养基(fluka51208,25g/l)中生长过夜。然后将过夜的培养物在20℃和5000g下离心10分钟,并且将沉淀在无菌的milliq水中洗涤两次,并且将其重悬于milli-q水中。将洗涤的细胞在13000rpm下离心1分钟并且倾析尽可能的上清液。将洗涤的细胞在真空离心机中干燥1小时。将细胞沉淀重悬于柠檬酸–磷酸盐缓冲液(ph6.5)中,这样使得在540nm处的光密度(od)=1。在浊度测定中测量溶菌酶抗微生物活性将待测的溶菌酶样品稀释于柠檬酸–磷酸盐缓冲液(ph6.5)中,至浓度为100-200mg酶蛋白/l,并且将其保持在冰上直到使用。在一个96孔微量滴定板(nunc)中,向每个孔中添加200μl的底物,并且将该平板在versamax酶标仪(分子设备公司(moleculardevices))中在25℃或37℃下孵育5分钟。孵育后,在540nm处测量每个孔的吸光度(起始值)。为了开始测量活性,向每个底物(200μl)中添加20μl的稀释的溶菌酶样品并且在25℃或37℃下,在540nm处开始吸光度的动力学测量,持续最少30分钟长达24小时。监测每个孔在540nm处的测量的吸光度并且如果该溶菌酶具有溶菌酶活性,那么看到吸光度随着时间下降。烟曲霉gh25溶菌酶(考新斯卡等人(2010)同上)作为参照被包括在该测试中并且将结果示于下表4中。表4:如通过光密度下降所测量的gh25溶菌酶针对溶壁微球菌和不死微小杆菌的溶菌酶活性nt意指未被测试-意指没有影响+意指有小的影响++意指有中等影响+++意指有大的影响实例5:米曲霉中的p242m9gh25蛋白的纯化通过具有0.22μm截留的fastpesbottletop过滤器过滤具有溶菌酶的发酵上清液。用10%乙酸将ph调节至4.5。在调节ph后,该溶液变得有一点模糊并且通过具有0.22μm截留的fastpesbottletop过滤器过滤来去除这种模糊。在预处理后,通过在xk26柱中的大约50ml的sp琼脂糖(spsepharose)上的色谱法纯化约650ml包含该溶菌酶的溶液,使用50mm乙酸钠(ph4.5)作为缓冲液a并且使用50mm乙酸钠+1mnacl(ph4.5)作为缓冲液b。基于色谱图(在280nm和254nm处的吸收)和sds-page分析将来自该柱的部分进行池化。将池化的部分进行缓冲液交换进50mm乙酸钠(ph5.5)中,并且使用具有10kda截留的amicon自旋过滤器进行浓缩。如从sds-page中估算的分子量大约为22kda并且纯度>95%。实例6:p242m9gh25的温度稳定性测量了acremoniumalcalophilump242m9gh25溶菌酶(seqidno:4)的温度稳定性。这一研究的目的是确定在60℃-85℃下热处理后acremoniumalcalophilumgh25溶菌酶的残余活性。将样品在不同温度下孵育很短的时间(30s和60s),然后使用革兰氏阳性细菌滕黄微球菌作为底物在柠檬酸–磷酸盐缓冲液中,在37℃下测量残余活性,持续1h。使用od下降浊度测定来确定溶菌酶活性。热处理在不同温度下,在预热的pcr热循环仪(geneamppcr系统9700)中,在cremoniumalcalophilumgh25溶菌酶(seqidno:4)的缓冲液中进行热处理,持续30/60秒钟。使用60℃、65℃、70℃、75℃、80℃以及85℃持续30或60秒钟,然后将这些试管放在冰浴上用于瞬间冷却样品。浊度测定通过在分光光度计中测量被测的重悬滕黄微球菌(又名溶壁微球菌)attcno.4698(西格玛奥德里奇m3770)的溶液在540nm下的吸光度/光密度的下降(decrease,drop)确定溶菌酶的活性。滕黄微球菌底物的制备在使用之前,将这些细胞重悬在柠檬酸–磷酸盐缓冲液(通过将29ml0.1m柠檬酸与61ml0.2mna2hpo4混合并且用hcl或naoh调节至ph6.5而制备)中,至0.5mg细胞/ml的浓度并且在540nm处测量光密度(od)。然后调节细胞悬液,所以细胞浓度等同于od540=1.0。然后在使用之前将调节的细胞悬液冷冻存储。在4小时内使用悬浮的细胞。在浊度测定中测量溶菌酶抗微生物活性将溶菌酶样品稀释于柠檬酸–磷酸盐缓冲液中,至浓度为100-200mg酶蛋白/l,并且将其保持在冰上直到使用。在一个96孔微量滴定板(nunc)中,向每个孔中添加滕黄微球菌底物(200μl),并且将该平板在versamax酶标仪(分子设备公司)中在37℃下孵育5分钟。孵育后,在540nm处测量每个孔的吸光度(起始值)。为了开始测量活性,向每个孔中的ph调节的稀释底物(200μl)中添加稀释的溶菌酶样品(20μl)并且在37℃下,在540nm处开始吸光度的动力学测量,持续最少30分钟长达24小时。监测每个孔在540nm处的测量的吸光度并且如果该溶菌酶具有抗微生物活性,那么看到吸光度随着时间下降。将在t=0和时间点的吸光度之间的差异计算为δod并且在测试底物之间进行比较(表5和图2)。通过将热处理的样品的δod与未被热处理的样品的δod进行比较来计算百分比剩余活性。一式三份地进行上述实验。表5:如通过od下降测量的p242m9gh25溶菌酶的温度稳定性表6:p242m9gh25溶菌酶的百分比剩余活性结果显示甚至在85℃下30秒钟后p242m9gh25溶菌酶是稳定的并且在85℃下甚至在60秒钟后该gh25溶菌酶保留超过80%活性。实例7:使用dsc确定的p242m9gh25的热稳定性使用预包装的pd-10柱,将如在实例7中纯化的溶菌酶(p242m9gh25)的蛋白样品的等分部分进行缓冲液交换(参见下表中的缓冲液)。将该样品进行0.45μm过滤并且用缓冲液稀释至大约2a280单位。将该缓冲液用作参考溶液。使用配备有自动采样器的vp-capillarydsc仪器(microcal公司,皮斯卡塔韦,新泽西州,美国)通过差示扫描量热法(dsc)确定该溶菌酶在不同ph值中的热稳定性。将以恒定程序化加热速率加热缓冲液中的溶菌酶溶液后获得的温度自记曲线(cp对t)中热变性峰值(主吸热峰)作为热变性温度,td(℃)。将样品和参考溶液(大约0.5ml)在20℃下用热方法预平衡10分钟并且以200k/小时的扫描速率在从20℃至110℃进行dsc扫描。使用microcalorigin软件(版本7.0383)处理数据。以大约+/-0.5℃的精确度确定变性温度。将dsc测量值的结果总结于表7和图3中。表7:p242m9gh25溶菌酶的变性温度实例8:来自acremonioumalkalophilum的溶菌酶编码基因(seqidno:8)的克隆与表达基于被鉴定为seqidno:3的核苷酸序列,由geneart(geneartagbiopark公司,约瑟夫-恩格特大街(josef-engert-str.)11号,93053,雷根斯堡,德国)合成具有seqidno:7的合成基因。使用在下表8中列出的pcr引物组来pcr扩增合成的gh25基因。用于克隆目的,将限制酶切位点bamhi和ecori引入进pcr片段的末端(在下面所列的引物序列中将限制酶切位点加下划线并且粗体字母代表编码序列)。表8:用于gh25的pcr扩增的引物将pcr片段旋转纯化,用bamhi和ecori(新英格兰生物实验室(newenglandbiolabs))消化并且使用快速dna连接试剂盒(rapiddnaligationkit)连接进双米曲霉/大肠杆菌质粒表达载体peni1898中,该表达载体已经首先用bamhi和ecori进行了消化。peni1898修饰自载体peni1861(wo03/070956),因为已经通过用hindiii消化该载体随后重新连接琼脂糖凝胶纯化的载体去除了ama序列(clutterbuck(克拉特巴克)a.j.等人(1991)gene(《基因》)98(1):61-67)。进一步地,peni1861携带pyrg基因并且能够补足pyrg缺陷型曲霉属菌株。在室温下孵育5分钟之后,将该连接反应转化进感受态大肠杆菌top10细胞(英杰公司)中,将其铺板在包含150μg/ml氨比西林的lb琼脂板上。将平板在37℃下孵育16小时。从选定的转化株中纯化质粒dna,并且对其进行测序,用于证实克隆程序。编码的预测蛋白质是248个氨基酸并且包含一个23个残基的信号肽以及207个氨基酸的成熟蛋白。seqidno:4的成熟序列与seqidno:8的成熟序列相同。实例9:溶菌酶gh25变体的克隆与表达gh25基因的变体对在合成的gh25溶菌酶基因中包含一个单一的氨基酸改变的10个变体进行克隆和表达。gh25溶菌酶的变体由如下的单一的取代组成:w10h、y28m、s39d、g92p、a93m、e97a、v133m、t142n、f178i或d190a。gh25的变体的克隆为了产生如上所述的gh25变体,用引入了所希望的序列改变(取代)的诱变引物进行基于pcr的定点诱变。设计引物,这样使得突变位于具有足够侧翼核苷酸(15-25个)的寡核苷酸的中部。将包含gh25的质粒dna用作模板并且用校正dna聚合酶(phusiondna聚合酶(新英格兰生物实验室))建立pcr。根据来自制造商的说明,使用pcr产物来转化感受态大肠杆菌top10细胞(英杰公司)。从单克隆转化的大肠杆菌菌株中分离质粒dna并且对其测序,以证实所希望的取代的存在。gh25和变体的转化与表达将编码溶菌酶基因的质粒dnapeni1898用于转化进如在实例2中所述的米曲霉toc1512原生质体中(wo2005/070962)并且将其铺板在不具有尿苷的nano3蔗糖板上,用于选择携带正确的构建体的转化株。将平板在37℃下孵育72小时。通过在37℃下,将菌落在nano3蔗糖板上再划痕、持续72小时并且使其在34℃下、在yp培养基中生长72小时来分离单一的菌落。在通过在处于ph6.4的50mm3,3二甲基戊二酸中的浊度测定检查发酵液以后选择表达溶菌酶的菌落,用溶壁微球菌细胞壁作底物。进一步地,通过sds-page分析可视化检查一个大约23kda的条带来确认溶菌酶的表达。将表达溶菌酶的转化株再划痕并且使其在37℃下、在coven-gly斜面上再生长5天并且将其接种进200ml的g2-gly摇瓶中。在30℃下伴随剧烈搅拌培养1天后,将3ml的每个培养物转移进摇瓶中的200ml的mdu-2bp中,以在30℃下培养3天。以类似于在上面的实例6中纯化p242m9gh25溶菌酶的方式纯化培养液。实例10:抗微生物活性针对两种产气荚膜梭菌菌株测试p242m9gh25溶菌酶、合成的gh25溶菌酶以及11个合成的gh25溶菌酶的变体的抗微生物活性。方法与材料通过测量在暴露于溶菌酶之前和之后的产气荚膜梭菌培养物的菌落形成单位的光密度和数目来确定该活性。将产气荚膜梭菌暴露于活性溶菌酶将导致杀死细菌以及光密度(od-下降)和菌落形成单位的数目的相对应的下降。简言之,将溶菌酶母液在pbs(ph6)中稀释至50μg/ml的浓度。在pbs(ph6)中进行这些50μg/ml溶液的两倍稀释系列,至0.4μg/ml的结束浓度。然后,将产气荚膜梭菌的过夜培养物重悬于pbs(ph6)中。测量od546并将其调节至1。将培养物(75μl)与制备的溶菌酶-溶液(75μl)1:1混合在微量滴定板(nunc)中,这导致产气荚膜梭菌暴露于从0.4-25μg/ml变化的终浓度的溶菌酶(在总对溶菌酶中7个浓度)。在42℃下,在厌氧条件下,将培养物向溶菌酶暴露4小时。在时间点0和暴露后4小时测量od546和cfu/ml。结果将测试活性的结果示于表9、10和11以及图4和5中。表9示出了gh25溶菌酶或变体的产气荚膜梭菌的两个菌株/ml的菌落形成单位(cfu/ml)的减少。暴露于活性溶菌酶典型地导致cfu/ml的1-2log的减少。如果cfu/ml的减少≥1log,那么将溶菌酶活性评估为显著。表10示出了当暴露于gh25lysozymep242m9(seqidno:4)、合成的gh25溶菌酶(seqidno:8)或seqidno:8的11个变体时,产气荚膜梭菌nn01260的光密度下降(δod)。表11示出了当暴露于gh25lysozymep242m9(seqidno:4)、合成的gh25溶菌酶(seqidno:8)或seqidno:8的11个变体时,产气荚膜梭菌临床分离株的光密度下降(δod)。表9:当用野生型和变体gh25溶菌酶处理时,产气荚膜梭菌的cfu/ml的下降++在测试的溶菌酶浓度的全范围内的显著活性。+针对测试的减少数目的溶菌酶浓度的显著活性。-溶菌酶没有显著活性。表10:当用野生型和变体gh25溶菌酶处理时,产气荚膜梭菌nn011260的od-下降*三个生物重复的平均值表11:当用野生型和变体gh25溶菌酶处理时,产气荚膜梭菌临床分离株的od-下降*三个生物重复的平均值这些结果显示9个位置的突变不导致溶菌酶活性的丢失。然而,位置97的突变导致活性的丢失,这指示这一位置不能被突变。实例11:ph活性曲线针对一系列ph值,通过在分光光度计中测量被测的重悬滕黄微球菌attcno.4698(西格玛奥德里奇m3770)的溶液在540nm下的吸光度/光密度的下降(decrease,drop)来确定本发明的溶菌酶的ph活性曲线以便确定在哪个ph处该gh25溶菌酶或变体具有峰值溶菌酶活性。如在实例6中所述的制备滕黄微球菌底物。如在实例6中所述的测量溶菌酶抗微生物活性,除了在开始实验之前用hcl或naoh将柠檬酸-磷酸盐缓冲液调节至以下ph之一:3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5以及7.0。一式两份地或一式三份地进行上面描述的实验并且将结果给出于下面的表12中。表12:野生型和变体gh25溶菌酶的ph活性曲线结果显示与野生型溶菌酶相比,具有取代y28m、g92p、a93m、v133m、t142n或f178i的本发明的gh25溶菌酶变体保留抗微生物活性,在ph活性曲线中没有显著改变。具有取代w10h或s39d的本发明的gh25溶菌酶变体导致改变的ph曲线,这样使得ph曲线增加0.5ph单位同时保留抗微生物活性。实例12:胃稳定性在包含胃蛋白酶的人工胃液(ph2)中孵育长达1小时后,通过浊度测定测试母鸡蛋白溶菌酶、a.alcalophilumgh25溶菌酶(seqidno:8)和两种变体(w10h和s39d)的活性。然后将这一活性与在相同或相当但是没有用包含胃蛋白酶的胃液进行孵育的条件下得到的每种溶菌酶的标准曲线进行比较。将不同的溶菌酶在人工胃液中孵育0、15、30或60分钟的时间跨度。孵育后,添加一种终止缓冲液,以升高ph并且由此阻止低ph和胃蛋白酶降解溶菌酶的肽键。使胃蛋白酶失活后,与所讨论的用于比较的不同浓度的溶菌酶的标准曲线一起进行活性浊度测定。人工胃液:(hclph2,1mg/ml胃蛋白酶,0.1mnacl)。溶液a:0.01mhcl,0.1mnacl(通过将275μl1mhcl与2.5ml1mnacl混合并添加22.23mlmq水,至25ml的总体积而制备)。溶液b:0.01mhcl,0.1mnacl,10mg/ml胃蛋白酶(通过称出50mg胃蛋白酶并添加5ml溶液a而制备)。标准曲线的制备向每个微量滴定孔中添加人工胃液(160μl),随后添加20μl柠檬酸-磷酸盐缓冲液(对于母鸡蛋白溶菌酶而言是ph7,对于a.alcalophilumgh25溶菌酶而言是ph4并且对于变体w10h和s39d而言是ph4.5)。添加溶菌酶溶液(20μl),然后向每个孔中添加滕黄微球菌底物(20μl,如在实例6中所描述而制备)(标准曲线以及时间序列样品)并且在37℃下每分钟测量od540nm、持续一小时。如在实例6中所描述地测量溶菌酶抗微生物活性,除了通过添加hcl或naoh针对不同溶菌酶(如在先前段落中所给出的)将柠檬酸-磷酸盐缓冲液调节至最佳ph以外。一式两份地进行上面描述的实验并且将结果给出于下面的表13中。表13:在用人工胃液孵育之后,溶菌酶的残余活性甚至在15分钟后,在人工胃液中孵育之后,母鸡蛋白溶菌酶的剩余溶菌酶活性便大大减少。相比之下,来自acremoniumalcalophilum的gh25溶菌酶的活性未显示出减少。另外,具有取代w10h或s39d的两个gh25变体也保留溶菌酶活性,展示出与来自acremoniumalcalophilum的gh25溶菌酶相似的残余活性。实例13:基因组dna的分离将添加acremoniumalcalophilumgh25溶菌酶(seqidno.8)以及母鸡蛋白溶菌酶和acremoniumalcalophilumgh25溶菌酶(seqidno.8)的组合的细菌基因组dna纯化的收率与不具有溶菌酶并单独地具有母鸡蛋白溶菌酶的dna纯化进行比较。从五种不同的细菌中分离基因组dna。方法通过用接种环从琼脂板上刮掉细胞或通过离心液体培养物来获得细菌质量(参见表14)。使用修饰版本的qiaampdna血液迷你试剂盒(qiaampdnabloodminikit)(目录号51106)分离dna并且使用qiagenqiacube或手动工艺进行纯化。表14:测试的细菌菌株、细菌起始材料和纯化方法综述。使用qiacube分离dna:将适合一个10μl接种环的菌落刮屑重悬于3mlm9缓冲液(通过将8.77gna2hpo.2h2o、3gkh2po4、4gnacl以及0.2gmgso4.7h2o溶解于1000mlh2o中并且用naoh或hcl将ph调节至7而制备)中。将该溶液在3000rpm下离心5min并且将沉淀重悬于3mlp1缓冲液(被包括在qiagen试剂盒#51106中)中。将200μl等分部分添加至122ml试管中并且一式三份地向试管中添加15μl的水、a.alcalophilumgh25溶菌酶(10mg/ml)、母鸡蛋白溶菌酶(10mg/ml)或a.alcalophilumgh25溶菌酶(10mg/ml)+母鸡蛋白(10mg/ml)1:1混合物。将试管放置在qiacube中并且根据qiagen的推荐进行处理。手动dna分离:将液体培养物沉淀和菌落刮屑重悬于3mlm9缓冲液中。将细菌的m9缓冲液悬浮液在3000rpm下离心5min并且将沉淀重悬于3mlp1缓冲液中。将200μl等分部分添加至122ml试管中并且一式三份地向试管中添加15μl的水、a.alcalophilumgh25溶菌酶(10mg/ml)、母鸡蛋白溶菌酶(10mg/ml)或a.alcalophilumgh25溶菌酶(10mg/ml)+母鸡蛋白(10mg/ml)1:1混合物。将试管在37℃下孵育30min,然后添加25μlqiagen蛋白酶和200μlqiagen缓冲液al。然后,将这些试管在56℃下孵育20min。接下来,向每个试管中添加210μl96%乙醇。将这些试管涡旋并且将液体转移至qiagen旋转柱上并且在8000rpm下离心1min。将这些柱用500μlaw1缓冲液(被包括在qiagen试剂盒#51106中)洗涤两次。在第一次洗涤之后,将这些柱在8000rpm下离心1min,并且在第二次洗涤之后,将这些柱在15000rpm下离心3min。通过向每个柱中添加100μlmilliq水(加热至70℃)将基因组dna从柱洗脱,在室温下孵育1min并且在8000rpm下将其离心1min进艾本德(eppendorf)试管中。所有孵育一式三份地重复。结果通过使分离的dna在琼脂糖凝胶上跑胶并且可视地检查dna带的强度来估算基因组dna的收率(表15)。通过眼睛使用4个不同的评分估算在每种细菌菌株的4个不同处理之间的相对dna收率。表15:在acremoniumalcalophilumgh25溶菌酶(seqidno.8)和母鸡蛋白溶菌酶的不同组合之间的基因组dna收率的比较通过眼睛使用以下量度为收率打分:-没有看见dna带+弱带++中等带+++强带。与母鸡蛋白溶菌酶相比,在6种情况中有3种,使用a.alcalophilumgh25溶菌酶给出一样好的或更好的基因组dna收率。与任一单独的溶菌酶相比,在6种情况中有3种,使用a.alcalophilumgh25溶菌酶和母鸡蛋白溶菌酶的组合给出一样好的或更好的基因组dna收率。序列表<110>诺维信a/s<120>具有溶菌酶活性的多肽和编码所述多肽的多核苷酸<130>12166-ep-epa<160>10<170>patentin版本3.5<210>1<211>782<212>dna<213>acremoniumalcalophilum<220><221>cds<222>(1)..(133)<220><221>信号肽<222>(1)..(57)<220><221>cds<222>(215)..(345)<220><221>cds<222>(516)..(779)<400>1atggtctctttcaagcagctcgccctcctggcactgggcgccgtccaa48metvalserphelysglnleualaleuleualaleuglyalavalgln151015gtacaggcgcagtgcgtcggcccggctatcaattccgcggctcttaac96valglnalaglncysvalglyproalaileasnseralaalaleuasn202530ctcatcaaggagtttgagggatggaggcccaacatttgtgcgttccc143leuilelysgluphegluglytrpargproasnile3540ttctacgttacatcacccagttcccttgttattcagacattatttctatattcctggcta203acactgtaaagaccgcgaccccgtcggcctccccaccgtcggatacggc252tyrargaspprovalglyleuprothrvalglytyrgly455055cacctctgccgcgactcgagctgctctgacgtcccttacccaattccc300hisleucysargaspsersercysseraspvalprotyrproilepro606570ctgtccgttgccaacggcgagcgtctccttcggagcgacctagcg345leuservalalaasnglygluargleuleuargseraspleuala758085gtgagtctatcccctttgcacttcataaaacgtcgccttctctgttgtcattctacctgg405acagcctccccctatttctctcttctatcttttcttctttcccgttctgcaagcttgacc465cctgaccaaccatatccacccagacctaccagaactgcatcacgatgcagacggcc521thrala90tcgtccgtcgtcctgaatgcgaaccagtacggcgccctggtcagctgg569serservalvalleuasnalaasnglntyrglyalaleuvalsertrp95100105gccttcaacgtcggctgcggcgccaccagcacgtcgactctgatccgc617alapheasnvalglycysglyalathrserthrserthrleuilearg110115120cgcctcaacgccggagagagccccaacaccgtcgctgcccaggagctg665argleuasnalaglygluserproasnthrvalalaalaglngluleu125130135cctcgctggaacaaggctggcggccaggtcctgcccggcctggtgcgc713proargtrpasnlysalaglyglyglnvalleuproglyleuvalarg140145150cgccgtgctgccgaggtagagctgcatcgtacttccaccagtgtccgt761argargalaalagluvalgluleuhisargthrserthrservalarg155160165170gctctgcctgcttgctcttag782alaleuproalacysser175<210>2<211>176<212>prt<213>acremoniumalcalophilum<400>2metvalserphelysglnleualaleuleualaleuglyalavalgln151015valglnalaglncysvalglyproalaileasnseralaalaleuasn202530leuilelysgluphegluglytrpargproasniletyrargasppro354045valglyleuprothrvalglytyrglyhisleucysargaspserser505560cysseraspvalprotyrproileproleuservalalaasnglyglu65707580argleuleuargseraspleualathralaserservalvalleuasn859095alaasnglntyrglyalaleuvalsertrpalapheasnvalglycys100105110glyalathrserthrserthrleuileargargleuasnalaglyglu115120125serproasnthrvalalaalaglngluleuproargtrpasnlysala130135140glyglyglnvalleuproglyleuvalargargargalaalagluval145150155160gluleuhisargthrserthrservalargalaleuproalacysser165170175<210>3<211>838<212>dna<213>acremoniumalcalophilum<220><221>cds<222>(1)..(147)<220><221>信号肽<222>(1)..(57)<220><221>cds<222>(302)..(835)<400>3atgaagcttcttccctccttgattggcctggccagtctggcgtccctc48metlysleuleuproserleuileglyleualaserleualaserleu151015gccgtcgcccggatccccggctttgacatttcgggctggcaaccgacc96alavalalaargileproglypheaspileserglytrpglnprothr202530accgactttgcaagggcgtatgctaatggagatcgtttcgtctacatc144thraspphealaargalatyralaasnglyaspargphevaltyrile354045aaggtacgttcaaccttgccaccaagttgcgaacccgagacaagactgtgacc197lysgcctcctttgccctggggcagctcacgcacccagcagcatcccatcccccggccccccac257gtaccaccggaaagctaacatcaaccccctaccactgctaccaggccaccgagggc313alathrglugly50accacattcaagagctccgcattcagccgccagtacaccggcgcaacg361thrthrphelysserseralapheserargglntyrthrglyalathr556065caaaacggcttcatccgcggcgcctaccacttcgcccagcccgccgcg409glnasnglypheileargglyalatyrhisphealaglnproalaala70758085tcctcgggcgccgcgcaggcgagatacttcgccagcaacggcggcggc457serserglyalaalaglnalaargtyrphealaserasnglyglygly9095100tggtccaaggacggcatcaccctgcccggggcgctggacatcgagtac505trpserlysaspglyilethrleuproglyalaleuaspileglutyr105110115aaccccaacggcgccacctgctacggcctctcgcaatcggccatggtg553asnproasnglyalathrcystyrglyleuserglnseralametval120125130aactggatcgaggactttgtcaccacctaccacggcatcacctcccgc601asntrpilegluaspphevalthrthrtyrhisglyilethrserarg135140145tggcccgtcatctacaccaccaccgactggtggacccagtgcaccggc649trpprovaliletyrthrthrthrasptrptrpthrglncysthrgly150155160165aactccaaccgcttcgcgaaccgctgcccgctgtggatcgcccgctac697asnserasnargphealaasnargcysproleutrpilealaargtyr170175180gccagctccgtcggcactctgcccaatggctggggcttttacaccttc745alaserservalglythrleuproasnglytrpglyphetyrthrphe185190195tggcagtacaacgacaagtatcctcagggcggtgattcgaactggttc793trpglntyrasnasplystyrproglnglyglyaspserasntrpphe200205210aacggcgatgcgtcgcgtctcagggctctcgctaacggagactaa838asnglyaspalaserargleuargalaleualaasnglyasp215220225<210>4<211>227<212>prt<213>acremoniumalcalophilum<400>4metlysleuleuproserleuileglyleualaserleualaserleu151015alavalalaargileproglypheaspileserglytrpglnprothr202530thraspphealaargalatyralaasnglyaspargphevaltyrile354045lysalathrgluglythrthrphelysserseralapheserarggln505560tyrthrglyalathrglnasnglypheileargglyalatyrhisphe65707580alaglnproalaalaserserglyalaalaglnalaargtyrpheala859095serasnglyglyglytrpserlysaspglyilethrleuproglyala100105110leuaspileglutyrasnproasnglyalathrcystyrglyleuser115120125glnseralametvalasntrpilegluaspphevalthrthrtyrhis130135140glyilethrserargtrpprovaliletyrthrthrthrasptrptrp145150155160thrglncysthrglyasnserasnargphealaasnargcysproleu165170175trpilealaargtyralaserservalglythrleuproasnglytrp180185190glyphetyrthrphetrpglntyrasnasplystyrproglnglygly195200205aspserasntrppheasnglyaspalaserargleuargalaleuala210215220asnglyasp225<210>5<211>41<212>dna<213>人工序列<220><223>正向引物f-p242m9<400>5acacaactggggatccaccatgaagcttcttccctccttga41<210>6<211>38<212>dna<213>人工序列<220><223>反向引物r-p242m9<400>6agatctcgagaagcttattagtctccgttagcgagagc38<210>7<211>747<212>dna<213>人工序列<220><223>合成构建体<220><221>cds<222>(1)..(744)<220><221>信号肽<222>(1)..(69)<220><221>成熟肽<222>(121)..(744)<400>7atgaagttcttcaccaccatcctcagcaccgccagccttgttgctgct48metlysphephethrthrileleuserthralaserleuvalalaala-40-35-30-25ctccccgccgctgttgactcgaaccataccccggccgctcctgaactt96leuproalaalavalaspserasnhisthrproalaalaprogluleu-20-15-10gttgcccggagtcctattcgtcgacgcattcccggattcgatatctcg144valalaargserproileargargargileproglypheaspileser-5-115ggatggcagccgacgacggacttcgcaagggcgtacgcaaacggagac192glytrpglnprothrthraspphealaargalatyralaasnglyasp101520cgattcgtgtacatcaaggcaacagagggaacaacattcaaatcgtcg240argphevaltyrilelysalathrgluglythrthrphelysserser25303540gcattctccaggcagtacaccggagcaacccagaacggcttcatccga288alapheserargglntyrthrglyalathrglnasnglypheilearg455055ggagcctaccacttcgcccagcctgcagcctcctcgggagcagcccag336glyalatyrhisphealaglnproalaalaserserglyalaalagln606570gcaaggtacttcgcatcgaacggtggcggttggtccaaggacggtatc384alaargtyrphealaserasnglyglyglytrpserlysaspglyile758085accctccctggtgccttggatatcgagtacaaccccaacggagcaaca432thrleuproglyalaleuaspileglutyrasnproasnglyalathr9095100tgttatggtctctcgcagtcggcgatggtgaactggattgaggacttc480cystyrglyleuserglnseralametvalasntrpilegluaspphe105110115120gtgacaacctaccacggcatcacctcgaggtggcctgtgatctacacc528valthrthrtyrhisglyilethrserargtrpprovaliletyrthr125130135acaaccgactggtggacgcagtgtaccggcaactccaaccgattcgcg576thrthrasptrptrpthrglncysthrglyasnserasnargpheala140145150aacaggtgtccgctctggatcgcgaggtatgcctcctccgtcggcacc624asnargcysproleutrpilealaargtyralaserservalglythr155160165ctcccgaacggatggggcttctataccttctggcagtacaacgataag672leuproasnglytrpglyphetyrthrphetrpglntyrasnasplys170175180tacccccagggaggagattccaactggttcaacggtgatgcatcgagg720tyrproglnglyglyaspserasntrppheasnglyaspalaserarg185190195200ctcagggcattggcgaacggcgattag747leuargalaleualaasnglyasp205<210>8<211>248<212>prt<213>人工序列<220><223>合成构建体<400>8metlysphephethrthrileleuserthralaserleuvalalaala-40-35-30-25leuproalaalavalaspserasnhisthrproalaalaprogluleu-20-15-10valalaargserproileargargargileproglypheaspileser-5-115glytrpglnprothrthraspphealaargalatyralaasnglyasp101520argphevaltyrilelysalathrgluglythrthrphelysserser25303540alapheserargglntyrthrglyalathrglnasnglypheilearg455055glyalatyrhisphealaglnproalaalaserserglyalaalagln606570alaargtyrphealaserasnglyglyglytrpserlysaspglyile758085thrleuproglyalaleuaspileglutyrasnproasnglyalathr9095100cystyrglyleuserglnseralametvalasntrpilegluaspphe105110115120valthrthrtyrhisglyilethrserargtrpprovaliletyrthr125130135thrthrasptrptrpthrglncysthrglyasnserasnargpheala140145150asnargcysproleutrpilealaargtyralaserservalglythr155160165leuproasnglytrpglyphetyrthrphetrpglntyrasnasplys170175180tyrproglnglyglyaspserasntrppheasnglyaspalaserarg185190195200leuargalaleualaasnglyasp205<210>9<211>46<212>dna<213>人工序列<220><223>正向引物bamhi<400>9tacacaactggggatccagcggccgcaccatgaagttcttcaccac46<210>10<211>37<212>dna<213>人工序列<220><223>反向引物ecori<400>10atacttgtccgaattcctaatcgccgttcgccaatgc37当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 奶牛金黄色葡萄球菌乳房炎亚单位的疫苗及其制备方法和应用与流程
- 奶牛金黄色葡萄球菌乳房炎亚单位疫苗的组合物及其制备方法和应用与制造工艺
- 含水流动状组合物及其制造方法、以及溶菌酶加工品和/或其盐、及其制造方法与制造工艺
- 一种纳米材料/群体感应淬灭酶颗粒改性复合膜制备方法与制造工艺
- 一种检测泪液中乳铁蛋白的专用胶体金检测卡的制造方法与工艺
- 一种鸡溶菌酶和鸡β‑防御素7融合基因及其制备方法与制造工艺
- 一种制备治疗敏感菌感染性疾病的药物盐酸头孢他美酯组合物的方法与制造工艺
- 含有复合益生元溶菌酶功能性无糖软糖及其制备方法与制造工艺
- 运用核酸适配体与溶菌酶特异性识别并形成G四链体进行荧光显现潜指纹的方法与制造工艺
- 用于制备结晶DTPMP的方法与制造工艺