一种天目琼花枝叶木脂素及提取方法和用途与流程
本发明属于天然产物技术领域,尤其涉及一种天目琼花枝叶木脂素成分提取方法和用途。
背景技术:
天目琼花(Viburnum sargentii)是忍冬科(Caprifoliaceae)荚蒾属(Viburnum)植物。我国黑龙江、吉林、辽宁、河北北部、山西、陕西南部、甘肃南部,河南西部、山东、安徽南部和西部、浙江西北部、江西(黄龙山)、湖北和四川均有分布。其味甘、苦,性平,入肺、肝、脾、肾四经,有通经活络、活血消肿、祛风杀虫之功效。现代药理研究表明天目琼花的果实能够治疗慢性支气管炎、咳嗽痰喘、抗肿瘤等作用,而对天目琼花的木脂素类成分提取方法的研究未见报道。本发明首次对泰山野生天目琼花化学成分进行系统研究,为进一步开发利用该植物提供科学依据。
木脂素是一类结构多样的天然化合物,具有广泛的生物活性,存在于多种植物中。现代药理研究表明木脂素具有抵抗多种肿瘤细胞、抗炎抗病毒、抗氧化、调节血浆胆固醇等药理作用。木脂素结构复杂多变,多数呈游离型,为亲脂性成分,少数与糖结合成苷。如何从植物中提取、制备高纯度的木脂素单体,是开发相关产品的关键技术之一,现有技术中公开的几种常用提取法为有机溶剂提取法、超声波提取法、二氧化碳超临界等提取技术。有机溶剂提取法和超声波提取法主要是对药材药用成分的前期批量萃取的粗提取手段;二氧化碳超临界提取技术虽然融合了萃取和分离技术,但提取的极性范围有限,对提取挥发油成分比较好使;而木脂素类化合物结构复杂多变,与植物叶绿素和脂质成分混合难以分离、纯化,利用现有方法很难分离到高纯度木脂素类化合物单体。为此,本发明所要解决的技术问题在于提供一种采用“有机溶剂萃取法”“超声波提取法”和“柱色谱法”相结合的方法从天目琼花枝叶中提取高纯度的木脂素单体,并探索其医药用途。
动脉粥样硬化疾病是指高脂饮食诱导的高脂血症、氧化应激或炎症等因素引起的动脉粥样硬化性疾病。多糖抗动脉粥样硬化的研究较多,对木脂素单体的抗动脉粥样硬化研究未见报道。
技术实现要素:
本发明的目的是提供天目琼花枝叶木脂素成分提取方法,旨在解决目前的提取方法不能获得高纯度天目琼花木脂素类化合物单体及抗动脉粥样硬化的活性的问题。
本发明是这样实现的,一种天目琼花木脂素的提取方法,所述天目琼花木脂素的提取方法包括如下步骤:
步骤一,将干燥的天目琼花枝叶粉碎后用95%乙醇室温冷浸48~72小时渗漉提取,乙醇提取液用30L旋转蒸发仪减压浓缩,将蒸出乙醇倒回渗漉罐子冷浸24~48小时;对药粉进行二次渗漉提取,二次浓缩,将蒸出乙醇再次倒回渗漉罐子冷浸24~48小时;对药粉进行第三次渗漉提取,三次浓缩,回收乙醇,至浓缩液无醇味,得总浸膏,回收乙醇;
步骤二,使用恒温超声仪温水混悬浸膏,分别使用1倍~1.5倍的石油醚、氯仿、乙酸乙酯和正丁醇依次萃取,减压浓缩,分别得到4个部位不同极性组分的浸膏;
步骤三,取氯仿部位浸膏甲醇溶解,用MCI柱色谱依次用30%~95%的甲醇溶液洗脱除去叶绿素;用聚酰胺柱色谱洗去黄酮杂质;进行硅胶柱层析,洗脱溶剂采用体积比为二氯甲烷:丙酮=100:1~5:1的混合液,取层析物进行中压C18反相柱色谱层析,依次用30%~95%的甲醇溶液洗脱,此后的层析物一组经凝胶柱Sephadex LH-20进行纯化,洗脱剂为采用体积比为二氯甲烷:甲醇=1:1的混合液,得化合物1,最后经高效液相色谱仪分离纯化,甲醇:水体积比为55:45,得化合物2和3;另一组再进行硅胶柱层析,洗脱溶剂采用体积比为二氯甲烷:甲醇=25:1~10:1,得化合物4,层析物再次经凝胶柱Sephadex LH-20进行纯化,洗脱剂为甲醇,得化合物5。
进一步,所述的步骤二中使用恒温超声仪温水混悬浸膏,除了温水混悬浸膏外,超声仪水浴液也进行恒温来增加水溶性,用40KHz频率处理20~30分钟,主要目的是震碎大的颗粒和促使微小气泡生长破裂,来避免分布萃取中乳化现象。
进一步,所述步骤三中各种柱色谱层析洗脱条件均根据正相和反相层析板的指示进行的。
进一步,所述步骤三得到的得化合物1、化合物2、化合物3、化合物4、化合物5的结构式分别为:
本发明另一目的在于提供一种利用上述天目琼花木脂素的提取方法提取的天目琼花木脂素制备的治疗动脉粥样硬化药物。以8周龄雄性小鼠为研究模型,通过喂饲高脂饲料建立动脉粥样硬化模型,将42只小鼠随机分成对照组(普通饮食)、对照组(高脂饮食)木脂素1组(高脂饮食+20mg化合物1/kg/d)、木脂素2组(高脂饮食+20mg化合物2/kg/d)、木脂素3组(高脂饮食+20mg化合物3/kg/d)、木脂素4组(高脂饮食+20mg化合物4/kg/d)木脂素5组(高脂饮食+20mg化合物5/kg/d),每组6只,持续喂饲8周后,8周末,小鼠禁食10小时,采用酶法检测血清总胆固醇、非高密度脂蛋白胆固醇、高密度脂蛋白胆固醇和甘油三酯水平。第8周末处死小鼠,观察主动脉粥样硬化形成情况。
现有提取方法存在的缺点及本发明解决办法,来说明本发明的创造性:
1.现有提取技术缺点:植物叶绿素与木脂素类化合物混合在一齐,影响木脂素的分离,干扰层析板的指示,使分离变得困难。现有技术一般采用大孔树脂、硅胶、反相等方法去除叶绿素,去除率仅有60%~70%。
解决办法:本发明采用最新的SBC MCI GEL反相色谱填料,使叶绿素效果去除率从60%~70%提高到97%~100%。
2.现有提取技术缺点:现代提取方法多数使用汽油、苯、乙醚、乙醇、丙酮、石油醚等有机溶剂,采用液液萃取、固液萃取、二氧化碳超临界萃取、大孔树脂层析,沉淀、结晶等提取方法,得到木脂素类化合物的总提取物,而且总提取物中木脂素类化合物成分含量仅有30%~85%。
解决办法:本发明将萃取后的混合物浸膏经正相柱和反相柱后,采用凝胶柱Sephadex LH-20以二氯甲烷:甲醇=1:1为洗脱剂进行分离纯化,反复2次富集得到纯度96%~99%的化合物1单体;剩余的化合物2和化合物3用甲醇:水(55:45)高效液相色谱仪分离纯化得到纯度96%~99%的化合物化合物2和化合物3单体;采用类似的方法可得到纯度96%~99%的化合物4和化合物5。与现有分离技术30%~85%纯度相比有了显著提高;
3.现有提取技术缺点:木脂素类化合物的提取中洗脱剂多采用石油醚和苯以及苯和乙酸乙酯组合,这些组合不易分离回收,回收率仅有30%~40%,而且苯的毒性较大。
解决办法:本发明正相柱采用二氯甲烷和丙酮以及二氯甲烷和甲醇的组合方式,二氯甲烷和丙酮组合减压回收后可采用高效分馏柱(塔)分馏进行分离回收,回收率达到80%-85%,二氯甲烷和甲醇组合减压回收后可采用水萃取的方法快速分出二氯甲烷,回收率达到80%~90%,萃取水中甲醇可采用高效分馏柱(塔)分馏进行分离回收回收率达到75%~80%。与现有分离回收率30%~40%相比有了显著提高。
本发明将萃取后的混合物浸膏经正相柱和反相柱后,采用凝胶柱Sephadex LH-20以二氯甲烷:甲醇=1:1为洗脱剂进行分离纯化,反复2次富集得到纯度96%~99%的化合物1单体;剩余的化合物2和化合物3用甲醇:水(55:45)高效液相色谱仪分离纯化得到纯度96%~99%的化合物化合物2和化合物3单体;采用类似的方法可得到纯度96%~99%的化合物4和化合物5;与现有分离技术30%~85%纯度相比有了显著提高;化合物1~5结构明确,可进行目标性结构修饰,应用于药物合成,获得活性更好的药物分子,以进一步开发利用药用植物资源。本发明的5个木脂素均为首次从天目琼花中提取到,使得获取这类天然活性成分的途径更加广泛。本发明正相柱采用二氯甲烷和丙酮以及二氯甲烷和甲醇的组合方式,二氯甲烷和丙酮组合减压回收后可采用高效分馏柱(塔)分馏进行分离回收,回收率达到80%-85%;二氯甲烷和甲醇组合减压回收后可采用水萃取的方法快速分出二氯甲烷,回收率达到80%~90%,萃取水中甲醇可采用高效分馏柱(塔)分馏进行分离回收,回收率达到75%~80%;与原有30%~40%回收率相比有了显著提高;此方法排污少,适宜于现代精细工业生产。本发明采用最新的SBC MCI GEL反相色谱填料,使叶绿素的去除率从现有技术的60%~70%提高到97%~100%。天目琼花5个木脂素类化合物对防治动脉粥样硬化疾病均有明显的效果,为治疗动脉粥样硬化疾病指明了方向。
附图说明
图1是本发明实施例提供的天目琼花木脂素的提取方法流程图;
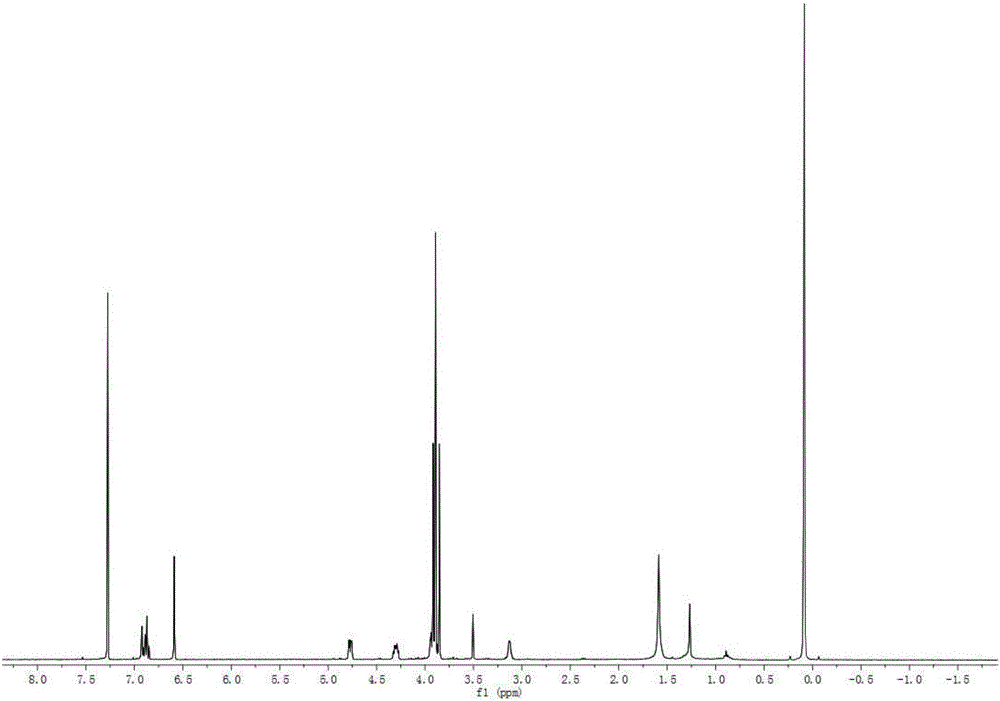
图2是本发明实施例提供的化合物1氢谱图;
图3是本发明实施例提供的化合物1碳谱图;
图4是本发明实施例提供的化合物2氢谱图;
图5是本发明实施例提供的化合物2碳谱图;
图6是本发明实施例提供的化合物3氢谱图;
图7是本发明实施例提供的化合物3碳谱图;
图8是本发明实施例提供的化合物4氢谱图;
图9是本发明实施例提供的化合物4碳谱图;
图10是本发明实施例提供的化合物5氢谱图;
图11是本发明实施例提供的化合物5碳谱图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
下面结合附图对本发明的应用原理作详细的描述。
如图1所示,本发明是实例提供的天目琼花木脂素的提取方法,包括如下步骤:
S101:将干燥的天目琼花枝叶粉碎后用95%乙醇室温冷浸48~72小时渗漉提取,乙醇提取液用30L旋转蒸发仪减压浓缩,将蒸出乙醇倒回渗漉罐子冷浸24~48小时;对药粉进行二次渗漉提取,二次浓缩,将蒸出乙醇再次倒回渗漉罐子冷浸24~48小时;对药粉进行第三次渗漉提取,三次浓缩,回收乙醇,至浓缩液无醇味,得总浸膏,回收乙醇;
S102:使用恒温超声仪温水混悬浸膏,分别使用1倍~1.5倍的石油醚、氯仿、乙酸乙酯和正丁醇依次萃取,减压浓缩,分别得到4个部位不同极性组分的浸膏;
S103:取氯仿部位浸膏甲醇溶解,用MCI柱色谱依次用30%~95%的甲醇溶液洗脱除去叶绿素;用聚酰胺柱色谱洗去黄酮杂质;进行硅胶柱层析,洗脱溶剂采用体积比为二氯甲烷:丙酮=100:1~5:1的混合液,取层析物进行中压C18反相柱色谱层析,依次用30%~95%的甲醇溶液洗脱,此后的层析物一组经凝胶柱Sephadex LH-20进行纯化,洗脱剂为采用体积比为二氯甲烷:甲醇=1:1的混合液,得化合物1,最后经高效液相色谱仪分离纯化,甲醇:水体积比为55:45,得化合物2和化合物3;另一组再进行硅胶柱层析,洗脱溶剂采用体积比为二氯甲烷:甲醇=25:1~10:1,得化合物4,层析物再次经凝胶柱Sephadex LH-20进行纯化,洗脱剂为甲醇,得化合物5。
进一步,所述的步骤二中使用恒温超声仪温水混悬浸膏,除了温水混悬浸膏外,超声仪水浴液也进行恒温来增加水溶性,用40KHz频率处理20~30分钟,主要目的是震碎大的颗粒和促使微小气泡生长破裂,来避免分布萃取中乳化现象。
进一步,所述步骤三中各种柱色谱层析洗脱条件均根据正相和反相层析板的指示进行的。
进一步,所述步骤三得到的得化合物1~5的结构式分别为:
下面结合实施例对本发明的应用原理作进一步的描述
实施例1
将20Kg干燥的天目琼花枝叶粉碎后用95%乙醇50L室温冷浸48~72小时渗漉提取,乙醇提取液用30L大型旋转蒸发仪减压浓缩,将蒸出乙醇倒回渗漉罐子冷浸24~48小时;对药粉进行二次渗漉提取,二次浓缩,将蒸出乙醇再次倒回渗漉罐子冷浸24~48小时;对药粉进行第三次渗漉提取,三次浓缩,回收乙醇,至浓缩液无醇味,得总浸膏2000g,回收乙醇。使用恒温超声仪温水混悬浸膏,分别使用1~1.5倍的石油醚、氯仿、乙酸乙酯和正丁醇依次萃取,减压浓缩,分别得到4个部位不同极性组分的浸膏。取氯仿部位浸膏甲醇溶解,用MCI柱色谱除去叶绿素(依次用30%~95%的甲醇溶液洗脱);用聚酰胺柱色谱洗去黄酮杂质(水洗脱);进行硅胶柱层析,洗脱溶剂为二氯甲烷:丙酮(体积比为100:1~5:1),取层析物进行中压C18反相柱色谱层析(依次用30%~95%的甲醇溶液洗脱),此后的层析物一组经凝胶柱Sephadex LH-20进行纯化,洗脱剂为二氯甲烷:甲醇(1:1),得化合物1,最后经高效液相色谱仪分离纯化,甲醇:水(体积比为55:45)得化合物2和3。另一组再进行硅胶柱层析,洗脱溶剂为二氯甲烷:甲醇(体积比为25:1~10:1),得化合物4,层析物再次经凝胶柱Sephadex LH-20进行纯化,洗脱剂为甲醇,得化合物5。
实施例2以8周龄雄性小鼠为研究模型,通过喂饲高脂饲料建立动脉粥样硬化模型,将42只小鼠随机分成对照组(普通饮食)、对照组(高脂饮食)木脂素1组(高脂饮食+20mg化合物1/kg/d)、木脂素2组(高脂饮食+20mg化合物2/kg/d)、木脂素3组(高脂饮食+20mg化合物3/kg/d)、木脂素4组(高脂饮食+20mg化合物4/kg/d)木脂素5组(高脂饮食+20mg化合物5/kg/d),每组6只,持续喂饲8周后,8周末,小鼠禁食10小时,采用酶法检测血清总胆固醇、非高密度脂蛋白胆固醇、高密度脂蛋白胆固醇和甘油三酯水平。第8周末处死小鼠,观察主动脉粥样硬化形成情况。
结果表明,与高脂饮食组相比,给予木脂素1组、木脂素2组、木脂素3组、木脂素4组和木脂素5组天目琼花木脂素单体后,血清中总胆固醇分别降低了30.77%、28.37%、28.95%、32.62%和29.55%;非高密度脂蛋白胆固醇分别下降了36.22%、35.04%、33.22%、34.50%和34.22%;高密度脂蛋白胆固醇显著增加了56.22%、55.44%、53.32%、54.39%和52.02%;对甘油三酯水平没有影响。
主动脉粥样硬化情况,空白对照组主动脉结构正常,几乎无脂质沉积和斑块形成。高脂饮食8周后,高脂组主动脉内壁脂质斑块形成显著。给药天目琼花木脂素8周后,木脂素1-5组均未见脂质条纹形成和斑块的形成。由此可见,天目琼花木脂素单体化合物1-5均有较好的抗粥样硬化作用。
实施例3单体木兰脂素(化合物1)的结构确定
白色粉末(氯仿)。ESI-MS m/z:417[M+H]+,分子式为C23H28O7。1H-NMR(400MHz,CDCl3)δ:3.10(2H,m,H-1,5),3.82,3.86,3.88(each,3H,s,OMe),3.86(6H,s,OMe),3.92,4.27(each 2H,m,H-4,8);4.74(2H,m,H-2,6),6.81-6.90(5H,m,Ar-H).13C-NMR(100MHz,CDCl3)δ:54.3(C-1),54.6(C-5),56.1(OMe),56.4(OMe),61.2(OMe),72.0(C-4),72.2(C-8),85.9(C-2),86.3(C-6),103.0(C-2″,6″),109.4(C-2′),111.2(C-5′),118.5(C-6′),133.6(C-1′),137.0(C-1″),137.7(C-4″),148.9(C-3′),149.4(C-4′),153.7(C-3″,5″)。氢谱和碳谱见说明书附图2和图3
实施例4单体(+)-桉脂素(化合物2)的结构确定
白色粉末(氯仿)。ESI-MS m/z:387[M+H]+,分子式为C22H26O6。1H-NMR(400MHz,CDCl3)δ:6.90-6.80(6H,m,Ar-H),3.10(2H,m,H-1,5),4.74(2H,d,J=4.1Hz,H-2,6),4.25(2H,dd,J=8.9,6.9Hz,H-4α,8α),3.95(2H,dd,J=8.9,6.9HzH-4β,8β),3.88(6H,s,OCH3×2),3.86(6H,s,OCH3×2),;13C-NMR(CDCl3,100MHz)δ:54.4(C-1,5),86.0(C-2,6),71.9(C-4,8),134.6(C-1′,1″),110.9(C-2′,2″),149.5(C-3′,3″),149.7(C-4′,4″),112.3(C-5′,5″),119.3(C-6′,6″),56.1(OCH3×2),56.2(OCH3×2)。氢谱和碳谱见说明书附图4和图5。
实施例5单体(-)-表桉叶明(化合物3)的结构确定
白色粉末(氯仿)。ESI-MS m/z:387[M+H]+,分子式为C22H26O6。1H-NMR(CDCl3,400MHz):6.93-6.80(6H,m,Ar-H),2.90(1H,m,H-1),4.43(H,d,J=7.2Hz,H-2),3.33(1H,m,H-4β),3.35(1H,m,H-5),4.86(1H,d,J=5.4Hz,H-6),4.12(1H,m,H-8β),3.87(1H,d,J=9.6Hz,H-4α,8α),3.86(3H,s,OCH3),3.87(3H,s,OCH3),3.88(3H,s,OCH3),3.89(3H,s,OCH3);13C-NMR(CDCl3,100MHz)δ:133.9(C-1),109.2(C-2),149.1(C-3),149.0(C-4),111.2(C-5),118.7(C-6),87.9(C-7),54.7(C-8),71.2(C-9),131.2(C-1′),109.4(C-2′),149.5(C-3′),148.3(C-4′),118.7(C-5′),117.9(C-6′),82.3(C-7′),50.4(C-8′),70.0(C-9′),56.2(OCH3×2),56.1(OCH3×2)。氢谱和碳谱见说明书附图6和图7。
实施例6单体vibsanol(化合物4)的结构确定
白色粉末(氯仿)。ESI-MS m/z:343[M+H]+,分子式为C19H18O6。1H-NMR(400MHz,CDCl3)δ:7.51(1H,d,J=1.9Hz,H-2′),6.93(1H,d,J=8.2Hz,H-5′),7.36(1H,dd,J=8.2,1.9Hz,H-6′),4.80(1H,s,H-9′),6.87(1H,d,J=1.3Hz,H-2),7.20(1H,d,J=1.3Hz,H-6),6.6(1H,d,J=15.8Hz,H-7),6.3(1H,dt,J=15.8,5.8Hz,H-8),4.2(2H,dd,J=5.8Hz,H-9),3.9(3H,s,OCH3);13C-NMR(400MHz,CDCl3)δ:134.7(C-1),109.6(C-2),143.4(C-3),143.7(C-4),133.2(C-5),110.4(C-6),132.7(C-7),128.5(C-8),55.6(C-9),123.6(C-1′),112.1(C-2′),149.4(C-3′),148.9(C-4′),116.6(C-5′),122.0(C-6′),155.9(C-7′),115.2(C-8′),64.0(C-9′),56.4(OCH3)。氢谱和碳谱见说明书附图8和图9。
实施例7单体3,4′-dimethoxylvibsanol(化合物5)的结构确定
白色粉末(氯仿)。ESI-MS m/z:357[M+H]+,分子式为C20H20O6。1H-NMR(400MHz,CDCl3)δ:7.35(1H,d,J=1.9Hz,H-2′),6.91(1H,d,J=8.2Hz,H-5′),7.44(1H,dd,J=8.2,1.9Hz,H-6′),4.83(1H,s,H-9′),6.87(1H,d,J=1.3Hz,H-2),7.14(1H,d,J=1.35Hz,H-6),6.64(1H,d,J=15.79Hz,H-7),6.32(1H,dt,J=15.79,5.82Hz,H-8),4.30(2H,dd,J=5.78Hz,H-9),3.95/4.00/4.03(9H,s,3,3′,4′-OCH3);13C-NMR(400MHz,CDCl3)δ:133.0(C-1),108.4(C-2),144.0(C-3),145.3(C-4),132.1(C-5),111.5(C-6),131.5(C-7),127.6(C-8),56.3(C-9),123.5(C-1′),112.0(C-2′),149.4(C-3′),149.9(C-4′),118.4(C-5′),123.5(C-6′),157.0(C-7′),112.0(C-8′),64.1(C-9′),56.3(OCH3×3)。氢谱和碳谱见说明书附图10和图11。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!