一种Leg1蛋白及其在肥胖相关疾病中的应用的制作方法
本发明涉及基因的功能与应用技术领域,具体而言,涉及一种Leg1蛋白及其在肥胖相关疾病中的应用。
背景技术:
在过去的几年里,肥胖症病例在全世界范围内迅速增长,目前已是导致人类死亡的第五号威胁。在发达国家,肥胖症早在20世纪80年代就已初露端倪,病例在其后持续增加,只是在过去8年里增加速度有所减缓;而在发展中国家,肥胖患者每年都以极快的速度在增加。尽管肥胖一般不会直接导致死亡,但是,肥胖导致的并发症,尤其是心血管疾病却可以是致命的。在2010年,肥胖大约导致了340万人的死亡。此外,对美国本土的肥胖症患者的研究表明,肥胖症很可能会降低将来人类的平均寿命。据统计,为了治疗肥胖症,美国差不多每年要花费1170亿美元。同时,世界范围内对肥胖症的关注也越来越多。但是,目前,对于有效治疗肥胖症的药物的研究成果还比较少,且与肥胖症或者调节脊椎动物体内脂肪合成积累相关的药物靶点也比较少。
技术实现要素:
本发明的目的在于提供一种Leg1蛋白,其氨基酸序列如(1)或(2)所示:(1)SEQ ID NO.2;(2)由SEQ ID NO.2所示的序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的且与SEQ ID NO.2具有相同生物活性的衍生序列。
本发明的目的在于还提供上述的Leg1蛋白在制备用于治疗脂肪缺少疾病或用于促进人类脂肪积累的药物中的应用,该药物的活性成分是上述Leg1蛋白。
本发明的目的在于还提供上述的Leg1蛋白在制备或筛选用于治疗糖尿病的药物中的应用,该药物的活性成分是上述Leg1蛋白。
本发明的目的在于还提供一种重组Leg1蛋白,上述重组Leg1蛋白由编码上述的Leg1蛋白的Leg1基因在原核表达系统中进行重组表达、纯化后得到。
进一步地,当Leg1蛋白的氨基酸序列如SEQ ID NO.2所示时,Leg1基因的碱基序列如SEQ ID NO.4所示。
进一步地,上述原核表达系统是大肠杆菌表达系统、枯草芽孢杆菌表达系统和链霉菌表达系统中的任意一种。
本发明的目的在于还提供上述的重组Leg1蛋白在制备用于治疗肥胖或减肥的药物中的应用,该药物的活性成分是上述重组Leg1蛋白。
本发明的目的在于还提供一种修饰化Leg1蛋白,其由上述的Leg1蛋白上的一个或多个氨基酸残基经修饰后得到,上述修饰为糖苷化修饰、乙酰化修饰、甲基化修饰和磷酸化修饰中的一种或多种。
本发明的目的在于还提供上述的修饰化Leg1蛋白在制备用于治疗肥胖或减肥的药物中的应用,该药物的活性成分是上述修饰化Leg1蛋白。
本发明的目的在于还提供上述的修饰化Leg1蛋白在制备用于治疗脂肪缺少疾病或用于促进人类脂肪积累的药物中的应用,该药物的活性成分是上述修饰化Leg1蛋白。
本发明的目的在于还提供上述的修饰化Leg1蛋白在制备用于治疗糖尿病的药物中的应用,该药物的活性成分是上述修饰化Leg1蛋白。
本发明提供的一种Leg1蛋白及其在肥胖相关疾病中的应用的有益效果是:
本发明以现有技术没有研究过的Leg1基因为基础,以mLeg1基因(SEQ ID NO.4)敲除小鼠为研究对象,利用遗传学,分子生物学,生物化学,细胞生物学的手段对mLeg1基因和mLeg1蛋白的功能进行了非常全面的研究。本发明的研究结果显示:mLeg1蛋白(SEQ ID NO.2)可以通过EGFR调控体内Akt的信号,进而调控机体内的脂肪合成,mLeg1基因(SEQ ID NO.4)和mLeg1蛋白的表达水平与机体内的脂肪合成密切相关(增强mLeg1基因的表达水平或者mLeg1蛋白的表达水平或mLeg1蛋白的含量,可以促使脂肪合成积累;抑制mLeg1基因的表达水平或者mLeg1蛋白的表达水平或mLeg1蛋白的含量,可以抑制脂肪积累),表明mLeg1蛋白(SEQ ID NO.2)、与mLeg1蛋白具有相同结构域的Leg1蛋白(SEQ ID NO.1以及SEQ ID NO.5-8)、及其这些蛋白的编码基因(包括SEQ ID NO.4和SEQ ID NO.3)都可以作为与调节脂肪合成相关药物的全新的靶点,可以将其应用到制备用于治疗肥胖症或减肥的药物、用于治疗脂肪缺少疾病或用于增肥的药物、制备或筛选用于治疗糖尿病的药物、制备用于调节脊椎动物脂肪积累的药物等调节脂肪合成相关药物领域中,并为开发研究用于调节脊椎动物体内的脂肪合成积累的药物或者治疗脂肪相关疾病提供一个全新的思路。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
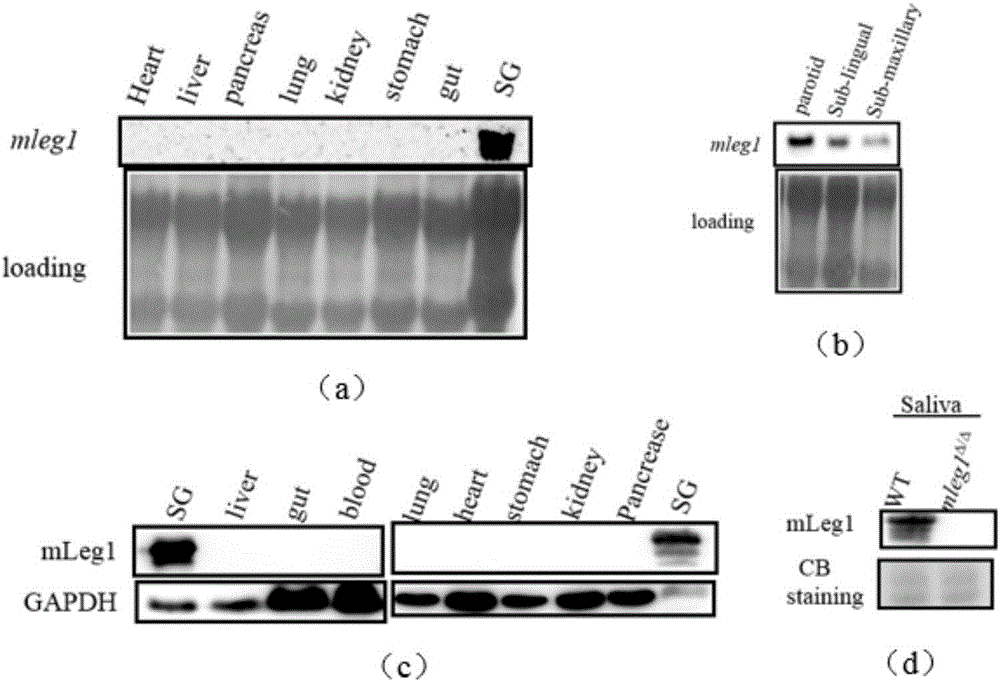
图1本发明实施例1-5的检测结果图(图中:a为采用Northern印记分析检测mLeg1在野生型小鼠的不同组织的表达情况的结果图;b为采用Northern印记分析mLeg1在野生型小鼠的唾液腺的3个腺体中表达情况的检测结果图;c为采用Western Blot检测mLeg1蛋白在野生型小鼠的不同的组织中分布情况的结果图;d为野生型小鼠和mLeg1基因敲除型小鼠唾液中mLeg1蛋白含量的检测结果图);
图2为本发明实施例4的mLeg1基因敲除策略示意图;
图3为本发明本发明实施例4-5的凝胶电泳检测结果图(图中:a为采用普通PCR方法检测mLeg1Δ/Δ小鼠中第三个外显子被敲除的凝胶电泳结果图;b为采用RT-PCR检测mLeg1Δ/Δ小鼠中第三个外显子被敲除的凝胶电泳结果图;c为采用Western blot方法检测mLeg1蛋白在mLeg1Δ/Δ小鼠唾液腺的表达情况的结果图);
图4为本发明实施例5的mLeg1Δ/Δ小鼠的mLeg1基因的测序结果对比图;
图5为本发明实施例6的mLeg1Δ/Δ小鼠和野生型小鼠的唾液腺的HE染色结果对比图;
图6为本发明实施例6采用唾液淀粉酶和细胞连接蛋白pan-Cadherin进行蛋白免疫荧光标记观察mLeg1Δ/Δ小鼠和野生型小鼠的唾液腺的结果对比图;
图7为本发明实施例6的mLeg1Δ/Δ小鼠和野生型小鼠的唾液腺分泌的粘液的阿新蓝染色检测结果对比图;
图8为本发明实施例7-8的检测结果图(图中:a为mLeg1Δ/Δ小鼠和野生型小鼠的血指标的检测结果图;b为mLeg1Δ/Δ小鼠和野生型小鼠的葡糖糖耐受情况的检测结果图;c为mLeg1Δ/Δ小鼠和野生型小鼠血清中的三酰甘油和胆固醇含量的检测结果图;d为mLeg1Δ/Δ小鼠和野生型小鼠肝脏中的三酰甘油和胆固醇含量的检测结果图);
图9为本发明实施例9的mLeg1Δ/Δ小鼠和野生型小鼠的不同部位的脂肪大小对比图(图中:a为mLeg1Δ/Δ小鼠和野生型小鼠背部脂肪直观对比图;b为1mLeg1Δ/Δ小鼠和野生型小鼠背侧脂肪块大小直观对比图;c为mLeg1Δ/Δ小鼠和野生型小鼠腹部脂肪直观对比图;d为mLeg1Δ/Δ小鼠和野生型小鼠腹部侧脂肪块大小直观对比图);
图10为本发明实施例9的mLeg1Δ/Δ小鼠和野生型小鼠的体重变化检测结果图(图中:a为mLeg1Δ/Δ小鼠和野生型小鼠在正常饲料和高脂饲料饲养条件下的体重变化曲线图;b为mLeg1Δ/Δ小鼠和野生型小鼠在高脂饲料饲养半年后的体型大小直观对比图);
图11为本发明实施例9的脂肪合成相关基因的表达水平检测结果图(图中:a为mLeg1Δ/Δ小鼠和野生型小鼠肝脏中脂肪β氧化相关基因的表达水平的检测结果图;b为明mLeg1Δ/Δ小鼠和野生型小鼠肝脏中脂肪合成相关基因的表达水平的检测结果图);
图12为本发明实施例10的小鼠肝脏中脂肪合成途径的示意图;
图13为本发明实施例11的mLeg1Δ/Δ小鼠和野生型小鼠肝脏中调控脂肪合成的转录因子的表达水平的检测结果图;
图14为本发明实施例12-14的Akt磷酸化水平检测结果图(图中:a为mLeg1Δ/Δ小鼠和野生型小鼠肝脏中的Akt磷酸化水平的检测结果图;b为mLeg1Δ/Δ小鼠和野生型小鼠唾液腺中的Akt磷酸化水平的检测结果图;c为经野生型和mLeg1Δ/Δ小鼠唾液腺细胞的细胞培养液中mLeg1的蛋白水平;d为经mLeg1Δ/Δ小鼠和野生型小鼠唾液腺细胞培养上清液培养后的HepG2细胞的Akt磷酸化水平的检测结果图)
图15为本发明实施例15-16的Akt磷酸化水平的检测结果图(图中:a为经腹腔或者尾静脉注射唾液腺原代培养上清后诱导mLeg1Δ/Δ小鼠肝脏的Akt磷酸化水平的检测结果图;b为由野生型小鼠的唾液腺纯化的不同mLeg1蛋白浓度激活HepG2细胞的Akt磷酸化水平的检测结果图)
图16为本发明实施例16-18的Akt磷酸化水平的检测结果图(图中:a为通过柱层析和离子交换从唾液腺中纯化得到的mLeg1蛋白激活HepG2细胞的Akt磷酸化水平的检测结果图;b为在抑制剂LY290004的作用条件下,经mLeg1Δ/Δ小鼠和野生型小鼠唾液腺细胞原代培养的上清液培养后的HepG2细胞的Akt磷酸化水平的检测结果图;c为在抑制剂LY290004的作用条件下,通过柱层析和离子交换从唾液腺中纯化得到的mLeg1蛋白激活HepG2细胞的Akt磷酸化水平的检测结果图;d为经mLeg1蛋白培养后的HepG2细胞的酪氨酸磷酸化水平的检测结果图);
图17为本发明实施例19的膜受体酪氨酸激酶(RTK)筛选检测结果图;
图18为本发明实施例19-22的检测结果图(a为mLeg1蛋白对细胞内EGFR受体蛋白的激活水平的检测结果图;b为在抑制剂AG1478作用条件下,mLeg1蛋白对细胞内EGFR受体蛋白的激活水平的检测结果图;c为采用免疫共沉淀法检测mLeg1蛋白与EGFR之间的相互作用的结果图;d为mLeg1蛋白灌胃mLeg1Δ/Δ小鼠后,不同时间点检测mLeg1蛋白与EGFR之间的相互作用的结果图);
图19为本发明实施例23的对重组mLeg1-Re蛋白的检测结果及其功能检测的结果图(图中:a为采用免疫印迹法检测野生型mLeg1蛋白与由大肠杆菌表达系统表达重组得到的mLeg1蛋白的分子量大小的对比结果图;b为由大肠杆菌表达系统表达重组的mLeg1蛋白激活HepG2细胞的Akt磷酸化的结果图);
图20为本发明实施例23的重组mLeg1蛋白对野生型小鼠的体重影响结果图(a为在高脂食物饲养条件下,灌胃mLeg1-Re蛋白的野生型小鼠的体重增长结果图;b为采用免疫共沉淀的方法检测mLeg1-Re蛋白是否能到达mLeg1Δ/Δ小鼠肝脏的结果图)。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
下面对本发明的一种Leg1蛋白、Leg1基因及其在非人类中的应用进行具体说明。
本发明的发明人选取小鼠为研究模型动物,对Leg1基因(liver enriched gene 1、肝富集基因1,该基因编码表达出的蛋白称之为Leg1蛋白)和Leg1蛋白在小鼠中的同源基因mLeg1基因(如SEQ ID NO.4所示)和mLeg1蛋白(SEQ ID NO.2)进行相关功能性研究。揭示了mLeg1基因及其编码表达mLeg1蛋白的功能,也同时揭示了在所有脊椎动物中具有同源性的Leg1基因和相应Leg1蛋白的功能。
mLeg1也称2310057J18Rik RIKEN cDNA 2310057J18gene(GeneID:67719),是Leg1在小鼠中的同源基因,其在小鼠中的功能研究几乎空白。生物信息分析显示,mLeg1基因位于10号染色体上,全长约14.016kb,包含6个外显子和5个内含子,其中翻译起始位点ATG位于第一个外显子上。mLeg1基因编码一个长为337个氨基酸的蛋白(如SEQ ID NO.2所示),分析预测显示其含有一具有20个氨基酸的前导信号肽,前导信号肽的序列为SEQ ID NO.2所示的第1-21位氨基酸序列,表明mLeg1是一个新型的分泌蛋白。
人(Homo sapiens)的hLeg1蛋白(其氨基酸序列如SEQ ID NO.1)与小鼠中的同源蛋白mLeg1蛋白(其氨基酸序列如SEQ ID NO.2所示)具有71.2%的相似性,因此,通过对鼠的mLeg1蛋白的编码基因即mLeg1基因(如SEQ ID NO.4所示)和mLeg1蛋白的功能研究能够为人类的hLeg1基因(编码序列即CDS序列如SEQ ID NO.3所示)和hLeg1蛋白的功能和应用提供指导和参考的意义,同时为研发相关脂肪疾病的药物提供理论依据。
Leg1蛋白在斑马鱼(Danio rerio)中具有两个拷贝,分别是dLeg1a蛋白(氨基酸序列如SEQ ID NO.5所示)和dLeg1b蛋白(氨基酸序列如SEQ ID NO.6所示),二者与mLeg1蛋白分别具有47.5%和48.6%的相似性;存在于绵羊(Ovis aries)中的oLeg1蛋白(氨基酸序列如SEQ ID NO.7所示),其与mLeg1蛋白具有49.1%的相似性;存在于牛(Bos taurus)中的bLeg1蛋白(氨基酸序列如SEQ ID NO.8所示),其与mLeg1蛋白具有45.7%的相似性(本发明的相似性对比所用的方法是:使用欧洲生物信息中心(ebi)配对比对软件needle,参数设置为:Matrix:EBLOSUM62,Gap_penalty:10.0,Extend_penalty:0.5进行比对)。
由于,Leg1蛋白是在所有脊椎动物中保守存在的分泌蛋白高度,它们的Leg1蛋白具有相同的DUF结构域(例如SEQ ID NO.2中第28位-337位、SEQ ID NO.1中的第28位-320位、SEQ ID NO.5中的第29位-362位、SEQ ID NO.6中的第29位-362位、SEQ ID NO.7中的第34位-354位、以及SEQ ID NO.8中的第1位-317位,这些氨基酸残基序列在三维空间中都构成一个功能相似的DUF结构域),因此,它们之间具有相似的功能和应用前景。因此,对于所有脊椎动物的leg1蛋白及其编码基因的与脂肪合成相关的应用均属于本发明的保护范围。
还需要说明的是,由SEQ ID NO.2所示的序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的且与SEQ ID NO.2具有相同的生物活性的衍生序列所示的蛋白及其应用也属于本发明的保护范围。只要在SEQ ID NO.2所示的leg1蛋白的基础上,经过上述的改造,使其改造后的突变体leg1与SEQ ID NO.2所示的leg1蛋白具有相同的DUF结构域,使其与leg1蛋白具有相同或相似的生物活性,对于这些突变体蛋白及其编码基因的脂肪合成相关的应用同样属于本发明的保护范围。
需要说明的是,本发明所指的脊椎动物包括人、鼠、斑马鱼、绵羊、牛,还包括兔、猪、马、虎、豹、狼、狗、鸡、鸭、鱼、鹅、熊以及猴等,但不限于前述的动物。
本发明通过遗传学,分子生物学,生物化学,细胞生物学的手段,以模式生物小鼠及人类细胞系为研究模型,对新型分泌蛋白mLeg1的功能进行全面系统的研究,通过提供大量证据证明分泌蛋白mLeg1是一个新的信号分子,建立从mLeg1到EGFR/PI3K,最后激活Akt的信号调控网络,并证明该网络促进小鼠体内脂肪合成。同时本发明的发明人证明mLeg1敲除的小鼠能正常生长,更为重要的是mLeg1敲除的小鼠可以抗高脂食物引起的肥胖症。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实验动物及饲养
实验动物:选用背景为C57BL/6的野生型小鼠;利用Cre-loxP系统,选用C57BL/6-Tg(Zp3-cre)93Knw/Jnju的Cre工具鼠用于全身敲除mLeg1基因,以获得全身敲除mLeg1基因的小鼠(mLeg1Δ/Δ敲除小鼠)。(上述各品系的小鼠均购于南京生物医药研究院(NRI))。饲养条件:温度22℃,湿度50%~60%,并给予12h光照/12h黑暗的光周期。小鼠的普通饲料为上海斯莱克公司生产的大小鼠辐照育成料(M02-F),高脂饲料为上海斯莱克公司生产的大小鼠高脂实验料(M04-F)。
1.Northern印迹分析mLeg1在不同组织的表达情况
以8周龄的雄性的背景为C57BL/6的小鼠作为研究对象,采用Northern印迹分析检测mLeg1基因的表达谱。以mLeg1基因的反义链为探针,进行Northern印记分析,分析mLeg1基因小鼠包含肝脏在内的一系列消化器官(心脏(heart)、肝脏(liver)、胰腺(pancreas)、肺(lung)、肾(kidney)、胃(stomach)、肠(gut)、唾液腺(SG))中的表达情况。
Northern印迹分析的实验方法如下。
1.1RNA提取:
1.1.1取需要提取RNA的组织,用液氮研碎至无明显颗粒,研磨过程保持有液氮存在以防RNA降解。
1.1.2取50-100mg样品加入1ml Trizol(Reagent,Life Technologies,Cat.no.15596-026),通过26G针头抽打充分匀浆。
1.1.3室温静置5min。加入0.2ml氯仿用力混匀30秒,室温静置5min。4℃下12000g离心15min使各液相分离。
1.1.4取水相(即最上层液体)加入到0.5ml异丙醇中,颠倒混匀后室温孵育10min,使RNA析出。4℃下12000g离心15min,弃上清。
1.1.5沉淀加入1ml 75%的乙醇(用DEPC水配置)清洗,并4℃下12000g离心5min弃上清。重复用75%的乙醇清洗一次,并充分除去上清。42℃烘干后加适量DEPC水溶解。提取的RNA马上用于后续实验或保存在-80℃冰箱中,需要时直接取出使用。
1.2地高辛(DIG)标记探针制备:
(1)用DIG标记的dNTP(10X PCR DIG Labeling Mix,Roche Cat.No.11585550910)代替dNTP,通过PCR反应将DIG掺入到双链DNA中作为Norhern的探针。PCR引物为:probeF:GGCTGTCCTGGCTTCCTG;probeR:CTCTCCATCTGTTCATTGTTCC。PCR采用普通的taq酶(反应体系为:模板1ul,正反引物各0.3ul,taq酶0.3ul,10x的buffer2ul,2.5mM dNTP 1ul,水15.1ul)(taq酶反应体系下同),反应程序:步骤1:94℃3分钟;步骤2:94℃30秒;步骤3:58℃30秒;步骤4:72℃30秒;步骤5:重复步骤2到步骤4,33次;步骤6:72℃10分钟。
(2)PCR反应产物通过琼脂糖凝胶电泳检测大小和纯度,并通过PCR纯化试剂盒进行纯化。纯化后的探针在100℃中变性10min,并马上在冰上冷却至少2min,用DIG Easy Hyb(Roche Cat.No.11603558001)稀释探针到25ng/ml,并保存在-20℃中备用。
1.3RNA变性凝胶制备:RNA凝胶电泳在在变性的缓冲液和凝胶中进行。将10X的MOPS缓冲液(0.2M MOPS,50mM NaoAc,10mM EDTA,pH 7.0)用灭菌的去离子水稀释到1X,并加入1.3%的琼脂糖粉末,通过微波炉加热充分融解,冷却到50℃左右的时候加入5.3%的浓度为37%的甲醛,混匀后倒入制胶模具中,静置冷却凝固备用。
1.4RNA样品处理:取适量RNA(即步骤1.1提取出的RNA样品,10到30μg)加入到17.5μl RNA变性剂中(含10μl去离子甲酰胺,2μl 10X MOPS,3.5μl 37%甲醛,2μl RNA上样缓冲液(Gel Loading Buffer II,Life Technologies,Cat.No.AM8546G),65℃变性20min后马上置于冰上10min。
1.5RNA变性凝胶电泳:取冷却凝固的RNA变性胶置于1X MOPS电泳缓冲液中,加入RNA样品进行电泳,同时加入RNA分子Marker(Fermentas Cat.No.SM1821)进行分子量估算,以4-10V/CM的电压进行电泳,根据片段大小决定电泳时间,一般为4~7小时。
1.6RNA转膜:
1.6.1取出已完成RNA变性凝胶电泳的凝胶(RNA胶),用灭菌的去离子水清洗,并置于10X的SSC中平衡。按胶大小裁取适当大小的Hybond-N+膜(Amersham Bioscience Cat.No.RPN303B)和3MM滤纸(Whatman Cat.No.3030917),同样在10XSSC中平衡。
1.6.2取一干净的敞口瓷盘容器,倒入10X的SSC缓冲液,并取一有机玻璃盖于瓷盘上。裁取2层长度略长于有机玻璃,宽度略宽于RNA胶的3MM滤纸,用10X SSC浸润后盖于有机玻璃上,滤纸纵向两端浸泡于瓷盘中的SSC缓冲液中。将RNA胶倒扣在滤纸上,再依次覆盖上Hybond-N+膜和两层3MM滤纸,以及多层吸水纸,并上压重物,转膜过夜。转膜完成后,取下膜在紫外交联仪(UVP Ultraviolet Crosslinker Cat.No.CL-1000)下,150m j/cm2能量交联。随后用RNA亚甲基蓝染色液(0.3M NaOAc,pH 5.2,0.03%Methylene Blue)染色,检测RNA转膜效果及质量。
1.7探针杂交及显影分析:
DIG探针的杂交和清洗用Roche公司的DIG洗涤和封闭试剂盒(Roche Cat.No.11585762001)依说明书进行。具体如下。
1.7.1取一杂交管,将RNA膜(由1.6.2步骤得到的)置于其中,加入适量预杂交液(Roche Cat.No.11603558001),50℃封闭2小时。期间,取-20℃保存的DIG标记的探针,在100℃变性10min后在50℃平衡。封闭2小时后,加入平衡好的探针,50℃杂交过夜。
1.7.2次日,回收探针,RNA膜按以下次序依次清洗:2X SSC/0.1%SDS常温清洗,每次10min;0.5X SSC/0.1%SDS 65℃清洗两次,每次15min;0.1X SSC/0.1%SDS 65℃清洗两次,每次15min;洗涤缓冲液室温清洗10min。加入10%DIG blocking buffer封闭1小时,接着换入用10%DIG blocking buffer以1:20000稀释的Anti-Digoxigenin-AP Fab fragments抗体(Roche Cat.No.11093274910)室温孵育2小时。洗涤缓冲液清洗两次,每次15。
1.7.3最后将膜用检测缓冲液平衡5min。取膜夹于塑料膜中,并于其中滴入Ready-to-use CDP-star溶液(Roche Cat.No.12041677001)显色,在荧光化学发光成像仪(Clinx Science Instruments Cat.No.3400)里成像。结果如图1中的(a)所示。
由图1中的(a)可知(图1的(a)中:SG代表唾液腺、liver代表肝脏、gut代表肠道、lung代表肺、heart代表心脏、stomach代表胃、kidney代表肾、pancrease代表胰腺),mLeg1基因并没有在肝脏中富集表达,却在在唾液腺(SG)中有非常高的表达,而在其它组织(heat、liver、pancreas、lung、kidney、stomach、gut)中基本没有检测到mLeg1的表达。
小鼠的唾液腺主要包括三个部分:(颌下腺(submandibular gland),舌下腺(sublingular gland)和腮腺(parotid),因此,采用Northern blot印记分析(具体方法同实施例1),本发明的发明人分别探究了mLeg1基因在这3个腺体中的表达情况,结果如图1中的(b)所示。
由图1中的(b)可知(图1的(b)中:parotid代表腮腺、sub-lingual代表舌下腺、sub-maxillary代表颌下腺),mLeg1基因在这3个腺体中均有明显表达,其在腮腺组织中的表达高于颌下腺和舌下腺。
实施例2
由于mLeg1蛋白在斑马鱼中的同源蛋白Leg1是一个分泌蛋白,上述结果已表明mLeg1基因主要在唾液腺表达,但是其mLeg1蛋白也可能分泌运输到别的组织中发挥作用。因此,本发明的发明人提取小鼠不同组织的总蛋白,通过Western Blot检测mLeg1蛋白在不同的组织中分布情况。
采用Western Blot检测mLeg1蛋白在不同的组织中分布情况。实验方法如下。
2.1蛋白提取:
小鼠猝死后,摘取目的组织(SG、liver、gut、blood、lung、heat、stomach、kindney、pancrease),分别置于1.5ml离心管中,并迅速于液氮中冷冻,防止降解。提蛋白时,取出样品,通过液氮研磨粉碎,将样品粉末收集于离心管中,并加入蛋白裂解液(150mM NaCl,50mM PH7.6Tris-Hcl,0.1%SDS,1%Triton X100,1.5%脱氧胆酸钠,1X的Complete(EDTA-free)(Roche Cat.No.11873580001),100mg样品加入100μl裂解液),置于冰上,26G针头抽打数次,4℃于垂直摇床孵育15min,4℃12000g离心15min,取上清,通过Braford法测蛋白浓度。
2.2蛋白免疫引迹(Western blot):
2.2.1取制备的10~20μg蛋白样品进行SDS-PAGE凝胶电泳,通过半干转膜仪(TRANSSD SEMI-DRY TRANSFER CELL(Bio-Rad Cat.No.170-390)将凝胶中蛋白转移到PVDF膜(Millipore Cat.No.IPVH00010)中。转膜条件为20V,140mA,转膜时间依蛋白大小而定,一般为50min到60min之间。
2.2.2转膜后,用5%的脱脂牛奶封闭1小时,再加入稀释于牛奶中的目的蛋白抗体(根据检测的目标蛋白来确定,本实施例为mLeg1抗体,其稀释比例依抗体而定,一般为1:1000),室温孵育1小时或4℃孵育过夜。
2.2.3PBST(0.1%Tween 20in PBS)100~150rpm清洗5x5min。加入相应的1:10000稀释于牛奶中的二抗(辣根过氧化物酶标记山羊抗小鼠IgG(碧云天Cat.No.A0216)或辣根过氧化物酶标记山羊抗兔IgG(碧云天Cat.No.A0208)),室温孵育1小时,PBST 100~150rpm清洗5x5min。
2.2.4加入显色底物(Thermo Cat.No.34095)在荧光化学发光成像仪(Clinx Science Instruments Cat.No.3400)里成像。结果如图1中的(c)所示。
由图1中的(c)可知(图1的(c)中:SG代表唾液腺、liver代表肝脏、gut代表肠道、blood代表血清、lung代表肺、heart代表心脏、stomach代表胃、kidney代表肾、pancrease代表胰腺),与RNA表达位置相一致的,mLeg1蛋白也主要存在于唾液腺(SG)中,其它组织包括肝脏,肠道,肺,心脏,位,肾,胰腺都没有检测到明显的mLeg1蛋白的存在,同时,小鼠血液中并没有存在大量的mLeg1,因此,在小鼠中,mLeg1的蛋白合成和储存都主要发生在唾液腺中。
实施例3
由于唾液腺是一个分泌性腺体,其最重要功能是分泌唾液,而mLeg1也是一个分泌蛋白。因此,本发明的发明人对mLeg1是否会分泌到唾液中进行了研究。
采用Western Blot检测mLeg1在唾液中的含量。具体步骤如下。
3.1唾液收集:于小鼠腹腔按0.5mg/kg的量注射匹罗卡品(Pilocarpine,Sigma),将毛细管置于小鼠口腔引流收集分泌的唾液。匹罗卡品是一种用于治疗口腔干燥的药物,它能促进唾液的大量分泌。分别收集野生型小鼠和mLeg1全身敲除小鼠(其获得的方法见下文)分泌的唾液。
3.2唾液处理:收集的唾液,用1/5唾液体积的5x的Laemmli buffer(10%SDS,250mM Tris-HCl,0.1‰Bromphenol blue,500mM DTT,50%Glycerol),100℃煮沸5分钟。
3.3利用Western Blot印记分析唾液中mLeg1蛋白含量,具体操作参考实施例2的Western Blot检测步骤。结果如图1中的(d)所示。
由图1中的(d)可知(图1的(d)中:WT为野生型小鼠,mLeg1Δ/Δ为mLeg1基因全身敲除型小鼠),mLeg1蛋白确实大量存在于野生型小鼠的唾液中,而mLeg1全身敲除小鼠的唾液中并不存在mLeg1蛋白。
实施例4
mLeg1基因全身敲除小鼠(mLeg1Δ/Δ)的获得
为了获得mleg全身敲除小鼠,本发明的发明人选用传统的Cre-loxP系统将小鼠中的mLeg1基因进行敲除。该系统主要是依赖Cre酶能够识别loxP序列,并将两个同向的loxP序列中的序列进行删除,从而达到基因敲除的目的。而当Cre酶在特定时空表达时,即可以使mLeg1在特定时空敲除,从而避免胚胎致死造成的研究难点。这里本发明的发明人将loxP序列插入到mLeg1第三个外显子的两侧,同时在第三个外显子和其后面的loxP序列之间加入一个NEO基因,用于正向抗性筛选。通过同源重组,胚胎移植和遗传筛选本发明的发明人获取mLeg1第三个外显子两端加入loxP序列的mlegfl/fl稳定遗传的转基因小鼠。
Cre-loxP系统的另一个组成部分是Cre酶。当Cre酶受特定空间或特定时间激活的启动子驱动表达时,就能在特定空间或时间将loxP序列进行删除。基于该原理获取mLeg1敲除小鼠的敲除策略如图2所示。这里,本发明的发明人选用zp3启动子驱动Cre表达的小鼠对mLeg1进行全身敲除。zp3是卵透明带3(zona pellucida glycoprotein 3)基因,该基因只在第一次减数分裂前的卵母细胞中表达。
因此,将mLeg1fl/fl小鼠与Zp3驱动Cre表达的小鼠(C57BL/6-Tg(Zp3-cre)93Knw/JNju)配种时,得到Zp3-CRE+mLeg1fl/wt的小鼠。其中的母鼠产生的卵母细胞中,由于zp3启动子的激活,诱导CRE酶的表达,从而将mLeg1基因的第三个外显子进行敲除。将得到的母鼠与野生型公鼠配种后,得到ZP3-CRE+mLeg1Δ/WT和ZP3-CRE-mLeg1Δ/WT小鼠。ZP3-CRE-mLeg1Δ/WT小鼠自交即可得到mLeg1Δ/Δ和mLeg1WT/WT小鼠。mLeg1Δ/Δ小鼠即为mLeg1基因全身敲除小鼠。
采用PCR法,从上述得到的mLeg1Δ/Δ和mLeg1WT/WT小鼠中,鉴定出mLeg1Δ/Δ小鼠:
取小鼠并剪取脚趾用于编号,同时收集剪下脚趾用碱裂解法提取基因组DNA。往收集的脚趾中加入75μl的裂解液I(25mM NaOH,EDTA 0.2mM,PH 12),95℃30min,冰上冷却。再加入75μl的裂解液II(Tris 40mM,PH5)中合。充分反应后作为PCR模板,每20μl PCR反应中加入4μl模板进行反应。基因型鉴定引物:上游引物mLeg1Fwd:CCTTTCTTAATGACACTTCAGTATGT;下游引物mLeg1Rv:CACATGCCTATTCACTCTCTCC。PCR采用普通的taq酶,反应条件为:1、94℃3分钟,2、94℃30秒,3、58℃30秒,4、72℃30秒,5、重复2到4步33次,6、72℃10分钟。将PCR产物进行凝胶电泳实验,其中野生型小鼠产生一条685bp的条带,突变体小鼠由于第三个外显子和部分内含子被删除,产生一个293bp大小的条带(如图3中的(a)所示)。
将鉴定出的mLeg1Δ/Δ小鼠按常规方法进行饲养,用于后续实验。
此外,杂交配种的结果显示:当对mLeg1Δ/W自交配种时,mLeg1Δ/Δ小鼠可以正常的出生,呈现正常的1:3孟德尔遗传比例。幼鼠可生长发育为健康成鼠,且mLeg1Δ/Δ成年小鼠可以正常的产生后代,其每胎小鼠个数与野生型没有明显差异。
实施例5
mLeg1Δ/Δ小鼠的验证
为了进一步验证mLeg1确实被敲除,本发明的发明人分别收取鉴定为mLeg1Δ/Δ和mLeg1WT/WT的小鼠的唾液腺,提取总RNA,进一步合成cDNA。实验方法如下。
5.1提取总RNA:分别提取mLeg1Δ/Δ和mLeg1WT/WT的小鼠的唾液腺的总RNA,提取方法同实施例1中的1.1步骤的RNA提取。
5.2RNA逆转录成cDNA:取1μg提取的RNA样品,加入1μl 50μM的OligodT,加入1μl10mM dNTP,用水补齐到10μl。65℃变性5min,冰上至少1分钟。加入10μl cDNA混合物(4μl 5x First Line Buffer,2μl 0.1M DTT,1μl M-MLVRT酶,3μl DEPC水)。37℃反应50min后在70℃15min终止反应。合成的cDNA用于后续实验或保存于-20冰箱中。
5.3PCR鉴定:
用mLeg1基因的第三个外显子两侧的引物2qPCR F282:CCTCTGCAGTTTGGCTGGCAGT和3’ARM rev-1:TCCAAGGATGAGGCATGGGCTTC,分别对野生型和mLeg1敲除小鼠的cDNA进行PCR。PCR采用普通的taq酶,反应条件为:1、94℃3分钟,2、94℃30秒,3、58℃30秒,4、72℃30秒,5、重复2到4步33次,6、72℃10分钟。
5.4扩增后的产物进行凝胶电泳,结果如图3中的(b)所示(图3的(b)中:WT为野生型小鼠,mLeg1Δ/Δ为mLeg1基因全身敲除型小鼠),野生型小鼠将产生一条约377bp大小的条带,而突变体小鼠由于第三个外显子的删除将产生一条大小为192bp大小的条带。同时扩增后的产物经纯化后测序,测序结果如图9所示,经测序验证,mLeg1Δ/Δ的PCR产物的第三个外显子确实被删除(如图4所示)。
5.5采用Western blot检测mLeg1Δ/Δ和野生型的小鼠的唾液腺中的mLeg1蛋白水平,具体步骤可参考实施例2。检测结果如图3中的(c)所示。
由图3中的(c)可知,mLeg1Δ/Δ小鼠的唾液腺确实不表达出mLeg1蛋白,而野生型的小鼠唾液腺表达出mLeg1蛋白。
以上数据充分说明,本发明的发明人获得了mLeg1Δ/Δ小鼠,且mLeg1基因敲除后并不影响该小鼠的生存和繁殖,以此mLeg1Δ/Δ小鼠作为研究mLeg1基因的功能的模型动物,所得到的研究结果可信度高。
实施例6
检测mLeg1的敲除对唾液腺的结构和功能产生影响。
小鼠唾液腺的三个腺体中都表达mLeg1,而颌下腺是小鼠唾液腺的最大组成部分,因此,本发明的发明人以颌下腺为研究对象,研究mLeg1基因的敲除是否会对其结构和功能产生影响。
6.1采用HE染色法观察mLeg1基因敲除是否会对唾液腺的形态结构造成影响。
6.1.1制备颌下腺组织切片:小鼠颌下腺用4%的多聚甲醛(Sigma,目录号:P6148,溶解于PBS)在室温中固定1小时后,用PBS洗两次,每次10分钟。在一个小空间内,如1.5ml Eppendorf管的帽子中,用温度约45℃的1.5%的低熔点琼脂糖溶液(用30%蔗糖PBS溶液煮沸溶化配制)冷却固定。之后在30%的蔗糖PBS溶液中4℃平衡过夜。平衡后,这些小块用O.C.T.复合物(Sakura目录号:4583)固定在塑料模型的底部。取-80℃预冷的酒精加入干冰,将塑料模型置入其中冷冻。冰冻的样品立即使用,或-80℃下于密封盒中储存。切片时,冰冻的样品块用O.C.T.复合物固定在支撑物中。样品切片前在切片机(Leica,HM505)-30℃下预冷平衡两小时。样品切成8~12μm厚度的薄片,多聚赖氨包被的玻璃载玻片(Menzel,目录号:J2800AMNZ)收集切的薄片上,收集样品马上使用或置于-80℃下保存。
6.1.2HE染色:取出已经切好的冰冻切片,苏木素染色5min,流水冲洗5min,1%的盐酸乙醇(1%的盐酸+99%无水乙醇)分化5s,流水冲洗10min,伊红染色5min,然后80%,95%,100%的乙醇一次清洗,每个2s,洗净伊红。放入二甲苯透明,滴上加拿大树脂封片,镜检观察。结果如图5所示。
由图5可知,mLeg1Δ/Δ小鼠和野生型小鼠的唾液腺HE染色结果并无显著差别,两者都包含中空、伊红染色较深的导管,以及伊红染色稍浅的实质腺泡组织,并且它们都有完整而紧凑的结构,意味着mLeg1敲除后对唾液腺的管状运输系统和唾液分泌单元的发育和形态结构并无显著影响。
6.2采用蛋白免疫荧光标记法观察mLeg1基因敲除是否会对唾液腺的形态结构造成影响。
为了进一步验证mLeg1敲除是否会对唾液腺的形态结构造成影响,本发明的发明人选取两个唾液腺的标记蛋白唾液淀粉酶(Amylase)和细胞连接蛋白(pan-cadherin),进行免疫荧光标记,从细胞层面上分析研究mLeg1的敲除对唾液腺形态结构的影响。实验方法如下。
6.2.1制备颌下腺组织切片:方法同6.1.1步骤,或者直接采用步骤6.1.1已制备好的组织切片。
6.2.2取如上所述处理的组织切片用PBST(0.2%triton X100)渗透,增加膜的通透性,便于抗体穿过细胞膜,一般处理时间为5min,接着用PBB(0.5%BSA(Sangon Cat.No.A0332)溶于1×PBS)清洗10min。
6.2.3用PBB配置20%的山羊血清进行封闭,按100:1的比例用PBB稀释一抗即抗pan-cadherin抗体(Sigma C1821),在4℃孵育样品过夜。60rpm下,PBB清洗3x10min。以1:400比例用PBB稀释荧光二抗(Goat anti-Mouse IgG(H+L)Secondary Antibody,Alexa Fluor Plus 647,Thermo,A32728),并以1/500的比例加入DAPI(Beyotime Cat.No.C1002),室温孵育1小时。60rpm下,PBB清洗3x10min后,用80%的甘油进行封片。
6.2.4激光共聚焦显微镜(Olympus FV1000)采集数据。结果如图7所示。
6.2.5Amylase蛋白免疫荧光标记,方法与步骤6.2.1-6.2-4基本相同,区别在于,在6.2.3步骤中用抗Amylase抗体(Santa Cruz sc-9890)替换抗pan-cadherin抗体,荧光二抗替换为(Goat anti-Rabbit IgG(H+L)Secondary Antibody,Alexa Fluor 488,Thermo,A-11034)。结果如图6所示。
由图6可知,mLeg1敲除并没有影响唾液淀粉酶(Amylase)和细胞连接蛋白(pan-cadherin)的表达和分布,暗示着mLeg1的敲除确实没有对唾液腺的组织结构、细胞组成和分布产生明显的影响。
6.4对mLeg1Δ/Δ小鼠的唾液腺唾液产生功能进行研究。
唾液腺的一个重要功能是产生和分泌唾液,因此,本发明的发明人也对mLeg1Δ/Δ小鼠的唾液腺唾液产生功能进行研究。腺泡细胞分泌产生的粘液(mucin)可以被阿新蓝(Alcian Blue)染色。因此,本发明的发明人用阿新蓝染色评估唾液腺的分泌能力。用阿新蓝分别染色野生型和mLeg1Δ/Δ小鼠的颌下腺切片。方法如下。
6.4.1制备颌下腺组织切片:同步骤6.1.1。
6.4.2阿新蓝染色:切片用双蒸水复水,之后用3%的乙酸处理3分钟,接着阿新蓝染色液(1%的阿新蓝,3%的冰醋酸,PH 2.5)室温染色30分钟,流水冲洗2分钟后,双蒸水润洗,用二甲苯润洗脱水后用加拿大树脂封片镜检观察。结果如图7所示。
由图7显示的结果可知,野生型小鼠和mLeg1Δ/Δ小鼠的导管之间的腺泡都存在非常明显的浓缩的阿新蓝阳性信号(图7中箭头所指位置),意味着颌下腺腺泡都可以正常的产生和分泌粘液。因此,mLeg1基因的敲除并没有影响颌下腺分泌唾液的能力。
实施例7
7.1检测mLeg1Δ/Δ小鼠血浆脂肪含量。
由于mLeg1是一个分泌蛋白,而mLeg1的敲除似乎对小鼠的唾液腺的发育和功能并没有造成影响,因此唾液腺可能并不是mLeg1的靶器官,也就是说,mLeg1可能运输到别的器官进而发挥功能。为了对mLeg1的功能进行研究,本发明的发明人对小鼠进行全身检查,研究mLeg1Δ/Δ小鼠是否会出现一些生理上的异常。本发明的发明人抽取小鼠的血液,对血清中的各项血指标进行检测。实验方法如下。
7.1.1将小鼠麻醉后,通过股动脉取血并置入抗凝管中,于1000g离心5min,取上清。
7.1.1将稀释的上清通过自动生化分析仪(迪安诊断代检)(奥林巴斯)检测各项血指标。检测结果如图8中的(a)所示。
由图8中的(a)可知(图8的(a)中:位于上方的大括号半框显示的是降低的指标项目,位于下方的大括号半框显示的mLeg1Δ/Δ小鼠中升高的指标项目,WT1WT2为野生型,ZCBA1,ZGA2,ZGA3,为mLeg1Δ/Δ小鼠),mLeg1Δ/Δ小鼠中三酰甘油的含量显著减少。此外,3种胆汁酸(T-BIL,DBIL和IBIL)都有所减少,而胆汁酸也跟脂肪的吸收代谢相关,这暗示着mLeg1Δ/Δ小鼠的代谢,尤其是脂肪代谢可能出现异常。因此,本发明的发明人对小鼠进行了甄别代谢是否紊乱的经典实验:葡萄糖耐受实验。
7.2葡萄糖耐受实验,具体方法如下。
7.2.1实验前小鼠饥饿过夜使血糖降低到最低水平,按1g葡萄糖每kg小鼠体重的量腹腔注射葡萄糖液(葡萄糖溶于灭菌PBS中),分别在注射后0min,15min,30min,60min和90min检测小鼠血糖含量。血糖含量通过Roche血糖仪(ACCU CHEK)检测。结果如图8中的(b)所示。
由图8中的(b)所显示的结果可知(图8的(b)中:实线为mLeg1Δ/Δ小鼠,虚线为野生型小鼠),腹腔注射了葡萄糖的野生型小鼠由于葡萄糖被吸收,血糖先是上升,在注射后30min达到顶点,而为了维持机体的血糖平衡,机体会通过分泌胰岛素降低血糖含量,因此在注射葡萄糖30min后,野生型小鼠的血糖开始缓慢下降。而注射了葡萄糖的mLeg1Δ/Δ小鼠,葡萄糖却以更快的速度被吸收并进入血液循环,注射后10min,血糖含量就已达到最高点,且比野生型小鼠的血糖最高点更高。另一方面,mLeg1Δ/Δ小鼠的血液中的葡萄糖也以更快的速率回到平衡状态。因此,尽管mLeg1Δ/Δ小鼠保留了的血糖吸收和调控机能,但mLeg1Δ/Δ小鼠的代谢出现了某种程度的异常。
实施例8
检测mLeg1Δ/Δ小鼠肝脏脂肪含量
肝脏是哺乳动物体内最大的器官,是机体代谢的中枢所在,是脂类合成代谢和分解代谢的重要场所。此外,当肝脏合成脂肪时需要通过血液循环运往脂肪组织,当机体处于饥饿状态,需要利用脂肪时,脂肪组织储存的脂肪需要通过血液循环运往肝脏进行利用。通过对小鼠血清中的脂肪含量检测来验证mLeg1敲除影响了肝脏的功能。
8.1检测血清中的脂肪含量。实验方法如下。
8.1.1取10周龄野生型和mLeg1Δ/Δ小小鼠的血清,在仪器上检测血清中的三酰甘油和胆固醇含量,重复3次,结果以平均值表示。结果如图8中的(c)所示。
由图8中的(c)可知(图8的(c)中:灰色柱状为mLeg1Δ/Δ小鼠,白色柱状为野生型小鼠,TRIG代表三酰甘油,TCHOL代表胆固醇),mLeg1Δ/Δ小鼠血液中三酰甘油减少,只有野生型小鼠的一半左右。
8.2检测肝脏组织中的脂肪含量。
上述结果暗示mLeg1敲除影响了肝脏的功能。因此,本发明的发明人对肝脏进行重点研究,对肝脏脂肪含量进行检测。结果如图8中的(d)所示。
由图8中的(d)可知(图8的(d)中:灰色柱状为mLeg1Δ/Δ小鼠,白色柱状为野生型小鼠,TRIG代表三酰甘油,TCHOL代表胆固醇),在肝脏中,三酰甘油也是显著的减少,同时,mLeg1Δ/Δ小鼠肝脏中胆固醇的含量也显著地减少。
实施例9
mLeg1敲除小鼠脂肪组织中脂肪储存量减少。
mLeg1Δ/Δ小鼠血液和肝脏中脂肪含量的减少促使本发明的发明人去研究脂肪的储存场所,也即脂肪组织中的脂肪含量是否减少。小鼠的脂肪组织主要有腹部脂肪组织和背部脂肪组织。
10.1分别检测小鼠的腹部脂肪组织和背部脂肪组织的脂肪含量,实验方法如下。
10.1.1小鼠猝死后,采用常规方法解剖观察腹部和背部脂肪。结果如图9所示。
由图9中的(a)和(b)的显示结果可知,10周龄的mLeg1Δ/Δ小鼠中,背部脂肪组织中的脂肪含量减少的尤为明显,而腹部脂肪组织中脂肪含量也有一定程度的减少(如图9中的(c)和(d)所示)。因此mLeg1的敲除,确实减少了小鼠体内的脂肪储存。
10.2小鼠在高脂喂食条件下的生长情况
上述结果,也进一步促使本发明的发明人猜想小鼠是否会对高脂食物喂食引起的肥胖产生抵抗。通过对不同类型的小鼠持续地喂食高脂饲料。实验方法如下。
10.2.1在鼠笼中提供充足的正常食物或高脂食物,让小鼠自由采食。
10.2.2在不同的时间点(4、5、6、7、9、10、11、12、13、15、16、17、19、22、24周龄)检测其体重,重复两次,每次每组3到6只小鼠,结果以平均值表示。以检测时间点为横坐标,以体重值(单位为g)为纵坐标,绘制小鼠的体重变化曲线图,结果图10中的(a)所示。
由图10中的(a)可知(图中:chow代表正常食物饲养、HFD代表高脂饲料饲养、mLeg1Δ/Δchow代表采用正常食物饲养的mLeg1Δ/Δ、mLeg1Δ/ΔHFD代表采用高脂食物饲养的mLeg1Δ/Δ、wt chow代表采用正常食物饲养的野生型小鼠、wt HFD代表采用高脂食物饲养的野生型小鼠),当给野生型和mLeg1Δ/Δ小鼠进行正常食物的喂食时,两种小鼠的体重都随着年龄增长而增长。而当用高脂食物代替正常食物进行喂食时,野生型的小鼠由于获取过多的能量并将这些能量以脂肪的形式进行储存,因此,野生型的小鼠在高脂喂食的情况下,体重快速增长,并最终发展成为肥胖症。同时,突变体小鼠在高脂喂食下,体重增长与正常饮食的小鼠并无明显差别。
另外,当用高脂食物进行喂食六个月后,野生型小鼠体型增大,腹部和背部存在很厚的脂肪层,表现出非常明显的肥胖症状,而mLeg1Δ/Δ小鼠则继续保持着在正常喂食情况下小鼠的体型(如图10中的(b)所示)。这些结果进一步证实mLeg1的功能确实与脂肪代谢息息相关。
实施例10
脂肪酸合成能力的减弱导致mLeg1Δ/Δ小鼠脂类减少
10.1检测肝脏中β氧化相关酶类的表达水平
脂肪含量的减少一方面可能是脂肪消耗增加,另一方面则可能脂肪酸或三酰甘油合成减少所致。脂肪酸的分解代谢主要在肝脏中通过β氧化实现。因此,通过荧光定量PCR(qRT-PCR)检测β氧化相关酶类的表达水平来验证mLeg1Δ/Δ小鼠脂肪含量的减少是由脂肪消耗增加还是脂肪酸或三酰甘油合成减少所致。实验方法如下。
10.1.1采用qRT-PCR检测野生型和mLeg1Δ/Δ小鼠肝脏β氧化相关酶基因(FBP1/PCX/ACOX/PEPCK)的表达水平,每组取三只独立的小鼠,基因表达量以β-actin为参照归一化后,表达量以平均值表示。qRT-PCR的检测方法如下(后文同此):
(1)RNA提取:操作方法同实施例1中的1.1RNA提取步骤,或者直接采用实施例1中的1.1RNA提取步骤所提取出的RNA样本进行检测。(2)RNA纯化:由于Trizol法抽提的总RNA可能会含有基因组DNA的污染,因此,用于荧光定量PCR的RNA样品先用DNA酶消化除去可能的存在的DNA。50μl反应体系中,按每10μg总RNA加入2单位无RNA酶污染的DNaseI(NEB Cat.No.M0303S),加入5μl 10x的反应缓冲液,用DEPC水补齐到50μl。37℃反应20min后用Mini Kit(QIAGEN Cat.NO.74106)进行RNA纯化。(3)RNA逆转录:纯化后的RNA经上述步骤逆转录为cDNA,RNA通过逆转录试剂盒(M-MLV First Strand Kit,Life Technologies,Cat.No.C28025-032)合成cDNA。(4)合成步骤如下:取1μg提取的RNA样品,加入1μl 50μM的OligodT,加入1μl 10mM dNTP,用水补齐到10μl。65℃变性5min,冰上至少1分钟。加入10μl cDNA混合物(4μl 5x First Line Buffer,2μl 0.1M DTT,1μl M-MLVRT酶,3μl DEPC水)。37℃反应50min后在70℃15min终止反应。合成的cDNA用于后续实验或保存于-20冰箱中。
(5)荧光定量PCR:以得到的cDNA为模板进行荧光定量PCR。荧光定量反应根据产品说明书使用SsoFastTM EvaSupermix试剂盒(Bio-Rad Cat.No.172-5201)进行。每个反应以10μl体系进行,其中含cDNA模板0.5μl,Supermix 5μl,10μM正反向引物各0.5μl,双蒸水3.5μl。荧光定量PCR所用正反向引物为:正向引物beta actin Fwd:GTGACGTTGACATCCGTAAAGA;反向引物beta actin Rv:GCCGGACTCATCGTACTCC。荧光信号的定量通过CFX96TM Real-Time System(Bio-Rad C1000TM Thermal Cycler)进行。各基因所用引物如表1所示。
检测结果如图11的(a)所示。
表1.本发明实施例进行qRT-PCR所用的引物序列表
由图11中的(a)可知(图11的(a)中:纵坐标为相对表达水平,横坐标为相关的β氧化酶基因的相对表达水平),脂肪酸的分解代谢主要在肝脏中通过β氧化实现,对比野生型和mLeg1Δ/Δ小鼠肝脏中β氧化相关酶类的表达水平,发现mLeg1基因的敲除并没有造成这些基因表达的异常升高,说明mLeg1的敲除并没有加速β氧化的发生,即并没有造成脂肪消耗的增加。mLeg1Δ/Δ小鼠的脂肪减少由脂肪酸或三酰甘油合成减少所致。
10.2检测肝脏中脂肪酸合成相关酶类的表达水平,实验方法如下。
10.2.1采用与10.1.1类似的方法检测野生型和mLeg1Δ/Δ小鼠肝脏脂肪酸合成相关酶(ACC1/ACC2/FAS/SCD1/ACL/GPAT1/DGAT1/DGAT2)的表达水平,所用引物如下表1所示。
检测结果如图11中的(b)所示。
由图11中的(b)可知(图11的(b)中:纵坐标为相对表达水平,横坐标为脂肪酸合成相关酶),通过比较野生型和mLeg1Δ/Δ小鼠肝脏中脂肪酸合成相关酶类的表达谱时,发现这些酶的表达均有不同程度的降低。脂肪酸从头合成相关的几个酶的表达都有不同程度的减少,基本为野生型的一半左右。其中,ACC1,ACC2,FAS和DGAT1在mLeg1Δ/Δ敲除小鼠中都显著减少。
当进一步的观察这些基因在脂类合成过程中发挥的作用时,本发明的发明人发现这些基因编码催化从三羧酸循环产物到脂肪酸合成一系列生化反应的酶类(如图12所示,图中:方框标注的是mLeg1敲除后差异表达的基因)。这些基因(SCD1/FASN/ACC/ACL)的表达下调,意味着mLeg1Δ/Δ小鼠的肝脏中脂肪从头合成能力的减弱,即将其它能源物质转化为脂肪酸并进行脂肪存储的能力显著减弱。肝脏内合成脂肪的减少,解释了肝脏内部血管附近中性脂肪的减少,解释了mLeg1Δ/Δ小鼠血液中三酰甘油为何减少,也解释了mLeg1Δ/Δ小鼠脂肪组织脂肪减少的原因。
实施例11
11.1检测调控脂类合成基因表达的转录因子的表达水平
调控脂类合成基因表达的转录因子主要有4个,PPARγ,chrebp,PGC1α和srebp1c。因此,本发明的发明人先对肝脏中这几个转录因子的表达水平进行研究。实验方法如下。
11.1.1采用与步骤11.1.1类似的方法检测野生型和mLeg1Δ/Δ小鼠肝脏转录因子(PPARγ,chrebp,PGC1α和srebp1c)表水平具体实验方法可参考实施例2中的步骤2.1-2.4,所用的相关引物见表1,检测结果如图13所示。
由图13可知(图中:纵坐标为相对表达水平,横坐标为调控脂肪合成的转录因子),4种转录因子(PPARγ,chrebp,PGC1α和srebp1c)中只有srebp1c的表达在mLeg1Δ/Δ小鼠肝脏中显著减少,因此,mLeg1Δ/Δ小鼠中肝脏的脂类合成酶的表达下降是srebp1c表达减少所致。
实施例12
12.1mLeg1Δ/Δ小鼠肝脏中的Akt的磷酸化水平
Srebp1c的活性调控主要有两种方式:其一是未被磷酸化的Srebp1c通常驻留在细胞质中,而Akt通过mTORC1调控Srebp1c的磷酸化,从而使得其从细胞质中转移入细胞核中,并发挥其转录活性;其二是Akt可以以一种不是特别明了的机制正向调控srebp1c的转录水平。因此Srebp1c的活性调控主要是通过Akt的活性来实现的。
本实施例中,本发明的发明人检测脂类合成中心肝脏,以及mLeg1表达的唾液腺中Akt活性水平。而Akt的活性可以用其磷酸化水平来指示。因此,可通过检测磷酸化水平来反应Akt的活性。实验方法如下。
12.1.1按步骤3.1方法提取肝脏,唾液腺蛋白,通过Western blot,使用Akt磷酸化抗体(Cell signalling#4060P)检测Akt的磷酸化水平。
检测结果如图14中的(a)和(b)所示。
由图14中的(a)和(b)可知(图中:WT代表野生型小鼠,mLeg1Δ/Δ代表mLeg1基因敲除小鼠),mLeg1Δ/Δ小鼠肝脏中的Akt的磷酸化水平显著低于野生型小鼠(如图14的(a)所示)。而唾液腺中的Akt磷酸化的差异更为显著,野生型小鼠中存在明显的磷酸化Akt蛋白,而mLeg1Δ/Δ小鼠的唾液腺中基本检测不到Akt的磷酸化(如图14的(b)所示)。这些结果都证明,mLeg1Δ/Δ小鼠Akt的活性受到了抑制,也给出了srebp1c表达减少的解释。
实施例13
唾液腺细胞分泌到上清液的因子可以诱导HepG2细胞Akt磷酸化
为了验证mLeg1的敲除是否和肝脏中Akt活性减弱直接相关,本发明的发明人首先采取体外的实验系统检测mLeg1能否能够激活Akt。由于mLeg1是在小鼠唾液腺中丰富表达的分泌蛋白,如果对唾液腺细胞进行原代培养,则可以在细胞培养上清中得到分泌出来的mLeg1。因此,本发明的发明人对唾液腺原代培养的细胞及细胞培养上清进行Western blot检测。实验方法如下。
13.1唾液腺细胞的原代培养:
13.1.1小鼠断颈处死后,迅速的取下唾液腺,并用灭菌的PBS清洗两次,除尽粘附的毛发。用剪刀将取下的唾液腺剪碎。
13.1.2以40mg/ml的比例将剪碎的唾液腺收集到buffer中(体积为V)。每2ml buffer中加入25μl透明质酸酶(hyaluronidase),25μl二型胶原酶(collagenase II)和250μl 50mM的CaCl2,于37℃孵育40min。
13.1.3 1500rpm离心去上清,并重复步骤13.1.2。
13.1.4 1500rpm离心去上清,并用V体积的buffer清洗,离心去上清,再用1/2V的buffer重复清洗一次,离心去上清。
13.1.5用1/2V的buffer重悬浮离心下来的组织,并用细胞过滤器(Cell strainer,BD Cat.NO.352340)过滤取滤液用MSG培养液培养。
其中,所用溶液配方如下:
Buffer:(1%BSA(Amresco Cat.NO.0332)in Hank’s buffer(Beyotime,Cat.NO.C0218))。
重组酶配方:用buffer溶解透明质酸酶(Sangon Biotech,Cat.NO.A002594),浓度为40mg/ml;用buffer溶解二型胶原酶(GIBCO Cat.NO.17101-015),浓度为23mg/ml。酶溶液均新鲜配置为宜。
MSG培养液:DMEM高糖培养基(GIBCO Cat.NO.11965-092),1X的青霉素和链霉素(Beyotine,Cat.NO.C0222),1X的insulin-transferin-Selenium-X(GIBCO,Cat.NO.41400-045),1μM的dexamethasone(Sigma D4902),10%的胎牛血清(GIBCO Cat.NO.16000-044)。
13.2提取经原代培养后的唾液腺细胞的总蛋白:取上述步骤得到的培养液,于1000g离心5min,弃上清后加入SDS裂解液(63mM Tris-Hcl,PH6.8,10%甘油,5%β-巯基乙醇,3.5%SDS,1X的Complete)裂解,100℃变性7min后进行后续Western blot检测分析或保存于-20℃中。(对于贴壁细胞,按如下进行:去培养上清后,加入SDS裂解液,用细胞刮刮下贴壁细胞后收集于1.5ml离心管中。100℃变性7min后进行后续Western blot检测分析或保存于-20℃中)。
13.3直接取原代培养后的细胞培养上清用于后续进行Western blot检测。
13.4Western blot检测的方法同步骤实施例3的步骤3.2。检测结果如图14中的(c)所示。
由图14中的(c)可知(图14的(c)中:CK media代表未培养唾液腺细胞的细胞培养液,salivary media代表培养了野生型唾液腺细胞的细胞培养液,salivary cell代表唾液腺原代培养的细胞),细胞和细胞培养上清中都存在mLeg1蛋白,并且通过检测细胞中的Akt蛋白量确证细胞培养上清中的mLeg1并不是由于细胞污染导致的。
实施例14
在实施例13的实验基础上,本发明的发明人用这种含有mLeg1的培养液(来自野生型唾液腺细胞培养上清)和不含mLeg1蛋白的培养液(来自mLeg1Δ/Δ小鼠唾液腺细胞培养上清)去培养人肝癌细胞HepG2,研究唾液腺分泌物能否直接促进肝癌细胞Akt的磷酸化,并且这种诱导激活磷酸化Akt的能力在有无mLeg1蛋白条件下是否存在差异。实验方法如下。
14.1人肝癌细胞HepG2培养:用DMEM高糖型培养基加入10%的新生牛血清(GIBCO Cat.NO.16010-159)培养在5%CO2,37℃的恒温及饱和湿度的培养箱中培养。传代时,除尽培养液,用0.25%胰酶(EDTA-free,Sigma Cat.NO.T4549)适时消化,取适量细胞传代培养或后续实验。
14.2以原代培养野生型小鼠唾液腺细胞和mLeg1Δ/Δ小鼠唾液腺细胞培养上清孵育贴壁生长的HepG2细胞,分别在20分钟和10小时后收集细胞样品。
14.3通过Western blot,用Akt磷酸化抗体检测p-Akt的含量,以反应Akt的磷酸化水平。
14.4结果如图14中的(d)所示。
由图14中的(d)可知(图14的(d)中:CK代表mLeg1Δ/Δ小鼠唾液腺细胞培养上清,mLeg1代表野生型小鼠唾液腺细胞培养上清),不论是培养HepG2细胞10小时,还是20分钟,用野生型唾液腺细胞上清培养的HepG2细胞的Akt的磷酸化水平都显著高于用mLeg1Δ/Δ上清培养的细胞,并且在短短的20分钟内mLeg1就可以诱导Akt的磷酸化,证明野生型小鼠唾液腺分泌物确实能够促进Akt磷酸化,而当mLeg1敲除后,唾液腺分泌物对Akt激活的能力显著下降,证明唾液腺分泌的mLeg1可以直接或间接的对Akt进行活性调节。
实施例15
唾液腺细胞分泌到上清液的因子可以诱导mLeg1Δ/Δ小鼠肝脏Akt的磷酸化
上述体外实验证明野生型唾液腺细胞分泌物能够促进肝癌细胞的Akt的磷酸化。进一步的,本发明的发明人对这些分泌物能否对体内的肝脏Akt的磷酸化水平进行调控进行研究。实验方法如下。
15.1分别采用腹腔注射和尾静脉注射方法将野生型和mLeg1Δ/Δ小鼠唾液腺原代培养细胞分泌的上清注射到mLeg1Δ/Δ小鼠中。
15.2注射后1小时猝死小鼠,收集肝脏,并通过Western Blot,使用Akt磷酸化抗体检测肝脏中Akt的磷酸化水平是否发生变化。结果如图15中的(a)所示。
由图15中的(a)可知(图15的(a)中:WT代表野生型小鼠唾液腺细胞培养上清,mLeg1Δ/Δ代表mLeg1Δ/Δ小鼠唾液腺细胞培养上清,lumbar代表腹腔注射,vein代表尾静脉注射),不论是腹腔注射或尾静脉注射的野生型的唾液腺细胞分泌物都能促进mLeg1Δ/Δ小鼠肝脏Akt的磷酸化。以上结果证明,含mLeg1的唾液腺分泌物同样可以对体内肝脏中的Akt磷酸化进行调控,此外,该结果还暗示唾液腺分泌物可以通过血液运输最终到达肝脏发挥作用。
实施例16
从唾液腺纯化所得的不同浓度的mLeg1蛋白诱导Akt的磷酸化
野生型和mLeg1Δ/Δ小鼠唾液腺细胞最直接的差别在于它们能否表达mLeg1,那么,野生型和mLeg1Δ/Δ小鼠唾液腺细胞分泌物造成的Akt磷酸化差异是否是由mLeg1直接造成的,即mLeg1蛋白是否能够直接诱导Akt的磷酸化。本发明的发明人通过如下实验方法进行研究。
16.1柱层析分离纯化的mLeg1蛋白诱导Akt的磷酸化水平。实验方法如下。
16.1.1取两到三只野生型小鼠的唾液腺,置于预冷的PBS缓冲液中漂洗,取出后用剪刀剪成细小的碎片,之后转移到组织匀浆器中。加入4ml裂解液(50mM的Tris-Hcl,PH 8.0,150mM的NaCl,0.5%的NP40,2x的complete),冰上充分匀浆。之后用23G针头反复抽碎,4℃垂直摇床孵育30min,4℃离心机12000g离心15min,取上清。
16.1.2将上清在4℃中匀速通过sephalose 6B分子筛,其中洗脱用PBS缓冲液。以4ml/管收集不同洗脱组分。
16.1.3并通过Western blot检测各组分中mLeg1的含量。取mLeg1含量最高的一管为纯化的mLeg1,并以大肠杆菌中重组表达的mLeg1蛋白为对照,估算mLeg1的浓度,并用于后续实验。
16.1.4将纯化的mLeg1蛋白稀释至不同的浓度(分别为3.14x10-2ng/μl、0.314ng/μl和3.14ng/μl)分别加入HepG2培养基培养HepG2中,37℃孵育20分钟后,然后提取细胞总蛋白(提取方法参考步骤13.2),并通过Western blot检测各浓度下的Akt的磷酸化水平(参考步骤14.3,相应抗体选用抗p-Akt抗体(S473,Cell signalling#4060P),使用时稀释比例为1:1000)。结果如图15中的(b)所示。
由图15中的(b)可知(图15的(b)中:A代表3.14ng/μl、B代表0.314ng/μl、C代表3.14x10-2ng/μl、“-”代表未加入),mLeg1蛋白可以诱导Akt的磷酸化,并且纳克级的mLeg1即可诱导HepG2细胞的Akt磷酸化。
16.2来自野生型小鼠和mLeg1Δ/Δ小鼠唾液腺的组分诱导Akt的磷酸化水平。实验方法如下。
16.2.1分别提取野生型小鼠和mLeg1Δ/Δ小鼠唾液腺富含mLeg1蛋白的组分。
16.2.2将16.2.1提取的组分分别加入到HepG2培养基中培养HepG2,37℃孵育20分钟后,然后提取培养后的细胞的总蛋白(提取方法可参考步骤13.2)。
16.2.3通过Western blot检测各浓度下的Akt的磷酸化水平(具体可参考步骤13.2,相应抗体选用抗p-Akt抗体(S473,Cell signalling#4060P),使用时稀释比例为1:1000)。结果如图16中的(a)所示。
由图16中的(a)可知(图16的(a)中:“-”代表mLeg1Δ/Δ小鼠唾液腺总蛋白,“+”代表野生型小鼠唾液腺总蛋白),野生型小鼠唾液腺含mLeg1组分诱导Akt磷酸化显著强于mLeg1Δ/Δ小鼠唾液腺相应组分。
实施例17
mLeg1激活Akt依赖PI3K通路
由于mLeg1是一个细胞分泌蛋白,而用mLeg1培养HepG2细胞的实验中,mLeg1相当于一个细胞外蛋白,同时Akt的磷酸化是细胞内的一个重要的信号传递过程,因此,这里涉及细胞外信号转化为激活细胞内信号的过程。纵观已知的细胞外信号诱导的Akt磷酸化,主要依赖于PI3K磷酸化PIP2,并将其转化为PIP3,从而进一步诱导Akt的磷酸化。因此,mLeg1诱导的Akt磷酸化可能也依赖PI3K通路。本发明的发明人选用PI3K的特异性抑制剂LY290004抑制PI3K信号通路,并观察PI3K通路被抑制后,mLeg1对Akt激活能力是否发生改变。实验方法如下。
17.1处理前,HepG2细胞用0.1%血清饥饿培养过夜,用0.25%胰酶(EDTA-free,Sigma Cat.NO.T4549)适时消化,取适量细胞置于离心管中,
17.2用野生型(含mLeg1)和mLeg1Δ/Δ(不含mLeg1)小鼠唾液腺细胞原代培养的上清液培养HepG2细胞,并在野生型小鼠唾液腺细胞的培养上清液中加入不同浓度(低到高依次为10μM,20μM和40μM)的PI3K抑制剂LY290004(cell signaling)抑制PI3K通路。
17.3通过Western blot检测各浓度下的Akt的磷酸化水平,具体操作可参考步骤18.2.2。检测结果如图16中的(b)所示。
17.4另外,在步骤17.1之后,用柱层析纯化的mLeg1和10μM的LY290004培养HepG2细胞,细胞培养箱中培养15min,1000g离心5min去上清。加入SDS裂解液裂解细胞提取蛋白(具体操作可参考步骤13.2)。
17.5通过Western blot检测HepG2细胞的Akt的磷酸化水平。检测结果如图16中的(c)所示。
由图16中的(b)可知(图16的(b)中:WT media代表野生型小鼠唾液腺原代培养细胞培养上清,“-”代表未加入,A代表加入浓度为10μM,B代表加入浓度为10μM,C代表加入浓度为10Μm,CK media代表mLeg1Δ/Δ小鼠唾液腺细胞培养上清),野生型小鼠唾液腺原代培养细胞培养上清(WT media)激活Akt的能力显著强于mLeg1Δ/Δ小鼠唾液腺细胞培养上清(CK media),当在WT media里面加入不同浓度PI3K抑制剂LY29004时,均可以非常显著地抑制野生型小鼠的唾液腺成分引起的Akt的磷酸化。说明,当加入LY290004时,含mLeg1的培养液不再能诱导Akt的磷酸化,并且细胞内的Akt磷酸化保持在非常低的水平。而PTEN的磷酸化水平并没有随着LY290004的加入升高,证明这种Akt磷酸化水平的抑制并不是由于PTEN引起的。
同时,由图16中的(c)可知(图16的(c)中:上排中的“-”代表mLeg1Δ/Δ小鼠唾液腺,“+”代表野生型小鼠唾液腺;下排中的“-”代表加入LY29004,“+”代表未加入LY29004),本发明的发明人在HepG2培养基中加入柱层析纯化的mLeg1和10μM LY290004,发现LY290004能够完全的抑制mLeg1对Akt磷酸化的诱导。因此,mLeg1诱导的Akt磷酸化依赖于PI3K信号通路。
实施例18
mLeg1通过RTK激活Akt
细胞外信号传递到细胞内需要经过细胞膜,而连接细胞外信号与细胞内PI3K信号的一类膜蛋白即受体酪氨酸激酶(Receptor tyrosine kinase,RTK)。RTK与相应配体结合后能够自身磷酸化并磷酸化下游底物,并且这种磷酸化发生在酪氨酸残基上,因此,可以通过检测细胞内总酪氨酸磷酸化的水平差异来甄别mLeg1诱导的Akt磷酸化是否是通过RTK来实现的。实验方法如下。
18.1往HepG2细胞培养基中加入mLeg1并培养HepG2细胞,然后提取细胞总蛋白。
18.2通过酪氨酸磷酸化抗体4G10(Millipore,05-321)检查细胞内的总的酪氨酸磷酸化的水平。结果如图16中的(d)所示。
由图16中的(d)可知(图16的(d)中:CK为未加入mLeg1),mLeg1蛋白加入后,细胞内的酪氨酸磷酸化水平远远高于对照组。此外,Western结果也指示,发生酪氨酸磷酸化的蛋白的分子量都较大,这与RTK的分子量都较大非常吻合。进一步暗示着mLeg1促进Akt的磷酸化是很可能是通过RTK来实现的。
实施例19
mLeg1激活EGFR
人类基因组中,总共有58个基因编码RTK,因此,本发明的发明人决定研究mLeg1是具体通过激活哪个RTK来传递信号的,这里本发明的发明人选取了R&D的RTK筛选系统。该系统通过将49个RTK的抗体分别交联在同一张膜上,通过这些抗体将细胞裂解液中的相应的RTK蛋白拉下并附着在膜上。基于RTK激活会在自身的酪氨酸上发生磷酸化特性,可以通过酪氨酸磷酸化抗体检测各个附着的RTK酪氨酸磷酸化水平,用以指示RTK的激活情况。实验方法如下。
19.1受体酪氨酸激酶的的筛选通过RTK assay kit(Proteome Profiler Human Phospho-RTK Array Kit,R&D Cat.no.ARY001B)依说明书进行操作。该kit总共可以检测58个RTK中的49个,操作步骤简而言之,用mLeg1和对照分别处理细胞(长满于10cm培养皿),用500μl lysis buffer17裂解细胞。RTK筛选膜经Assay buffer1封闭1小时后,敷上细胞裂解液结合过夜,通过1X Wash Buffer洗3次,每次10分钟,加入用1X Array Buffer2以1:5000倍稀释的Anti-Phospho-Tyrosine-HRP Detection Antibody,室温孵育2小时。1X Wash Buffer洗3次,每次10分钟后,敷上Chemi Reagent Mix显影,通过荧光化学发光成像仪(Clinx Science Instruments Cat.No.3400)里成像收集信号。结果图17所示。
由图17可知,HepG2细胞中大部分RTK的活性并不受是否加入mLeg1的影响,都保持在较低的水平,而只有EGFR(如图17中圆圈圈出的点所示)在mLeg1掺入后,其酪氨酸磷酸化显著增加,意味着mLeg1加入,激活了EGFR,并进一步激活下游Akt信号。
进一步地,本发明的发明人通过EGFR的磷酸化特异性抗体检测mLeg1对细胞内EGFR的激活水平的影响,由图18的(a)的结果也显示(图18的(a)中:“-”代表未加入,“+”代表加入),mLeg1的掺入可以非常迅速地激活EGFR受体,并在之后激活Akt信号。
实施例20
mLeg1激活Akt依赖EGFR的激活
由实施例21的RTK的筛选结果显示mLeg1很可能通过EGFR的激活来诱导Akt的磷酸化,如果通过EGFR的抑制剂抑制EGFR的活性能阻断mLeg1诱导的Akt的磷酸化,则将进一步证实mLeg1是通过EGFR来激活Akt的。这里本发明的发明人选取EGFR的特异性抑制剂AG1478来抑制EGFR的活性。实验方法如下。
20.1HepG2细胞培养,具体可参考步骤18.1。
20.2往细胞培养液中分别加入添加物(BSA、mLeg1、AG1478),进行处理,培养15分钟后,提取总蛋白(参考步骤13.2),并进行Western blot检测各处理组中的各蛋白(p-Akt、Akt、P-EGFR)水平(参考步骤2.2)。结果如图18中的(b)所示。
由图18中的(b)可知,当HepG2细胞的培养基中加入柱层析分离的mLeg1时,可以诱导Akt磷酸化,而加入牛血清白蛋白的BSA对照组,Akt磷酸化基本不受影响。当往培养基中再加入1μM的AG1478抑制EGFR活性时,本发明的发明人发现mLeg1诱导的Akt磷酸化被阻断。同时,对EGFR的磷酸化水平研究发现,mLeg1处理诱导了EGFR的磷酸化,而加入AG1478后,EGFR的激活则被抑制。因此,mLeg1诱导Akt的磷酸化依赖于细胞膜表面的EGFR受体的激活。
实施例21
mLeg1与EGFR受体存在蛋白与蛋白间的互作
以上的结果显示mLeg1可以通过EGFR激活PI3K信号,从而诱导Akt的磷酸化。EGFR是细胞膜表面的一个受体蛋白,而mLeg1是一个分泌蛋白,因此mLeg1可能直接与EGFR结合,作为一个信号分子直接激活下游信号。因此,本发明的发明人接着通过免疫共沉淀检测mLeg1与EGFR之间是否存在互作。
由于以上结果显示mLeg1能够影响肝脏的功能,本发明的发明人通过将柱层析分离纯化的mLeg1蛋白去孵育肝脏匀浆分离得到的细胞。由于mLeg1激活EGFR的反应非常迅速,而激活后的EGFR很快走向降解,因此,本发明的发明人用mLeg1在4℃孵育肝细胞,同时加入交联剂DSP稳定mLeg1和其潜在互作蛋白的相互作用,随后将mLeg1洗净并通过NP40裂解液裂解肝细胞进行免疫共沉淀。实验方法如下。
21.1抗体交联:取30μl proteinA/G(beyotime Cat.NO.P2012),低速(500~1000g)离心去上清。4℃预冷的PBS清洗两次后加入抗体(20μg抗体溶于1X 100μl PBS中),室温孵育30min。离心去上清。用300μl PBS清洗3次珠子,加入50μl DSS溶液(5μl 10x PBS,36μl H2O,9μl 2.5mM DSS(Thermo,Cat.No.21655),室温孵育50分钟。离心去上清后,用50μl 100mM PH2.2甘氨酸清洗珠子3次,300μl含1%NP40的PBS清洗两次,最后用300μl PBS清洗一次。交联抗体的珠子保持湿润,使用前离心弃尽上清。
21.2通过柱层析分离,得到野生型唾液腺的含mLeg1的组分以及mLeg1Δ/Δ小鼠唾液腺不含mLeg1的组分。
21.3用上述组分分别孵育肝脏匀浆分离得到的细胞,4℃孵育肝细胞,同时加入交联剂DSP稳定mLeg1和其潜在互作蛋白的相互作用。
21.4免疫共沉淀:组织或细胞通过NP40裂解液(50mM的Tris-Hcl,PH 8.0,150mM的NaCl,1%的NP40,2Mm EDTA,1mM PMSF,2x的complete)充分匀浆,4℃垂直摇床充分裂解15min,4℃下12000g离心15min,取上清用于后续操作。往上清中加入交联了抗体的珠子,4℃孵育过夜后。用4℃预冷的PBST(0.1%Tween 20)清洗3次,再用预冷PBS清洗两次。加入50μl 100mM PH2.2甘氨酸洗脱珠子上结合的蛋白,加入2μl 1M PH9.5的甘氨酸中和PH后于-20℃保存或是直接后续分析。
21.5通过Western Blot检测mLeg1抗体拉下来的蛋白。结果如图18中的(c)所示。
由图18中的(c)可知(图18的(c)中:input代表用于免疫共沉淀实验的蛋白;“-”代表为灌胃mLeg1蛋白的对照组;“+”代表灌胃mLeg蛋白的实验组;IP:α-mLeg1代表mLeg1抗体结合并拉下mLeg1蛋白及其相互作用蛋白),未加入mLeg1的肝细胞中的EGFR并不能被mLeg1的抗体拉下,而加入mLeg1后,mLeg1抗体共沉淀组分中除了含有mLeg1蛋白外,还含有EGFR蛋白,因此,mLeg1与EGFR之间确实存在相互作用。
实施例22
上述的研究表明mLeg1调节肝脏Akt活性的功能是通过结合并激活EGFR来实现的,这需要mLeg1能够到达肝脏并与EGFR相结合。本发明的发明人知道mLeg1在唾液腺中表达,并分泌入唾液中。那么这种口腔中的mLeg1是否能到达肝脏并与肝脏中的EGFR发生相互作用呢?为了模拟这一情况,通过如下实验方法进行了研究。
22.1将柱层析纯化的mLeg1按每克小鼠体重用50ng的mLeg1从口腔灌胃入mLeg1Δ/Δ小鼠中。
22.2灌胃后不同时间点(0、10、20、40、60min)将小鼠猝死并收集肝脏样品,通过mLeg1的抗体对肝脏可能存在的mLeg1蛋白进行免疫沉淀实验,以检测处理后mLeg1Δ/Δ小鼠mLeg1蛋白与EGFR相互作用的结果,具体可参考步骤21.2-21.5。
借助上述方法模拟唾液腺分泌的mLeg1进入消化道后的行为。
基于以上理论,mLeg1需要在肝脏中发挥作用,那么灌胃后小鼠的肝脏理应存在mLeg1蛋白。结果如图18中的(d)所示。
由图18中的(d)可知,小鼠灌胃10分钟后即可在其肝脏中检测到mLeg1蛋白,并且蛋白量在灌胃20分钟后达到最大值,灌胃40分钟和60分钟后肝脏中的mLeg1开始减少。同时,本发明的发明人观察到灌胃10分钟后,mLeg1结合的EGFR最多,之后结合的EGFR蛋白量随着时间的延续不断减少。这可能是由于mLeg1与EGFR快速结合并迅速传递下游信号所致:体外实验中mLeg1在1分钟之内就可以激活EGFR,EGFR在3分钟之内磷酸化水平就开始减少。同时,本发明的发明人也检查了这种灌胃的mLeg1蛋白对下游Akt的激活情况。mLeg1灌胃后10分钟后,肝脏中的Akt磷酸化就有所增加,并且这种增加灌胃后40分钟到60分钟更为明显。综合以上结果,唾液腺分泌表达的mLeg1可以通过消化道被血液吸收,并最终到达脏并激活肝脏中的EGFR,从而激活Akt,最终对肝细胞的生理功能进行调控。
实施例23
修饰缺陷的mLeg1蛋白有竞争性的抑制野生型mLeg1的功能
生物体内的蛋白往往需要被正确的修饰才能发挥正确的功能。因此,修饰缺陷的mLeg1蛋白有可能也散失其激活Akt的能力,并同时有可能竞争性的抑制野生型mLeg1的功能。为了验证这一猜想,本发明的发明人用大肠杆菌表达系统,表达重组的mLeg1蛋白(mLeg-Re)。由于大肠杆菌为原核生物,在该表达系统中表达的真核蛋白往往会失去正确的修饰。实验方法如下。
23.1以唾液腺cDNA为模板,采用引物mLeg1ATG BamHI fw:CTCAGTggatccATGGCTGTCCTGGCTTCC和mLeg1TAA XhoI Rv:TACCTCGAGAGAAGATGTTGCCAGGAACTCTT进行PCR扩增。反应条件为:95℃3分钟,95℃30秒,58℃30秒,72℃1分钟,34个循环后,72℃10分钟。将PCR产物纯化,之后和Pet30(a)载体用BamHI和XhoI进行酶切过夜。将酶切产物纯化后,取PCR产物和载体各50ng,用T4DNA进行连接。室温反应10分钟后,将连接产物用感受态细胞DH5α转化。步骤为冰上30秒,42℃热激90秒,冰上2分钟,之后加入1ml LB培养基,37℃摇菌1小时。取100ul菌液涂含KANA抗性的LB平板过夜。选取单克隆,测序确定单克隆中mLeg1片段的正确插入。将正确的单克隆用含KANA抗性的LB培养基扩大培养过夜后提取质粒。
表达mLeg1-Re蛋白的过程如下:将提取的质粒转化入DE3表达感受态中,同样的涂板,挑单克隆并测序验证单克隆中含有正确的mLeg1质粒。用含KANA抗性的LB过夜培养单克隆。取10ml过夜培养的菌液稀释入1L的含KANA抗性的LB中,37℃下摇菌培养至菌液OD值为0.5后,加入1mM的IPTG诱导表达mLeg1-Re蛋白的表达。继续摇菌培养4小时后离心收集菌体。加入10ml的裂解液(50mM NaH2PO4,300mM NaCl和10mM咪唑,PH8.0)重悬浮菌液,加入1mg/ml的溶菌酶冰上反应1小时。超声破碎菌体后,加入4ml的Ni-NTA(QIAGEN,30230)的珠子,反应过夜。4℃下1000g离心去上清,用4ml清洗液缓冲液(50mM NaH2PO4,300mM NaCl和20mM咪唑,PH8.0)清洗两次后,用4ml洗脱液(50mM NaH2PO4,300mM NaCl和250mM咪唑,PH8.0)洗脱。将洗脱产物置入半透膜(Thermo,SnakeSkin Dialysis Tubing,#68100),用PBS透析3天,每12小时更换一次PBS。最后得到的蛋白为mLeg1-Re蛋白,测浓度后保存于-80℃。
23.2通过Western blot检测mLeg1-Re蛋白的大小。结果如图19中的(a)所示。
23.3用提取的重组蛋白mLeg1-Re和野生型mLeg1蛋白孵育HepG2细胞,检测HepG2细胞的Akt磷酸化的水平。具体可参考步骤18.2.2。结果如图19中的(b)所示。
免疫印迹结果显示,mLeg1-Re蛋白的大小确实显著小于野生型mLeg1蛋白(如图19中的(a)所示)。当用重组蛋白mLeg1-Re去单独孵育HepG2细胞时,mLeg1-Re蛋白确实散失了诱导Akt磷酸化的能力。当在纯化野生型mLeg1蛋白(50ng)中加入过量的mLeg1-Re蛋白(500ng),并室温孵育10分钟后,共同孵育HepG2细胞,结果显示mLeg1蛋白仍然可以诱导Akt的磷酸化。这意味着mLeg1-Re蛋白并不能和mLeg1蛋白结合并抑制mLeg1蛋白的功能。当用等量的mLeg1-Re蛋白先孵育HepG2细胞10分钟后,再加入mLeg1蛋白,结果显示,mLeg1蛋白激活Akt的能力被完全抑制(如图19中的(b)所示)。这很可能是mLeg1-Re蛋白也能够竞争性的与EGFR受体结合,从而阻断野生型mLeg1与EGFR受体结合并激活下游Akt的能力。
进一步的,mLeg1-Re蛋白是否在小鼠体内也能竞争性的抑制野生型mLeg1的功能,从而抑制脂肪合成的通路,最终阻断肥胖的发生。通过如下实验方法验证。
23.4取10周龄的体重(t1)一致的野生型小鼠,随机分为3个组,每个组3到4只小鼠。给野生型小鼠喂食高脂食物,并每天通过口腔灌喂20ug的mLeg1-Re蛋白,作为灌喂mLeg1-Re的实验组。给另一组同样年龄的野生型小鼠喂食同样的高脂食物,并每天通过口腔灌喂等量的牛血清白蛋白(BSA),作为灌喂BSA的实验组。再给另一组同样年龄的野生型小鼠喂食同样的正常食物,作为对照组。一个月后,称其体重(t2),结果以增加的体重(t2-t1)表示。实验重复两次,最终体重改变取平均值。结果如图20中的(a)所示。
由图20中的(a)可知,由于高脂食物的喂食,灌喂BSA的实验组相比于喂食正常食物的小鼠,体重出现明显的增长,而同时灌喂mLeg1-Re蛋白的实验组小鼠则体重增长与喂食正常食物小鼠相差不大,都显著的少于对照组。表明mLeg1-Re蛋白具有抑制由过度饮食高脂食物引起的肥胖或体重增长。
这些结果,进一步暗示mLeg1-Re蛋白能够与肝脏中的EGFR受体结合,并阻断正常mLeg1的功能。为了进一步验证这个猜想,发明人用mLeg1-Re蛋白去灌胃mLeg1Δ/Δ小鼠,并免疫共沉淀的方法检测mLeg1-Re蛋白是否能到达肝脏,并于肝脏中的EGFR结合。结果如图20中的(b)所示(图中:input代表用于免疫共沉淀实验的蛋白“-”代表为灌胃mLeg1-Re的对照组;“+”代表灌胃mLeg-Re的实验组;IP:α-mLeg1代表mLeg1抗体结合并拉下mLeg1蛋白及其相互作用蛋白):灌胃两小时后,可以在mLeg1Δ/Δ小鼠肝脏中检测到mLeg-Re的蛋白,并在用mLeg1抗体拉下的蛋白中可以检测到明显的EGFR蛋白的存在。结果证实,mLeg1-Re蛋白确实可以从口腔进入肝脏,并于EGFR结合,阻断正常mLeg1的功能,最终减少脂肪的合成。
综上所述,在给正常小鼠持续喂食高脂肪含量(10%)的食物时,该小鼠的体重将持续增重,最终导致肥胖,以及一系列肥胖综合症的发生。而当敲除mLeg1基因,即抑制mLeg1的功能时,即使持续喂食高脂肪含量食物,小鼠体重增长跟喂食正常食物并无明显差别,并未发展出肥胖的症状。这意味着mLeg1的功能抑制,可以抑制过度饮食所引起的肥胖。mLeg1的功能是通过EGFR-Akt-Srebp1c信号轴来发挥调控脂肪合成的,意味着干扰mLeg1,EGFR,Akt,Srebp1c中的任意一个因子功能的化合物,都有可能作为发展抑制饮食引起的肥胖的药物。因此,抑制mLeg1-EGFR-Akt-Srebp1c信号轴的作用,阻断新的脂肪的合成,有可能成为治疗肥胖症的新手段。而在农业动物中敲除Leg1同源基因或通过特定化合物下调Leg1的表达或活性,可以减少脂肪积累。
此外,mLeg1蛋白能够通过EGFR-Akt-Srebp1c信号轴来促进脂肪合成,因此,mLeg1可以用于制备促进脂肪合成的药剂,一方面用于治疗脂肪缺少的疾病,包括化疗引起的脂肪缺少等,另一方面也可以用于增肥作用,包括用于瘦弱人群的增肥、饲养动物的增肥等。
另外,mLeg1蛋白可以通过与EGFR相互作用激活Akt信号。同时,前人研究指出糖尿病发生的一个重要机制是肝脏对胰岛素信号发生抵抗,使得胰岛素不能很好的激活Akt信号,从而无法使肝细胞胞浆中的GLUT2蛋白运输到细胞膜表面,导致血糖无法运输进入肝脏进行转换,最终血糖含量过高。而mLeg1蛋白可以不通过胰岛素激活Akt,这意味着mLeg1蛋白同时是一种潜在的治疗糖尿病的药物。
由于mLeg1(Leg1)蛋白在所有脊椎动物中都保守存在,因此,这些物种中的Leg1蛋白,包含人类中的hLeg1蛋白,将具相似的功能。因此,在这些物种中的Leg1蛋白以及关于Leg1-EGFR-Akt-Srebp1c信号轴的功能与应用都是都在本发明专利的保护范围之内。
综上所述研究结果,本发明的主要结论如下:
(1)mLeg1Δ/Δ小鼠体内脂肪含量减少,并对高脂喂食导致的肥胖症产生抵抗。
(2)mLeg1Δ/Δ小鼠肝脏中由于Akt活性的减弱导致脂肪合成能力的减弱。
(3)mLeg1能够促进人肝癌细胞HepG2和小鼠肝脏的Akt磷酸化。
(4)mLeg1通过与EGFR相互作用,激活EGFR,再经EGFR/PI3K信号轴激活Akt。当抑制EGFR或是PI3K信号中其中一个时,mLeg1则不再能激活Akt。
(5)在小鼠体内,肝脏外源性的mLeg1参与调控肝脏Akt活性水平。唾液腺表达的mLeg1被分泌到唾液中,并经过消化道进入血液循环,并最终到达肝脏发挥作用。体外灌胃进入消化道中的mLeg1蛋白可以在10分钟之内进入血液到达肝脏,并与EGFR结合激活下游Akt信号。
本研究对从未报道过相关功能的mLeg1进行了详实的研究。研究指出mLeg1蛋白是机体内一个脂肪代谢调控因子。它由mLeg1基因编码,并主要在唾液腺中富集表达,转录翻译后的mLeg1蛋白可以被运输到肝脏,通过与肝脏表面的EGFR受体结合,激活PI3K—Akt—Srebp1c信号通路,调控肝脏中脂肪的从头合成途径,从而对整个机体的脂肪代谢进行调控。
本研究指出mLeg1蛋白主要在唾液腺中富集表达,因此mLeg1蛋白可以作为唾液腺形态结构及疾病诊断的一个分子标记。
本研究指出mLeg1主要由唾液腺表达,因此mLeg1的启动子可以用于制备在唾液腺特异性表达某种基因产物的转基因动物,包括用于制备唾液腺特异性表达Cre的工具鼠等。
总之,本发明以现有技术没有研究过的mLeg1基因为基础,以mLeg1基因敲除小鼠为研究对象,利用遗传学,分子生物学,生物化学,细胞生物学的手段对mLeg1基因的功能进行了非常全面的研究,研究结果表明mLeg1蛋白可以通过EGFR调控体内Akt的信号,进而调控机体内的脂肪合成,该结果表明mLeg1基因和蛋白与机体内的脂肪合成密切相关,也进一步表明脊椎动物包括人类的Leg1基因或Leg1蛋白可以作为靶点基因或靶点蛋白用于制备与脂肪合成相关的药物中去,该研究结果为后期人为对人类肥胖症的治疗或预防、癌症病人化疗后的体质恢复或增肥、糖尿病治疗等领域的药物、以及脊椎动物的脂肪积累相关药物领域的研发供了一个全新的药物靶点以及新的治疗手段和思路。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
序列表
<110> 浙江大学
<120> 一种Leg1蛋白及其在肥胖相关疾病中的应用
<160> 8
<170> PatentIn version 3.5
<210> 1
<212> PRT
<213> 智人(Homo sapiens)
<400> 1
Met Ala Phe Leu Pro Ser Trp Val Cys Val Leu Val Gly Ser Phe Ser
1 5 10 15
Ala Ser Leu Ala Gly Thr Ser Asn Leu Ser Glu Thr Glu Pro Pro Leu
20 25 30
Trp Lys Glu Ser Pro Gly Gln Leu Ser Asp Tyr Arg Val Glu Asn Ser
35 40 45
Met Tyr Ile Ile Asn Pro Trp Val Tyr Leu Glu Arg Met Gly Met Tyr
50 55 60
Lys Ile Ile Leu Asn Gln Thr Ala Arg Tyr Phe Ala Lys Phe Ala Pro
65 70 75 80
Asp Asn Glu Gln Asn Ile Leu Trp Gly Leu Pro Leu Gln Tyr Gly Trp
85 90 95
Gln Tyr Arg Thr Gly Arg Leu Ala Asp Pro Thr Arg Arg Thr Asn Cys
100 105 110
Gly Tyr Glu Ser Gly Asp His Met Cys Ile Ser Val Asp Ser Trp Trp
115 120 125
Ala Asp Leu Asn Tyr Phe Leu Ser Ser Leu Pro Phe Leu Ala Ala Val
130 135 140
Asp Ser Gly Val Met Gly Ile Ser Ser Asp Gln Val Arg Leu Leu Pro
145 150 155 160
Pro Pro Lys Asn Glu Arg Lys Phe Cys Tyr Asp Val Ser Ser Cys Arg
165 170 175
Ser Ser Phe Pro Glu Thr Met Asn Lys Trp Asn Thr Phe Tyr Gln Tyr
180 185 190
Leu Gln Ser Pro Phe Ser Lys Phe Asp Asp Leu Leu Lys Tyr Leu Trp
195 200 205
Ala Ala His Thr Ser Thr Leu Ala Asp Asn Ile Lys Ser Phe Glu Asp
210 215 220
Arg Tyr Asp Tyr Tyr Ser Lys Ala Glu Ala His Phe Glu Arg Ser Trp
225 230 235 240
Val Leu Ala Val Asp His Leu Ala Ala Val Leu Phe Pro Thr Thr Leu
245 250 255
Ile Arg Ser Tyr Lys Phe Gln Lys Gly Met Pro Pro Arg Ile Leu Leu
260 265 270
Asn Thr Asp Val Ala Pro Phe Ile Ser Asp Phe Thr Ala Phe Gln Asn
275 280 285
Val Val Leu Val Leu Leu Asn Met Leu Asp Asn Val Asp Lys Ser Ile
290 295 300
Gly Tyr Leu Cys Thr Glu Lys Ser Asn Val Tyr Arg Asp His Ser Glu
305 310 315 320
Ser Ser Ser Arg Ser Tyr Gly Asn Asn Ser
325 330
<210> 2
<211> 337
<212> PRT
<213> 小鼠(Mus musculus)
<400> 2
Met Ala Val Leu Ala Ser Trp Val Trp Val Leu Ala Gly Cys Phe Cys
1 5 10 15
Ala Ala Val Ala Glu Val Ser Asp Ser Ser Asp Pro Tyr Pro Pro Leu
20 25 30
Trp Glu Asp Ser Pro Glu Gln Leu Ser Asp Tyr Met Met Glu Asp Gly
35 40 45
Asn Tyr Ile Ile Asn Pro Trp Val Tyr Thr Asp Arg Met Gly Met Tyr
50 55 60
Arg Ile Leu Leu Glu Glu Thr Ala Met Tyr Phe Ala Lys Tyr Gly Pro
65 70 75 80
Glu Asn Glu Gln Asn Leu Leu Trp Gly Leu Pro Leu Gln Phe Gly Trp
85 90 95
Gln Tyr Gln Ser Gly Arg Leu Ala Asp Pro Thr Gly Met Thr Asp Cys
100 105 110
Gly Asn Glu Leu Asn Glu Ser Leu Cys Val Ser Val Asp Ser Trp Trp
115 120 125
Ala Asp Ile Asn Tyr Tyr Leu Ser Val Ile Pro Phe Leu Ala Ala Val
130 135 140
Asp Ser Gly Ile Thr Gly Ile Ser Pro Asn Gln Ile Thr Ile Leu Pro
145 150 155 160
Pro Pro Lys Asp Gln Met Arg Phe Cys Tyr Asn Val Ser Asp Cys Gln
165 170 175
Ser Ala Val Pro Gly Thr Met Asn Arg Trp Arg Asp Phe Phe Gln Tyr
180 185 190
Met Gln Leu Asn Ser Ser Asp Phe Asp Gly Leu Leu Asn Tyr Leu Trp
195 200 205
Glu Ala His Ala Ser Ser Leu Asp Tyr Pro Thr Ser Ala Phe Gly Asp
210 215 220
Arg Tyr Asn Phe Tyr Ser Glu Lys Glu Ala Asn Phe Glu Glu Asn Trp
225 230 235 240
Ala Ile Ala Val Asn Tyr Leu Ala Ala Ala Arg Leu Pro Thr Thr Gln
245 250 255
Asn Arg Thr Tyr Ser Phe Gln Arg Gly Leu Pro Pro Arg Val Leu Val
260 265 270
Asp Thr Asp Ile Ala Pro Phe Ile Pro Asp Phe Thr Pro Leu Gln Asn
275 280 285
Glu Val Leu Val Ser Leu Lys Leu Leu Gly Asp Thr Asp Arg Asn Ser
290 295 300
Gly Ser Leu Ser Leu Thr Leu Trp Glu Asn Leu Met Ser Thr Lys Leu
305 310 315 320
Ala Arg Thr Leu Phe Leu Lys Ala Phe Glu Glu Phe Leu Ala Thr Ser
325 330 335
Ser
<210> 3
<211> 49
<212> DNA
<213> 智人(Homo sapiens)
<400> 3
atggcttttc ttccttcctg ggtttgtgta ctagttggtt ccttttctgc ttccttagca 60
gggacttcca atctctcaga gacagagccc cctctgtgga aggagagtcc tggtcagctc 120
agtgactaca gggtggagaa cagcatgtac attattaatc cctgggtata ccttgagaga 180
atggggatgt ataaaatcat attgaatcag acagccaggt attttgcaaa atttgcacca 240
gataatgaac agaatatttt atgggggttg cctctgcagt atggctggca atataggaca 300
ggcagattag ctgatccaac ccgaaggaca aactgtggct atgaatctgg agatcatatg 360
tgcatctctg tggacagttg gtgggctgat ttgaattatt ttctgtcttc attacccttt 420
cttgctgcgg ttgattctgg tgtaatgggg atatcatcag accaagtcag gcttttgccc 480
ccacccaaga atgagaggaa gttttgttat gatgtttcta gctgtcgttc atccttccct 540
gagacaatga acaagtggaa caccttttac cagtatttgc agtcaccttt tagtaagttt 600
gatgatctgt tgaagtactt atgggctgca cacacttcaa ccttggcaga taatatcaaa 660
agttttgaag acagatatga ttattattct aaagcagaag cgcattttga gagaagttgg 720
gtactggctg tggatcattt agctgcagtc ctctttccta caaccttgat tagatcatat 780
aagttccaga agggcatgcc accacgaatt cttcttaata ctgatgtagc ccctttcatc 840
agtgacttta ctgcttttca gaatgtagtc ctggttcttc taaatatgct tgacaatgtg 900
gataaatcta taggttatct ttgtacagaa aaatctaatg tatatagaga tcattcggaa 960
tctagctcta gaagttatgg aaataactcc tga 993
<210> 4
<211> 1132
<212> DNA
<213> 小鼠(Mus musculus)
<400> 4
atggctgtcc tggcttcctg ggtctgggta ctggctggct gcttctgtgc agctgtagca 60
gaggtttctg atagctcaga tccatatcct cctttatggg aagacagccc tgagcagttg 120
agtgactaca tgatggagga tgggaactac ataattaatc cttgggtata cactgacaga 180
atggggatgt acagaatctt actggaagag acagctatgt attttgcaaa atatggtcca 240
gaaaatgaac aaaatcttct ttggggattg cctctgcagt ttggctggca gtatcaatca 300
ggtagattag ctgatcccac tggaatgaca gactgtggca atgaacttaa tgagagtctg 360
tgtgtctctg tggacagttg gtgggcagat ataaattatt atctgagtgt gatacctttc 420
cttgctgctg ttgattctgg aataacagga atatcaccaa accaaatcac gatcctgcct 480
ccacccaagg atcagatgag gttttgttat aatgtttctg actgtcaatc tgccgtccct 540
ggaacaatga acagatggag agactttttt cagtacatgc agttgaattc cagtgacttt 600
gatggccttc ttaactactt atgggaagcc catgcctcat ccttggacta tcccaccagt 660
gcctttggag acagatataa tttctattct gaaaaagaag caaattttga ggaaaactgg 720
gctattgctg tgaactattt agcggcagcc cgtcttccta caacccaaaa tagaacatac 780
agctttcaga ggggcctgcc cccacgagtc cttgttgata ctgacatagc cccttttatt 840
cctgacttca ctcctcttca gaacgaagtc ctggtatcac tcaaacttct tggtgatact 900
gacagaaatt caggatcatt atctttgact ctatgggaaa atctcatgag tacaaaactt 960
gcaagaacat tatttctaaa agcctttgaa gagttcctgg caacatcttc ttaa 1014
<210> 5
<211> 364
<212> PRT
<213> 斑马鱼(Danio rerio)
<400> 5
Met Ser Glu Met Gly Phe Leu Arg Ser Val Ala Ala Val Leu Leu Leu
1 5 10 15
Ala Val Phe Ser His Ala Ala Val Val Thr Glu Asn Gly Leu Pro Ile
20 25 30
Gln Trp Gly Lys Ala Pro Ser Asp Leu Ser His Leu Pro Ile Ser Asp
35 40 45
Thr Gly Val Gln Val Asn Pro Trp Asp Tyr Ser Gln Arg Met Thr Met
50 55 60
Tyr Lys Met Leu Ile Asn Ala Thr Asn Ala Tyr Met Ser Ser Met Gly
65 70 75 80
Pro Gly Glu Gln Glu Asn Pro Leu Trp Ser Leu Pro Leu Gln Leu Gly
85 90 95
Trp Lys Leu Lys Ser Gly Arg Leu Ala Asp Pro Thr Leu Asp Ser Ser
100 105 110
Ser Thr Cys Gly Ser Glu Ala Ser Asp Pro Val Cys Ile Ser Pro Leu
115 120 125
Ser Trp Phe Ala Cys Val Asn Tyr Tyr Leu Ser Val Leu Pro Phe Leu
130 135 140
Ala Ala Val Glu Thr Gly Val Val Ser Ser Gly Gly His Gln Val Leu
145 150 155 160
Ile Gln Val Pro Ala Glu Val Ala Gln Asp Tyr Cys Ser Ser Tyr Ser
165 170 175
Asp Cys Ser Thr Lys His Pro Asn Ala Met Ala Lys Trp His Leu Phe
180 185 190
Phe Gln Ser Leu Arg Gln Val Ser Gln Ser Glu Asp Ser Asp Phe Asn
195 200 205
Lys Lys Asp Ser Ile Leu Gly Leu Met Trp Ala Ala Glu Glu Glu Ser
210 215 220
Leu Gln Thr Ala Ser Gly Ala Cys Thr Glu Arg Gln Lys Leu Tyr Ser
225 230 235 240
Ser Pro Glu Val Ser Phe Gln Gln Ser Trp Leu Asn Ser Ala Ala Phe
245 250 255
Val Ser Ala Ala His Phe His Ala Asn Ile Glu Arg Ser Glu Lys Phe
260 265 270
Met Ala Pro Leu Pro Ser Arg Val Leu Gln Glu Ala Asp Ser Pro Pro
275 280 285
Asn Ile Ala Asp Leu Ser Thr Glu Glu Asn His Thr Leu Tyr Ile Phe
290 295 300
Gly Trp Met Asn Ser Val Asn Gln Leu Leu Gly Gly Ser Leu Val Asn
305 310 315 320
Leu Trp Arg Lys Ala Met Cys Ser Ala Gln Ala Arg Glu Lys Gly Gln
325 330 335
Ala Leu Leu His Asp Leu Ile Leu Asp Pro Lys Phe Pro Gly Ser Ser
340 345 350
Leu Trp Ser Ile Leu Ser Glu Met Ser Thr Ser Cys
355 360
<210> 6
<211> 364
<212> PRT
<213> 斑马鱼(Danio rerio)
<400> 6
Met Ser Glu Met Gly Phe Leu Arg Ser Val Ala Ala Val Leu Leu Leu
1 5 10 15
Ala Val Phe Ser His Ala Ala Val Val Thr Glu Asn Gly Leu Pro Ile
20 25 30
Gln Trp Arg Lys Ala Pro Ser Asp Leu Ser His Leu Pro Ile Ser Asn
35 40 45
Thr Gly Val Gln Val Asn Pro Trp Val Tyr Ser Gln Arg Met Thr Met
50 55 60
Leu Lys Met Val Ile Asn Ala Thr Asn Ala Tyr Met Ser Ser Met Gly
65 70 75 80
Pro Gly Glu Gln Glu Asn Pro Leu Trp Ser Leu Pro Leu Gln Leu Gly
85 90 95
Trp Lys Leu Lys Ser Gly Arg Leu Ala Asp Pro Thr Pro Asp Ser Ser
100 105 110
Ser Thr Cys Gly Ser Glu Ala Ser Asp Pro Val Cys Ile Ser Pro Leu
115 120 125
Ser Phe Phe Gly Cys Val Asn Tyr Tyr Leu Ser Val Leu Pro Phe Leu
130 135 140
Ala Ala Val Glu Thr Gly Val Val Ser Ser Gly Gly His Gln Met Leu
145 150 155 160
Ile Gln Val Pro Ala Glu Val Ala Gln Asp Tyr Cys Ser Ser Tyr Ser
165 170 175
Asp Cys Ser Thr Lys His Pro Asn Thr Met Ala Lys Trp His Leu Phe
180 185 190
Phe Gln Ser Leu Arg Gln Val Ser Gln Ser Lys Glu Ser Asp Phe Asn
195 200 205
Lys Lys Asp Ser Ile Leu Gly Leu Met Trp Ala Ala Glu Glu Glu Ser
210 215 220
Ile Gln Thr Ala Ser Gly Ala Cys Thr Glu Arg Gln Lys Leu Tyr Ser
225 230 235 240
Ser Pro Glu Val Ser Phe Gln Gln Ser Ser Val Asn Leu Gly Ala Phe
245 250 255
Ile Ser Ala Ala His Tyr His Ala Ser Ile Glu Arg Ser Gly Lys Phe
260 265 270
Met Ser His Leu Pro Ser Arg Val Leu Gln Glu Ala Asp Ser Pro Pro
275 280 285
Asn Ile Ala Asp Leu Ser Thr Glu Glu Asn His Ala Leu Tyr Met Leu
290 295 300
Ser Trp Met Asn Ser Ile Asn Gln Leu Leu Gly Gly Ser Leu Val Asp
305 310 315 320
Leu Trp Arg Lys Ala Met Cys Ser Ala Gln Ala Arg Glu Lys Gly Gln
325 330 335
Ala Phe Leu Asp Asp Leu Ile Leu Asp Pro Lys Phe Pro Gly Ser Ser
340 345 350
Leu Trp Ser Ile Ile Cys Val Met Ser Thr Ser Cys
355 360
<210> 7
<211> 355
<212> PRT
<213> 绵羊(Ovis aries)
<400> 7
Met Trp Ser Ser Leu Val Ile Pro Thr Phe Leu Phe Leu Ser Phe Ser
1 5 10 15
Ser Val Gly Leu Ala Pro Asp Pro Gly Ser Thr Thr His Glu Asn Asp
20 25 30
Asn Tyr Pro Pro Phe Trp Gly Gln Thr Asp Gly Asp Ile Ala Glu Phe
35 40 45
Pro Val Gln Asn Asn Lys Ile Ile Val Asp Pro Trp Lys Tyr Met Asp
50 55 60
Arg Leu Arg Ile Phe Lys Ile Leu Ile Thr Glu Ser Asn Lys Tyr Phe
65 70 75 80
Ala Ser Phe Gly Lys Asn Asp Thr Gly Asn Val Phe Trp Ala Leu Thr
85 90 95
Leu Leu Tyr Gly Ser Leu Phe Lys Ser Asp Arg Phe Ser Glu Pro Pro
100 105 110
Asn Ser Ser Arg Cys Ala Tyr Glu Ser Gly Val Ser Ser Cys Ile Ser
115 120 125
Ile Asn Ser Gly Trp Gly Gly Ile Ser Tyr Tyr Val Val Ile Met Tyr
130 135 140
Phe Leu Ala Ala Ile Glu Ser Glu Phe Leu Gly Asn Leu Pro Tyr Glu
145 150 155 160
Val Glu Leu Leu Ser Arg Lys Glu Tyr Arg Ser Asn Phe Cys Tyr Ser
165 170 175
Val Glu Glu Cys Arg Ala Ala Tyr Pro Gln Ala Met Asp Ile His Asn
180 185 190
Arg Phe Tyr Lys Tyr Leu Gln Ser Arg Lys Ile Val Ser Thr Thr Ser
195 200 205
Gly Ile Pro Gln Tyr Asn Thr Asp Glu Asp Thr Ala Ile Phe Lys Met
210 215 220
Trp Ala Ala His Gln Ala Ala Leu Asp Val Ala Lys Pro Lys Phe Arg
225 230 235 240
Asp Val Ser Phe Tyr Ser Ser Glu Thr Glu Arg Asp Phe Thr Met Asp
245 250 255
Phe Leu Leu Ala Ala Glu Phe Ile Glu Ala Val Leu Tyr Arg Pro Tyr
260 265 270
Phe Glu Ser Ser Ala Glu Phe Leu Ala Gly Phe Pro His Arg Leu Leu
275 280 285
Thr Asp Gln Asp Arg Asn Val Leu Thr Ser Asn Phe Ser Arg Arg Glu
290 295 300
Lys Ala Leu Ile Thr Val Val Lys Leu Ile Thr Lys Ile Asn Lys Ser
305 310 315 320
Thr Gly Gly Leu Leu Leu Thr Ile Trp Lys Lys Leu Met Thr Ser Lys
325 330 335
Phe Ala Arg Ala Met Gly Arg Phe Phe Ile Lys Arg Leu Leu Leu Ile
340 345 350
Pro Val Glu
355
<210> 8
<211> 317
<212> PRT
<213> 牛(Bos taurus)
<400> 8
Pro Pro Phe Trp Asp Gln Ile Asp Gly Asp Ile Ala Glu Phe Pro Val
1 5 10 15
Gln Asn Asn Lys Ile Ile Val Asp Pro Trp Lys Tyr Met Asp Arg Leu
20 25 30
Arg Ile Phe Lys Ile Leu Ile Thr Glu Ser Asn Lys Tyr Phe Ala Ser
35 40 45
Phe Gly Lys Asn Asn Thr Gly Asn Val Phe Trp Ala Leu Thr Leu Leu
50 55 60
Tyr Gly Arg Leu Phe Lys Thr Asp Arg Phe Ala Glu Pro Pro Asn Ser
65 70 75 80
Ser Arg Cys Ala Tyr Glu Ser Gly Ile Ser Ser Cys Ile Ser Ile Asn
85 90 95
Ser Gly Trp Gly Gly Ile Ser Tyr Tyr Val Val Met Met Tyr Phe Leu
100 105 110
Ala Ala Ile Glu Ser Glu Phe Leu Gly Ser Leu Pro Tyr Glu Val Glu
115 120 125
Leu Leu Ser Arg Glu Glu Tyr Arg Ser Asn Phe Cys Tyr Ser Ile Glu
130 135 140
Glu Cys Arg Ala Ala His Pro Gln Ile Met Asp Ile Ala Asn Arg Phe
145 150 155 160
Tyr Lys Gln Thr Lys Lys Ile Val Ser Thr Thr Ser Gly Ile Pro Gln
165 170 175
Tyr Asp Thr Asp Glu Asp Thr Ala Ile Phe Lys Met Trp Ala Ala His
180 185 190
Gln Ala Ala Ile Asp Val Ala Lys Pro Met Phe Ser Asp Val Ser Phe
195 200 205
Tyr Ser Ser Glu Thr Glu Arg Asp Phe Thr Met Asp Phe Leu Leu Ala
210 215 220
Ala Glu Phe Phe Glu Ala Ala Leu Tyr Arg Pro Tyr Phe Glu Ser Ser
225 230 235 240
Ala Glu Phe Leu Val Gly Phe Pro His Arg Leu Leu Thr Asp Gln Asp
245 250 255
Arg Asn Val Leu Met Ser Asn Phe Ser Arg Arg Glu Lys Ala Leu Ile
260 265 270
Thr Val Ala Lys Leu Thr Thr Lys Ile Asn Lys Ser Thr Gly Gly Leu
275 280 285
Leu Leu Thr Ile Trp Lys Lys Leu Met Thr Ser Lys Phe Ala Arg Ala
290 295 300
Thr Gly Arg Phe Phe Ile Lys Arg Leu Leu Leu Ile Pro
305 310 315
- 还没有人留言评论。精彩留言会获得点赞!