一种酪蛋白磷酸肽的标签肽及其应用的制作方法
本发明属于食品检测技术领域,特别是涉及一种酪蛋白磷酸肽的标签肽及其应用。
背景技术:
酪蛋白磷酸肽(Casein Phosphopeptides)(以下简称:CPPs)是经单一酶或复合酶系水解牛酪蛋白后产物分布于αs1、αs2、β以及κ酪蛋白中的不同区域。它可以用于各种营养、保健食品中,能有效提高人体对钙、铁、锌等二价矿物质的摄入量以及吸收和利用率。市场上出现了大量添加CPPs的婴幼儿配方奶粉,由于不同加工工艺等原因造成产品质量良莠不齐,但又没有建立准确有效的评价检测方法。
目前普遍采用乙醇沉淀法、电泳法、高效液相色谱法、高效液相色谱-质谱联用法测定酪蛋白磷酸肽。
授权公告号为CN103792298B的中国发明专利公开了一种乳制品中酪蛋白磷酸肽含量的检测方法,该方法主要包括以下步骤:采用BaCl2-乙醇法对酪蛋白磷酸肽原料进行纯化;采用高效液相色谱法对纯化后的酪蛋白磷酸肽原料进行标准曲线的绘制;采用固相萃取对乳制品样品进行纯化后,用高效液相色谱法对其进行检测,得到检测结果。乙醇沉淀法既可分离磷酸肽,也适用于CPPs原料的含量测定,但是,此方法灵敏度低且特异性差,不适用于添加CPPs的食品及保健品的测定。
申请号为201010134407.5的中国发明专利公开了一种检测牛乳制品中酪蛋白磷酸肽含量的方法,使用了高压毛细管电泳分析仪作为检测设备。上述方法包括制备酪蛋白磷酸肽标准溶液以生成酪蛋白磷酸肽含量与高压毛细管电泳分析仪获得的分析图谱积分值之间的标准曲线、对待测牛乳制品进行检测、根据待测牛乳制品的检测结果利用标准曲线获得待测牛乳制品的酪蛋白磷酸肽含量。电泳法,重现性且易受样品中蛋白质和其它非目标多肽的干扰,不适合检测复杂食品基质中CPPs的含量。
授权公告号为CN103760246B的中国发明专利公开了一种牛奶中酪蛋白磷酸肽液相检测方法,步骤包括:将待检牛奶加入酪蛋白磷酸肽制成10~100ppm的酪蛋白磷酸肽分散溶液,脱蛋白后过阳离子交换树脂柱脱钙,将脱钙后所得洗脱液过阳离子交换树脂柱,除杂和富集,将收集液在温度60~70℃,转速为50~60rpm下真空旋转蒸发,过膜后作为液相检测样品;然后进行液相检测,按外标法以峰面积法计算牛奶中添加酪蛋白磷酸肽的浓度。高效液相色谱法分离效能高但是灵敏度较低。乳制品是富含蛋白质和多肽的复杂基质样品,且酪蛋白磷酸肽是一系列分子量分布不等的多肽混合物,在紫外或荧光检测器下难以找到不受干扰的特征峰,无法实现准确有效的定量检测分析。
技术实现要素:
针对现有技术的不足,本发明提供了一种用于检测奶制品中酪蛋白磷酸肽的标签肽。使用该标签肽以及相应的经同位素标记的内标肽,利用高效液相色谱-质谱联用技术可准确测定样品中的酪蛋白磷酸肽的含量。
一种酪蛋白磷酸肽的标签肽,氨基酸序列为LSQSKVLPVPQK。
一种酪蛋白磷酸肽的内标肽,氨基酸序列为LSQSKVL*PV*PQK,其中L*和V*为碳氮全同位素标记的氨基酸残基。使用时,可以通过向样品中添加内标肽,可以达到对检测结果进行校正的目的。
本发明又提供了所述的标签肽在奶制品中酪蛋白磷酸肽含量检测中的应用。
优选的,所述奶制品为婴幼儿配方奶粉。
本发明还提供了一种检测奶制品中酪蛋白磷酸肽含量的方法,包括以下步骤:
(1)如果待测样品为固体,先用水溶解,如果待测样品为液体则直接使用,然后加入内标肽;
(2)使用高效液相色谱-质谱联用对样品进行检测;
(3)计算待测样品中,所述的标签肽与对应的内标肽的峰面积比;
(4)将待测样品中所述的标签肽的峰面积比数据代入标准曲线中,计算出所述标签肽的浓度,然后根据相应的转换公式计算出待测样品中酪蛋白磷酸肽的含量。
待测样品通过高效液相色谱能够尽量分离纯化为一个单一组分的峰,然后将单一的峰分别通过质谱分析确定成分,再通过质谱的结果确定高效液相色谱结果中所述的标签肽以及对应的内标肽的峰,而峰面积的大小即为各自成分的量。如果不加入内标肽,则通过配制已知浓度的标签肽标准样品,检测后获得相应峰面积结果,通过浓度与峰面积之间的关系获得标准曲线,该标准曲线为线性。但是由于样品在处理过程中存在样品损失、高效液相色谱回收率存在损失和波动等问题存在,使得没有添加所述内标肽时,所得结果不够准确,而且检测结果波动较大,使得检测结果不够可靠和准确。
而通过加入已知浓度和量的内标肽,可以通过计算标签肽与对应的内标肽的峰面积比,这样就尽量避免了样品在处理过程中存在样品损失、高效液相色谱回收率存在损失和波动等问题,因为内标肽也是按相同比例在损失,所以可以通过内标肽来校准。
优选的,所述的内标肽的氨基酸序列为LSQSKVL*PV*PQK,其中L*和V*为碳氮全同位素标记的氨基酸残基。所述内标肽的使用量可以在较宽范围内选择,只要结果能够检测到。但是,最优的情况是所添加的内标特征肽的量与所检测样品中相应的特征肽的量接近,这样可以使校准结果最准确。但同时也得考虑到成本等问题。所以将内标肽的使用浓度控制在几十ng/mL为宜,常用可以选择50ng/mL。
优选的,所述待测样品经过前处理,所述前处理方法为:使用pH为4.6的乙酸铵溶液进行蛋白沉淀。
优选的,所述标准曲线由以下方法获得:
将所述的标签肽稀释不同浓度梯度作为标准品,然后加入内标肽,再经高效液相色谱-质谱联用检测,由标签肽的含量与标签肽、内标肽检测峰面积比值获得标准曲线,其中,样品检测与标准曲线制备时高效液相色谱和质谱的检测条件相同。
优选的,所述高效液相色谱使用BEH300C18色谱柱,柱温为35℃,流动相为0.1%甲酸乙腈和0.1%甲酸水溶液,流速为0.3mL/min。
优选的,所述质谱使用的毛细管电压为3.5kV,脱溶剂温度375℃,脱溶剂气流量11.5L/min,所述的标签肽的母离子为442.1m/z,子离子372.4m/z对应的碰撞能量为15eV,子离子568.5m/z对应的碰撞能量为15eV;内标物特征母离子为446.3m/z,子离子372.2m/z,对应的碰撞能量为15eV,子离子574.5m/z,对应的碰撞能量为10eV。
本发明通过选择酪蛋白磷酸肽中的一种特征肽作为检测目标来对奶制品中酪蛋白磷酸肽进行定量检测,该特征肽为经过筛选最终确定的,为酪蛋白磷酸肽中最具代表性的一种多肽,在酪蛋白磷酸肽原料中含量相对稳定,再加入经同位素标记的内标肽来对结果进行校正,该方法具有较好的线性、回收率高、准确性好。
附图说明
图1为实施例1中各肽段多反应监测(MRM)色谱图,其中A为AVPITPT,B为IQKEDVPSERY,C为FYQKFPQY,D为LNYYQQKP,E为IVPNs(p-s)AEERLHSM,F为VLSRYPSYG,G为LSQSKVLPVPQK;
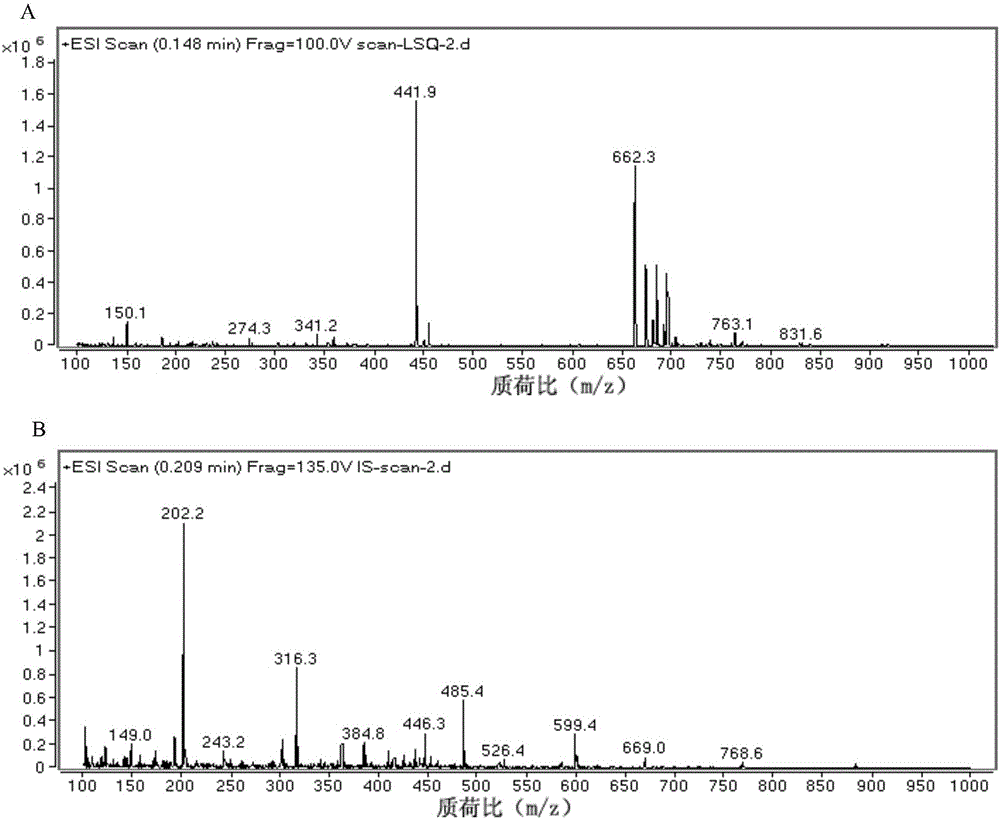
图2为本发明标签肽与对应的同位素标记的内标肽在相同条件下的质谱扫描图,其中A为标签肽,B为内标肽;
图3为本发明标签肽与对应的同位素标记的内标肽在相同条件下的多反应监测(MRM)色谱图,其中A为标签肽,B为内标肽;
图4为本发明内标肽的多反应监测(MRM)色谱图,其中A为标签肽通道,B为内标肽通道;
图5为空白试样在内标肽离子通道的多反应监测(MRM)色谱图;
图6为使用不同乙腈浓度作为溶剂溶解本发明标签肽的效果对比图;
图7为实施例4中特异性检测结果,其中A~E分别为乳清蛋白、全脂乳粉、大豆蛋白、大米蛋白和标准品;
图8为实施例5中标准曲线图。
具体实施方式
实施例1
CPPs标签肽的寻找和确定。
由于CPPs是一个多肽的混合物。先将多个批次的CPPs原料溶解,稀释至100μg/mL,进行反相色谱分离和质谱全扫描。根据Proteome Discoverer 2.1软件以及蛋白质数据库,尽可能找出所有批次都含有并且相对较稳定的特征肽段(表1),共找到以下7条肽段(表1)。
表1筛选出的7条酪蛋白磷酸肽特征肽段的基本信息
注:平均亲水性0~2,多肽在水中亲水性很好;平均亲水性=0,多肽在水中的溶解性一般;平均亲水性-2~0,多肽在水中的溶解性较差。
在保证方法的稳定性与准确性的前提下,为便于日后方法推广,在已查找到的特征肽段中选择1条既具特异性,又有良好的稳定性和较高灵敏度的多肽作为CPPs最终的标签肽。
使用高效液相色谱-质谱联用技术进行检测,色谱与质谱条件如下:
高效液相色谱分离条件:色谱柱:BEH300C18色谱柱;柱温为40℃,流动相为0.1%甲酸乙腈和0.1%甲酸水溶液,梯度洗脱,流速为0.3mL/min;
质谱条件:CPPs标签肽的母离子为442.1m/z,子离子372.4m/z对应的碰撞能量为15eV,子离子568.5m/z对应的碰撞能量为15eV;内标物特征母离子为446.3m/z,子离子372.2m/z,对应的碰撞能量为15eV,子离子574.5m/z对应的碰撞能量为10eV;毛细管电压3.5kV,脱溶剂温度:375℃,脱溶剂气流量:11.5L/min。
(1)灵敏度
在连续3天中,使用高效液相色谱-质谱联用技术进样检测分析,每个样品平行检测3次,找出响应值最高的肽段,结果如图1所示,对于CPPs原料肽段1(LSQSKVLPVPQK)具有较高灵敏度,信噪比较大且其色谱保留也相对较强,有助于与杂质的分离。
(2)精密度及回收率
在连续3天中,使用高效液相色谱-质谱联用技术进样检测分析,每个样品平行检测3次,找出稳定性高的肽段,结果如表2所示,肽段LSQSKVLPVPQK的日内精密度和日间精密度均小于3%,且其氨基酸组成个数为12个,对于序列越长的,其特异性越强;酪蛋白中β-casein含量较高,来源于该蛋白的肽段LSQSKVLPVPQK灵敏度较高。
表2各肽段回收率和精密度
综上,本发明选择肽段1(LSQSKVLPVPQK)作为CPPs原料的特征肽段。
实施例2
同位素内标的确定。
质谱定量检测最大的问题之一为基质干扰,使用内标以消除基质干扰对结果带来的影响是较为普遍亦是较为理想的手段,尤其同位素内标为最佳选择。鉴于本发明方法检测的对象为多肽,在电喷雾离子(ESI+)模式下产生的为多电荷离子,另外,碳(1.11%13C)、氮(0.37%15N)元素的天然同位素丰度较高,在灵敏的质谱检测器中响应较显著,如果同位素标记个数过少则会存在干扰,因此选择两个氨基酸L和S进行同位素标记,同位素标记肽段为(LSQSKVL*PV*PQK)。L*和V*为碳、氮全同位素标记。
将同一浓度的特异肽与内标肽混合后进样,内标肽与特异肽之间不仅具有相同的色谱行为,而且还具有相同的质谱行为(图2、图3);
为考察CPPs标签肽(LSQSKVLPVPQK)以及空白试样是否对同位素标记肽(内标肽)存在干扰,将同位素肽稀释后进质谱分析,发现只在内标肽通道出峰,对CPPs标签肽不存在干扰(图4)。空白样品经处理后进样分析,空白试样在内标肽通道不出峰,对同位素内标肽同样不存在干扰(图5)。
本实施例色谱和质谱的检测条件及参数同实施例1中。
实施例3
(1)样品前处理方法的优化。
本发明通过对样品的提取(溶解),以及纯化(沉淀蛋白)两方面进行优化。
a、试样的溶解
由表1可知,LSQSKVLPVPQK多肽亲水性一般,因此需要先选择合适的溶液溶解所选肽段。实验设计比较了样品经过不同浓度的乙腈溶液溶解处理后,CPPs标签肽的峰面积。具体操作如下:
准确称取5.0g样品21份,分别用纯水、10%、15%、20%、25%、30%、40%的乙腈溶液溶解样品,每个浓度平行3个样品。充分溶解后定容至100mL。分别取80μL,用10mmoL乙酸铵溶液(pH=4.6)定容至1mL,分装于离心管中,6000r/min(4℃),离心5min。取上清液用0.22μm滤膜过滤,以备进样,然后使用高效液相色谱-质谱联用方法进行检测,结果如图6所示,可以看到,所选肽段随着乙腈比例的增加,溶解能力逐渐降低,因此选择超纯水作为溶剂。
b、蛋白质的沉淀
乳制品中通常具有较高的蛋白含量,而其中酪蛋白又占多数,对目标物的提取和准确测定会产生一定影响,因此,需要对样品进行适当的前处理优化以去除大部分的蛋白干扰,蛋白质的沉淀可以选用乙腈沉淀蛋白、调节pH至等电点沉淀蛋白。乙腈沉淀蛋白法,可以将样品中的所有蛋白沉淀,不具有专一性;又因为所选肽段在纯乙腈中溶解度很差,所以本实验不采用此方法。通过查找文献发现,酪蛋白的等电点为pH=4.6。因此本实验采用调节pH至4.6进行蛋白质沉淀。实验过程如下。从表3结果来看,方法一的回收率更佳,且稳定性好,而且实验操作时更方便,分析效率高。因此选择方法一作为样品的前处理方法。
方法一:称取5.0g奶粉样品,用超纯水溶解,定容至100mL,取80μL,加入50μL同位素内标肽,用10mmoL的乙酸铵缓冲液定容至1mL。
方法二:称取5.0g奶粉样品,用超纯水溶解,定容至100mL,取800μL,加入500μL同位素内标肽,加入5mL纯水,用10%甲酸溶液调节pH至4.6,用纯水定容至10mL。
分装于离心管中,6000r/min(4℃),离心5min。取上清液用0.22μm滤膜过滤,以备进样,然后使用高效液相色谱-质谱联用方法进行检测,结果如表3所示,方法一的回收率较接近100%,且标准差(RSD)值较小,优选方法一作为本发明样品前处理的方法。
表3两种前处理方法的比较
(2)色谱与质谱条件
高效液相色谱分离条件:色谱柱:BEH300C18色谱柱;柱温为40℃,流动相为0.1%甲酸乙腈和0.1%甲酸水溶液,梯度洗脱,流速为0.3mL/min;
质谱条件:CPPs标签肽的母离子为442.1m/z,子离子372.4m/z对应的碰撞能量为15eV,子离子568.5m/z对应的碰撞能量为15eV;内标物特征母离子为446.3m/z,子离子372.2m/z,对应的碰撞能量为15eV,子离子574.5m/z对应的碰撞能量为10eV;毛细管电压3.5kV,脱溶剂温度:375℃,脱溶剂气流量:11.5L/min。
(3)结果计算
a、由公式1计算原料中标签肽的含量Cx1
公式1:
其中
Cx1——原料中酪蛋白磷酸肽标签肽的含量,单位为毫克每100克(mg/100g);
na1——根据标准曲线计算得到的原料中酪蛋白磷酸肽标签肽的浓度,单位为纳克每毫升(ng/mL);
v1——原料的定容体积,单位为毫升(mL);
m1——原料的质量,单位为克(g);
F1——待测原料溶液的稀释倍数;
10-4——将单位ng/g换算为mg/100g的换算系数。
b、由公式2计算待测样品中酪蛋白磷酸肽的含量Cx2;
公式2:
其中
Cx2——试样中酪蛋白磷酸肽的含量,单位为毫克每100克(mg/100g);
na2——根据标准曲线计算得到的试样中酪蛋白磷酸肽标签肽的浓度,单位为纳克每毫升(ng/mL);
v2——试样的定容体积,单位为毫升(mL);
m2——试样质量,单位为克(g);
f——酪蛋白磷酸肽与酪蛋白磷酸肽标签肽之间的关系,本发明方法中f=8.0×10-3;(经检测100g酪蛋白磷酸肽原料中平均含本发明标签肽815.3mg,则f=8.0×10-3,815.3mg/100g≈8.0×10-3)
F2——待测试样溶液的稀释倍数;
10-4——将单位ng/g换算为mg/100g的换算系数。
实施例4
特异性实验:为证明所选择的肽段LSQSKVLPVPQK是CPPs所特有的,本实验首先在Uniprot蛋白数据库进行序列分析,发现所选的肽段只在动物体酪蛋白中存在,特异性强。其次选择了乳清蛋白、全脂粉、大豆蛋白、大米蛋白等不同类型不同基质的蛋白进行了特异性验证实验,既将上述几种样品按实施例3优化的前处理方法进行处理,按优化好的色谱及质谱条件进行分析,色谱图如图7所示,由图可知,上述蛋白均不在所选肽段离子通道中出峰,更不会产生干扰,由此说明所选肽段为CPPs的特异肽段。
实施例5
(1)标准曲线的建立
准确吸取CPPs标签肽标准品(1μg/mL)、10μL、25μL、50μL、100μL、200μL,并加50μL内标肽(1μg/mL),再分别加入0.1%的甲酸溶液940μL、925μL、900μL、850μL、750μL,涡旋混匀。所得溶液按实施例2所述方法进行检测分析,每个样品平行检测6次,所得结果制作标准曲线如图8所示,标准曲线公式:y=0.026523x+0.132701,R2=0.99,其中x为CPPs标签肽的浓度(ng/mL),y为样品峰面积与内标肽峰面积的比值。
(2)待测样品检测
称取原料(共11个待测样品)各约0.1g于试管中,用超纯水将试样充分溶解(必要时置于涡旋混合器上充分涡旋或者超声)后定容至100mL。定容后取125μL,加875μL超纯水,涡旋混匀。取80μL于2mL试管中,加入50μL内标(1μg/mL)加入870μL乙酸铵溶液(pH=4.6),摇匀后,将溶液倒入离心管中,4℃离心5min,6000r/min,取上清液过0.22μm滤膜。所得溶液按实施例3所述方法进行检测分析。用内标法(标准曲线公式:y=0.026523x+0.132701)根据样品峰面积与同位素内标峰面积的比值(y)计算11批原料中CPPs标签肽的浓度(x)如表4。根据实施例3中给出的公式1计算各原料CPPs标签肽的含量分别为803.8(Cx1=80.38×1×10000×10-4/0.1001=803.8)、709.8、649.8、826.3、824.9、888.2、731.6、1009.8、807.2、731.4、985.4,单位为mg/100g。
表4CPPs原料检测数据
实施例6
配方奶粉的检测:
称取固体试样约5g(精确至0.01g,内含酪蛋白磷酸肽约5mg)于50mL试管中,用超纯水将试样充分溶解(必要时置于涡旋混合器上充分涡旋或者超声)后用超纯水定容至100mL。定容后取80μL于2mL离心管中,加入50μL内标物(1μg/mL),加入870μL乙酸铵溶液(pH=4.6),摇匀后,将溶液倒入离心管中,4℃离心5min,6000r/min,取上清液过0.22μm滤膜。所得溶液作为进样液进行高效液相色谱-质谱联用分析。
用内标法计算得na2=20.73ng/mL,带入实施例3中的公式2,Cx2=20.73×100×12.5×10-4/(5.0×8×10-3)=64.8,样品中CPPs原料的含量为64.8mg/100g。
SEQUENCE LISTING
<110> 杭州帕匹德科技有限公司
<120> 一种酪蛋白磷酸肽的标签肽及其应用
<130>
<160> 7
<170> PatentIn version 3.3
<210> 1
<211> 12
<212> PRT
<213> 人工序列
<400> 1
Leu Ser Gln Ser Lys Val Leu Pro Val Pro Gln Lys
1 5 10
<210> 2
<211> 9
<212> PRT
<213> 人工序列
<400> 2
Val Leu Ser Arg Tyr Pro Ser Tyr Gly
1 5
<210> 3
<211> 8
<212> PRT
<213> 人工序列
<400> 3
Leu Asn Tyr Tyr Gln Gln Lys Pro
1 5
<210> 4
<211> 7
<212> PRT
<213> 人工序列
<400> 4
Ala Val Pro Ile Thr Pro Thr
1 5
<210> 5
<211> 8
<212> PRT
<213> 人工序列
<400> 5
Phe Tyr Gln Lys Phe Pro Gln Tyr
1 5
<210> 6
<211> 13
<212> PRT
<213> 人工序列
<400> 6
Ile Val Pro Asn Ser Ala Glu Glu Arg Leu His Ser Met
1 5 10
<210> 7
<211> 11
<212> PRT
<213> 人工序列
<400> 7
Ile Gln Lys Glu Asp Val Pro Ser Glu Arg Tyr
1 5 10
- 还没有人留言评论。精彩留言会获得点赞!