树蛙防御肽cathelicidin‑PP及其基因和应用的制作方法
本发明涉及一种树蛙(Polypedates puerensis)防御肽cathelidin-PP及其基因和应用,属于生物医学领域。
背景技术:
:
近年来的研究表明,抗菌肽是所有动物、植物和微生物防御系统中的一个重要组成部分。它们是机体为抵御病原微生物侵袭而产生的一类小分子活性多肽,具有分子量小、稳定性好、杀菌迅速和不易产生耐药性等特点。这些特性使得抗菌肽具有非常广阔的运用前景,有望替代目前临床上易于产生耐药性的传统抗生素药物。抗菌肽不易产生耐药性的原因是,其杀菌机理与传统抗生素不同。它们主要是作用于细菌的细胞膜,破坏其稳定性,进而细胞膜渗透性发生改变,使得内容物外泄导致细胞死亡。不同物种来源或同一物种中抗菌肽的结构形式和生物活性差别较大。国内外研究人员一直致力于从不同物种中发掘结构新颖的抗菌肽,直接利用或者以其为模板进行分子改造。目前,已有抗菌肽用于海产品保鲜和动物饲料添加剂中。结合生态环境从各种自然资源中发掘具有潜在药用价值的抗菌肽是目前多肽新药研究的一个热点。
两栖动物是抗菌肽资源发掘中最重要的一类资源,其皮肤裸露,为抵御环境中各种微生物的侵袭,它们能够分泌多种分子结构新颖、功能复杂多样的的抗菌肽。这些活性多肽广泛参与机体的各种生理活动,具有各种药理活性,如抗微生物、抗肿瘤、抗氧化、免疫调节、创伤修复、镇痛等作用。树蛙与其它的两栖动物明显不同的地方就是,它们的大部分时间都是在树上度过,而其它的两栖动物大部分时间都在水里或陆地上。这种特异的树栖生活使得它们面临的天敌以及外界微生物都与其他的两栖动物有所差异,经过适应性进化,必然拥有一套具有自身优势的先天免疫防御系统。普洱泛树蛙Polypedates puerensis主要分布于云南省普洱市周边地区,是我国特色资源动物之一,其皮肤分泌物中cathelicidin家族的抗菌肽尚无报道。
技术实现要素:
:
本发明的目的在于提供一种新的具有广谱抗微生物(包括革兰氏阴性菌和真菌)的树蛙防御肽及其基因和应用。
本发明的防御肽cathelicidin-PP是中国两栖类树蛙防御肽基因编码的一种环状多肽,分子量3366.08道尔顿,等电点10.05,多肽全序列一级结构(氨基酸序列SEQ ID NO:1)为:
(ASENGKCNLLCLVKKKLRAVGNVIKTVVGKIA),其第七位半胱氨酸和第十一位半胱氨酸组成一对分子内二硫键。
该树蛙防御肽前体的编码基因由615个核苷酸(SEQ ID NO:2)组成,其自5’端至3’端序列为:
其中,第346–441位核苷酸为成熟树蛙防御肽cathelicidin-PP的编码基因。
本发明的树蛙防御肽cathelicidin-PP在制备大肠杆菌、甲型副伤寒沙门氏菌、绿脓杆菌和光滑念球菌引起的感染疾病的治疗药物中的应用。
本发明的有益效果在于:提供一种新的具有广谱抗微生物(包括革兰氏阴性细菌和真菌)的树蛙防御肽cathelidin-PP,本发明对大肠杆菌、甲型副伤寒沙门氏菌、绿脓杆菌和光滑念球菌引起的感染疾病具有显著的抑制细菌和真菌生长的作用。
附图说明:
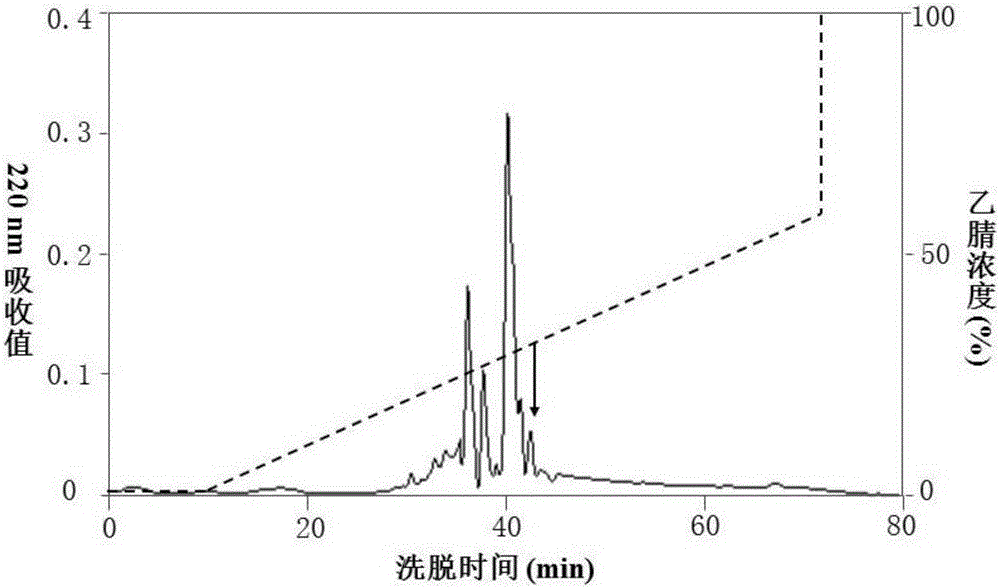
附图1显示使用反相高压液相分离纯化树蛙皮肤分泌液,箭头所示为具有抗菌活性的组分。
附图2显示使用反相高压液相进一步纯化该组分,箭头所示为纯化的防御肽cathelicidin-PP。
具体实施方式:
下面结合附图对本发明作详细说明。
一、树蛙防御肽cathelicidin-PP的制备和氨基酸序列测定:
1、收集树蛙皮肤分泌液:
活体树蛙用水清洗干净,置于直径10厘米,高10厘米的圆柱体样品瓶中。乙醚刺激2分钟后,用10ml 0.1M pH 6.0的磷酸盐缓冲溶液(PBS)冲洗蛙背部泡沫液体。将该分泌液于4℃条件下12000rpm离心15分钟,上清于-80℃保存。2、树蛙防御肽cathelicidin-PP的分离纯化:
以上述收集的上清液为原料,按照下述程序纯化防御肽cathelicidin-PP,分离纯化的每个组分都进行抗菌活性检测,具体方法如下:
(a)采用美国Millipore公司的超滤管将上清液中分子量大于10kDa的物质去除。上清液加入超滤管(10kDa,15ml)中进行第一次离心(3000×g,40分钟),收集滤液,再进行第二次离心(3000×g,10分钟),收集滤液,再进行第三次离心(3000×g,5分钟),收集剩余的滤液,于-20℃保存。
(b)上述的滤液采用反相高压液相(RP-HPLC)C18色谱柱进行纯化,该步骤在美国Waters公司的2795四元梯度高效液相色谱仪中进行,以0-60%乙腈线性梯度进行洗脱,流速为0.7ml/min,收集各洗脱组分,如图1所示,并测定抗菌活性。将图1箭头所示的具有抗菌活性的组分冻干,继续使用RP-HPLC C18色谱柱进一步纯化,得到如图2箭头所示的纯化的树蛙防御肽cathelicidin-PP。
3、树蛙防御肽cathelicidin-PP的氨基酸测定
纯化的树蛙防御肽cathelicidin-PP运用Edman降解法进行测序,该步骤在美国ABI公司的Proscise TM 491蛋白质测序仪中进行。测序结果表明树蛙防御肽的全序列一级结构为:ASENGKCNLLCLVKKKLRAVGNVIKTVVG KIA。
二、树蛙防御肽cathelicidin-PP基因的克隆
1、树蛙皮肤总RNA提取:
活体树蛙用水清洗干净,放入液氮中速冻10小时,取300mg皮肤组织,加入3ml Trizol溶液,于20ml玻璃匀浆器中匀浆30分钟。加入等体积酚/氯仿溶液,剧烈混匀,室温放置10分钟,4℃,12000rpm离心10分钟,弃除沉淀。上清加入等体积的异丙醇,室温放置10分钟,4℃,12000rpm离心10分钟,沉淀用75%乙醇洗一次,晾干,管底沉淀物即为树蛙皮肤总RNA 。
2、树蛙皮肤mRNA的纯化:mRNA分离纯化采用美国PROMEGA公司的mRNA Isolation Systems试剂盒。
提取的树蛙皮肤总RNA溶于500μl DEPC水中,放入65℃水浴10分钟,加入3μl的Oligo(dT)探针和13μl 20×SSC溶液,混匀后放置室温冷却,称为A液。将磁珠(SA-PMP)轻弹混匀,至磁力架吸附30秒,弃上清,加0.5×SSC 0.3m1,至磁力架吸附30秒,最后加0.1ml 0.5×SSC悬浮,称之为B液。将A液加入B液中,室温放置10分钟,至磁力架吸附30秒,弃上清,用0.1×SSC洗涤4次,最后弃上清,加0.1ml DEPC水悬浮,至磁力架上吸附30秒,将上清移至新的试管,再加入0.15m1DEPC水重新悬浮,至磁力架吸附30秒,移上清至上述试管,则上清中为纯化的树蛙皮肤mRNA。加入1/10体积3M乙酸钠,pH5.2,等体积异丙醇,于-70℃放置30分钟,4℃,12000rpm离心10分钟,弃上清,沉淀溶解于10μl DEPC水中。
3、树蛙皮肤cDNA文库构建:
采用CLONTECH公司CreatorTM SMART TM cDNA Library Construction Kit质粒cDNA文库构建试剂盒。
(a)cDNA第一链合成(mRNA反转录):
在0.5ml无菌的离心管加入1μl树蛙皮肤mRNA、1μl SMART IV寡聚核苷酸、1μl CDS III/3’PCR引物,加2μl去离子水使总体积达到5μl。混匀离心管中的试剂并以12000rpm离心15秒,72℃保温2分钟。将离心管在冰上孵育2分钟。在离心管中加入以下试剂2.0μl 5×第一链缓冲、1.0μl 20mM二硫苏糖醇、1.0μl10mM dNTP混合物、1.0μl PowerScript反转录酶。混合离心管中试剂并以12000rpm离心15秒,在42℃保温1小时。将离心管置于冰上中止第一链的合成。从离心管取2μl所合成的cDNA第一链备用。
(b)采用长末端聚合酶链式反应(LD-PCR)方法扩增第二链
95℃预热PCR仪,将2μl cDNA第一链(mRNA反转录)、80μl去离子水、10μl 10×Advantage 2PCR缓冲液、2μl 50×dNTP混合物、2μl 5’PCR引物、2μl CDS III/3’PCR引物以及2μl大肠杆菌聚合酶离心管进行反应。在PCR仪中按以下程序扩增:95℃,20秒钟;22个循环(95℃,5秒钟;68℃,6分钟)。循环结束后,将离心管中合成的cDNA双链进行回收。
(c)PCR产物回收:
用PROMEGA公司的SV Gel and PCR Clean-Up System试剂盒进行抽提回收,步骤如下:
将通过PCR得到的cDNA双链加入等体积的膜结合缓冲颠倒混匀,然后将混和液转入离心纯化柱,室温静置5分钟,使DNA充分与硅胶膜结合。12000rpm离心30秒,倒掉收集管中的废液。加入700μl的洗脱液(含乙醇)于离心纯化柱中,以12000rpm离心30秒,倒掉收集管中的废液。重复步骤2。12000rpm离心5分钟,将离心纯化柱置于新的离心管中。加入30μl超纯水,在室温下静置5分钟。12000rpm离心30秒,管底溶液即为所纯化过的cDNA双链。
(d)大肠杆菌DH5α感受态细胞的制备:
挑取单个DH5α菌落,接种于3ml不含氨苄青霉素的Luria-Bertani(LB)培养基中,37℃培养过夜,次日取上述菌液按比例1:100再接种于50ml LB培养液中,37℃振荡2小时。当OD600值达到0.35时,收获细菌培养物。将细菌转移到一个无菌、一次性使用的、用冰预冷的50m1聚丙烯管中,在冰上方置10分钟,使培养物冷却至0℃。于4℃以4100rpm离心10分钟,回收细胞。倒出培养液,将管倒置l min以使最后的痕量培养液流尽。每50ml初始培养液且30ml预冷的0.1mol/LCaCl2-MgCl2溶液(80mmol/L MgCl2,20mmol/L
CaCl2)重悬每份细胞沉淀。于4℃以4100rpm离心10分钟,回收细胞。倒出培养液,将管倒置l分钟以使最后的痕量培养液流尽。每50m1初始培养物用2m1用冰预冷的0.1mol/L CaCl2重悬每份细胞沉淀,分装后备用。
(e)酶切、连接以及连接产物的转化:
在微量离心管中加入1μl Takara pMD18-T载体、4μl树蛙cDNA双链溶液,全量为5μl。加入5μl(等量)的连接酶缓冲混合物。16℃反应2小时。全量10μl加入100μl DH5α感受态细胞中,冰中放置30分钟。42℃加热90秒钟后,再在冰中放置1分钟。加入37℃温浴过的LB培养基890μl,37℃缓慢振荡培养60分钟。取200μl涂布于含有X-Gal、IPTG、Amp的LB培养基上37℃培养16小时,形成单菌落。每个LB平皿用5ml LB液体培养基洗涤菌落,加30%甘油冻存。构建的cDNA大约含1×106个单独克隆。
4、树蛙防御肽基因克隆筛选:
扩增引物序列为5’ATGAAGGTCTGGCAGTGTGTGATC3’,PCR另一扩增引物为CLONTECH公司SMART TM cDNA Library Construction Kit中的3’PCR Primer引物,其序列为5’ATTCTAGAGGCCGAGGCGGCCGACATG 3’。PCR反应在如下条件下进行:94℃,30秒钟;52℃,45秒钟;72℃,2分30秒钟,共35个循环。首先滴定构建的细菌cDNA文库,然后用含100μg/ml氨苄青霉素的LB培养基稀释至适当的细菌浓度(大约5000个细菌/毫升,和30个细菌/毫升分别用于首轮筛选第二轮筛选),在96孔培养板上按8×8矩阵铺板(共64孔,每孔100μl),37℃过夜培养。按行、列分别合并细菌培养液,有10个样品进行PCR鉴定,交叉阳性孔细菌样品进入第二轮筛选。
5、树蛙防御肽基因序列测定:
提取质粒DNA用双脱氧法测定核苷酸序列,使用仪器为美国Applied Biosystems373A全自动核苷酸序列测定仪,测序引物为BcaBESTTM Sequencing Primer RV-M和BcaBESTTM Sequencing Primer M13-47,BcaBESTTM Sequencing Primer RV-M序列:5`GAGCGGATAACAATTTCAC ACAGG 3’,BcaBESTTM Sequencing Primer M13-47:5’CGCCAGGGTTTTC CCAGTCACGAC 3’。
基因测序结果表明编码树蛙防御肽前体的基因由615个核苷酸(SEQ ID NO:2)组成(GenBank Accession Number:KY610282),自5’端至3’端序列为:
其中第346–441位核苷酸为成熟树蛙防御肽cathelicidin-PP的编码基因。
三、树蛙防御肽cathelicidin-PP抑制细菌生长的作用:
以Luria-Bertani(LB)液体培养基作为培养介质。供试菌株经LB固体培养基复苏后,用无菌水稀释菌落成每毫升含2×105个细菌的菌液,备用。测定最小抑菌浓度时,采用二倍稀释法进行抗菌检测。具体方法如下:在0.19ml培养基中加入0.01ml样品作为第一孔,混匀后取0.1ml加入第2孔(已加入0.1ml新鲜培养基),依次倍比稀释,自第6孔吸出0.1ml弃去,四周各孔系对照,将各孔中加入已校正的菌液(2×105cfu/ml)0.1ml,混匀后放置37℃培养18小时,于600nm波长处测定光吸收。最小抑菌浓度为看不见细菌生长的最低样品浓度。细菌菌株来源于昆明医科大学,此试验重复三次,取平均值,结果如表1。
表1,树蛙防御肽cathelicidin-PP抑制细菌生长的作用:
由表1可见,树蛙防御肽cathelicidin-PP具有显著的抑制细菌和真菌生长的作用。
SEQUENCE LISTING
<110> 昆明医科大学
<120> 树蛙防御肽cathelicidin-PP及其基因和应用
<130> 2017
<160> 2
<170> PatentIn version 3.5
<210> 1
<211> 32
<212> PRT
<213> Polypedates puerensis
<400> 1
Ala Ser Glu Asn Gly Lys Cys Asn Leu Leu Cys Leu Val Lys Lys Lys
1 5 10 15
Leu Arg Ala Val Gly Asn Val Ile Lys Thr Val Val Gly Lys Ile Ala
20 25 30
<210> 2
<211> 615
<212> DNA
<213> Polypedates puerensis
<400> 2
atgaaggtct ggcagtgtgt gatctttcta gcggctctaa cattgcacct ggctcacttt 60
cagtcaggac ggatcagagc agcgctggat gcctacaacc agaaggatga tggagagtgc 120
tactttaagt tcgtgtcgga tctcccgggg tccctcctgc aggaggagga agagtctcca 180
tcagtcaact ttttaatcaa ggagacggag tgccgcaagt ccgaagacgt tgacttggag 240
cgatgcgagt acaagaagga cggggaggtg aaggcgtgcg ctctgtacct ggagaaagag 300
gaggtggaat gcgtcagtct ttccgagaat tcgcgcccca agcgagccag tgagaatgga 360
aagtgcaact tattgtgctt agtgaagaag aagctgcgag ctgtcggcaa cgttatcaag 420
accgtcgtcg gtaaaatagc atagcgaata ttatccgtat tttgccgcgc cttcaatgca 480
accttccttt accgctaata tcccctccga gcttttgcaa ggatggtgtt tgtgcacaga 540
gcgccgacat cgccccaaac ccgaataaat ttgcattccc ataaagaaaa aaaaaaaaaa 600
aaaaaaaaaa aaaaa 615
- 还没有人留言评论。精彩留言会获得点赞!
- 一个太子参环肽HB前体蛋白基因及其应用的制作方法与工艺
- 一种新型小分子肽和其在阿尔兹海默症检测中的应用的制作方法与工艺
- 一种脱脂豆粕制备小分子蛋白肽猪饲料的优化工艺的制造方法与工艺
- 两亲性温敏型聚肽嵌段共聚物分子刷及其制备方法和应用与流程
- 两个小分子肽及其制备方法和在制备抗病毒药物中的应用与流程
- 杀虫基因PPTX-15及其编码的杀虫肽与应用的制造方法与工艺
- 可溶性通用的增强ADCC的合成融合基因和融合肽的技术及其应用的制造方法与工艺
- 修饰的人类U1snRNA分子、编码修饰的人类U1snRNA分子的基因、包括该基因的表达载体及其在基因治疗中的用途的制造方法与工艺
- 黑框蟾蜍抗氧化肽及其基因和在制药中的应用的制造方法与工艺
- 一种抗凝肽重组分子、其制备方法及应用与制造工艺
- 一个太子参环肽HB前体蛋白基因及其应用的制作方法与工艺
- 一种新型小分子肽和其在阿尔兹海默症检测中的应用的制作方法与工艺
- 一种脱脂豆粕制备小分子蛋白肽猪饲料的优化工艺的制造方法与工艺
- 两亲性温敏型聚肽嵌段共聚物分子刷及其制备方法和应用与流程
- 两个小分子肽及其制备方法和在制备抗病毒药物中的应用与流程
- 杀虫基因PPTX-15及其编码的杀虫肽与应用的制造方法与工艺
- 可溶性通用的增强ADCC的合成融合基因和融合肽的技术及其应用的制造方法与工艺
- 修饰的人类U1snRNA分子、编码修饰的人类U1snRNA分子的基因、包括该基因的表达载体及其在基因治疗中的用途的制造方法与工艺
- 黑框蟾蜍抗氧化肽及其基因和在制药中的应用的制造方法与工艺
- 一种抗凝肽重组分子、其制备方法及应用与制造工艺