抗生素pyrazolofluostatinA‑C及其制备方法和应用与流程
本发明属于工业微生物领域,具体涉及新的抗生素pyrazolofluostatin A-C及其制备方法和应用。
背景技术:
:
Fluostatins是一类非典型角环素类化合物,这一家族的化合物结构多样,具有抗菌、抗肿瘤、蛋白酶抑制等多种生物活性。Pyrazolofluostatin A-C是具有吡唑环结构的新颖的fluostatins家族化合物。
技术实现要素:
:
本发明的第一个目的是提供三种新的非典型角环素pyrazolofluostatins A-C。
本发明的三种新的非典型角环素pyrazolofluostatin A-C,其结构如式(I)所示:
化合物1为pyrazolofluostatin A,R1为OH,C1为R构型,R2为OH,C2为S构型,R3为OH,C3为S构型;化合物2为pyrazolofluostatin B,R1为OH,C1为R构型,R2为OH,C2为R构型,R3为OH,C3为S构型;化合物3为pyrazolofluostatin C,R1为OH,C1为R构型,R2为OH,C2为R构型,R3为H,C3为S构型。
本发明的第二个目的是提供一种制备抗生素pyrazolofluostatin A-C的方法,其特征在于,包括以下步骤:
a)制备小单孢菌(Micromonospora rosaria)SCSIO N160的发酵培养物,将该发酵培养物的发酵液和菌丝体分离开,发酵液经大孔树脂吸附,后用丙酮洗脱大孔树脂,洗脱液回收丙酮后剩余的水混合液用丁酮萃取,丁酮层经蒸馏浓缩后得到浸膏A;菌丝体先用丙酮浸提,浸取液回收丙酮后剩余的水混合液再用丁酮萃取,丁酮层经蒸馏浓缩后得到浸膏B;
b)将浸膏A和浸膏B合并的粗提物经硅胶柱层析,用氯仿/甲醇作为洗脱剂,从体积比100:0~0:100进行梯度洗脱,收集氯仿/甲醇体积比50:50梯度洗脱下来的馏分Fr.4,后经LH-20凝胶柱,以氯仿/甲醇体积比1:1作为流动相洗脱,洗脱馏分再经HPLC制备分离,得到化合物pyrazolofluostatin A-C。
所述的a步骤的制备小单孢菌(Micromonospora rosaria)SCSIO N160的发酵培养物是通过以下方法制备:将活化的小单孢菌(Micromonospora rosaria)SCSIO N160接入种子培养基,28℃,200rpm,培养144h得种子液,将种子液以10%的接种量接入到发酵培养基中,28℃,200rpm,振荡培养120h,而制得发酵培养物,所述的种子培养基和发酵培养基的配方都为每升培养基中含有:淀粉10g,葡萄糖20g,酵母粉10g,玉米粉3g,牛肉膏3g,MgSO4·7H2O 0.5g,K2HPO4 0.5g,CaCO3 2g,余量为海盐质量分数为3%的海水或陈海水。
本发明的第三个目的是提供小单孢菌(Micromonospora rosaria)SCSIO N160在制备权利要求1所述的化合物pyrazolofluostatin A、pyrazolofluostatin B和pyrazolofluostatin C中的应用。
本发明的第四个目的是提供化合物pyrazolofluostatin A、pyrazolofluostatin B或pyrazolofluostatin C在制备抗氧化药物中的应用。
一种抗氧化药物,其特征在于,包括化合物pyrazolofluostatin A、pyrazolofluostatin B或pyrazolofluostatin C作为抗氧化活性成分。
本发明从小单孢菌(Micromonospora rosaria)SCSIO N160的发酵培养物中分离到了三个具有抗氧化活性的新的化合物pyrazolofluostatin A、pyrazolofluostatin B和pyrazolofluostatin C,这三个化合物具有良好的抗氧化活性,能用于制备抗氧化活性药物,具有良好的应用前景。
本发明的小单孢菌(Micromonospora rosaria)SCSIO N160于2012年10月08日保藏于中国典型培养物保藏中心(CCTCC),地址:中国武汉武汉大学,其保藏编号为:CCTCC NO:M 2012392。其公开于专利号为:ZL201210467946.X,发明名称为:一种小单孢菌及利用该菌制备多种抗生素的方法的专利中。
附图说明:
图1是上清液的提取物(上清提取物)-浸膏A和菌丝体的提取物-浸膏B的高效液相色谱图;
高效液相色谱(HPLC)条件:色谱柱为phenomex 150×4.6mm(SphereClone SAX),流动相包括A相和B相,流动相A相:10%(体积分数)的乙腈+0.08%(体积分数)的甲酸,溶剂为水,流动B相:90%(体积分数)的乙腈,溶剂为水;进样程序:0-20min,流动相比例为A相/B相(体积比):95:5-0:100,20-21min,流动相比例为A相/B相(体积比):0:100,21-22min,流动相比例为A相/B相(体积比):0:100-95:5,22-30min,流动相比例为A相/B相(体积比):95:5,检测波长254nm,流速1ml/min,其中1代表化合物1,2代表化合物2,3代表化合物3。
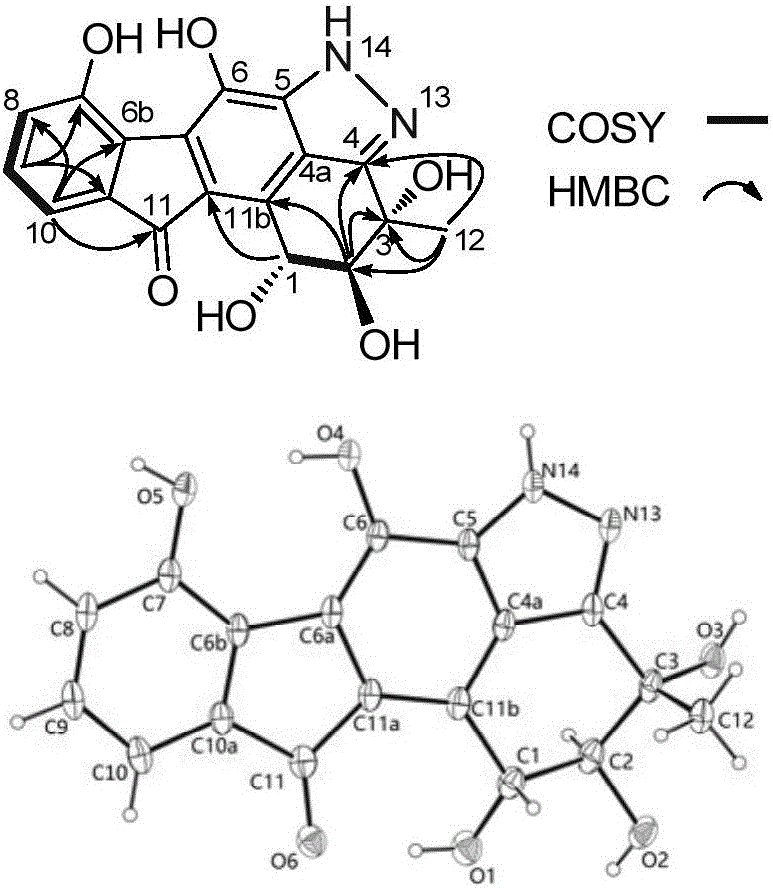
图2化合物1的关键的HMBC,1H–1H COSY及化合物1的晶体衍射结构。
图3化合物2-3的关键的HMBC,1H–1H COSY和NOE相关。
图4化合物1的H谱图。
图5化合物1的C谱图。
图6化合物2的H谱图。
图7化合物2的C谱图。
图8化合物3的H谱图。
图9化合物3的C谱图。
具体实施方式:
以下实施例是对本发明的进一步说明,而不是对本发明的限制。
实施例1:活性代谢产物pyrazolofluostatin A-C的分离和制备
1、配制培养基:
种子培养基配制,每升种子培养基中含有:淀粉10g,葡萄糖20g,酵母粉10g,玉米粉3g,牛肉膏3g,MgSO4·7H2O 0.5g,K2HPO4 0.5g,CaCO3 2g,余量为海盐质量分数为3%的海水或陈海水,pH 7.2,其配制方法是将上述组分按其含量混合均匀后调pH值,然后115℃,灭菌30min,备用;
发酵培养基与种子培养基相同。
2、发酵:
种子培养:将在平板上活化的海洋来源的小单孢菌(Micromonospora rosaria)SCSIO N160接入种子培养基(800mL)中,28℃,200rpm,培养144h制得种子液;
规模发酵培养:将种子液以体积分数10%的接种量接入到发酵培养基中(8L),28℃,200rpm,培养120h,而制得小单孢菌(Micromonospora rosaria)SCSIO N160的发酵培养物。3、发酵液的萃取:
发酵培养物先进行离心分离(3500r·min-1,8min),得到9L体积的上清液(发酵液)和菌丝体。发酵液经大孔树脂XAD16固相萃取,后用丙酮洗脱大孔树脂3次,洗脱液回收丙酮后剩余的水混合液用丁酮萃取3次,丁酮层经蒸馏浓缩后得到上清液提取物-浸膏A(3.6g);菌丝体用2L丙酮在室温下浸提3次,每次3小时,合并提取液,减压回收丙酮后剩余水混合液用6L丁酮萃取,丁酮层减压蒸馏得菌丝体提取物—浸膏B(0.7g)。将浸膏A与B合并为浸膏C(6.5g)。
浸膏A和浸膏B通过HPLC分析,其含有化合物1、2和3,具体如图1所示。
4、化合物的分离
a)浸膏C经硅胶柱层析(300-400mesh),以氯仿/甲醇作为洗脱剂,从体积比100:0~0:100进行梯度洗脱,收集氯仿/甲醇体积比50:50梯度洗脱下来的馏分Fr.4。
b)300mg的馏分Fr.4经凝胶sephadex LH-20柱层析,用体积比为1:1的氯仿-甲醇作为流动相洗脱,洗脱1200ml,每100ml收集为一个馏分,先后依次得馏分Fr.4A至Fr.4I,把收集的第7个馏分Fr.4G(120mg)。Fr.4G(120mg)使用半制备型高效液相色谱(乙腈:水85:15v/v,流速2.5ml/min),运用C-18反相柱(250×10.0mm i.d.,5μm,Phenomenex,USA)制备,收集保留时间为第7分钟的馏分,旋转蒸干制备获得pyrazolofluostatin B(11mg,化合物2);收集保留时间第9分钟的馏分,旋转蒸干制备获得pyrazolofluostatin A(17mg,化合物1),收集保留时间第11分钟的馏分,旋转蒸干制备获得pyrazolofluostatin C(7mg,化合物3)。
5、化合物的鉴定
通过结构分析,对本发明的从小单孢菌(Micromonospora rosaria)SCSIO N160的发酵培养物中制备得到的3个化合物—化合物1-3(对应化合物pyrazolofluostatin A-C)(式(I))对其进行鉴定,其鉴定结果如下:
图2化合物1的关键的HMBC,1H–1H COSY及化合物1的晶体衍射结构。
图3化合物2-3的关键的HMBC,1H–1H COSY和NOE相关。
图4化合物1的H谱图。
图5化合物1的C谱图。
图6化合物2的H谱图。
图7化合物2的C谱图。
图8化合物3的H谱图。
图9化合物3的C谱图,化合物1、2和3的核磁数据如表1所示。
化合物1(pyrazolofluostatin A):白色晶体,UV(MeOH)λmax(logε)202nm(4.04),263nm(4.02),284nm(3.80);IR(KBr)νmax 3211,1656,15973cm-1.1H and 13C NMR data,see Table 1;HRESIMS(m/z 353.0784,[M-H]-,calcd for 353.0779)
化合物1的负源高分辨电喷雾质谱图显示其准分子离子峰为m/z 353.0784,[M-H]-,推测其分子式为C18H14N2O6(计算值为353.0779,不饱和度为13),IR谱在3265cm-1有强吸收,提示在分子中存在NH。分析1H,13C和HSQC(表1)数据表明该化合物含有一个甲基(δH1.42,3H,s),一对连氧的相互偶合的次甲基(δH 5.03,1H,d,J=4.0Hz;3.80,1H,d,J=4.0Hz),一个1,2,3-三取代的苯环(δH 6.71,1H,d,J=7.5Hz;6.90,1H,dd,J=7.0,7.5Hz;6.82,d,J=7.0Hz),碳谱显示有18个碳,包括1个甲基,2个sp3杂化的次甲基,3个sp2杂化的次甲基,和12个季碳。进一步的2D NMR分析,显示化合物1中有一个典型的fluorenone环(A,B,C环),和一个不已烯环(D环),以上的这些信号说明化合物1是非典型角环素家族中的一员(Zhang,W.;Liu,Z.;Li,S.;Lu,Y.;Chen,Y.;Zhang,H.;Zhang,G.;Zhu,Y.;Zhang,G.;Zhang,W.;Liu,J.;Zhang,C.,.J.Nat.Prod.2012,75,1937-1943)。
化合物1的NMR谱与fluostatin C相似。与fluostatin C相比,化合物1中C-2,C-3位碳化学位移下移,说明化合物1中C-2,C-3位是两个羟基,不同于fluostatin C,C-2,C-3是环氧。另外,根据化合物1的分子式、不饱和度,及C-4位的化学位移的变化,推测化合物1中含有吡唑环。这样构建了化合物1的平面结构,化合物1的相对构型是通过偶合常数与NOE相关来确定的。根据H-1/H-2间的偶合常数(3JH1-H2 4.0Hz)及与参考文献的比较(Zhang,W.;Liu,Z.;Li,S.;Lu,Y.;Chen,Y.;Zhang,H.;Zhang,G.;Zhu,Y.;Zhang,G.;Zhang,W.;Liu,J.;Zhang,C.,.J.Nat.Prod.2012,75,1937-1943),将H-1/H-2归属为反式构型。H-1/H-3间的NOE相关说明了H-1/H-3同侧。最后,在水:甲醇混合体系中,我们得到了化合物1的单晶(CCDC 1481191),从而进一步确证了化合物1的结构。根据化合物的Flack常数0.05(3),将化合物1确定为1R,2S,和3S。
化合物2(pyrazolofluostatin B):白色固体,Pyrazolofluostatin B(2):UV(MeOH)λmax(logε)203nm(4.11),263nm(4.06),284nm(3.88),331nm(3.62);IR(KBr)νmax 3265,1660,1589,cm-1.1H and 13C NMR data,see Table 1;HRESIMS(m/z 353.0788,[M-H]-,calcd for 353.0779,Figure S2A).
化合物2的负源高分辨电喷雾质谱图显示其准分子离子峰为m/z 353.0788([M-H]-,推测其分子式为C18H14N2O6(计算值为353.0779)。化合物2的1H和13C谱数据(表1)与化合物1的很相似,分子量与化合物1相同。推测化合物2与化合物1是一对立体异构体。进一步,通过仔细分析化合物2的2D NMR确认了化合物2的平面结构。与化合物1相比,化合物2中H-1/H-2间的偶合常数变大[3JH1-H2(7.3Hz),化合物1中为(3JH1-H2 4.0Hz)],推测化合物2中H-1/H-2间的构型为顺式。化合物2中OH-1/OH-3和H-2/H3-12间的NOE相关说明OH-2与OH-3在同一侧,也进一步说明H-1与H-2为顺式。最后,通过与化合物1相比,将化合物2的绝对构型归属为1R,2R,3S。
化合物3(pyrazolofluostatin C):UV(MeOH)λmax(logε)202nm(4.02),261nm(4.01),285nm(3.97),323nm(3.48);IR(KBr)νmax 3265,167,1662cm-1.1H and 13C NMR data,see Table 1;HRESIMS(m/z 337.0838,[M-H]-,calcd for 337.0830,Figure S3A)
化合物3为白色固体。化合物3的负源高分辨电喷雾质谱图显示其准分子离子峰为m/z337.0838[M-H]-,推测其分子式为C18H14N2O5(计算值为337.0830)。化合物3的1H和13C NMR数据与化合物1的很相似(表1)。主要的不同之处在于化合物3中C-3位由甲基取代了羟基。H-3/H3-12间的COSY相关及H3-12到C-2/C-3/C-4的HMBC相关证明了这种不同。进一步,通过详细的分析2D NMR归属了化合物3的平面结构。根据化合物3中H-1/H-2and H-2/H-3间的偶合常数(JH-1/H-2=2.0Hz和JH-2/H-3=3.0Hz)及H-1/H-3,和H-2/H3-12的NOE相关,将H-1/H-2,H-2/H-3间确定为反式构型。
由此确定化合物1-3的结构如式(I)所示:
化合物1为pyrazolofluostatin A,R1为OH,C1为R构型,R2为OH,C2为S构型,R3为OH,C3为S构型;化合物2为pyrazolofluostatin B,R1为OH,C1为R构型,R2为OH,C2为R构型,R3为OH,C3为S构型;化合物3为pyrazolofluostatin C,R1为OH,C1为R构型,R2为OH,C2为R构型,R3为H,C3为S构型。
表1.化合物pyrazolofluostatin A–C(1–3)的NMR(500MHz)核磁数据归属
Table1.1H NMR(500MHz)and 13C NMR(125MHz)assignments of compounds 1–3(J in Hz within parentheses).
aRecorded at 500MHz in DMSO-d6;assignments were based on DEPT,HSQC,COSY,HMBC,and NOESY experiments.
实施例2:pyrazolofluostatin A–C的抗氧化活性测定
Pyrazolofluostatin A–C针对DPPH进行了抗氧化活性测定,实验方法参考文献[Chou,T.-H.;Ding,H.-Y.;Lin,R.-J.;Liang,J.-Y.;Liang,C.-H.,Inhibition of Melanogenesis and Oxi dation by Protocatechuic Acid from Origanum vulgare(Oregano).J.Nat.Prod.2010,73,1767-1774],以Vitamin C作为对照(对DPPH的EC50是19.8±0.89μM)。结果表明pyrazo lofluostatin A对DPPH的EC50是48.6±0.62μM;Pyrazolofluostatin B对DPPH的EC50是31.7±0.43μM;Pyrazolofluostatin C对DPPH的EC50是21.7±0.47μM。Pyrazolofluostatin A–C对所测的DPPH有抗氧化活性,通过生物工程或化学修饰可望开发成为抗氧化新药。
表2.化合物pyrazolofluostatin A–C的抗氧化测定。
aVitamin C,positive control。
- 还没有人留言评论。精彩留言会获得点赞!