基于转录测序获得黑果枸杞SSR引物的方法与流程
本发明涉及一种获得SSR引物的方法,特别涉及一种基于转录测序获得黑果枸杞SSR引物的方法,属于生物学分子遗传分子标记技术技术领域。
背景技术:
简单重复序列(simple sequence Repeats,SSR),也称作微卫星DNA(Microsatellite DNA)是指一类由几个(多为1~6个)碱基组成的基元串联重复而成的DNA序列,如(AT)n、(GCA)n、(AATC)n等重复,它广泛而均匀地分布于真核生物基因组中。由于多态性高、技术重复性好,易于操作等优点,自上世纪九十年代初以来,SSR标记一直作为一种优良的分子标记而被广泛应用于物种的遗传分析。人们对微卫星DNA在人类、动物以及植物中的发生与分布做了大量的研究。SSR标记的传统开发涉及一系列繁复的操作过程,不仅效率低下,而且由于成本因素的限制,长期以来使得SSR标记仅在模式植物或者是经济价值较高的作物上得到开发和应用。
SSR两端的序列多是相对保守的单拷贝序列,人们常常根据其两端的序列设计特异引物进行扩增,根据扩增产物长短的变化而显示不同基因型的个体在每个SSR位点上的多态性。SSR根据序列来源,一般分为基因组gSSR(genomic SSR)和EST-SSR(eSSR)两种。
黑果枸杞(Lycium ruthenicum Murr.)为茄科枸杞属多年生灌木植物,是我国西北荒漠地区一种特有的野生植物,主要分布于青海、新疆、内蒙、宁夏、甘肃等地。该种耐盐、抗旱,多分布于盐碱土荒地、池地或路旁,对盐渍土壤有很强的适应性。但与宁夏红果枸杞相比,黑果枸杞在繁育手段及品种鉴定等方面存在明显的差距,在分子标记研究方面,仅见到有关于SRAP的报道,未见关于其基因组信息或转录组信息的报道。
随着对黑果枸杞栽培品种需求的日益增加,关于黑果枸杞分子标记辅助的问题也迫切需要研究和解决。
目前,黑果枸杞尚无基因组信息,SSR引物数量较少。因此,如何基于转录测序获得黑果枸杞SSR引物,从而更好地研究不同种源之间的亲缘关系,用于黑果枸杞分子育种,为获得大量优秀种质资源奠定基础,就成为该技术领域急需解决的技术难题。
技术实现要素:
本发明的目的之一是提供一种基于转录测序获得黑果枸杞SSR引物的方法,从而更好地研究不同种源之间的亲缘关系,用于黑果枸杞分子育种,为获得大量优秀种质资源奠定基础。
为实现上述目的,本发明采取以下技术方案:
一种基于转录测序获得黑果枸杞SSR引物的方法,其步骤如下:
(1)取3个种源地的黑果枸杞作为样本,将地上部分做转录组测序;
(2)使用在线微卫星位点扫描工具SSRIT(或MISA软件)检测EST-SSR位点,SSR≥20bp,搜索设置为三核苷酸最低重复6次,四核苷酸最低重复5次,五核苷酸最低重复4次,六核苷酸最低重复3次;
(3)采用软件primer3.0进行SSR引物设计,引物参数设置为长度18-25bp,Tm55-65℃,产物大小为100-300bp;
(4)使用CTAB法提取10个种源地黑果枸杞的DNA,每个种源地取25个样品作为重复;
(5)利用PRIMER PREMIER 5.0对(3)中的引物以及它们对应的SSR位点进行进一步随机筛选检验,所筛选出的引物序列送到公司进行合成,合成后进行PCR扩增;
(6)使用8%非变性聚丙烯酰胺凝胶电泳进行多态性引物筛选:根据跑胶结果所显示条带,同种引物在不同种源地能扩增出差异条带的,认为具有多态性。
优选地,所述步骤(1)中所述转录组测序中,处理分为对照组、盐处理组与混合盐处理组,其中盐处理组使用100mL、pH=7、200mmol/L的NaCl溶液,混合盐处理组使用100mL、pH=8.54、Na2CO3、NaCl、Na2SO4、NaHCO3按照1:9:9:1混合的终浓度为200mmol/L的混合溶液。
优选地,所述步骤(1)中所述转录组测序的具体步骤如下:CTAB法提取黑果枸杞总RNA,分离mRNA,合并成双链cDNA,加腺嘌呤和测序接头,对大小在200bp-700bp的片段进行扩增,用Illumina HiSeq 2000对扩增后的文库进行检测,利用trinity软件拼接测序数据,使每条基因中最长的转录本编号为1个unigene。
优选地,所述步骤(5)中所述PCR扩增使用的PCR仪为BoiRad T100型号。
优选地,所述步骤(4)中所述提取10个种源地黑果枸杞的DNA的具体步骤如下:
①取超低温保存的叶片样本,研钵磨碎后加入2.0ml离心管中(加入的叶片粉末量没过2.0ml离心管的底部的尖端即可;
②迅速加入65℃预热过的CTAB 500μl(2%CTAB,使用前加入0.5-1%β-巯基乙醇),混合均匀后放入65℃水浴半小时,每十分钟摇动一次,使CTAB与叶片样本充分混匀;
③取出离心管放置2分钟后,加入等体积氯仿/异戊醇(24:1)混合液,将混合液与CTAB混匀后,涡旋混合,使CTAB与氯仿充分接触;
④12000rpm离心10分钟,吸取上清液至1.5ml离心管中;
⑤加入二倍体积无水乙醇洗涤DNA沉淀,12000rpm离心10min,弃上清;
⑥将乙醇洗涤过的DNA风干(超净工作台吹一下或者真空浓缩仪);
⑦风干后用50μl ddH2O溶解,得DNA浓度为30ng/μl,-20℃保存待用。
优选地,所述步骤(5)中所述进一步随机筛选检验的具体步骤为:SSR≥20bp,搜索设置为三核苷酸最低重复6次,四核苷酸最低重复5次,五核苷酸最低重复4次,六核苷酸最低重复3次;引物参数设置为长度18-25bp,Tm 58-63℃,产物大小为100-300bp;选取77对引物。
优选地,所述步骤(5)中所述PCR扩增所用的反应体系为Mix 10μl,DNA 1μl,上游引物和下游引物各1μl,ddH2O7μl;反应过程:预变性95℃,5min,变性:95℃,持续30s,退火:60℃,持续30s,延伸:72℃,持续30s,34次循环,得到扩增产物。
优选地,所述步骤(6)的具体过程如下:
①配制8%非变性聚丙烯酰胺凝胶:ddH2O 30mL,10×TBE 4mL,丙烯
酰胺6mL,TEMED40μl,最后加20%过硫酸铵200μl,等待凝胶时间
40min;
②电压130v,电流250mA,功率30w,取2.5μl扩增产物,跑胶1小时15分钟;
③将跑好的胶放入容器内,加入200mL蒸馏水,放至摇床上,打开摇床100r左右,再加2mL硝酸银溶液,遮光反应10min;
④倒掉液体,蒸馏水冲洗3次,加入200mL 1.5%氢氧化钠溶液,放至摇床上,打开摇床,再加1mL甲醛溶液,遮光反应10min。
本发明的另一目的是提供一种能鉴定黑果枸杞品种和种苗纯度的引物。
本发明的上述目的是通过以下技术方案达到的:
鉴定黑果枸杞品种的引物组,其特征在于:包括11对SSR多态性引物:
(1)U20
上游引物:CCCACTTCTCAAAAATGGTACAC,下游引物:ATAGTTGCCAACAAACCCTTCTT;
(2)U21
上游引物:GGATGAAGAAGAAGAGGATGACA,下游引物:CTTCTCAAAAATGGTACACTGCC;
(3)U23
上游引物:CTACTTCCATTTGTGGAAAGCTG,下游引物:TAGCCAGTCTAATCTTCGGTTTG;
(4)U25
上游引物:CAGGAAGGAGAAGAGTCTGATGA,下游引物:TTATCATTAACGGCTTCCATTTG;
(5)U26
上游引物:AATGGGGAAAGGTAAAGGAAGTT,下游引物:CCTTGTGGAATTTTACTTTCCAAT;
(6)U27
上游引物:CCACCCAGATAGTGGTGGTAATA,下游引物:GCTGATGTTTTCACATTTGTCAC;
(7)U31
上游引物:TAGGGTTTGAGGGTTTGAAGAAT,下游引物:ATTATTATGGCTTCTTCACCTGG;
(8)U36
上游引物:CTACCACTCCAACGTGTACCAAT,下游引物:TTCTTGCTCTAATTCTGAAACCG;
(9)U42
上游引物:GTCTCCATTTTACCCCTACCAAG,下游引物:TTTGCAAATAAAATGCGATTATTG;
(10)U46
上游引物:ATGAAGGCAATATTTAGGGCAGT,下游引物:CAATTTCATATTTGTGCTCTGCAT;
(11)D1
上游引物:TTCCAAGAACATTAGCACAAACA,下游引物:TGGCACTTGTCCTAGTCCTAAAC。
本发明的第三个目的是提供一种鉴定黑果枸杞的方法。
本发明的上述目的是通过以下技术方案达到的:
一种鉴定黑果枸杞的方法,包括如下步骤:
提取待测样品基因组DNA,以该基因组DNA为模版,用上述11对SSR多态性引物进行PCR扩增反应,所述的PCR扩增反应包括如下:
1、以基因组DNA为模版,以U20、U21、U23、U25、U26、U27、U31、U36、U42、U46、D1为上下游引物分别扩增产物,得到长度不同的扩增产物;
2、使用聚丙烯酰胺凝胶电泳或毛细管电泳跑胶,根据不同长度的产物区分不同种源地品种。
本发明的优点在于:
本发明通过使用Illumina 2000平台进行转录组测序的基础上,获得大量的SSR信息,通过PCR检测,对选取的部分SSR进行验证和多态性分析,从而获得具有通用型的多态性引物。本发明旨在利用SSR分子标记技术明确黑果枸杞SSR的总体特点,开发黑果枸杞SSR引物,为利用SSR分子标记进行黑果枸杞种质资源遗传多样性、连锁图谱构建及亲缘关系研究奠定基础。
下面通过附图和具体实施方式对本发明做进一步说明,但并不意味着对本发明保护范围的限制。
附图说明
图1是本发明基于转录测序获得黑果枸杞SSR引物的方法的流程图。
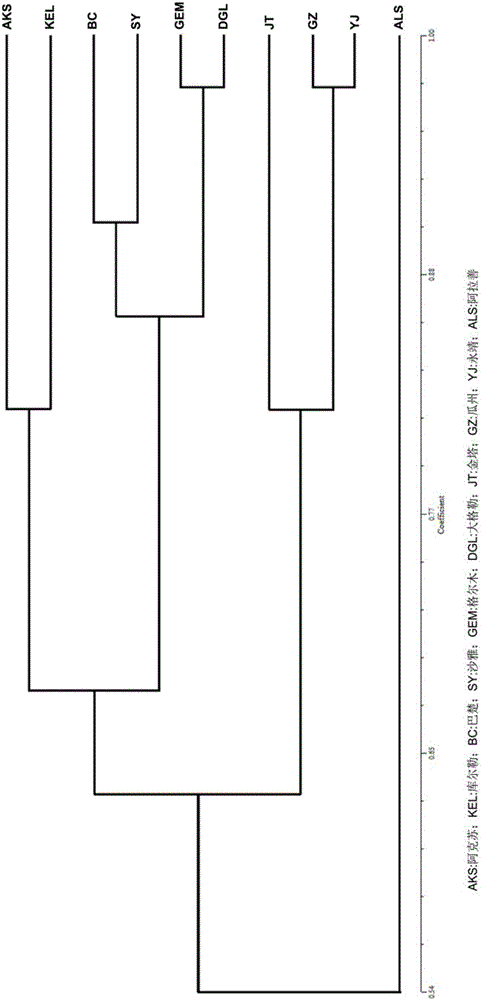
图2是本发明实施例2中10个种源地黑果枸杞的亲缘关系图。
具体实施方式
下面实施例中所用植物材料如下:
1、作为样本的3个种源地的黑果枸杞分别是:(1)阿克苏,(2)格尔木,(3)金塔;
2、提取DNA标本的10个种源地的黑果枸杞分别是:(1)阿克苏(AKS),(2)金塔(J-T),(3)沙雅(SY),(4)巴楚(BC),(5)永靖(YJ),(6)瓜州(GZ),(7)阿拉善(ALS),(8)格尔木(GEM),(9)大格勒(DGL),(10)库尔勒(KEL)。
如图1所示,为本发明基于转录测序获得黑果枸杞SSR引物的方法的流程图;左侧描述的是转录组测序的实验步骤:(1)提取样品总RNA并使用DNase I消化DNA后,用带有Oligo(dT)(多聚胸腺嘧啶、T重复寡核苷酸)的磁珠富集真核生物mRNA(若为原核生物,则用试剂盒去除rRNA后进入下一步);(2)加入打断试剂,在恒温混匀仪(Thermomixer)中适温,将mRNA打断成短片段;(3)以打断后的mRNA为模板合成一链cDNA;(4)然后配制二链合成反应体系,合成二链cDNA,并使用试剂盒纯化回收。
右侧描述的是SSR开发及引物设计:(5)以组装出来的非重复序列基因(Unigene)作为参考序列,使用SSR软件MicroSAtellite(MISA),来找出所有的SSR;(6)对所有SSR重复单元在非重复序列基因(Unigene)上前后序列的长度进行筛选,只保留前后序列均不小于150bp的SSR,用其设计引物。
实施例1
一种基于转录测序获得黑果枸杞SSR引物的方法,其步骤如下:
1)取3个种源地的黑果枸杞作为样本,将地上部分做转录组测序,处理分为对照组、盐处理组与混合盐处理组,其中盐处理组使用100mL、pH=7、200mmol/L的NaCl溶液,混合盐处理组使用100mL、pH=8.54、Na2CO3、NaCl、Na2SO4、NaHCO3按照1:9:9:1混合的终浓度为200mmol/L的混合溶液,处理6h后取叶片冻存于液氮中,进行转录组测序;
2)CTAB法提取黑果枸杞总RNA,分离mRNA,合并成双链cDNA,加腺嘌呤和测序接头,对大小在200bp-700bp的片段进行扩增,用Illumina HiSeq 2000对扩增后的文库进行检测,利用trinity软件(Trinity,是由the BroadInstitute开发的转录组de novo组装软件,由三个独立的软件模块组成:Inchworm,Chrysalis和Butterfly。三个软件依次来处理大规模的RNA-seq的reads数据。)拼接测序数据,使每条基因中最长的转录本编号为1个unigene;
3)使用在线微卫星位点扫描工具SSRIT(或MISA软件)筛选EST-SSR位点,SSR≥20bp,搜索设置为三核苷酸最低重复6次,四核苷酸最低重复5次,五核苷酸最低重复4次,六核苷酸最低重复3次;
4)采用软件primer3.0进行SSR引物设计,引物参数设置为长度18-25bp,Tm 55-65℃,产物大小为100-300bp;
5)使用CTAB法提取10个种源地黑果枸杞的DNA,每个种源地取25个样品作为重复,CTAB法即十六烷基三甲基溴化铵,植物DNA提取法,具体步骤如下:
①取超低温保存的叶片样本,研钵磨碎后加入2.0ml离心管中(加入的叶片粉末量没过2.0ml离心管的底部的尖端即可;
②迅速加入65℃预热过的CTAB 500μl(2%CTAB,使用前加入0.5-1%β-巯基乙醇),混合均匀后放入65℃水浴半小时,每十分钟摇动一次,使CTAB与叶片样本充分混匀;
③取出离心管放置2分钟后,加入等体积氯仿/异戊醇(24:1)混合液,将混合液与CTAB混匀后,涡旋混合,使CTAB与氯仿充分接触;
④12000rpm离心10分钟,吸取上清液至1.5ml离心管中;
⑤加入二倍体积无水乙醇洗涤DNA沉淀,12000rpm离心10min,弃上清;
⑥将乙醇洗涤过的DNA风干(超净工作台吹一下或者真空浓缩仪);
⑦风干后用50μl ddH2O溶解,得DNA浓度为30ng/μl,-20℃保存待用;
6)利用PRIMER PREMIER 5.0进行引物筛选,引物序列送到公司进行合成,SSR≥20bp,搜索设置为三核苷酸最低重复6次,四核苷酸最低重复5次,五核苷酸最低重复4次,六核苷酸最低重复3次;引物参数设置为长度18-25bp,Tm 58-63℃,产物大小为100-300bp;选取77对引物,合成后进行PCR扩增,扩增使用的PCR仪为BioRad T100型号;反应体系为Mix 10μl,DNA 1μl,上游引物和下游引物各1μl,ddH2O7μl;反应过程:预变性95℃,5min,变性:95℃,持续30s,退火:60℃,持续30s,延伸:72℃,持续30s,34次循环,得到扩增产物;
7)使用8%非变性聚丙烯酰胺凝胶电泳进行多态性引物筛选,过程如下:
①配制8%非变性聚丙烯酰胺凝胶:ddH2O 30mL,10×TBE 4mL,丙烯酰胺6mL,TEMED 40μl,最后加20%过硫酸铵200μl,等待凝胶时间40min;
②电压130v,电流250mA,功率30w,取2.5μl扩增产物,跑胶1小时15分钟;
③将跑好的胶放入容器内,加入200mL蒸馏水,放至摇床上,打开摇床100r左右,再加2mL硝酸银溶液,遮光反应10min;
④倒掉液体,蒸馏水冲洗3次,加入200mL 1.5%氢氧化钠溶液,放至摇床上,打开摇床,再加1mL甲醛溶液,遮光反应10min;
⑤根据跑出的条带,同一引物扩增出各个种源地DNA的差异性条带,则认为该引物具有多态性,在77对引物中选出如下表1中11对多态性高、在所有群体中都能稳定扩增的引物。
表1
实施例2利用SSR引物鉴定黑果枸杞
1、提取DNA
使用CTAB法提取10个种源地黑果枸杞的DNA,每个种源地取25个样品作为重复,具体步骤如下:
①取超低温保存的叶片样本,研钵磨碎后加入2.0ml离心管中(加入的叶片粉末量没过2.0ml离心管的底部的尖端即可;
②迅速加入65℃预热过的CTAB 500μl(2%CTAB,使用前加入0.5-1%β-巯基乙醇),混合均匀后放入65℃水浴半小时,每十分钟摇动一次,使CTAB与叶片样本充分混匀;
③取出离心管放置2分钟后,加入等体积氯仿/异戊醇(24:1)混合液,将混合液与CTAB混匀后,涡旋混合,使CTAB与氯仿充分接触;
④12000rpm离心10分钟,吸取上清液至1.5ml离心管中;
⑤加入二倍体积无水乙醇洗涤DNA沉淀,12000rpm离心10min,弃上清;
⑥将乙醇洗涤过的DNA风干(超净工作台吹一下或者真空浓缩仪);
⑦风干后用50μl ddH2O溶解,得DNA浓度为30ng/μl,-20℃保存待用;
2、PCR扩增
以步骤1提取的DNA为模版,用实施例1开发的11对SSR多态性引物进行PCR扩增,扩增方法同实施例1,具体为:以基因组DNA为模版,以U20、U21、U23、U25、U26、U27、U31、U36、U42、U46、D1为上下游引物分别扩增产物,得到长度不同的扩增产物;
3、检测分析
将步骤2中所得不同长度的扩增产物送交测序公司使用毛细管电泳测序,测序结果利用POPGENE 32(Yeh et al.,2000)软件计算各群体群体的遗传变异进行检测,进而分析各群体的遗传多样性。采用非加权平均法,基于Nei(1978)遗传距离,使用NTSYSpc 2.1进行聚类分析。结果如图2所示,是本发明实施例2中10个种源地黑果枸杞的亲缘关系图。
从图2可以看出,阿克苏与库尔勒相近,同属新疆地区品种;巴楚与沙雅相近,同属新疆地区品种;格尔木与大格勒相近,同属青海地区品种;瓜州与永靖最相近,并都与金塔相近,这三种都属于甘肃地区品种。
以上所述实施例的各技术特征可以任意组合,为使描述简洁,未对以上所述实施例的各技术特征所有可能的组合进行描述,然而,只要这些技术特征的组合不矛盾,都应该被认为是本说明书记载的范围。
本发明的基于转录测序获得黑果枸杞SSR引物的方法,可作为校正远亲物种间基因组连锁图谱与比较作图的方法,在这两方面有较高的利用价值。其最大的优点是开发简单、快捷、费用低。利用SSR分子标记技术明确黑果枸杞SSR的总体特点,开发黑果枸杞SSR引物,为利用SSR分子标记进行黑果枸杞种质资源遗传多样性、连锁图谱构建及亲缘关系研究奠定基础,从而更好地应用在分子育种中。
本发明的基于转录测序获得黑果枸杞SSR引物的方法,在高通量测序手段获得黑果枸杞转录组序列的基础上,对所得序列使用在线微卫星位点扫描工具筛选SSR位点。以阿克苏、巴楚、沙雅等10个种源的黑枸杞为试材,设计引物进行SSR位点验证,并建立和优化SSR-PCR反应体系,分别用琼脂糖和聚丙烯酰胺凝胶电泳分析产物。开发成功的标记能够应用于黑果枸杞分子育种,从而更好地研究不同种源之间的亲缘关系,为获得大量优秀种质资源奠定基础。
SEQUENCE LISTING
<110> 北京林业大学
<120> 基于转录测序获得黑果枸杞SSR引物的方法
<130>
<160> 22
<170> PatentIn version 3.3
<210> 1
<211> 23
<212> DNA
<213> U20上游引物
<400> 1
cccacttctc aaaaatggta cac 23
<210> 2
<211> 23
<212> DNA
<213> U20下游引物
<400> 2
atagttgcca acaaaccctt ctt 23
<210> 3
<211> 23
<212> DNA
<213> U21上游引物
<400> 3
ggatgaagaa gaagaggatg aca 23
<210> 4
<211> 23
<212> DNA
<213> U21下游引物
<400> 4
cttctcaaaa atggtacact gcc 23
<210> 5
<211> 23
<212> DNA
<213> U23上游引物
<400> 5
ctacttccat ttgtggaaag ctg 23
<210> 6
<211> 23
<212> DNA
<213> U23下游引物
<400> 6
tagccagtct aatcttcggt ttg 23
<210> 7
<211> 23
<212> DNA
<213> U25上游引物
<400> 7
caggaaggag aagagtctga tga 23
<210> 8
<211> 23
<212> DNA
<213> U25下游引物
<400> 8
ttatcattaa cggcttccat ttg 23
<210> 9
<211> 23
<212> DNA
<213> U26上游引物
<400> 9
aatggggaaa ggtaaaggaa gtt 23
<210> 10
<211> 24
<212> DNA
<213> U26下游引物
<400> 10
ccttgtggaa ttttactttc caat 24
<210> 11
<211> 23
<212> DNA
<213> U27上游引物
<400> 11
ccacccagat agtggtggta ata 23
<210> 12
<211> 23
<212> DNA
<213> U27下游引物
<400> 12
gctgatgttt tcacatttgt cac 23
<210> 13
<211> 23
<212> DNA
<213> U31上游引物
<400> 13
tagggtttga gggtttgaag aat 23
<210> 14
<211> 23
<212> DNA
<213> U31下游引物
<400> 14
attattatgg cttcttcacc tgg 23
<210> 15
<211> 23
<212> DNA
<213> U36上游引物
<400> 15
ctaccactcc aacgtgtacc aat 23
<210> 16
<211> 23
<212> DNA
<213> U36下游引物
<400> 16
ttcttgctct aattctgaaa ccg 23
<210> 17
<211> 23
<212> DNA
<213> U42上游引物
<400> 17
gtctccattt tacccctacc aag 23
<210> 18
<211> 24
<212> DNA
<213> U42下游引物
<400> 18
tttgcaaata aaatgcgatt attg 24
<210> 19
<211> 23
<212> DNA
<213> U46上游引物
<400> 19
atgaaggcaa tatttagggc agt 23
<210> 20
<211> 24
<212> DNA
<213> U46下游引物
<400> 20
caatttcata tttgtgctct gcat 24
<210> 21
<211> 23
<212> DNA
<213> D1上游引物
<400> 21
ttccaagaac attagcacaa aca 23
<210> 22
<211> 23
<212> DNA
<213> D1下游引物
<400> 22
tggcacttgt cctagtccta aac 23
- 还没有人留言评论。精彩留言会获得点赞!