一种酰胺酶PCR的方法与流程
本发明涉及酰胺酶PCR领域,具体涉及一种酰胺酶PCR的方法。
背景技术:
现代工业产生大量的酰胺类物质。据报道丙烯酰胺的年需求量从1999年内的1.79亿磅增加到2003年的2.05亿磅,而且其年需求量仍在逐年增加。而酰胺类物质的排放量则随着工业需求量的增加而增加。然而,酰胺类物质对人体均具有毒性,如丙烯酰胺对动物和人类的毒性作用主要表现在对神经系统的毒性作用,其中对末梢神经系统的毒性作用尤其明显,对中枢神经的毒性作用也有报道。因此,对酰胺类工业废水的处理意义重大且刻不容缓。目前对于酰胺类物质处理方法有内电解、高级氧化、水解酸化等技术。事实上,自然界中存在一些植物和微生物可降解酰胺,酶催化的反应具有高效、作用条件温和的特点。但是由于原生植物、微生物中酶的含量很低,提取原生植物和微生物的酶十分困难,并且价格高昂导致成本高,不利于工业化处理。而采用转基因技术改造大肠杆菌等,使酰胺酶高效表达,则能大大降低酶的价格,便于酰胺类物质污染的治理。
由于PCR是转基因技术的第一步,而实验条件对于PCR的进行至关重要,尤其是对于G-C含量高的DNA片段。现有技术中已有采用正交实验法优化PCR反应条件的报道,但其运算繁杂,实验耗时,不利于整个试验操作的连续进行。
技术实现要素:
鉴于上述现有技术的不足,本发明的目的在于提供一种酰胺酶PCR的方法,旨在对PCR实验条件进行优化,以解决现有技术中优化PCR反应条件运算繁杂,实验耗时,不利于整个试验操作连续进行的问题。
本发明的技术方案如下:
一种酰胺酶PCR的方法,其中,包括以下步骤:
A、在PCR反应管中加入模板DNA 0.4 uL、5*快速高保真PCR 缓冲溶液2 uL、 20*快速 PCR 增强剂0.5 uL、引物1 0.3 uL、引物2 0.3 uL、DMSO 0.6 uL、快速高保真聚合酶0.2 uL、水5.7 uL,组成10 uL反应体系;
其中,所述引物1与所述引物2之和为反应体系的总引物量;
B、升温至95℃,保持2min,95℃ 下DNA 变性 ,保持30s,然后于56℃下退火20 s,最后于72℃ 下引物延伸,保持2min;如此进行30个循环后,于72℃下保持10min,最后于12℃保存样品。
所述的酰胺酶PCR的方法,其中,还包括:
C、量取2.5 uL样品稀释至15uL,然后取7uL进行电泳实验,并于凝胶成像系统成像,保存结果。
所述的酰胺酶PCR的方法,其中,所述所述模板DNA 为稀有海洋放线菌Salinispora arenicola。
所述的酰胺酶PCR的方法,其中,
所述引物1的序列为:
Salinispora arenicola CNS-205-L: 5'GGGCATATGGCGGTGCAGGACATCA 3' (NdeI);
所述引物2的序列为:
Salinispora arenicola CNS-205-R: 5'CAGGAATTCCAGTTTCGTCATGCCC 3'(EcoRI)。
所述的酰胺酶PCR的方法,其中,所述反应在型号为Bio-rad伯乐T100型的PCR仪中进行。
所述的酰胺酶PCR的方法,其中,所述电泳实验电压为60V,电泳时间为1h。
有益效果:本发明采用简便的酰胺酶PCR的方法,操作简单,可参考性强,对于快速获得较佳PCR的条件具有很强的可操作性。此外,对于G-C碱基对含量较高的放线菌的PCR条件的探究也具有较高的参考价值,且经试验验证所述酰胺酶PCR的方法能大大提高目标条带扩增量,提高目标产物的产量。
附图说明
图1为本发明所述的酰胺酶PCR的方法中不同反应体系的电泳结果。
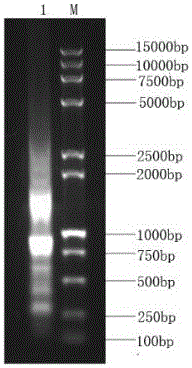
图2为本发明所述的酰胺酶PCR的方法所得产物的电泳结果。
图3为本发明所述的酰胺酶PCR的方法所得产物的梯度倍数稀释电泳结果。
具体实施方式
本发明提供一种酰胺酶PCR的方法,为使本发明的目的、技术方案及效果更加清楚、明确,以下对本发明进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
本发明提供了一种酰胺酶PCR的方法,所述PCR为Polymease Chain Reaction (聚合酶链式反应)的缩写,聚合酶链式反应是一种用于放大扩增特定的DNA片段的分子生物学技术,它可看作是生物体外的特殊DNA复制,PCR的最大特点,是能将微量的DNA大幅增加。PCR利用DNA在体外95℃时变性成为单链,低温 (常在60°C左右)时引物与单链然后按碱基互补配对的原则结合,再调温度至DNA聚合酶最适反应温度(72°C左右),DNA聚合酶沿着磷酸到五碳糖(5'-3')的方向合成互补链。
本发明中采用的模板DNA为稀有海洋放线菌Salinispora arenicola,引物1的序列为:Salinispora arenicola CNS-205-L: 5'GGGCATATGGCGGTGCAGGACATCA 3' (NdeI),引物2的序列为:Salinispora arenicola CNS-205-R: 5'CAGGAATTCCAGTTTCGTCATGCCC 3'(EcoRI),且所述引物1与所述引物2之和为反应体系的引物总量。本发明所述酰胺酶PCR的方法,包括以下步骤:
(一)在PCR反应管中加入模板DNA (Template )0.4 uL、5*快速高保真PCR 缓冲溶液(5*FAST HiFidelity PCR Buffer)2 uL、 20*快速 PCR 增强剂(20* FAST PCR Enhancer )0.5 uL、引物1 (Primer 1)0.3 uL、引物2 (Primer 2)0.3 uL、DMSO(二甲基亚砜) 0.6 uL、快速高保真聚合酶(FAST HiFidelity polymerase)0.2 uL、水5.7 uL,组成10 uL反应体系;其中,所述引物1与所述引物2比例为1:1,所述引物1与所述引物2之和为反应体系的引物总量,即10 uL反应体系中的引物总量为0.6 uL,所述引物1与所述引物2各加0.3 uL。另外,5*、20*分别表示该试剂占反应体系的5‰、20‰,但本实验加样时做了适当的调整。以上试剂均购自天根生化科技(北京)有限公司;
(二)加样完成后,将反应管放置于PCR仪,其中,所述PCR仪采用型号为Bio-rad伯乐T100型。基于聚合酶链式反应而制造的PCR仪是一款温控设备,能在DNA 变性温度、复性温度、延伸温度之间很好地进行控制。设置PCR仪,使其按照以下程序进行:升温至95℃,保持2min,95℃ 下DNA 变性 ,保持30s,然后于56℃下退火20 s,最后于72℃ 下引物延伸,保持2min;如此进行30个循环后,于72℃下保持10min,最后于12℃保存样品;
(三)为了验证以上条件下所得样品的品质,进行电泳实验。具体为:量取2.5 uL样品稀释至15uL,然后取7uL进行电泳,并于凝胶成像系统成像,保存结果。
当然,本发明所述的酰胺酶PCR的方法是经大量的实验探究结合理论分析所得到,下面以基于正交试验法对酰胺酶PCR的方法的探究过程为例进行说明。
正交试验法是利用排列整齐的表,即正交表来对试验进行整体设计、综合比较、统计分析,实现通过少量的实验次数找到较好的生产条件,以达到最高生产工艺效果。正交表能够在因素变化范围内均衡抽样,使每次试验都具有较强的代表性,由于正交表具备均衡分散的特点,保证了全面实验的要求,这些试验往往能够较好或更好的达到实验的目的。具体实验过程如下:
1、试剂
模板DNA:稀有海洋放线菌Salinispora arenicola
引物序列1:
Salinispora arenicolaCNS-205-L:5'GGGCATATGGCGGTGCAGGACATCA 3' (NdeI)
引物序列2:
Salinispora arenicola CNS-205-R: 5' CAGGAATTCCAGTTTCGTCATGCCC 3'(EcoRI)。其中,所述模板DNA是以稀有海洋放线菌Salinispora arenicola的总DNA作为研究材料,所述引物1和所述引物2由金斯瑞生物科技有限公司合成。
2、试验过程
选取影响PCR反应结果的4个重要因素及其各3个量化水平进行正交试验设计,并选用L9(34)正交表。所述4个因素是指引物总量、DMSO用量、退火温度和退火时间,所述引物总量为引物1和引物2之和,所述引物1和引物2体积比为1:1。将影响因素-水平表示为表1,将根据探究反应体系的实验序号与4个影响因素的3个量化水平对应关系的L9(34)正交表示为表2。
依照表1和表2准备9个PCR反应管,并标记实验序号1-9,按照10 uL反应体系一一加样,其中,9个反应体系可以概括为:模板DNA:0.4uL; 5*快速高保真PCR 缓冲溶液:2uL; 20*快速 PCR 增强剂:0.5uL; 引物1:B uL; 引物2: B uL;DMSO :A uL;H2O :(6.9-A-2B)uL;快速高保真聚合酶:0.2uL。(例如,实验序号为1的反应体系,加入模板DNA:0.4uL; 5*快速高保真PCR 缓冲溶液:2uL; 20*快速 PCR 增强剂:0.5uL; 引物1:0.2 uL; 引物2: 0.2 uL;DMSO :0.2 uL;则水为6.9-0.2-2*0.2=6.1uL。)
加样完成后,设置设置PCR仪,使其按照以下程序进行:升温至95℃,保持2min;95℃ 下DNA 变性 ,保持30s,然后于56℃下退火20 s,最后于72℃ 下引物延伸,2min;30个循环后,于72℃下保持10min,最后于12℃保存样品,其中,D s中D代表数字,即退火的时间,s是秒的缩写。
3、电泳
电泳实验可以验证酰胺酶PCR的方法所得样品的品质。首先,取样,分别取9个反应体系所得的样品各2.5uL,加水稀释至15uL,所述稀释液的PCR样品含量为16.7%,然后上样7uL于琼脂糖凝胶,在60V电压下进行电泳实验,电泳1h。完成试验后,取下凝胶放在凝胶成像系统成像,保存结果。
进一步地,所述电泳实验的具体操作如下:
(1)安装电泳槽
将有机玻璃的电泳凝胶床洗净,晾干,用胶带将两端的开口封好,放在水平的工作台上,插上样品梳;
(2)琼脂糖凝胶的制备
称取琼脂糖0.8g溶解在100ml电泳缓冲液中,置微波炉中加热至完全溶化(无需加热至沸腾),取出摇匀;
(3)灌胶
将冷却到60℃的琼脂糖溶液轻轻倒入电泳槽水平板上;
(4)待琼脂糖胶凝固后,在电泳槽内加入电泳缓冲液,然后拔出梳子;
(5)加样
量取PCR样品2.5ul,加水12.5ul混匀,然后取7ul样品,将所述样品与加样缓冲液溴酚蓝按4:1混匀后,用微量移液器将混合液加到样品槽中,并记录样品的点样次序和加样量;
(6)电泳
安装好电极导线,点样孔一端接负极,另一端接正极,打开电源,调电压至60V,电泳1h,当溴酚蓝移到距凝胶前沿1-2cm时,停止电泳;
(7)染色和观察
取出凝胶,放在含有溴化乙锭的染色液中染色30min,即可在254nm的紫外灯下观察,有橙红色荧光条带的位置,即为DNA条带,或在紫外灯下照相记录电泳图谱。
4、实验结果分析
为使实验结果方便分析,以扩增条带依目标条带(1500bp)的清晰度(70分;记为A)、杂带扩增数量(30分;记为B)为标准评分。A分数越高表示目标条带亮度越强,越清晰;B分数越高则表示扩增条带越浅,杂带扩增数量越少。正交试验法探究酰胺酶PCR的方法的电泳图像如附图1,结合附图3所得出的评分结果列于表3。其中,所述评分方法参照的文献包括:(刘顺枝,邓剑锋,田长恩等.基因工程实验教学中PCR反应条件的正交优化[J],安徽农业科学,2012,40(24):12276-12278;)及(何正文,刘运生,陈立华等.正交设计直观分析法优化PCR条件[J],湖南医科大学学报,1998,23(4):403-404)等。
如图1所示,从右起,分别是试验号1、2、3、4、5、6、7、8、9,M是作为对照的标尺。从图1可以看出,实验序号1、2、4目的条带不清晰,因此,表3中A项评分较低;实验序号5、6、9目的条带较为清晰,因此,表3中A项评分较高,实验序号5、6、9杂带较浅或数量较少,因此,表3中评分较高;而实验序号3、7、8杂带较多且颜色亮,因此,表3中评分较低。
因此,根据以上实验数据及结果分析,即得出10 uL反应体系的较佳反应条件为DMSO 0.6uL,引物总量0.6uL,退火温度56℃,退火时间20s。将正交试验结果列于表4,
表4
需要说明的是,所述表4结合表3的数据进一步整理所得。其中,T1为该项的第一个水平的分数相加之和,T2为该项的第二个水平分数相加之和,T3为该项第三个水平分数相加之和(所述水平表如表1,所述得分表如表3)。、、分别为T1、T2、T3的平均数,比较、、即可得出不探求交互因素的情况下该因素的最佳水平,得分最高的为该水平的最好条件。因此,将各个因素的最佳水平组合,即得出本发明所提供的10 uL反应体系中的较佳反应条件为DMSO 0.6uL,引物总量0.6uL,退火温度56℃,退火时间20s。
进一步地,将本发明所述的酰胺酶PCR的方法所得的样品按照以上正交试验法的操作步骤进行电泳实验,所得出的电泳图像如图2所示。具体为,将本发明中所述样品2.5uL加水稀释至15uL,然后上样7uL于琼脂糖凝胶,在60V电压下进行电泳实验,电泳1h。参照图1和图2可以看出,本发明所述10uL反应体系所得样品的条带较图1中9个反应体系的各个正交实验的反应条件组合都亮,证明扩增效率较正交实验中各个反应条件组合都高。
进一步地,为了更好地呈现本发明所述的酰胺酶PCR的方法,进行了梯度稀释的电泳试验。具体的,将本发明所得的PCR样品按照2.5uL加水稀释至15uL,记为第一次稀释液,然后分别取第一次稀释液1、3、5、7uL再次稀释至10uL,再分别取7uL上样至琼脂糖凝胶泳道1、2、3、4,而泳道5则取第一次稀释液3uL上样,在60V电压下电泳1小时。经凝胶成像系统得到图3所示的结果。如图3所示,从右起,分别是试验号1、2、3、4、5。1000-2000bp中间的1500bp为目标条带,图3中3号的目标条带与图1中目标条带最亮的9号亮度相似,甚至更亮。图1中9号PCR样品含量为16.7%,图3中3号PCR样品含量为8.35%,两者扩增效果相似,说明本发明中经正交试验法优化后的反应条件扩增效率至少为各条件随机组合的2倍,而梯度试验结果表明按不同的梯度倍数稀释后得到的条带亮度仍和原来相似,间接说明基于正交试验法优化得出的酰胺酶PCR最佳条件有效。
现在有技术中,PCR反应最大的难题就是PCR最优条件的探索,尤其是G-C含量高的样品,难度更加大,最佳条件难以确定,耗时长而影响后续一系列实验的进行。本发明的实验小组曾对所述菌株材料的PCR最优条件进行了大量的研究探索,但花费时间漫长仍未摸索出理想的条件。现有技术中也有对此作出详细探索的报道,如(刘顺枝,邓剑锋,田长恩等.基因工程实验教学中PCR反应条件的正交优化[J].安徽农业科学,2012,40(24):12276-12278),但其数理运算过多,实验繁复,不利于实际操作;也有研究者曾探究简便的正交实验法优化PCR的方法,如(何正文,刘运生,陈立华等.正交设计直观分析法优化PCR条件[J].湖南医科大学学报,1998,23(4):403-404),但其没有对PCR结果影响更大的退火时间和退火温度进行探究。
本实验采用L9(34)正交实验法探索Salinispora arenicola菌株的最佳PCR条件,操作简便,对快速找到较佳PCR条件有相当强的可操作性,对GC碱基对含量较高的放线菌的PCR很有参考价值。本发明中的酰胺酶PCR方法的目标条带扩增量较正交实验中的各条件组合都高,证明基于正交实验探究所得的结果相当可靠。
但同时本发明的实验存在一定局限性,如不能说明各因素的交互作用,难以估计实验误差等。在探究PCR各项条件的交互关系时,可采用更大的正交试验表,更细致地设定梯度,设置重复等。但在实际实验过程中,可以通过L934正交实验,快速找到最适条件以便后续实验的开展。
综上所述,本发明所述的酰胺酶PCR的方法,具体为:在PCR反应管中加入模板DNA 0.4 uL、5*快速高保真PCR 缓冲溶液2 uL、 20*快速 PCR 增强剂0.5 uL、引物1 0.3 uL、引物2 0.3 uL、DMSO 0.6 uL、快速高保真聚合酶0.2 uL、水5.7 uL,组成10 uL反应体系,升温至95℃,保持2min,95℃ 下DNA 变性 ,保持30s,然后于56℃下退火20 s,最后于72℃ 下引物延伸,保持2min;循环30次,于72℃下保持10min,最后于12℃保存样品,进行电泳实验。本发明操作简单,可参考性强,对于快速获得较佳PCR的条件具有很强的可操作性。此外,对于G-C碱基对含量较高的放线菌的PCR条件的探究也具有较高的参考价值,且经试验验证所述酰胺酶PCR的方法能大大提高目标条带扩增量,提高目标产物的产量。
应当理解的是,本发明的应用不限于上述的举例,对本领域普通技术人员来说,可以根据上述说明加以改进或变换,所有这些改进和变换都应属于本发明所附权利要求的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!