一种多肽及其作为siRNA递送载体的应用的制作方法
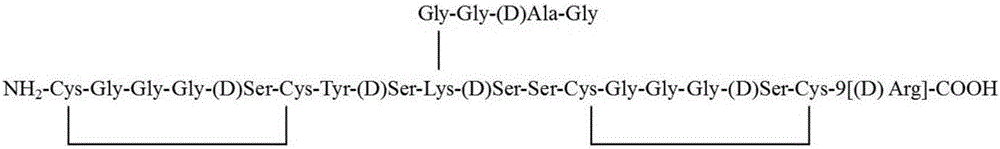
本发明涉及一种多肽及其作为siRNA递送载体的应用。
背景技术:
RNA干扰(RNAi)现象于1998年由Fire等发现,指通过沉默特定基因表达而治疗某些基因异常所致的疾病,目前已应用于基因功能、信号传导通路等基础研究领域,并具有应用于临床治疗的潜在价值。小干扰RNA(small interference RNA,siRNA)是由长的dsRNA前体被核酸酶dicer切割而得到的,能够特异性结合RNA诱导沉默复合物(RNA-induced silencing complex,RISC),之后siRNA解旋,在与RISC复合物结合的siRNA链引导下,选择性降解互补的mRNA,从而实现特异的基因沉默发挥RNAi作用。因此,RNAi作用的效率很大程度上取决于siRNA在体内向靶组织或靶细胞的成功、准确递送。
但是,siRNA在体内应用时面临许多的阻碍,尤其是通过静脉注射全身应用siRNA时的效率十分有限,这是由于siRNA在循环中易被肾小球滤过而快速清除,易被血浆中核酸酶降解;且相对分子质量较大,带有负电荷,对于靶细胞的细胞膜穿透能力有限。因此,构建靶向、特异性的siRNA递送系统对于成功实现RNAi体内应用时的最大潜能具有必不可少的作用。
目前,核酸的载体递送系统通常可被分为病毒载体和非病毒载体两大类。病毒载体是基因转染的有力工具,主要包括腺病毒、腺相关病毒、慢病毒、单纯疱疹病毒和逆转录病毒等,但由于其具有的免疫原性、潜在致癌性等缺点,限制了其在临床研究中的进一步应用。目前研究较多的非病毒载体主要包括脂质体、纳米颗粒、细胞穿膜肽(Cell Penetrating Peptides,CPP)和无机物材料等。
细胞穿膜肽(CPPs)或称为蛋白转导结构域(protein transduction domains,PTDs)是非病毒载体中受到广泛关注的一类,主要包括:穿透素(penetratin)、转运素(transportan)、反转录活化因子、N-甲基化嘌呤DNA糖基化酶、聚精氨酸、鱼精蛋白等;它包含短的氨基酸序列,可与siRNA通过静电结合或通过化学键(常用二硫键)共价结合的方式形成纳米颗粒。CPPs的主要优势在于安全性高、无免疫原性、便于大规模及标准化生产、转运效率高等。精氨酸九聚物(oligo-9-arginine,9R)属于CPPs的一类,可以直接穿过细胞膜或通过胞吞方式被摄取进入细胞,且已被实验证实具有相对高的转运效率和低的细胞毒性。由于CPPs的作用方式并不依赖于受体,因此在实际的、具体的体内应用中,靶向的配体与CPPs相结合对于将siRNA运送至特异的靶组织或靶细胞,实际发挥转运潜能至关重要。
此外,成功的基因递送需要对siRNA在体内的转运过程进行详尽、实时的监测,而放射性核素技术因其具有的高灵敏度、无创、可直观动态观测被标记物体内过程等突出优势,已使其广泛用于各类体内研究中。目前,放射性核素示踪技术仍然是唯一可被成功应用于实验室及临床中的针对整合素表达的示踪技术。
技术实现要素:
本发明的目的是提供一种多肽及其作为siRNA递送载体的应用。
本发明提供了一种多肽,命名为多肽c(RGD)2-9R,包括两个环状RGD和九聚精氨酸。
多肽c(RGD)2-9R中,其主链上包括两个环状RGD和九聚精氨酸。
所述RGD的氨基酸序列为Cys-Arg-Gly-Asp-(D)Ser-Cys或Cys-Arg-Gly-Asp-Ser-Cys。
所述环状RGD是借助所述RGD两端的Cys成环。
所述环状RGD的结构式如式(I)或式(II)所示。
所述多肽c(RGD)2-9R中,在第一个环状RGD和第二个环状RGD之间,还包括酪氨酸(Tyr)。所述酪氨酸(Tyr)的作用为标记放射性核素131I和125I。
所述多肽c(RGD)2-9R的主链上,在第一个环状RGD和第二个环状RGD之间,还包括酪氨酸(Tyr)。所述酪氨酸(Tyr)的作用为标记放射性核素131I和125I。
所述多肽c(RGD)2-9R中,在第一个环状RGD和第二个环状RGD之间,还包括丝氨酸(Ser)。所述丝氨酸(Ser)的作用为增加多肽的水溶性。
所述多肽c(RGD)2-9R的主链上,在第一个环状RGD和第二个环状RGD之间,还包括丝氨酸(Ser)。所述丝氨酸(Ser)的作用为增加多肽的水溶性。
所述多肽c(RGD)2-9R具体可如式(III)或式(IV)所示。
所述多肽c(RGD)2-9R中,还可具有侧链基团。
所述侧链基团连接于两个环状RGD和九聚精氨酸以外的氨基酸上。
所述侧链基团连接于两个环状RGD和九聚精氨酸和以上各个功能氨基酸以外的氨基酸上。
所述侧链基团具体连接于式(III)或式(IV)所示多肽的赖氨酸(Lys)上。
所述侧链具体可为甘氨酸-甘氨酸-(D)丙氨酸-甘氨酸(Gly-Gly-(D)Ala-Gly)四肽结构。所述侧链的作用为螯合放射性核素锝。
所述多肽c(RGD)2-9R具体可如式(V)或式(VI)所示。
以上任一所述多肽中,标注(D)的氨基酸为D型氨基酸,没有标注(D)的氨基酸为L型氨基酸。
本发明还保护一种具有放射性元素标记的多肽,是式(III)或式(IV)所示多肽的侧链“甘氨酸-甘氨酸-(D)丙氨酸-甘氨酸”上标记放射性核素锝得到的。
本发明还保护以上任一所述多肽的应用,为如下(a1)-(a11)中的至少一种:
(a1)作为siRNA递送载体;
(a2)作为siRNA递送载体将siRNA递送入动物的细胞、组织或个体;
(a3)作为siRNA递送载体将siRNA递送入人的细胞、组织或个体;
(a4)制备用于递送siRNA的试剂盒;
(a5)制备用于将siRNA递送入动物的细胞、组织或个体的试剂盒;
(a6)制备用于将siRNA递送入人的细胞、组织或个体的试剂盒;
(a7)制备用于沉默细胞中的特定基因的试剂盒;
(a8)制备用于沉默肿瘤细胞中与肿瘤细胞增殖相关的基因的试剂盒;
(a9)制备用于抑制肿瘤细胞增殖的试剂盒;
(a10)制备用于杀伤肿瘤细胞的试剂盒;
(a11)制备用于治疗肿瘤的试剂盒。
本发明还保护一种试剂盒,包括以上任一所述的多肽和siRNA;所述多肽和所述siRNA的摩尔比为10-15∶1。
所述多肽和所述siRNA的摩尔比具体可为10∶1。
所述多肽和所述siRNA的摩尔比具体可为12∶1。
所述多肽和所述siRNA的摩尔比具体可为15∶1。
所述试剂盒还包括放射性核素锝。
本发明还保护一种向目标物中递送siRNA的方法,包括如下步骤:将以上任一所述的多肽与所述siRNA共孵育,形成复合物;将所述复合物导入目标物中,完成所述siRNA的递送。
所述方法中,所述多肽和所述siRNA的摩尔比为10-15∶1。
所述多肽和所述siRNA的摩尔比具体可为10∶1。
所述多肽和所述siRNA的摩尔比具体可为12∶1。
所述多肽和所述siRNA的摩尔比具体可为15∶1。
所述siRNA的加入量可为200-400pmol。
所述siRNA的加入量具体可为200pmol。
所述siRNA的加入量具体可为400pmol。
所述方法中,所述孵育时间为20min。
所述方法中,所述孵育温度为室温(15-25℃)。
当所属目标物为细胞时,所述将复合物导入目标物中的方法为将复合物加入至细胞的培养液中。
本发明还保护一种产品,是将以上任一所述的多肽与siRNA共孵育得到的复合物。
根据siRNA的不同,所述产品具有不同功能。
例如siRNA的靶点为肿瘤基因时,所述产品的功能为抑制肿瘤细胞增殖或治疗癌症。
以上任一所述siRNA的靶点具体可为人端粒酶催化亚单位(human telomerase reverse transcriptase,hTERT)。
所述siRNA的正义链具体可为:5’-UUU CAU CAG CAA GUU UGG-3’。
所述siRNA的反义链具体可为:5’-UCC AAA CUU GCU GAU GAA-3’。
所述siRNA的正义链和反义链均可采用间断2’甲氧基(2’-OMe)修饰(从5’位碱基开始,间隔修饰)。所述修饰的作用为提高抗核酸酶降解能力。
所述siRNA的正义链和反义链均可在3’突出粘性末端增加脱氧胸苷。所述在3’突出粘性末端增加脱氧胸苷的作用为增加siRNA的稳定性及结合效率。
在本发明中,为了提高siRNA递送的靶向性,引入了精氨酸-甘氨酸-天冬氨酸(arginine-glycine-aspartate,RGD)多肽作为递送载体的靶向配体成分。RGD可以靶向特异性识别在多种肿瘤细胞和肿瘤新生血管内皮细胞表面都有很高表达的整合素αvβ3,整合素在肿瘤细胞转移所穿越的基底膜内皮细胞中的表达也很高,但在正常组织和成熟血管内皮细胞中则不表达或低表达。虽然RGD组分可以靶向至肿瘤细胞,但其并不能结合或递送siRNA,因此本发明将9R与环状RGD二聚体制备成螯合多肽c(RGD)2-9R,将其作为具有肿瘤靶向性的siRNA递送载体进行研究。递送的siRNA的基因靶点为人端粒酶催化亚单位(human telomerase reverse transcriptase,hTERT),其在约85%至90%的恶性肿瘤细胞及永生化细胞中可检测到高表达,是迄今所知最具特异性的肿瘤标志物之一。
本发明首次将c(RGD)2多肽与载体9R相结合,制备靶向RNA递送载体c(RGD)2-9R,并确认载体在离体及在体水平中均能具有较高的运载效率;通过使用放射性核素锝[99mTc]成功标记载体,完成了载体体内过程的非侵入性评估。
附图说明
图1为载体c(RGD)2-9R结构图。
图2为对照载体c(GGG)2-9R结构图。
图3为c(RGD)2多肽结构图。
图4为载体c(RGD)2-9R与siRNA最佳摩尔比摸索结果图。
图5为siRNA与不同载体结合情况观察结果图。
图6为载体c(RGD)2-9R与siRNA结合稳定性观察结果图。
图7为转染效率统计结果图。
图8为转染效率激光共聚焦显微镜观察结果图。
图9为Western Blot检测细胞中端粒酶表达情况结果图。
图10为放射化学纯度统计结果图。
图11为肿瘤部位的放射性摄取情况结果图。
图12为肿瘤部位放射性显像结果图。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
肝癌细胞HepG2:ATCC,货号:HB-8065。
99mTcO4-淋洗液:北京原子高科股份有限公司。
Sephadex G25层析柱:瑞典Amersham Bioscience公司。
BALB/c nu/nu裸鼠(雌性,20±3g,3-4周龄):北京大学医学部实验动物科学部。
实施例1、递送载体的制备
1、人工合成多肽c(RGD)2-9R。多肽c(RGD)2-9R的结构如图1所示。多肽c(RGD)2-9R中,Cys-Arg-Gly-Asp-(D)Ser-Cys为RGD序列,二聚体形式增加了多肽的亲和性,9[(D)Arg]为连续9个D型精氨酸,同时引入了可以标记放射性核素131I和125I的酪氨酸(Tyr)和可以增加多肽的水溶性的丝氨酸(Ser),在上述功能区以外的氨基酸残基上以侧链形式引入了甘氨酸-甘氨酸-(D)丙氨酸-甘氨酸(Gly-Gly-(D)Ala-Gly)四肽结构以螯合99mTc。
2、人工合成多肽c(GGG)2-9R,作为多肽c(RGD)2-9R的一个对照。多肽c(GGG)2-9R的结构如图2所示。
3、人工合成多肽c(RGD)2,作为多肽c(RGD)2-9R的另一个对照。多肽c(RGD)2的结构如图3所示。
上述多肽c(RGD)2-9R、多肽c(GGG)2-9R和多肽c(RGD)2如无特殊说明则使用DEPC水溶解。
实施例2、siRNA的制备
1、人工合成siRNA、FAM-siRNA和阴性对照siRNA,所述siRNA的靶点为人端粒酶催化亚单位(human telomerase reverse transcriptase,hTERT),具体信息见表1。
表1 siRNAs序列信息
表1合成的三种siRNA,正义链及反义链RNA均经过间断2’甲氧基(2’-OMe)修饰(从5’位碱基开始,间隔修饰),以提高抗核酸酶降解能力;在3’突出粘性末端增加脱氧胸苷以增加siRNA的稳定性及结合效率。
以上人工合成的siRNA、FAM-siRNA和阴性对照siRNA如无特别说明则使用DEPC水溶解。
实施例3、多肽c(RGD)2-9R作为载体运载siRNA效率的体外评估
一、载体与siRNA结合比例及稳定性分析
1、将2.5μL实施例1制备的多肽c(RGD)2-9R和2.5μL实施例2制备的siRNA(siRNA含量为20pmol)以不同摩尔比例(1∶10,1∶1,2∶1,5∶1,8∶1,10∶1,12∶1,15∶1)混合,轻微震荡后置于室温下20min。20min后将混合物样品进行2%琼脂糖凝胶电泳分析(每孔5μL样品+1μL6×loading buffer),采用紫外检测仪观察条带。采用5μLsiRNA(siRNA含量为20pmol)作为阳性对照。
结果如图4所示。多肽c(RGD)2-9R与siRNA在室温下混合后,可通过静电作用相结合,并且二者的结合为剂量依赖性。结果表明,多肽c(RGD)2-9R与siRNA的摩尔比由1∶10开始,逐渐增大的过程中,紫外检测仪观察到的游离siRNA条带亮度不断减低,至摩尔比例10∶1时,siRNA条带已完全看不到,表示此种比例下,已无游离siRNA存在。因此多肽c(RGD)2-9R与siRNA结合的最优摩尔比为10∶1。
2、制备如下样品溶液,置于室温下20min,进行2%琼脂糖凝胶电泳分析(每孔5μL样品溶液+1μL6×loading buffer),采用紫外检测仪观察条带。
溶液I:5μL siRNA样品溶液(siRNA含量为20pmol);
溶液II:将20μL实施例2制备的siRNA(siRNA含量为100pmol)与5μL脂质体(LipofectamineTM2000)混合,得到混合溶液样品;
溶液III:将2.5μL实施例1制备的多肽c(RGD)2-9R和2.5μL实施例2制备的siRNA(siRNA含量为20pmol)以摩尔比1∶10混合,得到混合溶液样品;
溶液IV:将2.5μL实施例1制备的多肽c(RGD)2-9R和2.5μL实施例2制备的siRNA(siRNA含量为20pmol)以摩尔比1∶1混合,得到混合溶液样品;
溶液V:将2.5μL实施例1制备的多肽c(RGD)2-9R和2.5μL实施例2制备的siRNA(siRNA含量为20pmol)以摩尔比10∶1混合,得到混合溶液样品;
溶液VI:将2.5μL实施例1制备的多肽c(RGD)2和2.5μL实施例2制备的siRNA(siRNA含量为20pmol)以摩尔比1∶10混合,得到混合溶液样品;
溶液VII:将2.5μL实施例1制备的多肽c(RGD)2和2.5μL实施例2制备的siRNA(siRNA含量为20pmol)以摩尔比1∶1混合,得到混合溶液样品;
溶液VIII:将2.5μL实施例1制备的多肽c(RGD)2和2.5μL实施例2制备的siRNA(siRNA含量为20pmol)以摩尔比10∶1混合,得到混合溶液样品。
结果如图5所示。结果表明,游离siRNA条带亮度最高;脂质体作为商业化生产的转染试剂,与siRNA混合时可完全包裹siRNA,因此未观察到游离siRNA存在;当不含9R结构的多肽c(RGD)2与siRNA以不同浓度混合时,游离siRNA均存在。说明多肽c(RGD)2-9R中可与siRNA结合的组分为9R,单独的多肽c(RGD)2并不能包裹siRNA。
3、将15μL实施例1制备的多肽c(RGD)2-9R和15μL实施例2制备的siRNA(siRNA含量为600pmol)以摩尔比10∶1混合,轻微震荡后置于室温下20min,得到c(RGD)2-9R/siRNA共30μL,取10μL c(RGD)2-9R/siRNA分别置于40μL DEPC水(室温)、40μL生理盐水(室温)或40μL人新鲜血清(37℃)中,分别孵育24h、48h及72h后行琼脂糖凝胶电泳分析,每个时间点取各组5μL混合液上样,采用5μLsiRNA(siRNA含量为20pmol)作为阳性对照。
结果如图6所示。c(RGD)2-9R/siRNA置于DEPC水(室温)、生理盐水(室温)及人新鲜血清(37℃)中,分别孵育24h、48h及72h后的电泳结果显示,各组均未观察到游离siRNA的存在,证实c(RGD)2-9R/siRNA具有良好的稳定性,具备应用于体内分析的条件。
二、离体细胞水平对多肽c(RGD)2-9R作为递送载体的运载效率的评估
1、将肝癌细胞HepG2接种至6孔板(每孔5×105个细胞),采用DMEM培养液(青霉素100U/mL+链霉素100μg/mL+FBS 0.1mL/mL),5%CO2,37℃静置培养24h。
2、完成步骤1后,取所述6孔板,弃掉培养基,用PBS缓冲液洗细胞一遍后加入不含青链霉素和FBS的DMEM培养液,加入转染复合物,6h后收集细胞,采用流式细胞仪分析细胞绿色荧光强度。
转染复合物:将10μL实施例1制备的多肽c(RGD)2-9R与10μL实施例2制备的FAM-siRNA(siRNA含量分别为100pmol、200pmol、400pmol、600pmol和800pmol)混合,多肽c(RGD)2-9R与FAM-siRNA的摩尔比为10∶1,轻微震荡后置于室温下20min,得到转染复合物。
结果如图7A所示。图7A中,横坐标为FAM-siRNA加入量。结果表明,转染效率在siRNA加入量为200pmol及400pmol时达到最高(大于60%),继续增大siRNA加入量时,转染效率转而下降。但当siRNA加入量由200pmol升高至400pmol时,转染效率并未显著升高,因此选定siRNA加入量200pmol为多肽c(RGD)2-9R转染的最佳siRNA加入量,也将此siRNA加入量应用于后续细胞转染实验中。
4、完成步骤1后,取所述6孔板,弃掉培养基,用PBS缓冲液洗细胞一遍后加入不含青链霉素和FBS的DMEM培养液,加入转染复合物,6h后收集细胞,采用流式细胞仪分析细胞绿色荧光强度。
转染复合物I:取10μL实施例2制备的FAM-siRNA(siRNA含量为200pmol),轻微震荡后置于室温下20min,得到转染复合物;
转染复合物II:取10μL实施例2制备的FAM-siRNA(siRNA含量为200pmol)与10μL脂质体(LipofectamineTM2000)混合,轻微震荡后置于室温下20min,得到转染复合物;
转染复合物III:取10μL实施例1制备的多肽c(GGG)2-9R和10μL实施例2制备的FAM-siRNA(siRNA含量为200pmol)以摩尔比10∶1混合,轻微震荡后置于室温下20min,得到转染复合物;
转染复合物IV:取10μL实施例1制备的多肽c(RGD)2-9R和10μL实施例2制备的FAM-siRNA(siRNA含量为200pmol)以摩尔比10∶1混合,轻微震荡后置于室温下20min,得到转染复合物。
结果如图7B所示。图7B中,1-4依次为转染复合物I-IV转染细胞后的统计结果。结果表明,当使用不同递送载体进行HepG2细胞转染时,转染效率差异表现明显。c(RGD)2-9R,c(GGG)2-9R,及LipofectamineTM2000转染siRNA的平均效率分别为61.0%±13.4%,58.6%±2.83%,91.5%±1.84%,此三组效率均明显高于无载体时的siRNA组效率(8.08%±6.45%)(P<0.05),证实载体的使用显著提高了siRNA的转染效率。
5、将步骤4收集的细胞采用DAPI染色液染核后使用激光共聚焦显微镜观察,激光共聚焦显微镜用绿色荧光和蓝色荧光波长的激发光激发后,镜下观察不同转染组HepG2细胞中绿色荧光强度和蓝色荧光强度的差异。
结果如图8所示。图8中,A为转染复合物II转染细胞后的荧光观察结果,B为转染复合物IV转染细胞后的荧光观察结果,C为转染复合物III转染细胞后的荧光观察结果,D为转染复合物I转染细胞后的荧光观察结果。结果表明,各组HepG2细胞核均显示清楚,但绿色荧光信号(FAM-siRNA)强度存在差异。最强的绿色荧光信号出现在脂质体转染组中,其次为c(RGD)2-9R及c(GGG)2-9R转染组,在无载体的FAM-siRNA组中,未观察到明显绿色荧光信号的存在,表示无载体存在时,FAM-siRNA进入细胞的能力十分有限。
三、c(RGD)2-9R递送siRNA后的端粒酶蛋白表达
1、将肝癌细胞HepG2接种至6孔板(每孔5×105个细胞),采用DMEM培养液(青霉素100U/mL+链霉素100μg/mL+FBS 0.1mL/mL),5%CO2,37℃静置培养24h。
2、完成步骤1后,取所述6孔板,弃掉培养基,用PBS缓冲液洗细胞一遍后加入不含青链霉素和FBS的DMEM培养液,加入转染复合物,72h后收集细胞。
转染复合物I:取10μL实施例2制备的siRNA(siRNA含量为200pmol),轻微震荡后置于室温下20min,得到转染复合物;
转染复合物II:取10μL实施例2制备的siRNA(siRNA含量为200pmol)与10μL脂质体(LipofectamineTM2000)混合,轻微震荡后置于室温下20min,得到转染复合物;
转染复合物III:取10μL实施例1制备的多肽c(RGD)2-9R和10μL实施例2制备的siRNA(siRNA含量为200pmol)以摩尔比10∶1混合,轻微震荡后置于室温下20min,得到转染复合物;
转染复合物IV:取10μL实施例1制备的多肽c(GGG)2-9R和10μL实施例2制备的siRNA(siRNA含量为200pmol)以摩尔比10∶1混合,轻微震荡后置于室温下20min,得到转染复合物;
转染复合物V:取10μL实施例1制备的多肽c(RGD)2-9R和10μL实施例2制备的阴性对照siRNA(siRNA含量为200pmol)以摩尔比10∶1混合,轻微震荡后置于室温下20min,得到转染复合物;
转染复合物VI:10μLPBS缓冲液。
3、取步骤2收集的细胞,Western Blot检测细胞中端粒酶(兔抗人TERT单克隆抗体,美国Sigma-Aldrich公司,1∶1000稀释)及对照内参β-actin蛋白的含量。
结果如图9所示。图9中,1-6依次为转染复合物I-VI转染细胞后的蛋白含量统计结果。结果表明,各组中内参蛋白β-actin的表达量基本一致,但端粒酶蛋白的表达量在不同转染组中存在明显的差别。端粒酶表达量最低,即实现最显著基因沉默效果的组别为脂质体转染组(亮度比0.27±0.02),其次为c(RGD)2-9R/siRNA转染组(亮度比0.45±0.05)和c(GGG)2-9R/siRNA转染组(亮度比0.47±0.01),单独应用siRNA时,端粒酶蛋白表达量抑制能力有限;使用空白PBS对照组及c(RGD)2-9R转染阴性非靶向端粒酶的阴性对照siRNA时未观察到端粒酶蛋白表达的明显抑制。实验表明使用多肽c(RGD)2-9R运载siRNA时不仅可以达到较高的转染效率,且可以成功实现蛋白水平的有效基因沉默。
实施例4、多肽c(RGD)2-9R作为递送载体运载siRNA效率的体内评估
一、递送载体的放射性标记
1、将实施例1制备的多肽c(RGD)2-9R溶解于0.5M的磷酸盐缓冲液(pH=7.4)中,得到多肽溶液(溶液中c(RGD)2-9R的含量为20μg)。
2、将酒石酸钠加至氯化亚锡盐酸溶液中(盐酸浓度为1M,氯化亚锡浓度为1g/L),使酒石酸钠的终浓度为3g/L。
3、向步骤1制备的多肽溶液中加入新鲜的99mTcO4-淋洗液(放射性剂量为37MBq),之后立即将混合溶液加至步骤2制备的氯化亚锡盐酸溶液中,多肽c(RGD)2-9R的终浓度为2μg/μL,室温下轻微震荡,反应30分钟,得到标记产物。
4、将步骤4得到的标记产物经Sephadex G25层析柱纯化,使用PBS作为洗脱剂,收集洗脱液(0.5mL/管),测定各管的放射性活度值和在260nm处的吸光度值(OD260nm),收集高峰管(放射性活度值和OD260nm值均最高的管),即为标记产物99mTc-c(RGD)2-9R。
5、采用实施例1制备的多肽c(GGG)2-9R替代多肽c(RGD)2-9R,按照步骤1-4进行操作,得到标记产物99mTc-c(GGG)2-9R。
6、采用纸层析法测定步骤4和步骤5得到的99mTc-c(RGD)2-9R和99mTc-c(GGG)2-9R的标记率及放射化学纯度。采用WhatmanlCHR层析纸色谱纸杂交滤纸(20cm×20cm)为固定相,分别采用丙酮和生理盐水为移动相。放射性核素99mTc标记的反应产物有三种:①游离锝,指未被亚锡离子还原的99mTcO4-;②水解锝,如99mTcO2;③络合锝,即为所需的标记产物99mTc-c(RGD)2-9R。前两种为放化杂质。三种99mTc标记产物在丙酮、生理盐水的双展开体系中的比移值(Rf)如下表所示。
比移值(Rf)=原点中心至色谱斑点中心的距离与原点中心至流动相前沿的距离之比。
表1三种标记产物在展开体系中的比移值
经纸层析法测定,计算标记产物99mTc-c(RGD)2-9R的平均标记率和比活度,计算方法如下:
在以丙酮为移动相的检测体系(体系1)中,99mTcO4-迁移到前沿,99mTc-c(RGD)2-9R和99mTcO2停留在原点附近。
在以生理盐水为移动相的检测体系(体系2)中,99mTcO4-和99mTc-c(RGD)2-9R一起迁移到前沿,99mTcO2停留在原点。
体系1中,99mTcO4-百分比=(前沿放射性计数-本底)/(总计数-本底)
体系2中,99mTcO2百分比=(原点放射性计数-本底)/(总计数-本底)
标记产物99mTc-c(RGD)2-9R的标记率=100%-99mTcO4-百分比-99mTcO2百分比
比活度计算为产物放射性活度与质量的比值。
标记产物99mTc-c(RGD)2-9R的平均标记率为(85.18±5.76)%,比活度可达1200kBq/mg。
7、将步骤4得到的标记产物99mTc-c(RGD)2-9R分别室温、室温下的生理盐水中和37℃人新鲜血清中,孵育0.5h、1h、2h、4h及6h后的放射化学纯度同样通过纸层析法测定。
结果如图10所示。图10中,纵坐标为放射化学纯度(%)(计算方式与标记率相同)。
横坐标为孵育时间(h)。结果表明,放射性产物99mTc-c(RGD)2-9R多肽分别置于不同条件下、经不同孵育时间后,放射化学纯度始终大于94%。
二、放射性标记99mTc-c(RGD)2-9R/siRNA体内分布研究
实验动物:BALB/c nu/nu裸鼠(雌性,20±3g,3-4周龄)。
1、取50μL步骤一制备的标记产物99mTc-c(RGD)2-9R和50μL实施例2制备的siRNA,以摩尔比10∶1混合,轻微震荡后置于室温下20min,得到99mTc-c(RGD)2-9R/siRNA。
2、取50μL步骤一制备的标记产物99mTc-c(GGG)2-9R和50μL实施例2制备的siRNA,以摩尔比10∶1混合,轻微震荡后置于室温下20min,得到99mTc-c(GGG)2-9R/siRNA。
3、向每只实验动物右前肢腋下皮下注射1×107个肝癌细胞HepG2。
4、待肿瘤长至直径约0.8cm至1.0cm时,将实验动物随机分为10组(每组5只),分组进行如下操作:
组I-组V:尾静脉370kBq步骤1制备的99mTc-c(RGD)2-9R/siRNA,分别于0.5h、1h、2h、4h和6h处死裸鼠,取其主要脏器、组织(心脏、肝脏、脾脏、肺脏、肾脏、胃壁、小肠壁、膀胱壁、股骨、肌肉、肿瘤、血液)称重并使用γ井型计数器测量其放射性计数,计算每克组织的放射性摄取率(%ID/g)及肿瘤与非肿瘤组织的放射性比值(tumor to non-tumor,T/NT)。
组VI-组X:尾静脉370kBq步骤2制备的99mTc-c(GGG)2-9R/siRNA,分别于0.5h、1h、2h、4h和6h处死裸鼠,取其主要脏器、组织(心脏、肝脏、脾脏、肺脏、肾脏、胃壁、小肠壁、膀胱壁、股骨、肌肉、肿瘤、血液)称重并使用γ井型计数器测量其放射性计数,计算每克组织的放射性摄取率(%ID/g)及肿瘤与非肿瘤组织的放射性比值(tumor to non-tumor,T/NT)。
99mTc-c(RGD)2-9R/siRNA和99mTc-c(GGG)2-9R/siRNA在各组织的放射性分布结果见表2和表3。
表299mTc-c(RGD)2-9R/siRNA在荷瘤裸鼠内的放射性分布(%ID/g)
表399mTc-c(GGG)2-9R/siRNA在荷瘤裸鼠内的放射性分布(%ID/g)
结果表明,注射99mTc-c(RGD)2-9R/siRNA后,放射性标记物主要聚积于肾、肝、脾、股骨和肿瘤,可知标记物经泌尿系统排泄。血液中放射性清除相对较慢,注射后0.5h为(2.74±0.28)%ID/g,注射后6h仍有(1.40±0.25)%ID/g。除了肿瘤部位的放射性摄取情况不同外,99mTc-c(RGD)2-9R/siRNA和99mTc-c(GGG)2-9R/siRNA在其他器官、组织的分布情况基本一致。
肿瘤部位的放射性摄取情况可见于图11。
结果表明,注射99mTc-c(GGG)2-9R/siRNA后,肿瘤组织的摄取呈现缓慢下降的过程,但肿瘤组织摄取99mTc-c(RGD)2-9R/siRNA在注射后2h逐渐升高,至6h仍能保持相对高的放射性摄取。注射后6h,99mTc-c(RGD)2-9R/siRNA在肿瘤部位的摄取明显高于99mTc-c(GGG)2-9R/siRNA(P<0.05);且此时99mTc-c(RGD)2-9R/siRNA放射性摄取在肿瘤/骨骼肌(tumor-to-muscle,T/M)的比值超过6.1,肿瘤/血液(tumor-to-blood,T/B)达1.8。
对比两组的放射性分布可知,99mTc标记的多肽c(RGD)2-9R可靶向性运载siRNA至肿瘤组织,并呈现出良好的体内生物学特性。
5、向每只实验动物右前肢腋下皮下注射1×107个肝癌细胞HepG2。
6、待肿瘤长至直径约0.8cm至1.0cm时,将实验动物随机分为10组(每组5只),分组进行如下操作:
组I:尾静脉7.4MBq步骤1制备的99mTc-c(RGD)2-9R/siRNA,分别于0.5h、4h和6h进行静态SPECT显像。显像采用平行孔、低能高分辨率准直器,采集条件为:矩阵256×256,放大系数2.0倍,采集200Kcounts计数。
组II尾静脉7.4MBq步骤2制备的99mTc-c(GGG)2-9R/siRNA,分别于0.5h、4h和6h进行静态SPECT显像。显像采用平行孔、低能高分辨率准直器,采集条件为:矩阵256×256,放大系数2.0倍,采集200Kcounts计数。
结果如图12所示。结果表明,注射99mTc-c(RGD)2-9R/siRNA后0.5h,已可见肿瘤组织轮廓,并随时间延长,肿瘤部位放射性聚积增多,至6h时,肿瘤显影清晰,轮廓清楚。而在注射99mTc-c(GGG)2-9R/siRNA后的各时刻显像中,肿瘤部位均未出现明显的放射性浓聚影。
- 还没有人留言评论。精彩留言会获得点赞!