罗非鱼源无乳链球菌重组CBP蛋白疫苗的制备方法及其应用与流程
本发明属于分子疫苗学技术领域。更具体地,涉及一种罗非鱼源无乳链球菌重组CBP蛋白疫苗的制备方法及其应用。
背景技术:
无乳链球菌(Streptococcus agalactiae)是一种人畜鱼共患革兰氏阳性菌,能引起新生儿脑膜炎、牛乳腺炎和鱼类脑膜脑炎。无乳链球菌能感染多种海水、淡水鱼类并引起死亡,给我国乃至世界水产养殖业造成重大经济损失。因此,研究无乳链球菌相关的防治技术具有很重要的现实意义。
目前,在国内已有一些与链球菌疫苗相关的专利。申请号:200580013779.X,发明名称:无乳链球菌疫苗公布了一种β溶血性无乳链球菌的完整灭活细胞和该菌培养物的浓缩提取物制备的组合疫苗通过注射和浸泡两种方式对罗非鱼抗无乳链球菌的免疫保护效果分别为80%和35%。申请号:200780025577.6,发明名称:抗链球菌的联合疫苗公布了一种联合疫苗,当难辨链球菌和海豚链球菌在疫苗制剂中的比例(基于细胞∶细胞)为20∶1或40∶1时,可得到抗难辨链球菌的64%的相对保护率和抗海豚链球菌的71%的相对保护率。申请号:201080047156.5,发明名称:链球菌组合疫苗,公布了一种组合疫苗,包含无乳链球菌生物型1血清型Ia细胞和血清型III细胞的组合疫苗提供针对罗非鱼抗无乳链球菌生物型1血清型Ia的88.9%保护率和抗罗非鱼无乳链球菌生物型1血清型III的92%的保护率。申请号:201010207289.6,发明名称:罗非鱼二联链球菌灭活疫苗的制备方法,公布了一种罗非鱼无乳链球菌和海豚链球菌等体积混合二联疫苗的制备过程。申请号:201210337267.0,发明名称:一种预防罗非鱼链球菌病的疫苗,公布了一种无乳链球菌全菌灭活疫苗通过浸泡、注射和口服免疫罗非鱼后最高分别能达到60%、90%和75%的免疫保护率。申请号:201410121138.7,申请名称:一种无乳链球菌的口服疫苗及其制备方法,构建一种表达无乳链球菌sip蛋白的重组减毒沙门氏菌,将其拌料投喂罗非鱼后最高可获得63%的抗无乳链球菌免疫保护率。
但是,以上公开使用的无乳链球菌疫苗均是单一或是二联全菌灭活疫苗,制备出的疫苗免疫效力与疫苗菌株的免疫原性直接相关,并且只对血清型一致的无乳链球菌有效,对海豚链球菌没有效果。
技术实现要素:
本发明要解决的技术问题是克服上述现有技术的缺陷和不足,提供一种罗非鱼源无乳链球菌Cbp基因编码的重组CBP蛋白,并作为重组蛋白疫苗来防治罗非鱼无乳链球菌病,能够对罗非鱼抗无乳链球菌不同血清型产生特异性的保护性。该重组蛋白疫苗的制备方法简单、制备过程安全,疫苗对罗非鱼抗无乳链球菌的免疫保护率达到56.35%±8.09%。
本发明的目的是提供一种罗非鱼源无乳链球菌重组CBP蛋白疫苗的制备方法。
本发明另一目的是提供所述罗非鱼源无乳链球菌重组CBP蛋白疫苗的应用。
本发明上述目的通过以下技术方案实现:
一种罗非鱼源无乳链球菌Cbp基因,其核苷酸序列如序列1所示。
所述的罗非鱼源无乳链球菌Cbp基因是从罗非鱼源无乳链球菌中克隆得到的。
一种罗非鱼源无乳链球菌Cbp基因编码的重组CBP蛋白,其氨基酸序列如序列2所示。
所述重组CBP蛋白是由上述罗非鱼源无乳链球菌Cbp基因编码得到。
另外,上述罗非鱼源无乳链球菌重组CBP蛋白的制备方法,包括如下步骤:
S1.利用引物对CBP-F和CBP-R,将Cbp基因克隆到原核表达系统中,得到含重组质粒pET28a-CBP的工程菌;
S2.将含重组质粒pET28a-CBP的工程菌进行扩大培养,纯化回收获得重组CBP蛋白;
其中,所述引物CBP-F的序列如序列3所示,引物CBP-R的序列如序列4所示;所述Cbp基因的序列如序列1所示。
另外,进一步优选地,步骤S1的具体方法是:
S11.克隆Cbp基因:以罗非鱼源无乳链球菌基因组DNA为模板,以引物CBP-F和CBP-R进行PCR克隆Cbp基因;
S12.构建CBP克隆菌株:将克隆的Cbp基因连接到pET28a载体,并转化E.coli DH5α感受态细胞,利用卡那青霉素筛选得到含有重组质粒pET28a-CBP的阳性CBP菌株;
S13.构建CBP表达菌株:将重组质粒pET28a-CBP转化E.coli BL21(DE3)感受态细胞,经卡那青霉素抗性筛选,挑取单菌落进行PCR鉴定,筛选出阳性克隆细胞,即为含重组质粒pET28a-CBP的工程菌。
其中,更优选地,步骤S11所述PCR反应体系为:25μl反应体系含50ng模板DNA(基因组DNA),2.5μl 10×PCR Buffer(Mg+),2μl dNTP Mixture(2.5mM),1μl CBP-F,1μl CBP-R,0.125μl rTaq(5U/μl),加灭菌蒸馏水至25μl。
更优选地,步骤S11所述PCR条件为:94℃预变性3min;然后94℃变性30s,53℃退火35s,72℃延伸2min下作用30个循环;最后72℃延伸8min;4℃保温。
更优选地,步骤S12所述连接的体系为:20μl体系内含3μl PCR产物,1μl Vector,2μl 10×Buffer,1μl Enzyme Mix A,13μl ddH2O。(注:连接体系所用载体、酶、缓冲液均来自斯丹赛生物技术公司‘如意连试剂盒’)
更优选地,步骤S12的具体方法如下:将步骤S11所述PCR的产物回收纯化后与pET28a载体连接,37℃下连接30min;将10μl连接产物转入100μl大肠杆菌DH5α感受态细胞,冰浴30min,42℃热激60s,冰浴5min;然后加入500μl LB液体培养基,37℃震荡培养45min;4000rpm离心5min,留100μl吹打沉淀菌液,将混合液加入含有50μg/ml卡那青霉素(Kan+)的LB固体培养基上,涂布均匀后在37℃培养过夜;随机挑取平板上的10个单菌落鉴定,鉴定结果为阳性的单菌落即为CBP克隆菌株。
更优选地,步骤S13的具体方法如下:将5μl质粒pET28a转入100μl大肠杆菌BL21(DE3)感受态细胞,冰浴30min,42℃热激60s,冰浴5min;然后加入500μl LB液体培养基,37℃震荡培养45min;4000rpm离心5min,留100μl吹打沉淀菌液,将混合液加入含有50μg/ml卡那青霉素(Kan+)的LB固体培养基上,涂布均匀后在37℃培养过夜;随机挑取平板上的10个单菌落鉴定,鉴定结果为阳性的单菌落即为CBP表达菌株。
进一步优选地,步骤S2的具体方法如下:
S21.将含有重组质粒pET28a-CBP的工程菌单菌落接种于含有卡那霉素的LB液体培养基中,震荡培养10h;
S22.将菌液加入含有卡那霉素的LB液体培养基中,扩大培养2h,至OD600为0.6;
S23.向菌液中加入IPTG诱导培养后,利用咪唑洗脱液纯化回收,得到纯化的重组CBP蛋白,即为所述罗非鱼源无乳链球菌重组CBP蛋白,其氨基酸序列如序列2所示。
其中,更具体优选地,步骤S2的具体方法如下:
S21.将含有重组质粒pET28a-CBP的E.coli BL21(DE3)单菌落接种于5ml含有50μg/ml卡那霉素的LB液体培养基中,37℃下200r/min震荡培养10h;
S22.将5ml菌液加入500ml含有50μg/ml卡那霉素的LB液体培养基中,1∶100扩大培养2h,至OD600约为0.6;
S23.向菌液中加入终浓度为1mmol/l的IPTG,16℃震荡培养过夜;离心收集过夜诱导的菌体,Lysis Buffer重悬,冰浴30min后超声破碎30min,离心收集上清;
S24.用Ni-NTA纯化上清液中的重组CBP蛋白,先用含有20mmol/l咪唑的洗脱液洗去杂质,再用含100mmol/l咪唑的洗脱液洗脱重组蛋白;洗脱的重组蛋白用10KDa超滤管超滤,除去洗脱液中的咪唑,得到纯化的重组CBP蛋白,即为所述罗非鱼源无乳链球菌重组CBP蛋白,其氨基酸序列如序列2所示。
另外,上述罗非鱼源无乳链球菌重组CBP蛋白在作为或制备罗非鱼源无乳链球菌重组CBP蛋白疫苗方面的应用,也在本发明的保护范围之内。
一种罗非鱼源无乳链球菌重组CBP蛋白疫苗的制备方法,是将罗非鱼源无乳链球菌重组CBP蛋白用灭菌PBS稀释至1mg/ml,与弗氏完全或不完全佐剂按1∶1混合均匀,制备成亚单位疫苗。
进一步地,取1ml制备好的疫苗,在3000×g下离心5min,疫苗无分层现象,则可用于后续免疫。
上述方法制备得到的罗非鱼源无乳链球菌重组CBP蛋白疫苗,以及所述罗非鱼源无乳链球菌重组CBP蛋白疫苗在制备防治罗非鱼无乳链球菌病的药物或制剂方面的应用,也都应在本发明的保护范围之内。
本发明具有以下有益效果:
本发明提供了一种罗非鱼源无乳链球菌重组CBP蛋白疫苗的制备方法,所得重组CBP蛋白疫苗可用于防治罗非鱼无乳链球菌病,能够对罗非鱼抗无乳链球菌不同血清型产生特异性的保护性,疫苗对罗非鱼抗无乳链球菌的免疫保护率达到56.35%±8.09%。
相比现有技术,本发明的重组CBP亚单位疫苗具有明显的优势,现有技术中对罗非鱼无乳链球菌的防治仍主要依赖传统药物,在养殖罗非鱼中新型抗无乳链球菌病疫苗的开发是近些年的研究热点,但是主要集中于全菌灭活疫苗和减毒活疫苗;这两种疫苗虽然制备方法简便,但是灭活疫苗在水产养殖动物中的使用需要大剂量、多次免疫接种,而减毒活疫苗的储藏和运输条件要求极高,有效期较短,且存在返毒危险;因此这两种疫苗均可能引起较大的毒副反应。亚单位疫苗即由具免疫活性的致病菌蛋白所制成的疫苗,本发明中的重组CBP亚单位疫苗仅含一种致病菌蛋白质,因而能消除许多无关抗原所诱发的抗体,减少疫苗带来的副反应以及因疫苗引起的其他疾病,安全性可靠。并且,与全菌灭活疫苗和减毒活疫苗相比,本发明的重组CBP疫苗不存在血清型特异性,可对抗不同血清型的无乳链球菌,适用范围更广。因此,在预防罗非鱼无乳链球菌方面具有良好的应用前景。
而且,本发明的蛋白疫苗制备方法采用原核表达系统,制备方法简单,流程简洁快速、制备过程安全、表达成本低、适于大规模生产应用。
附图说明
图1为罗非鱼源无乳链球菌Cbp基因PCR扩增产物;其中,泳道M:DL2000 Marker;泳道1:PCR扩增产物。
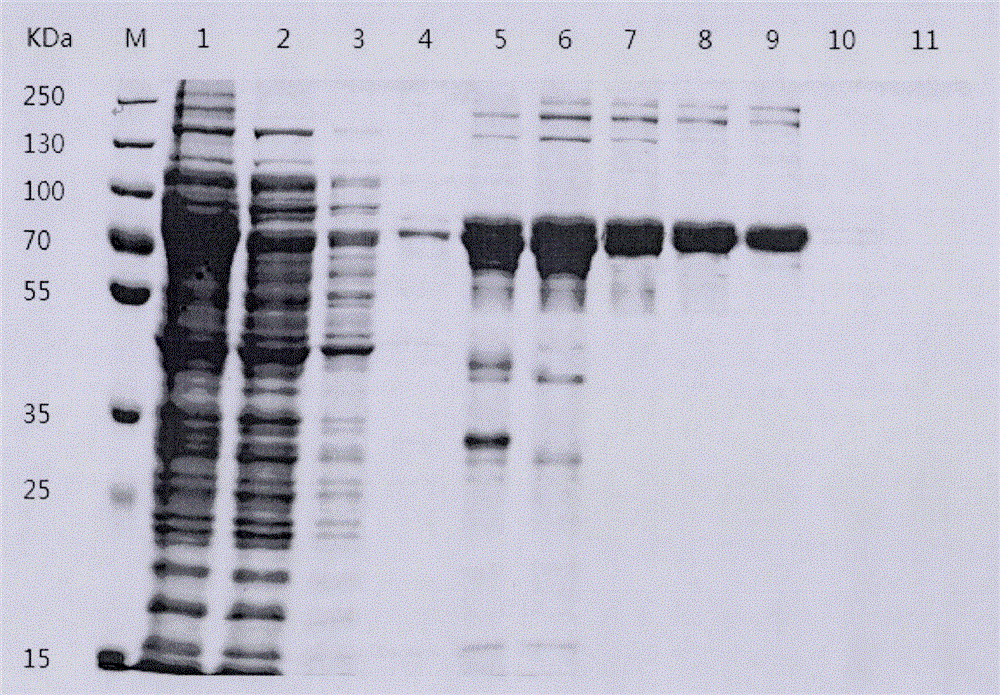
图2为罗非鱼源无乳链球菌CBP蛋白纯化SDS-PAGE图;M为蛋白Marker;Lane 1为蛋白超声液;Lane 2为流出液;Lane 3为Wash buffer的洗脱结果;Lane 4为50mM咪唑浓度的Elution buffer的洗脱结果;Lane 5-9为100mM咪唑浓度的Elution buffer的洗脱结果;Lane 10-11分别为200mM、250mM咪唑浓度的Elution buffer的洗脱结果。
图3为Western Blot检测CBP蛋白的免疫原性;M为蛋白Marker;
图4为重组CBP蛋白疫苗免疫罗非鱼后攻毒的存活曲线。横坐标为攻毒后天数;纵坐标为存活率。
图5为重组CBP蛋白Elisa检测血清抗体滴度;横坐标为初免后第2、4周的血清;纵坐标为抗体滴度,抗体滴度用产生阳性结果的最大稀释倍数表示。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均为市购。
实施例1制备罗非鱼源无乳链球菌重组CBP蛋白
1、引物设计:
以罗非鱼源无乳链球菌为模板,设计一对包含限制性内切酶的引物CBP-F和CBP-R,序列如下:
引物CBP-F(序列如序列3所示):
5’-GGGGGGTCTCTAGTGGATCAAACTACATCGGTTCAA-3’
引物CBP-R((序列如序列4所示)):
5’-GCCGGGTCTCGTGGGAATTTCAATATAGCGACGAAT-3’
2、Cbp基因克隆
(1)PCR扩增Cbp基因
提取罗非鱼源无乳链球菌基因组DNA,以基因组DNA为模板,以上述引物对CBP-F和CBP-R进行PCR反应。
PCR反应体系为:25μl反应体系含50ng模板DNA(基因组DNA),2.5μl 10×PCR Buffer(Mg+),2μl dNTP Mixture(2.5mM),1μl CBP-F,1μl CBP-R,0.125μl rTaq(5U/μl),加灭菌蒸馏水至25μl。
PCR条件为:94℃预变性3min;然后94℃变性30s,53℃退火35s,72℃延伸2min下作用30个循环;最后72℃延伸8min;4℃保温。
PCR扩增产物电泳图如附图1所示。M表示DL2000 DNA marker;1表示PCR扩增产物。
Cbp基因核苷酸序列如序列1所示。
(2)构建CBP克隆菌株
上述PCR产物回收纯化后与pET28a载体连接,37℃下连接30min。
连接体系为:20μl体系内含3μl PCR产物,1μl Vector,2μl 10×Buffer,1μl Enzyme Mix A,13μl ddH2O。(注:连接体系所用载体、酶、缓冲液均来自斯丹赛生物技术公司‘如意连试剂盒’)
将10μl连接产物转入100μl大肠杆菌DH5α感受态细胞,冰浴30min,42℃热激60s,冰浴5min;然后加入500μl LB液体培养基,37℃震荡培养45h;4000rpm离心5min,留100μl吹打沉淀菌液,将混合液加入含有50μg/ml卡那青霉素(Kan+)的LB固体培养基上,涂布均匀后在37℃培养过夜。
随机挑取平板上的10个单菌落鉴定,鉴定结果为阳性的单菌落即为CBP克隆菌株。
3、构建构建CBP表达菌株
提取CBP克隆菌株质粒,将重组质粒pET28a-CBP转化E.coli BL21(DE3)感受态细胞,经卡那青霉素抗性筛选,挑取单菌落进行PCR鉴定,筛选出阳性克隆细胞,即为含重组质粒pET28a-CBP的工程菌。
4、纯化重组CBP蛋白——重组质粒pET28a-CBP在E.coli BL21(DE3)中的表达和纯化:
(1)将含有重组质粒pET28a-CBP的E.coli BL21(DE3)单菌落接种于5ml含有50μg/ml卡那霉素的LB液体培养基中,37℃下200r/min震荡培养10h,将5ml菌液加入500ml含有50μg/ml卡那霉素的LB液体培养基中,1∶100扩大培养2h,至OD600约为0.6。向菌液中加入终浓度为1mmol/l的IPTG,16℃震荡培养过夜。离心收集过夜诱导的菌体,Lysis Buffer重悬,冰浴30min后超声破碎30min,离心收集上清。用Ni-NTA纯化上清液中的重组CBP蛋白,先用含有20mmol/l咪唑的洗脱液洗去杂质,再用含100mmol/l咪唑的洗脱液洗脱重组蛋白。洗脱的重组蛋白用10KDa超滤管超滤,除去洗脱液中的咪唑,得到纯化的重组CBP蛋白,即为所述罗非鱼源无乳链球菌重组CBP蛋白,其氨基酸序列如序列2所示。
(2)蛋白纯化结果如附图2所示。M为蛋白Marker;Lane 1为蛋白超声液;Lane 2为流出液;Lane 3为Wash buffer的洗脱结果;Lane 4为50mM咪唑浓度的Elution buffer的洗脱结果;Lane 5-9为100mM咪唑浓度的Elution buffer的洗脱结果;Lane 10-11分别为200mM、250mM咪唑浓度的Elution buffer的洗脱结果。
5、Western Blot检测
使用感染无乳链球菌THN菌株的兔血清作为一抗,检测重组蛋白CBP的免疫原性,具体操作如下:
(1)电泳结束后将分离胶割至合适的大小,放入转膜缓冲液中浸泡10min。
(2)膜处理:预先裁好与分离胶同样大小的滤纸和膜,放入转膜缓冲液中浸泡10min。
(3)转膜:在阴极电极板上从下至上依次叠放好层滤纸、膜、凝胶、层滤纸,保证其精确对齐无气泡,然后用100mA恒流转膜1h。
(4)用TBST洗膜,平稳摇动,5min×3次。
(5)加入包被液,4℃过夜。
(6)弃包被液,用TBST洗膜,5min×3次。
(7)加入一抗(稀释后的兔血清),37℃孵育3h。
(8)弃一抗,用TBST分别洗膜,平稳摇动,5min×3次。
(9)加入二抗羊抗兔(用TBS按1∶5000稀释),平稳摇动,室温孵育2h。
(10)弃二抗,用TBST分别洗膜,平稳摇动,5min×3次。
(11)DAB显色:将膜放入新鲜配制的DAB显色液中避光显色至出现条带时放入ddH2O终止反应。
结果如图3所示,在目的条带大小处有条带,证明重组蛋白CBP具有良好的免疫原性。
实施例2制备罗非鱼源无乳链球菌重组CBP蛋白疫苗
将实施例1获得的纯化的重组CBP蛋白用灭菌PBS稀释至1mg/ml,与弗氏完全及不完全佐剂按1∶1混合均匀,制备成亚单位疫苗。
取1ml制备好的疫苗,在3000×g下离心5min,疫苗无分层现象,则可用于后续免疫。
实施例3罗非鱼源无乳链球菌重组CBP蛋白疫苗免疫试验
1、免疫保护实验
(1)尼罗罗非鱼购自广州市中心沟水产养殖发展有限公司,规格为30±5.0g,实验前暂养两周。
(2)免疫实验时,将罗非鱼随机分为3组,即PBS组、PBS+佐剂组、CBP疫苗组。每组15尾,每组设三个平行。
CBP组和佐剂组分别腹腔注射100μl与弗氏佐剂等体积混合的重组抗原CBP以及PBS,PBS组注射100μl的灭菌PBS。
2、免疫程序
对罗非鱼进行两次免疫,初次免疫使用弗氏完全佐剂,加强免疫使用弗氏不完全佐剂亚单位疫苗。
初次免疫时,每尾鱼腹腔注射100μl疫苗。两周后,每尾鱼腹腔注射100μl疫苗进行加强免疫。
初免后第2和4周,每组选3尾鱼采血,室温放置2h后,4℃、8000×rpm离心10min,收集上清,分装后-80℃保存,用于免疫指标的测定。
3、免疫保护率测定
(1)加强免疫两周后,用LD50剂量进行细菌攻毒实验,每尾鱼腹腔注射100ul无乳链球菌菌液(1×108CFU/ml)。攻毒后,每天观察罗非鱼的状况,及时捞出死鱼,并记录14天内的死亡情况。连续观察14天,停止观察,实验结束。
根据下述公式计算罗非鱼的相对保护率(RPS):
RPS=(1-免疫组累积死亡率/对照组累积死亡率)×100%。
(2)攻毒后罗非鱼死亡情况如图4所示。
结果显示,初次免疫后第四周,用无乳链球菌进行攻毒。罗非鱼从攻毒后第1天开始就出现死亡,死亡主要集中在攻毒后的前3天。
此外,攻毒罗非鱼表现出一些患链球菌病的临床症状,如眼球突出且浑浊,离群独游和身体蜷曲等。
重组CBP蛋白作为抗罗非鱼无乳链球菌病疫苗用于注射免疫可获得56.35%±8.09%的免疫保护率。
4、Elisa检测抗体滴度
检测方法
(1)包被:用包被液稀释重组CBP蛋白至200μg/ml,加入96孔酶标板内,100μl/孔,4℃包被过夜。
(2)洗涤:弃去96孔中的包被液,用低盐Buffer清洗5次,3min×5次,每次250μl/孔,移液枪轻轻吹打后,用200rpm的速度缓和振荡,拍干。
(3)封闭:加入1%BSA进行封闭,250μl/孔,22℃,封闭2h。按上述条件进行洗涤,拍干。
(4)一抗反应:将采集的罗非鱼抗血清用PBS按2倍逐级稀释(如稀释倍数:2、22、23、24、25、26、27、28等),按100μl/孔加入,22℃,孵育3h。按上述条件进行洗涤,拍干。
(5)二抗反应:将鼠抗鱼IgM用PBS稀释10倍,按100μl/孔加入,22℃,孵育2h;洗涤,拍干。
(6)三抗反应:将羊抗鼠IgG-HRP标记的抗体用PBS稀释5000倍,按100μl/孔加入,22℃孵育2h;洗涤,拍干。
(7)显色:将TMB底物溶液按100μl/孔加入,室温孵育;10min后,加入反应终止液50μl/孔终止反应。
(8)读数:将此96酶标板置于酶标仪上进行读数,测定450nm处的吸光值,即OD450。
若试验组的读数大于或等于对照组的两倍,则记为阳性,否则为阴性。抗体滴度以阳性结果的最大稀释倍数表示。
结果如图5所示。免疫后血清抗体效价出现不同程度的增长,且在第四周达到峰值,为1∶8192。
- 还没有人留言评论。精彩留言会获得点赞!