一种厚藤金属硫蛋白IpMT及其编码基因的应用的制作方法
本发明属于生物基因工程领域,具体涉及厚藤金属硫蛋白IpMT(Ipomoea pes-caprae metallothionein,IpMT)及其编码基因IpMT在调控工程菌酿酒酵母镉耐受和镉积累方面的应用。
背景技术:
近年来,重金属污染已成为影响生态环境和人类健康重要因素之一,而重金属对植物(尤其是农作物)生长和品质的影响也成为制约国民经济的重要方面。在中国,以镉污染最为严重。镉是一种生物体非必需的毒性元素,一般在自然界中以非活化的化合物状态存在,含量极低,对生物体的毒性也较弱。随着人类活动对环境的干扰,具有较高生物学活性的镉被越来越多地释放到自然界中,并不同程度地积累于植物和农作物体内,危害植物的生长,并影响农作物的品质。镉也可通过食物链进入人体,从而对人体健康造成危害。
厚藤(Ipomoea pes-caprae L.)又名马鞍藤、二叶红薯、马蹄草,主要分布于热带和亚热带地区海边沙滩上及向阳的路边,是一种优良的滨海适生野生植物资源。有研究表明,在重金属污染的铅锌矿地区,野生厚藤对重金属镉的富集系数和转运系数均较高,表明厚藤对镉具有一定的富集能力,具备作为海滩重金属镉污染修复植物的基础。此外,厚藤作为一种泛热带性分布型盐生植物(halophyte),除了耐盐性强、生长迅速、地上部分生物量较大之外,还具备其他潜在的特征使其在滨海地区重金属污染植物修复方面比淡土植物(glycophyte)或超积累植物(hyperaccumulator)更具有优势。首先,盐生植物通常体内会合成一定的渗透调节剂,用来保护植物免受高盐或渗透压胁迫的伤害,而重金属毒害通常也会造成植物细胞内水平衡失衡和细胞结构紊乱,富余的植物渗透调节剂也可以通过缓解重金属胁迫引起的水分胁迫伤害,从而提高盐生植物对重金属胁迫的耐受性;其次,盐生植物体内具备较强的抗氧化体系,而这些抗氧化物质也会降低重金属引发的氧化胁迫伤害,从而提高植物对重金属毒性的耐受性;此外,盐滞土壤中的盐离子还可在一定程度上促进重金属在植物体内的转移,从而提高盐生植物对重金属的富集效率。
金属硫蛋白是生物体内广泛存在的金属结合蛋白,分子量较低,富含半胱氨酸,可以结合镉、锌、铜在内的多种重金属。同时,由于半胱氨酸残基具有较强的还原性,金属硫蛋白也是一个还原性的蛋白,能清除细胞内富余的活性氧,降低由各种逆境胁迫照成的氧化胁迫伤害。研究表明,金属硫蛋白不仅参与体内微量元素的储存、转运和代谢,拮抗电离辐射,清除自由基以及对重金属的解毒作用,还与生物体生长发育、抗病等有关。由于金属硫蛋白的这种特征,决定了该类蛋白已经在医学、环境、食品、化妆品等领域进行了开发和应用。
技术实现要素:
本发明的目的之一是提供一个厚藤金属硫蛋白IpMT,及其编码基因IpMT的应用。
本发明的所阐述的厚藤金属硫蛋白IpMT,其氨基酸序列如序列表中SEQ ID NO.1所示,其编码基因IpMT的cDNA阅读框核苷酸序列如序列表中SEQ ID NO.2所示。应当理解,考虑到密码子的简并性,在不改变氨基酸序列的前提下,对上述编码基因的核苷酸序列进行修改,也属于本发明的保护范围内。即所述IpMT基因的cDNA阅读框为如SEQ ID NO.2所示的核苷酸序列,或为与SEQ ID NO.2互补配对的核苷酸序列,或为编码序列氨基酸序列如SEQ ID NO.1的核苷酸序列。
本发明的另一目的是提供一种将上述厚藤金属硫蛋白基因IpMT应用于植物基因工程中,用于改变转基因植物对重金属镉的耐受和富集的可能性。本发明公开了厚藤金属硫蛋白基因在镉胁迫下的诱导表达特征,表明了该基因参与重金属镉胁迫的应答及解毒。本发明采用real time RT-PCR的方法鉴定了一个厚藤金属硫蛋白基因在重金属Cd胁迫下的表达特征,论证了该基因为厚藤体内应答重金属镉胁迫的重要基因,进一步延伸了该基因作为影响植物体内镉积累和胁迫的候选功能基因。
本发明的另一目的是公开一个酿酒酵母重组表达载体,该重组表达载体插入了厚藤金属硫蛋白基因IpMT。将该重组载体转化进入酿酒酵母中,能够在镉胁迫下,提高转基因酵母菌对重金属镉的耐受,并提高酵母细胞内镉积累。
本发明以厚藤幼苗为材料,提取RNA,并将RNA逆转录成cDNA,以cDNA为模板,设计以下引物分别扩增IpMT基因的cDNA全长序列,用于获取插入至酿酒酵母表达载体pYES2的cDNA阅读框片。引物如SEQ ID NO.3(IpMTYEF:5’-TACCGAGCTCGGATCCATGTCTTCCGGTTGCAAGTG-3’)和SEQ ID NO.4(IpMTYER:5’-TAGATGCATGCTCGAGCTAACAGTTGCAAGGGTCAC-3’)所示。
本发明的另一个目的是提供一种酿酒酵母工程菌株及其应用,该酿酒酵母工程菌株转化有上述的酿酒酵母重组表达载体。上述的酿酒酵母工程菌株在对环境中重金属镉污染的修复中的应用。
本发明的另一个目的是提供一种提高厚藤中重金属镉耐受性的生物制剂。
所述提高厚藤中重金属镉耐受性的生物制剂其活性成份来源于上述酿酒酵母重组表达载体或上述酿酒酵母,或其活性成份含有调控IpMT基因表达的生物制品,所述IpMT基因的cDNA阅读框为如SEQ ID NO.2所示的核苷酸序列,或为与SEQ ID NO.2互补配对的核苷酸序列,或为编码序列氨基酸序列如SEQ ID NO.1的核苷酸序列。
本发明的另一个目的是提供一种提高厚藤中重金属镉耐受性的生物制剂。
所述提高植物中重金属镉积累的生物制剂,其活性成份来源于上述酿酒酵母重组表达载体或上述酿酒酵母,或其活性成份含有调控IpMT基因表达的生物制品,所述IpMT基因的cDNA阅读框为如SEQ ID NO.2所示的核苷酸序列,或为与SEQ ID NO.2互补配对的核苷酸序列,或为编码序列氨基酸序列如SEQ ID NO.1的核苷酸序列。
所述调控植物中重金属镉耐受性或重金属镉积累的方法,该方法包括调控所述植物的IpMT基因的表达,所述IpMT基因的cDNA阅读框为如SEQ ID NO.2所示的核苷酸序列,或为与SEQ ID NO.2互补配对的核苷酸序列,或为编码序列氨基酸序列如SEQ ID NO.1的核苷酸序列。
以上PCR采用高保真的Taq酶进行扩增,并将得到的目的DNA片段进行回收,连接于酵母表达载体pYES2上(BamHI和XhoI之间),形成重组载体IpMT-pYES2,并测序。
采用醋酸锂的方法将上述厚藤金属硫蛋白重组载体转化进入酿酒酵母中,采用诱导的极限培养基(添加半乳糖)培养酵母转化子克隆,以转化pYES2空载体的酵母菌株为对照,30℃培养酵母至OD600为1.5-2,用于检测转基因酵母菌对重金属镉胁迫的耐受性以及对镉积累的变化。
在本发明中,我们公开了厚藤体内的一个金属硫蛋白基因,该基因在厚藤体内的表达对重金属镉胁迫响应。厚藤金属硫蛋白IpMT基因的表达能够提高酵母菌对重金属镉的耐受性,并影响重金属镉在酵母体内的积累,提供了将该基因应用于工程菌酿酒酵母的耐镉遗传改良的应用,也可应用于针对镉污染微生物修复工程菌的遗传改造;本发明也简单阐述了可将该基因应用于植物的遗传改造,培育用于重金属镉污染植物修复的转基因重金属超积累植物。
本发明的有益效果如下:在本发明中,我们通过逆转录PCR扩增获得的一个厚藤金属硫蛋白基因IpMT的应用性进行探索,阐述了该基因以下应用方式:(1)该金属硫蛋白基因IpMT在厚藤体内的表达具备重金属Cd诱导表达的特征,表明该基因具有镉胁迫应答的基本功能,可将该基因应用于植物(作物)针对重金属镉的遗传育种,改变植物(作物)对镉的耐受性或富集性。(2)厚藤金属硫蛋白基因IpMT在酿酒酵母中能够提高酵母对重金属镉的耐受性,可将该类基因应用于工程菌针对重金属镉的耐受性基因工程改良;(3)厚藤金属硫蛋白基因在酿酒酵母中的表达能够提高酵母细胞对重金属镉的积累,促进酵母对外界环境中镉的富集。可将该基因应用于针对重金属镉污染的微生物修复工程菌的遗传改造。
附图说明
图1示IpMT基因的cDNA阅读框序列PCR扩增电泳分析。
图2示构建完成的酿酒酵母重组表达载体IpMT-pYES2的示意图。
图3示转化IpMT-pYES2的转基因酵母突变体菌株ycflΔ对镉的耐受性提高,可以在含有0.1mM的Cd的培养基上生长。
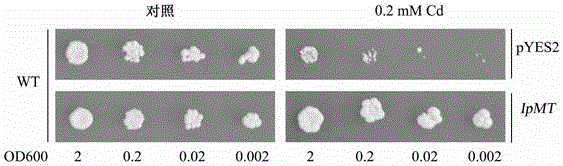
图4示转化IpMT-pYES2的转基因酵母野生型菌株WT对镉的耐受性提高,可以在含有0.2mM的Cd的培养基上正常生长。
图5示酿酒酵母重组表达载体IpMT-pYES2和空载体对照pYES2转化酵母野生型菌株WT在未添加Cd的培养基中生长曲线测定。
图6示酿酒酵母重组表达载体IpMT-pYES2和空载体对照pYES2转化酵母野生型菌株WT在添加20μM Cd的培养基中生长曲线测定。
图7示酿酒酵母重组表达载体IpMT-pYES2和空载体对照pYES2转化酵母野生型菌株WT和突变体菌株ycf1Δ后镉离子含量测定。
图8示厚藤金属硫蛋白基因IpMT在厚藤体内的表达中受到重金属镉的诱导。
具体实施方式
本发明描述了厚藤金属硫蛋白基因IpMT在生物工程方面的应用。本发明首先克隆了厚藤金属硫蛋白基因IpMT的cDNA阅读框全长。以采于惠州海滩(N22°41′24.81″,E114°44′48.02″)的幼嫩厚藤植物样品为材料,提取总RNA,逆转录成cDNA。以cDNA为模板,采用引物对IpMTYEF和IpMTYER扩增IpMT的cDNA阅读框全长,并采用In-Fusion的方法插入至酿酒酵母表达载体pYES2中。之后将这一重组载体转化进入酿酒酵母,使IPMT基因在酵母中超量表达,可以提高酵母对重金属镉的耐受性,并增加酵母对外界环境中重金属镉污染的富集。依次类推,由于该类基因来源于植物(厚藤),通过控制该金属硫蛋白基因IpMT在植物中的表达,也可将这一类基因应用于植物基因工程,用于培育耐镉的植物转基因品种,也可用来培育重金属镉超积累转基因植物,应用于环境重金属镉污染的植物修复工程。
我们以实验室萌发并培育的厚藤幼苗为材料,采用重金属Cd进行胁迫处理,采用real time RT-PCR方法分别检测IpMT基因在厚藤幼根和幼叶中的表达特征,所用的引物序列为SEQ ID NO.3(IpMTYEF:5’-TACCGAGCTCGGATCCATGTCTTCCGGTTGCAAGTG-3’)和SEQ ID NO.4(IpMTYER:5’-TAGATGCATGCTCGAGCTAACAGTTGCAAGGGTCAC-3’),采用的内参基因为厚藤肌动蛋白基因IpActin(NCBI登录号为:KU564627),其检测引物序列为SEQ ID NO.5(IpACTRTF:5’-TGGCGCTGAGAGATTTCGTT-3’)和SEQ ID NO.6(IpACTRTR:5’-GCTCATGCGATCGGCAATAC-3’)。本发明中,我们所公开的厚藤金属硫蛋白基因IpMT在厚藤植株中的表达受到重金属Cd的诱导,且在根中的诱导表达特征明显,表明该基因参与了厚藤应答重金属Cd的胁迫,具有进行烟草重金属镉解毒的基本特征,在本发明中,具有可推广应用于植物(作物)针对重金属的遗传育种的潜力。
SEQ ID NO.1
氨基酸序列
>IpMT protein
MSSGCKCGADCKCGSDCGCEEVTTTVTIIEGVAPVKLTLEGSSEKATEGGHACKCGSNCTCDPCNC
SEQ ID NO.2
cDNA阅读框核苷酸序列
>IpMT
ATGTCTTCCGGTTGCAAGTGTGGCGCCGACTGCAAGTGCGGCAGTGACTGTGGATGTGAAGAGGTGACCACCACCGTCACCATCATCGAGGGGGTTGCACCAGTGAAGTTGACCTTAGAGGGGTCTTCTGAGAAGGCTACAGAGGGAGGACATGCCTGCAAGTGTGGATCAAACTGCACCTGTGACCCTTGCAACTGTTAG
SEQ ID NO.3
RT-PCR扩增IpMT阅读框序列的上游引物核苷酸序列
>IpMTYEF
TACCGAGCTCGGATCCATGTCTTCCGGTTGCAAGTG
SEQ ID NO.4
RT-PCR扩增IpMT阅读框序列的下游引物核苷酸序列
>IpMTYER
TAGATGCATGCTCGAGCTAACAGTTGCAAGGGTCAC
SEQ ID NO.5
Real time RT-PCR检测厚藤内参基因IpActin的表达的上游引物核苷酸序列
>IpACTRTF
TGGCGCTGAGAGATTTCGTT
SEQ ID NO.6
Real time RT-PCR检测厚藤内参基因IpActin的表达的下游引物核苷酸序列
>IpACTRTR
GCTCATGCGATCGGCAATAC
为了便于理解本发明,下面将对本发明进行更全面的描述。本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明公开内容的理解更加透彻全面。
下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如Sambrook等人,分子克隆:实验室手册(New York:Cold Spring Harbor Laboratory Press,1989)中所述的条件,或按照制造厂商所建议的条件。实施例中所用到的各种常用化学试剂,均为市售产品。
除非另有定义,本发明所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不用于限制本发明。本发明所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
实施例1:厚藤金属硫蛋白IpMT基因cDNA序列的RT-PCR扩增
取采于惠州海滩(N22°41′24.81″,E114°44′48.02″)的幼嫩厚藤植物样品为材料提取总RNA,按照Magen公司HiPure Plant RNA Kits(R4151)的操作说明书提取叶片总RNA。对提取的叶片总RNA进行NanoDrop1000核酸蛋白检测仪检测浓度。
采用两步法以总RNA为模板进行逆转录反应获取cDNA第一链。cDNA单链的合成依照全式金公司TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix的说明书进行。
以厚藤叶片的cDNA单链为模板,采用高保真DNA聚合酶ProbestTM DNA Polymerase扩增厚藤金属硫蛋白IpMT基因。所采用的引物为IpMTYEF(SEQ ID NO.3)和IpMTYER(SEQ ID NO.4),PCR反应体积为50μL。PCR扩增反应体系为:10x PCR Buffer 5μL,10mM dNTP Mixture 4μL,10 μMIpMTYEF 1μL,10μM IpMTYER1μl,ProbestTM DNA Polymerase 0.5μL,cDNA模板2μL,ddH2O36.5μL。各种成分混匀后置于PCR仪上进行反应。反应程序为:94℃预变性5min;94℃变性30s、56℃退火45s、72℃延伸30s,30个循环;最后72℃延伸10min。
PCR产物通过1%的琼脂糖凝胶电泳检测,可获得单一的DNA条带(约220bp),即为PCR扩增得到的IpMT基因片段(见图1所示)。IpMT片段依照Magen公司HiPure Gel Pure DNA Kits说明书进行琼脂糖凝胶电泳回收。
实施例2:厚藤金属硫蛋白IpMT基因的酵母重组表达载体的构建
酿酒酵母表达载体pYES2经BamHI和XhoI双酶切处理,回收线性化载体。回收后IpMT的PCR片段和线性化pYES2载体经NanoDrop公司紫外分光光度计测定浓度,采用TaKaRa公司的HD Cloning Kit进行DNA片段和载体的同源重组连接。按照说明书的方法将反应产物转化大肠杆菌JM109(TaKaRa公司)感受态菌株。挑取单克隆,提取质粒,经测序鉴定为正确的阳性克隆后,保存质粒备用。经测序分析后,IpMT的cDNA阅读框核苷酸序列如SEQ ID NO.2所示,所编码的蛋白质氨基酸序列如SEQ ID NO.1所示。构建好的酿酒酵母重组表达载体IpMT-pYES2如图2所示。
实施例3:厚藤金属硫蛋白IpMT基因在酿酒酵母中的表达提高酵母对重金属镉的耐受性
培养酿酒酵母菌株WT和ycflΔ(购自欧洲酵母研究中心Euroscarf,http://web.uni-frankfurt.de/fb15/mikro/euroscarf/,菌株编号Y00000和Y04069),用pYES2质粒和重组质粒IpMT-pYES2对上述酵母进行转化。由于IpMT基因是置于酵母半乳糖诱导的启动子pGAL1调控之下(见图2所示),将IpMT-pYES2转化酿酒酵母并置于添加半乳糖的生长选择合成培养基(Synthetic Dropout Medium plus Galactose,SDG medium)上生长,即可诱导IpMT在酵母中异源超量表达。
酵母转化采用的方法为醋酸锂转化法,具体步骤如下:
1)接种待转化的酵母菌株WT和ycflΔ的单菌落于5mLYPD液体培养基中,于30℃恒温摇床(200rpm),培养过夜达到饱和。
2)按照1∶100比例转移上述培养物到20mLYPD液体培养基中于30℃恒温摇床(200rpm)继续培养,摇3-5h至菌液OD600值达0.4-0.6。
3)培养液在室温条件下4000g离心5min,收集细胞。细胞用10mL无菌超纯水重悬,再于室温下5000-6000g离心5min,沉淀细胞。
4)细胞用2mL锂盐溶液重悬,锂盐溶液按照下表配制(现配现用):
5)将2μL待转化质粒(约500ng/μL)和10μL变性鲑鱼精DNA一起加入1.5mL离心管中混匀。
6)往每个离心管中加入200μL用锂盐溶液重悬的细胞悬液,再加入1mL新鲜配制的PEG溶液。PEG溶液的配方为:
30℃摇荡温育30min。
7)于42℃热激15min,室温下离心5s,细胞沉淀用200μL-1 mL 1×TE缓冲液(从10×储液新鲜配制)重悬,并取其中200μL涂布在添加了2%半乳糖的SDG固体培养基平板上。30℃培养2-5天,直到出现转化子。
本方法中所采用的液体YPD培养基的配方为:酵母浸出物10g/L,蛋白胨20g/L,葡萄糖20g/L;所采用的液体SDG培养基的配方为:未添加氨基酸的酵母氮源(YNB,BD Difco,USA)1.7g/L,硫酸铵5g/L,半乳糖20g/L,pH6.8,组氨酸20mg/L,亮氨酸60mg/L,甲硫氨酸20mg/L。相应的固体培养基为液体培养基中添加20g/L的琼脂粉,115℃,高温高压灭菌15分钟。
挑取酵母菌株WT和ycflΔ转化空载体pYES2和IpMT基因超表达载体IpMT-pYES2的单克隆,接种于2ml添加了半乳糖的SDG液体培养基中,30℃恒温摇床(200rpm)培养至菌液OD600值达2。按照1∶1、1∶10、1∶100、1∶1000将菌液进行逐级稀释,分别吸取2μl逐级稀释的菌液滴至无添加和添加有0.1mM CdCl2的SDG固体培养基平板上。30℃培养7天,观察酵母生长情况。
如图3所示,WT示酿酒酵母野生型菌株,ycflΔ示酿酒酵母对镉敏感的突变体菌株,该菌株突变了一个镉转运蛋白(yeast cadmium factorl),体内易富集镉并产生毒性,在添加了0.1mM CdCl2的培养基上不能生长,即该菌株对镉敏感,耐受性较低。酵母菌株野生型WT作为对照,则可以在添加了0.1mM CdCl2的培养基上正常生长。很显然,超表达IpMT基因的转基因酵母(转化重组载体IpMT-pYES2)相比较于转化空载体pYES2的ycflΔ酵母突变株而言,能够在添加0.1mM CdCl2的SDG固体培养基平板上生长,而未表达IpMT基因的酵母(转化空载体pYES2)则不能生长,表明IpMT基因在酵母中的表达能够降低镉对酵母菌株ycflΔ的毒害,提高酵母突变体菌株ycflΔ对重金属镉的耐受性。
我们同样检测了IpMT基因能否提高野生型酵母菌株WT对重金属镉的耐受性。如图4所示,超表达IpMT基因的转基因酵母(转化重组载体IpMT-pYES2)相比较于转化空载体pYES2的野生型酵母菌株WT而言,能够在添加0.2mM CdCl2的SDG固体培养基平板上生长,而未表达IpMT基因的酵母(转化空载体pYES2)则生长收到抑制,表明IpMT基因在野生型酵母菌株WT中的表达能够降低镉对酵母的毒害,提高野生型酵母菌株WT对重金属镉的耐受性。
此外,我们还检测了厚藤金属硫蛋白基因IpMT在发酵瓶中对于提高酵母对重金属镉的耐受性方面的应用。将上述转化空载体pYES2的酵母野生型菌株WT和转化有厚藤金属硫蛋白基因(IpMT-pYES2)的转基因酵母菌株WT接种于2ml添加了半乳糖的SDG液体培养基中,30℃恒温摇床(200rpm)培养至菌液OD600值达0.5。此时,菌株的生长状态一致,且处于生长分裂较旺盛的时期。按照1∶100的比例将各种菌株接种于添加了半乳糖的20ml的SD液体培养基的发酵瓶中,以添加了20μM的CdCl2的发酵瓶为检测对象,而未添加CdCl2的发酵瓶作为对照。将发酵瓶置于30℃恒温摇床(200rpm)培养,分别在培养后的0小时、2小时、6小时、12小时、24小时、48小时、60小时和72小时取菌液测定其OD600的值,作为酵母菌的生长指标。如图5所示,在未添加CdCl2的发酵瓶中,2个待检的酵母株系均有一致的生长状态,且生长良好;而在添加了20μM的CdCl2的发酵瓶中,作为对照的转化有空载体pYES2的野生型酵母菌株WT生长受到一定的抑制,而转化了厚藤金属硫蛋白基因IpMT的酵母菌株(IpMT-pYES2)则可以正常生长(如图6所示),表明厚藤金属硫蛋白基因IpMT能够提高工程菌株酵母对重金属镉的耐受性。
实施例4:厚藤金属硫蛋白IpMT基因在酿酒酵母中的表达提高酵母体内镉的积累
培养酿酒酵母菌株野生型WT和ycflΔ(购自欧洲酵母研究中心Euroscarf,http://web.uni-frankfurt.de/fb15/mikro/euroscarf/,菌株编号Y00000和Y04069),采用实施例3的方法转化酵母表达载体空载体pYES2和IpMT基因超表达载体IpMT-pYES2。在超净台中用无菌牙签挑取四种酵母转化子(酵母菌株野生型WT和ycflΔ分别转化pYES2和IpMT-pYES2)到10mL添加了半乳糖的SDG液体培养基中,30℃恒温摇床(200rpm)培养至菌液OD600值达到2左右。之后将两种酵母按照1∶500的体积比接种于600ml添加了2%半乳糖的SDG液体培养基中,30℃摇床(200-250rpm)培养约12小时至OD600值达2,之后分别添加CdCl2至终浓度10μM。继续培养24小时后离心收集菌体。采用双蒸水清洗菌体3遍后,将菌体65℃干燥3-5天,干燥的酵母块进行微波消解后,采用火焰法原子吸收光谱测定酵母细胞中镉的积累。
在本发明中,转化IpMT-pYES2的两种酵母菌株(WT和ycf1Δ)在添加有10μM的CdCl2的培养基中,体内积累的镉均明显高于转化pYES2空载体的酵母菌株(见图7所示),这表明IpMT基因在酵母细胞内的表达提高了酵母对重金属镉的富集,可通过蛋白质螯合等方式促进了酵母体内镉的解毒。
实施例5:厚藤金属硫蛋白IpMT基因在厚藤体内受重金属Cd诱导表达的检测
本发明中所用的厚藤材料为本实验室萌发的厚藤小苗,种子采集于惠州海滩(N22°41′24.81″,E114°44′48.02″)。取100粒左右的饱满厚藤种子,采用40%硫酸浸泡12小时,之后用自来水清洗20遍,采用蛭石萌发厚藤种子(22℃,每天16小时光照/8小时黑暗),约一个月后长成小苗,将厚藤幼苗转移1/2MS液体培养基继续培养3天。然后用含有CdCl2(50μM)的1/2MS液体培养基处理厚藤幼苗,收集胁迫处理0h、2小时、24小时和48小时后的厚藤幼叶和幼根各0.5g,用于提取总RNA。RNA的提取依照Magen公司HiPure Plant RNA Kits(R4151)的说明书进行。采用两步法以总RNA为模板逆转录cDNA。cDNA链的合成依照全式金公司TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix的说明书进行。
通过克隆获得的IpMT基因的cDNA序列及网站NCBI(http://www.dtd.nlm.nih.gov/)在线设计real-time RT-PCR引物。用于检测IpMT基因表达模式的引物为IpMTYEF(SEQ ID NO.3)和IpMTYER(SEQ ID NO.4)。内参基因为厚藤肌动蛋白基因IpActin,引物为IpACTRTF:5’-TGGCGCTGAGAGATTTCGTT-3’(SEQ ID NO.5)和IpACTRTR:5’-GCTCATGCGATCGGCAATAC-3’(SEQ ID NO.6)。参考BIO-RAD公司iTaqTM Universal SYBR Green Supermix的说明书配制real time RT-PCR反应体系(冰上操作)。采用两步法PCR反应,扩增标准程序如下:
所有检测均采用两个生物学样本重复,每个生物学样本进行三次重复检测反应。引物第一次使用时添加程序Stage3检测溶解曲线,确认引物的特异性。
如图8所示,在镉胁迫处理下,无论在厚藤幼苗的根或者叶中,IpMT基因的表达都受到镉的强烈诱导,其最大诱导量可达到7倍。以上公开的内容表明了IpMT基因是一个重金属镉胁迫应答基因,该基因具备应用于针对重金属镉胁迫和富集的植物遗传工程改良的潜力。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
SEQUENCE LISTING
<110> 中国科学院华南植物园
<120> 一种厚藤金属硫蛋白IpMT及其编码基因的应用
<160> 6
<170> PatentIn version 3.3
<210> 1
<211> 66
<212> PRT
<213> IpMT protein
<400> 1
Met Ser Ser Gly Cys Lys Cys Gly Ala Asp Cys Lys Cys Gly Ser Asp
1 5 10 15
Cys Gly Cys Glu Glu Val Thr Thr Thr Val Thr Ile Ile Glu Gly Val
20 25 30
Ala Pro Val Lys Leu Thr Leu Glu Gly Ser Ser Glu Lys Ala Thr Glu
35 40 45
Gly Gly His Ala Cys Lys Cys Gly Ser Asn Cys Thr Cys Asp Pro Cys
50 55 60
Asn Cys
65
<210> 2
<211> 201
<212> DNA
<213> IpMT cDNA阅读框
<400> 2
atgtcttccg gttgcaagtg tggcgccgac tgcaagtgcg gcagtgactg tggatgtgaa 60
gaggtgacca ccaccgtcac catcatcgag ggggttgcac cagtgaagtt gaccttagag 120
gggtcttctg agaaggctac agagggagga catgcctgca agtgtggatc aaactgcacc 180
tgtgaccctt gcaactgtta g 201
<210> 3
<211> 36
<212> DNA
<213> 人工序列
<400> 3
taccgagctc ggatccatgt cttccggttg caagtg 36
<210> 4
<211> 36
<212> DNA
<213> 人工序列
<400> 4
tagatgcatg ctcgagctaa cagttgcaag ggtcac 36
<210> 5
<211> 20
<212> DNA
<213> 人工序列
<400> 5
tggcgctgag agatttcgtt 20
<210> 6
<211> 20
<212> DNA
<213> 人工序列
<400> 6
gctcatgcga tcggcaatac 20
- 还没有人留言评论。精彩留言会获得点赞!
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 降低种子重量的白桦AP2基因及其编码蛋白的制造方法与工艺
- 可编码ArtRD蛋白基因及其蛋白和应用的制造方法与工艺
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺