一种检测鲑鱼甲病毒的EvaGreen荧光定量PCR检测试剂盒及其应用的制作方法
本发明涉及用于病毒检测的引物和试剂盒,特别是涉及用于检测鲑鱼甲病毒的特异性的荧光定量PCR引物,本发明还涉及利用该引物和Eva Green荧光染料进行鲑鱼甲病毒检测的方法和试剂盒。本发明属于病毒检测技术领域。
背景技术:
鲑鱼甲病毒(salmonid alphavirus,SAV)隶属于披膜病毒科(Togaviridae),甲病毒属(Alphavirus),主要感染大西洋鲑(salmo salar)、虹鳟(Oncorhynchus mykiss)和褐鳟(Salmo trutta L.)等鲑科鱼类引起胰脏病、心肌炎症和昏睡等症状,致死率达1%~48%,并在水产养殖的各个阶段均有爆发。1995年Nelson等在爱尔兰首次从患胰脏病的大西洋鲑和虹鳟体内分离出该病毒,1997年Castric等又在法国从患昏睡病的大西洋鲑和虹鳟体内分离到SAV,目前该病广泛流行于英格兰、苏格兰、挪威、法国、波兰、意大利和西班牙等欧洲国家,据统计从1995年至2007年发病率逐年增加高达90%,每年由此疫病造成巨大的经济损失。2013年鲑鱼甲病毒感染被列入OIE水生动物疫病名录中。虽然,我国目前尚未有文献报道检测到该病毒,但是,随着近年我国对鲑科鱼类进口和鲑科鱼类卵引进的增加,该病传入我国的风险也日益增大。因此,我国建立SAV快速诊断和测检方法是紧迫的任务。
目前已发现六个基因型(SAV 1、SAV 2、SAV 3、SAV 4、SAV5、SAV 6)。其中,SAV 1、SAV 3、SAV 4、SAV 5、SAV 6可感染大西洋鲑引起胰腺病(Salmon pancreas disease,PD);SAV 2可感染虹鳟引起睡病(Sleeping disease,SD)。SAV病毒粒子具有囊膜,大小为65nm。单股正链RNA病毒,基因组长11-12kb,且含有两个开放阅读框(ORF)。基因组的第二个ORF编码26S子基因的mRNA,最终产生5个结构蛋白,即衣壳蛋白、E3、E2、6K、和E1共同构成了病毒的囊膜糖蛋白。E2在未成熟时,与E3相连,组成E2的前体,E3的作用相当于E2的信号肽。当E2成熟时,E2与E3分离,E2被转运到病毒粒子表面。
近年来,我国一些地方,特别是北方地区,大规模发展了冷水鱼类(如:虹鳟)养殖,且取得了巨大的经济效益。虽然我国目前尚未发现该病毒,但是随着近年我国对鲑科鱼类进口的增加,该病传入我国的风险也日益增大,因此有必要尽早建立对鲑鱼甲病毒快速灵敏的检测方法,防止该病传入我国,SAV的有效预报或者诊断是我们必须解决的问题。
核酸检测技术因具有快速、灵敏、特异性强等特点,已成为鲑鱼甲病毒的主要检测技术,广泛用于临床样品的检测和分子流行病学调查。
技术实现要素:
本发明的目的在于提供一种能够简便、快速、灵敏、特异和高效地检测鲑鱼甲病毒的Eva Green荧光定量PCR试剂盒。
本发明的另一个目的在于提供检测鲑鱼甲病毒的荧光定量PCR方法。该方法检测覆盖鲑鱼甲病毒六个基因型,是一种特异性强,准确性高、灵敏性高的检测方法。
为了实现本发明目的,本发明采用了以下技术手段:
本发明对已知鲑鱼甲病毒基因序列进行比对,筛选出鲑鱼甲病毒六个基因型的保守区序列,即E2蛋白基因中的一段保守序列(9471-9668bp)。针对该序列本发明发明人经反复筛选和验证,得到一对用于检测鲑鱼甲病毒六个不同基因型的荧光定量PCR引物,扩增片段大小为197bp(SEQ ID NO.1所示),所述引物的序列如下:
上游引物(TS1):5’-GCAACATTGCCGATCTGAGGTGTGG-3’(SEQ ID NO.2)
下游引物(TS2):5’-CGTAACATGCAACGACAGCCAGTGC-3’(SEQ ID NO.3)
进一步的,本发明还提出了一种用于检测鲑鱼甲病毒的Eva Green荧光定量PCR试剂盒,含有用于检测鲑鱼甲病毒的荧光定量PCR引物对以及Eva Green荧光定量PCR扩增缓冲液,其中所述的引物对由上游引物和下游引物组成,所述上游引物的序列如SEQ ID NO.2所示,所述下游引物的序列如SEQ ID NO.3所示。
在本发明所述的试剂盒中,优选的,所述Eva Green荧光定量PCR扩增缓冲液包括dNTPs、Mg2+、Eva Green、DNA聚合酶和RNA酶抑制剂。
在本发明所述的试剂盒中,优选的,所述Eva Green荧光定量PCR扩增缓冲液为Golden HS EVA Green qPCR Mix。
在本发明所述的试剂盒中,优选的,还包括阳性对照和阴性对照,所述的阳性对照为含有鲑鱼甲病毒E2基因的重组质粒标准品,所述的阴性对照为去离子水。
更进一步的,本发明还提出了使用本发明所述的Eva Green荧光定量PCR试剂盒检测鲑鱼甲病毒时,包括以下步骤:
(1)将待测样本匀浆,离心,取上清进行总RNA提取;
(2)以步骤(1)得到的总RNA为模板,反转录合成总cDNA,总cDNA样品保存至-80℃,备用;
(3)以步骤(2)得到的总cDNA、阳性对照品和阴性对照品分别为模板,在荧光定量PCR仪上进行PCR扩增;
(4)PCR反应结束后,记录样品的Ct值和起始DNA拷贝数。
其中,优选的,PCR扩增反应体系为:5×Golden HS EVA Green qPCR Mix 4μl,50×ROX Reference Dye 0.4μl,浓度为0.3μM的上游引物及下游引物各0.5μl,模板1μl,最后用灭菌的去离子水补至20μl。
其中,优选的,实时荧光定量PCR的反应程序为:(1)95℃预变性15min;(2)95℃变性10s、60℃退火30s,共40个循环。
其中,优选的,在检测中两种对照为有效扩增时,样本结果判断标准如下:Ct值≤40.0时样品结果为阳性;Ct值>40.0的样品结果为阴性。
再进一步的,本发明还提出了所述的Eva Green荧光定量PCR试剂盒在制备检测鲑鱼甲病毒的试剂中的应用。
其中,所述的鲑鱼甲病毒包括以下六个基因型:SAV 1、SAV 2、SAV 3、SAV 4、SAV5以及SAV 6。
相较于现有技术,本发明的有益效果是:
1、本发明参考多种鲑鱼甲病毒六个基因型毒株,基于E2基因,设计合成可以用于Eva Green荧光定量PCR检测的特异性引物;
2、本发明成功建立了Eva Green荧光定量PCR检测方法,优选采用Golden HS EVA Green为荧光试剂,成本低,定量PCR反应液配制简单,可以在宽广的定量区域内得到良好的标准曲线,对靶基因进行准确定量、定性检测,重复性好,可信度高,可适用于各荧光定量PCR扩增仪;
3、本发明定量检测方法具有较好的特异性、敏感性和重复性,可用于所有鲑鱼甲病毒六个基因型毒株的快速检测。
附图说明
图1为鲑鱼甲病毒Eva Green荧光定量PCR扩增动力学曲线;
图2为鲑鱼甲病毒Eva Green荧光定量PCR标准曲线;
图3为鲑鱼甲病毒Eva Green荧光定量PCR扩增产物溶解曲线;
图4为普通PCR方法检测本发明建立引物的灵敏性核酸电泳图;
图5为普通PCR方法检测OIE批准的用于检测鲑鱼甲病毒引物的灵敏性核酸电泳图;
图6为鲑鱼甲病毒Eva Green荧光定量PCR的特异性试验扩增动力学曲线。
具体实施方式
以下实施例进一步说明本发明的内容,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。
若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
实施例1鲑鱼甲病毒六个基因型特异性引物的设计
根据Genebank中发表的鲑鱼甲病毒(SAV)E2基因序列(JX163854),比较SAV的6个基因型不同毒株的E2基因序列,筛选出一段保守序列(9471-9668bp)。设计引物时,注意避开序列的突变点,经反复筛选和验证,得到一对用于检测鲑鱼甲病毒六个不同基因型的Eva Green荧光定量PCR引物:
上游引物(TS1):5’-GCAACATTGCCGATCTGAGGTGTGG-3’(SEQ ID NO.2)
下游引物(TS2):5’-CGTAACATGCAACGACAGCCAGTGC-3’(SEQ ID NO.3)
扩增鲑鱼甲病毒六个基因型的E2基因,片段大小为197bp,其核苷酸序列如SEQ ID NO.1所示。
实施例2检测鲑鱼甲病毒的Eva Green荧光定量PCR检测方法的建立
1、鲑鱼甲病毒E2基因重组质粒标准品的制备:
按照总RNA提取说明书提取鲑鱼甲病毒SAV 4640的总RNA,参照TOYOBO反转录试剂盒说明书进行反转录,将反转录所得cDNA用扩增鲑鱼甲病毒E2全长基因的引物进行常规PCR扩增,所述引物序列为:
上游引物序列:PF:5’-AGCTTCTTGCCGTCACCACCT-3’(SEQ ID NO.4);
下游引物序列:PR:5’-GCGGCCGCTTGGTCCACAAGTAG-3’(SEQ ID NO.5)
PCR产物经1.0%琼脂糖凝胶电泳检测,扩增E2全长为1375bp,用胶回收试剂盒回收目的产物,将回收片段与pET32a载体连接,转化感受态细胞,用质粒提取试剂盒提取质粒,由上海生工生物工程技术服务有限公司测序。将测序正确的阳性质粒命名为pET 32a-SAV E2,并作为DNA标准品,用分光光度仪测定浓度后进行10倍系列稀释,用于构建标准曲线。并根据标准质粒的浓度进行分析,根据公式计算出每微升质粒液体中含有的质粒拷贝数。
经计算得pET32a-SAV E2浓度为119ng/μl,根据得到的结果,将重组质粒进行10倍倍比稀释,得到的浓度为1.5×1010、1.5×109、1.5×108、1.5×107、1.5×106、1.5×105、1.5×104、1.5×103,1.5×102、1.5×101copies/μl的重组质粒,将其作为标准品模板。样品都设立1个阳性对照样品和阴性对照样品。阳性对照样品为上述重组质粒;阴性对照样品为去离子水。
2、Eva Green荧光定量PCR检测
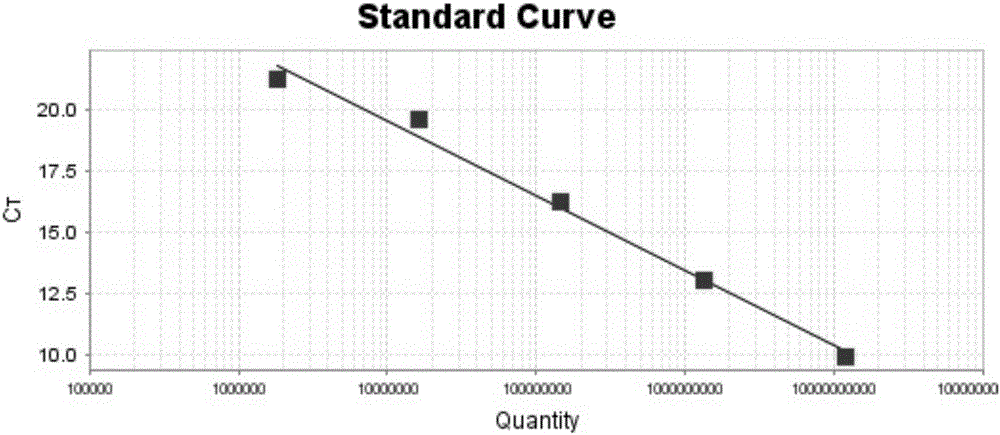
分别取浓度为1.5×1010、1.5×109、1.5×108、1.5×107、1.5×106copies/μl的重组质粒pET32a-SAV E2为模板进行Eva Green荧光定量PCR的扩增,得到扩增动力学曲线和标准曲线,如图1及图2所示,标准曲线的相关系数为0.99,斜率为-3.1,由此可看出线性关系良好。
其中PCR扩增反应体系为:5×Golden HS EVA Green qPCR Mix 4μl,50×ROX Reference Dye 0.4μl,浓度为0.3μM引物TS1、TS2各0.5μl,模板1μl,最后用灭菌的去离子水补至20μl。
PCR扩增反应程序为:
(1)95℃预变性15min;
(2)95℃变性10s、60℃退火30s,此步为一个循环,共40个循环。
当反应结束后,确认荧光定量PCR的溶解曲线,如图3所示,仅有单一套峰,引物特异性强,扩增效率最高,标准品的溶解温度都在87.2℃。
4、反应结束后,根据荧光定量PCR仪显示图片判断检测结果:
阴性样品没有扩增曲线出现,阳性样品有明显扩增曲线,且Ct值小于25。此时阴性对照和阳性对照都成立,可以对待测样品起对照作用;若待测样品扩增曲线Ct值小于或等于40,则说明样品为SAV核酸阳性;若待测样品无扩增曲线,或扩增曲线Ct值大于40,则样品为SAV核酸阴性。
实施例3鲑鱼甲病毒Eva Green荧光定量PCR检测方法的特性评价
1、灵敏度评价,即real-time PCR的最低检测限。
阳性参考DNA原液浓度为1.5×1010copies/μl。先将其10倍梯度稀释至1.5×101copies/μl,再分别以每个稀释度的溶液为模板,采用本发明实施例2建立的荧光定量PCR方法进行扩增,确定该方法最低可以检测到的模板量。根据检测结果,该荧光定量PCR方法最低可检测量为1.5×101copies/μl,说明本发明检测方法灵敏度高。
为了比较本发明建立的Eva Green荧光定量PCR引物与OIE认可的用于检测鲑鱼甲病毒普通RT-PCR引物(E2F/E2R)的灵敏性,用普通PCR检测同一模板来评价引物的最低检测限。OIE批准用于检测SAV的普通PCR引物序列为:
E2F:5’-CCGTTGCGGCCACACTGGATG-3’(SEQ ID NO.6)
E2R:5’-CCTCATAGGTGATCGACGGCAG-3’(SEQ ID NO.7)
该引物特异性扩增鲑鱼甲病毒E2基因,扩增目的片段大小为516bp。因此选用本发明建立的标准品质粒pET32a-SAV E2用灭菌的去离子水进行10倍梯度稀释,稀释质粒浓度为1.5×1010copies/μl至1.5×101copies/μl,再以每个稀释度的溶液为模板,分别用本研究建立的Eva Green荧光定量PCR引物和OIE认可的鉴定鲑鱼甲病毒引物(E2F/E2R)进行普通PCR,用去离子水作为阴性对照,检测同一模板来评价引物的最低检测限。
检测鲑鱼甲病毒的普通PCR反应体系见表1:
表1检测鲑鱼甲病毒普通PCR反应体系
本发明建立的荧光定量引物的PCR条件为:
95℃5min;94℃30s,58.8℃30s,72℃30s,共进行30个循环;72℃10m in。
引物E2F/E2R的PCR条件为:
95℃5min;94℃30s,57.5℃30s,72℃30s,共进行30个循环;72℃10m in。
将获得的PCR产物经2.5%核酸胶电泳,如图4和图5所示。图4显示本发明建立的Eva Green荧光定量所设计的引物最低质粒检出浓度为1.5×106copies/μl,扩增片段大小为197bp;E2F/E2R引物最低质粒检测浓度为1.5×107copies/μl,扩增片段大小为516bp(图5)。由此可见本发明建立的Eva Green荧光定量PCR的引物敏感性是OIE认定的鉴定鲑鱼甲病毒所用的普通PCR引物的10倍;本发明建立的荧光定量PCR方法最低可检测量为1.5×101copies/μl,其灵敏性远远高于普通PCR方法检测鲑鱼甲病毒,说明该发明检测方法灵敏度高。
2、特异度评价
利用本发明建立的EVA Green荧光定量PCR检测方法,在体系中分别加入了传染性造血器官坏死病病毒(IHNV)、传染性胰腺坏死病毒(IPNV)、鲤春病毒血症病毒(SVCV)、禽传染性法氏囊病毒(IBDV)、牛轮状病毒(BRV)、猪传染性胃肠炎病毒(TGEV)核酸作为阳性对照,同时以灭菌去离子水作为阴性对照,验证此方法的特异性。试验结果如图6显示,阳性对照及阴性对照均无S型曲线,只有以重组质粒pET32a-SAV E2为模板的PCR扩增,有S型曲线,说明具有很好的特异性。
3、重复性评价
采用构建好的阳性质粒pET32a-SAV E2模板,选取3个稀释度,分别作为模板在同等条件下进行扩增,每个稀释度做3个平行试验,计算Cq值的变异系数;同时,将上述所用样品保存,每周检查1次,连续检测2周,计算不同批次间Cq值的变异系数。结果显示批内变异系数在1%左右,批间变异系数均在1%以内,说明该方法具有较好的重复性(见下表2);
表2本发明重复性试验结果
实施例4检测鲑鱼甲病毒的临床应用及灵敏性评价
由于我国目前尚未发现鲑鱼甲病毒的感染,因此采用人工感染SAV的鱼苗作为待检病料,来评价本发明建立的检测SAV的Eva Green荧光定量PCR方法。利用SAV1(V4640)和SAV2(V4583)细胞培养病毒感染健康的虹鳟幼鱼制备病料进行检测。
按照总RNA提取说明书提取各组鱼苗组织病料的总RNA,参照TOYOBO反转录试剂盒说明书进行反转录,获得cDNA并保存至-80℃备用。为了与已发表的同样检测SAV针对E1基因设计的SYBR GreenⅠ荧光定量PCR检测方法的灵敏性进行对比,将获得的cDNA用灭菌的去离子水进行10倍比稀释,分别用这两种方法检测同一模板来评价引物的最低检测限,每组样品做三个平行。
1、采用已发表的引物分别进行SYBR GreenⅠ和EVA Green荧光定量PCR反应的体系及程序
已发表的针对E1基因设计的SYBR GreenⅠ荧光定量PCR引物序列为:
227-F:5’-GACTGGCCTCCTTACGGGG-3’(SEQ ID NO.8)
227-R:5’-TTACAACCGTGCGGTGCTGT-3’(SEQ ID NO.9)
SYBR GreenⅠ荧光定量PCR扩增反应体系为20μl,反应体系如下:
THUNDERBIRD qPCR Mix10μl,上、下游引物(0.3μM)各1μl,cDNA模板3μl,ddH2O 5μl。
PCR扩增反应程序为:
(1)95℃预变性30s;
(2)95℃变性3s、60℃退火30s,共40个循环;
EVA Green荧光定量PCR扩增反应体系为20μl,反应体系如下:
5×Golden HS EVA Green qPCR Mix 4μl,50×ROX Reference Dye 0.4μl,浓度为0.3μM引物TS1,TS2各0.5μl,模板1μl,最后用灭菌的去离子水补至20μl。
PCR扩增反应程序为:
(1)95℃预变性15min;
(2)95℃变性10s、60℃退火30s,此步为一个循环,共40个循环;
2、采用本发明的引物进行检测的体系及反应程序
引物序列分别如SEQ ID NO.2以及SEQ ID NO.3所示。
PCR扩增反应体系为20μl,反应体系如下:
5×Golden HS EVA Green qPCR Mix 4μl,50×ROX Reference Dye 0.4μl,浓度为0.3μM引物TS1,TS2各0.5μl,模板1μl,最后用灭菌的去离子水补至20μl。
PCR扩增反应程序为:
(1)95℃预变性15min;
(2)95℃变性10s、60℃退火30s,此步为一个循环,共40个循环;
试验结果如表3显示,本发明对感染SAV1(V4640)组织病料的cDNA可检测的最低稀释度为10-6,其灵敏度是已发表引物进行Eva green荧光定量检测方法的1000倍,是已发表引物进行SYBR GreenⅠ荧光定量检测方法的100倍;对感染SAV2(V4583)组织病料的cDNA可检测的最低稀释度为10-5,其灵敏度是已发表的引物用两种荧光定量检测方法的10倍。由此可见,本发明建立的针对SAV的Eva Green荧光定量PCR检测方法对于鲑鱼甲病毒临床样品的检测具有较高的灵敏性。
表3两种方法对感染SAV的临床样品检测的灵敏性比对
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
序列表
<110> 东北农业大学
<120> 一种检测鲑鱼甲病毒的Eva Green荧光定量PCR试剂盒及其应用
<160> 9
<170> PatentIn version 3.5
<210> 1
<211> 197
<212> DNA
<213> SAV
<400> 1
gcaacattgc cgatctgagg tgtggcttgc cctgggtgat actggcagcc gttaggactg 60
gctcctcaca cgtaaacgtc tgggagtcgc tggtgaaagt gacggttgcc aagtcagcgc 120
tcttgcattt cttgtcgaat ttcactgtgg taccaggtgg caccctcact gtgcactggc 180
tgtcgttgca tgttacg 197
<210> 2
<211> 25
<212> DNA
<213> 人工序列
<400> 2
gcaacattgc cgatctgagg tgtgg 25
<210> 3
<211> 25
<212> DNA
<213> 人工序列
<400> 3
cgtaacatgc aacgacagcc agtgc 25
<210> 4
<211> 21
<212> DNA
<213> 人工序列
<400> 4
agcttcttgc cgtcaccacc t 21
<210> 5
<211> 23
<212> DNA
<213> 人工序列
<400> 5
gcggccgctt ggtccacaag tag 23
<210> 6
<211> 21
<212> DNA
<213> 人工序列
<400> 6
ccgttgcggc cacactggat g 21
<210> 7
<211> 22
<212> DNA
<213> 人工序列
<400> 7
cctcataggt gatcgacggc ag 22
<210> 8
<211> 19
<212> DNA
<213> 人工序列
<400> 8
gactggcctc cttacgggg 19
<210> 9
<211> 20
<212> DNA
<213> 人工序列
<400> 9
ttacaaccgt gcggtgctgt 20
- 还没有人留言评论。精彩留言会获得点赞!
- 一种C型EV71病毒的TaqMan荧光实时定量PCR检测方法
- 一种鲤春病毒血症病毒的荧光定量pcr检测方法
- 一种利用实时荧光pcr检测偏肺病毒的方法和组合物的制作方法
- 一种病毒三重荧光定量rt-pcr检测方法及其试剂盒的制作方法
- 一种麻疹病毒一步实时荧光定量rt-pcr试剂盒的制作方法
- 一种用于检测日本乙型脑炎病毒的荧光rt-pcr试剂盒的制作方法
- 尼帕病毒和猪瘟病毒二重荧光rt-pcr检测试剂及其制备方法与用图
- 尼帕病毒和猪繁殖与呼吸综合症病毒二重荧光rt-pcr检测试剂及其制备方法与用图
- 用于辛德比斯病毒荧光rt-pcr检测的引物和lna探针及其试剂盒的制作方法
- 鸭痘病毒的实时荧光pcr检测方法及检测用引物和探针的制作方法
- 猪瘟病毒、牛病毒性腹泻病毒双重荧光定量RT‑PCR检测方法与流程
- 一种南瓜花叶病毒实时荧光RT‑PCR检测试剂盒及其方法与流程
- 鹿流行性出血病病毒实时荧光RT‑PCR检测试剂盒的制作方法与工艺
- 用于盖塔病毒实时荧光定量PCR检测体系及检测方法与流程
- 用于盖塔病毒实时荧光定量PCR检测体系及检测方法与流程
- 一种燕麦花叶病毒的实时荧光RT‑PCR检测方法、引物和探针及试剂盒与流程
- 一种检测羊边界病毒的实时荧光定量RT‑PCR试剂盒及应用的制造方法与工艺
- 检测口蹄疫病毒的荧光定量PCR试剂盒及系统的制造方法与工艺
- 五种猪腹泻病毒多重实时荧光定量PCR快速诊断试剂盒及应用的制造方法与工艺
- Sweepoviruses病毒实时荧光定量PCR检测的通用引物、探针及其检测方法与流程
- 一种鹅星状病毒实时荧光定量PCR检测的引物和探针的制作方法与工艺
- 一种葡萄斑点病毒荧光定量PCR检测的专用引物和方法与流程
- 一种樱桃病毒A荧光定量PCR检测的专用引物和方法与流程
- 猪瘟病毒、牛病毒性腹泻病毒双重荧光定量RT‑PCR检测方法与流程
- 一种南瓜花叶病毒实时荧光RT‑PCR检测试剂盒及其方法与流程
- 检测禽呼肠孤病毒的通用PCR引物及其检测试剂盒的制作方法与工艺
- 鹿流行性出血病病毒实时荧光RT‑PCR检测试剂盒的制作方法与工艺
- 用于盖塔病毒实时荧光定量PCR检测体系及检测方法与流程
- 用于盖塔病毒实时荧光定量PCR检测体系及检测方法与流程
- 一种用于绝对定量检测猪繁殖与呼吸综合征病毒的ddPCR方法、引物及其应用和试剂盒与流程