用于检测miR‑874‑3p表达的引物、试剂盒、检测方法及应用与流程
本发明涉及一种用于检测miR-874-3p表达的引物,同时还涉及包含该引物的试剂盒和检测方法,以及miR-874-3p在制备拮抗肿瘤耐长春新碱的药物中的应用,属于肿瘤生物治疗技术领域。
背景技术:
结直肠癌是最常见的消化道恶性肿瘤之一,发生于结肠部位,好发于直肠与乙状结肠交界处。结直肠癌以40~50岁年龄组的发病率最高,男女之比为2~3:1。在西方发达国家,结直肠癌的发病率居第3位。在我国,结直肠癌的发病率居第4位,且发病率和致死率呈逐年递增的趋势。临床数据表明,结直肠癌的转移率高、早期诊断率低,手术切除后易复发是造成结直肠癌致死率高的主要原因。
彻底切除结直肠癌是最有效的治疗方法,术后化疗在延长病人生存和改善生活质量方面有着重要作用。长春新碱(vincristine,VCR)是目前应用广泛的抗肿瘤化疗药物,用于结肠癌的临床治疗,但是长期治疗会使肿瘤细胞产生耐药性,导致化学治疗失败。数据显示,90%的癌症患者死亡与肿瘤的耐药性相关。
技术实现要素:
本发明的目的是提供一种用于检测miR-874-3p表达的引物。
其次,本发明提供一种包含上述引物的试剂盒。
次之,本发明提供一种检测miR-874-3p表达的方法。
再次,本发明提供一种上述引物、试剂盒的应用。
同时,本发明提供一种miR-874-3p在制备拮抗肿瘤细胞耐药性药物中的应用。
最后,本发明提供一种用于治疗肿瘤的药物组合物。
为了实现以上目的,本发明所采用的技术方案是:
用于检测miR-874-3p表达的引物,根据miR-874-3p序列(如SEQ ID NO:1所示)设计合成,包括逆转录引物和荧光定量PCR引物。逆转录引物如SEQ ID NO:2、3或4所示。荧光定量PCR引物中正向引物如SEQ ID NO:5或6所示,反向引物如SEQ ID NO:7所示。
所述肿瘤为结直肠癌,产生耐药性的药物为长春新碱。
用于检测miR-874-3p表达的试剂盒,包括上述引物以及通用的miRNA逆转录试剂(包含逆转录酶和dNTPmix)、荧光定量聚合酶链反应试剂(包含荧光染料、Taq DNA聚合酶和dNTPmix)。
所述试剂盒还可以包括DNA消化试剂(包含DNase I,RNase-free)以及内参的逆转录引物和荧光定量PCR引物。当内参采用U6 snRNA管家基因时,内参的逆转录引物如SEQ ID NO:10所示,内参的荧光定量PCR的正、反向引物分别如SEQ ID NO:8、9所示。
检测miR-874-3p表达的方法,包括以下步骤:
1)以细胞总RNA为模板,逆转录得到cDNA;
2)以cDNA为模板进行荧光定量PCR扩增,检测miR-874-3p的表达量;
步骤1)中逆转录的引物包括miR-874-3p的逆转录引物和内参的逆转录引物,miR-874-3p的逆转录引物如SEQ ID NO:2、3或4所示;
步骤2)中荧光定量PCR扩增的引物包括miR-874-3p的荧光定量PCR引物和内参的荧光定量PCR引物,miR-874-3p的荧光定量PCR引物中正向引物如SEQ ID NO:5或6所示,反向引物如SEQ ID NO:7所示。
步骤1)中逆转录的反应体系为:5×RT buffer(250mM Tris-HCl(pH 8.3)、375mM KCl、15mM MgCl2、50mM DTT)4μL,200U/μL逆转录酶1μL,10μM miR-874-3p的逆转录引物0.5μL,dNTP(2.5mM each)2.5μL,10μM内参的逆转录引物0.5μL,1.0μg/μL RNA 1μL,无RNA酶水补足至20μL。
步骤1)中逆转录的反应条件为:16℃30min,42℃30min,85℃灭活逆转录酶5min;反应结束后将其放在冰上待用或-20℃保存。
步骤2)中荧光定量PCR扩增的反应体系为:dNTP(2.5mM each)2.5μL,2×SYBR Green PCR Master Mix(购自ABI公司)10μL,1.0μg/μL cDNA 1μL,10μM miR-874-3p的正、反向引物各0.5μL,10μM内参的正、反向引物各0.5μL,双蒸水补足至20μL。
步骤2)中荧光定量PCR扩增的反应条件为:95℃变性5min,40个循环(95℃15s,60℃15s,72℃20s),95℃15s,60℃30s,95℃15s。
步骤2)中检测miR-874-3p的表达量以U6 snRNA管家基因作为内参,采用相对定量法。内参U6 snRNA的逆转录引物如SEQ ID NO:10所示,荧光定量PCR扩增的正、反向引物分别如SEQ ID NO:8、9所示。
上述引物、试剂盒在判断肿瘤细胞对长春新碱耐药性方面的应用。
上述引物、试剂盒在筛选拮抗肿瘤细胞对长春新碱耐药性药物中的应用。
miR-874-3p在制备拮抗肿瘤细胞耐药性药物中的应用。具体为:参照miR-874-3p序列设计合成miR-874-3p抑制物,以治疗有效量的miR-874-3p抑制物和药用辅料为原料制备拮抗肿瘤细胞耐药性的药物。
用于治疗肿瘤的药物组合物,包括治疗有效量的miR-874-3p抑制物和治疗有效量的长春新碱。
本发明的有益效果:
本发明通过试验证实microRNA分子miR-874-3p与长春新碱的耐药性相关,miR-874-3p在长春新碱耐药细胞中高表达、敏感细胞中低表达,因此可以作为肿瘤细胞长春新碱耐药的标志物。根据该标志物设计的引物、试剂盒及检测方法可用于临床判断肿瘤细胞对长春新碱的耐药性,进一步指导临床用药并实现精准治疗,提高疗效,降低副作用。本发明为设计肿瘤细胞长春新碱耐药药物提供了新的靶点,可用于直接开发拮抗肿瘤细胞长春新碱耐药性的药物。又由于miR-874-3p抑制物具有降低肿瘤细胞耐药的生物学功能,将其与治疗有效量的长春新碱联合使用,可以提高癌症的化疗效果,为有效逆转肿瘤细胞长春新碱耐药以及提高肿瘤细胞的临床化疗效果提供有效途径。
附图说明
图1为结肠癌细胞原代消化后在VCR下的细胞存活率;
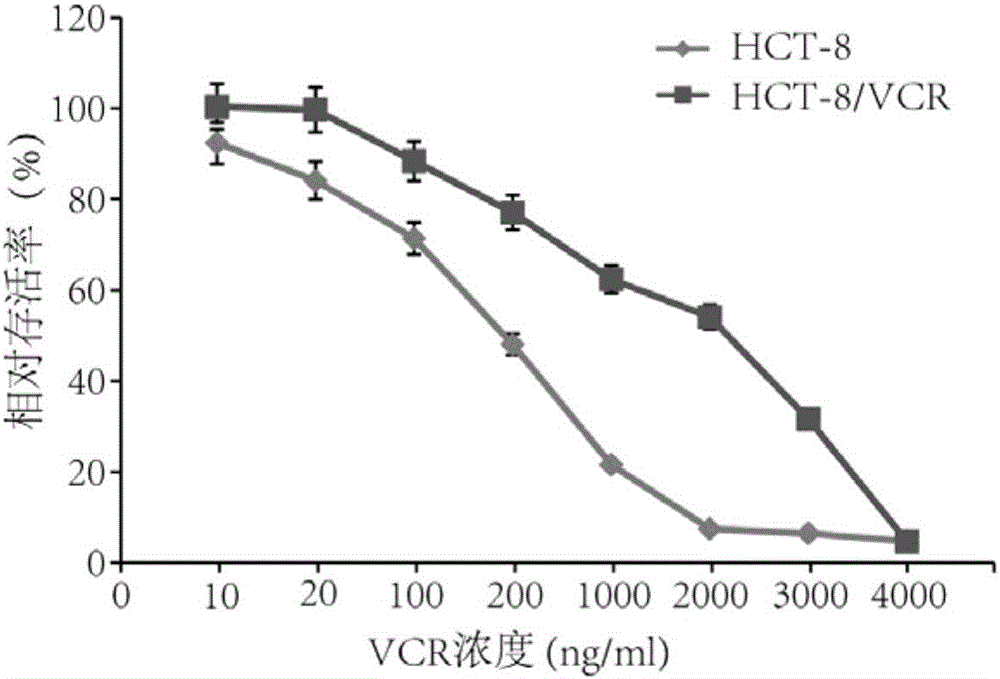
图2为结肠癌细胞HCT-8及HCT-8/VCR在不同VCR浓度下的相对存活率;
图3为HCT-8、HCT-8/VCR细胞中hsa-miR-874-3p的表达水平;
图4为HCT-8细胞转染hsa-miR-874-3p模拟物(minics)后对长春新碱的耐药能力;
图5为HCT-8/VCR细胞转染has-miR-874-3p抑制物(inhibitor)后对长春新碱的耐药能力。
具体实施方式
下述实施例仅对本发明作进一步详细说明,但不构成对本发明的任何限制。
实施例1
用于检测miR-874-3p表达的引物,根据miR-874-3p序列(如SEQ ID NO:1所示)设计合成,包括逆转录引物和荧光定量PCR引物,逆转录引物如SEQ ID NO:2、3或4所示,荧光定量PCR引物中正向引物如SEQ ID NO:5或6所示,反向引物如SEQ ID NO:7所示。
实施例2
用于检测miR-874-3p表达的试剂盒,包括实施例1中引物以及内参U6 snRNA的逆转录引物(如SEQ ID NO:10所示)和荧光定量PCR引物(正、反向引物如SEQ ID NO:8、9所示),还包括通用的DNA消化试剂(DNase I(RNase-free)、EDPC等)、miRNA逆转录试剂(逆转录酶、5×RT buffer、dNTP等)和荧光定量聚合酶链反应试剂(dNTP、2×SYBR Green PCR Master Mix等)。
实施例3
检测miR-874-3p表达的方法,包括以下步骤:
1)引物设计
根据miRBase数据库(http://www.mirbase.org)中hsa-miR-874-3p的成熟序列(No:MIMAT0004911)设计引物;
hsa-miR-874-3p:5′-CUGCCCUGGCCCGAGGGACCGA-3′;
逆转录引物:
逆转录引物1:5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCTCGGTCCC-3′;
逆转录引物2:5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCTCGGTCC-3′;
逆转录引物3:5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCTCGGTC-3′;
荧光定量PCR引物:
正向引物1:5′-ACACTCCAGCTGGGCTGCCCTGGCCCGAGGG-3′;
正向引物2:5′-ACACTCCAGCTGGGCTGCCCTGGCCCGAGG-3′;
反向引物:5′-CTCAACTGGTGTCGTGGAGT-3′;
根据NCBI数据库(https://www.ncbi.nlm.nih.gov/)中U6 snRNA管家基因(Genbank:NR_004394.1)设计如下引物:
U6 snRNA的逆转录引物:5′-CGCTTCACGAATTTGCGTGTCAT-3′;
U6 snRNA的荧光定量PCR引物:
U6正向引物:5′-CTCGCTTCGGCAGCACA-3′;
U6反向引物:5′-AACGCTTCACGAATTTGCGT-3′;
2)结肠癌组织细胞的制备
选取新乡某医院收治的20例结肠癌患者的结肠癌组织,病理分型确定,未经任何化疗;选取的结肠癌组织应尽可能避免纤维结缔组织或坏死的瘤组织,并立刻放到液氮中;在超净工作台上去除纤维结缔组织或坏死的瘤组织,用10mL PBS清洗组织3遍,吸弃上清液,将结肠癌组织切成1.5mm3小块(1~2mm3均可),用10mL PBS轻悬组织块,吸弃上清液;加入10mL预温到37℃的0.1%胶原酶溶液,37℃消化45min(30~60min均可),直至完全消化;终止消化,用100目筛网过滤,滤液500g离心9min(8~10min均可),弃上清;用10mL PBS轻轻吹打,悬浮沉淀,滤液500g离心9min(8~10min均可),弃上清;重复一次;用2.5mL RMPI-1640培养基轻轻吹打(2~3mL均可),悬起沉淀,调整细胞浓度5×105~1×106/mL;
3)MTT琼脂法体外药敏实验
将5mL预温到37℃的2×RMPI-1640培养基与5mL 1.5%高压灭菌后冷却到50℃的琼脂混匀,混匀后加入到96孔板中(每孔100μL),室温静置30min备用;按照100μL细胞悬液加入150ng/mL浓度的长春新碱,接种于96孔板中,每种药物浓度三复孔,设立背景对照组(不含细胞的等体积培养液),空白对照组加入不含VCR的培养液;37℃、5%CO2培养72小时后,MTT测细胞活性;96孔板中,每孔加入20μL 5mg/mL的MTT溶液,37℃孵育4h;每孔加入100μL含10%SDS的PBS,60℃孵育30min;560nm波长处测定OD值;计算背景组平均值,并以此平均值为零点进行调零,计算各组细胞的存活率;
细胞存活率/%=(试验组平均OD值-背景组平均OD值)/(空白对照组平均OD值-背景组平均OD值)×100%;
以150ng/mL浓度的长春新碱处理20例原代培养的结肠癌细胞,按照存活率小于40%作为敏感,大于70%作为耐药的判断指标,介于30~60%的不做进一步分析;结果表明,在20例原代培养的结肠癌细胞中,有14例判断为敏感或耐药的标本,其中8例样本是对VCR耐药的,6例是敏感的(见图1);
4)提取RNA
选取14例上述敏感或耐药的结肠癌原代细胞(5~10×106个/mL,见下表1),离心,弃上清;用移液管加入1mL提前预冷的Trizol试剂,反复吹打裂解细胞至均一透亮;将匀浆样品在冰上放置5分钟,保证细胞充分裂解;加入200μL氯仿,剧烈涡旋30秒后,室温静置5分钟;4℃、12000×g离心15分钟;小心转移上清至1.5mL RNase-free离心管中,加入等体积异丙醇混匀;4℃、12000×g离心15分钟,弃上清;加入750μL 75%乙醇,4℃、12000×g离心5分钟,弃上清;乙醇风干后,加入45μL DEPC处理水,室温静置2分钟溶解RNA;变性电泳检测后测定浓度为1.8μg/μL,待用(或-80℃保存);
提取过程在冰上操作,以防止RNA降解;全程佩戴一次性手套;采用无RNA酶的非一次性玻璃器皿或塑料器皿,玻璃器皿可在150℃烘箱中烘烤4小时,塑料器皿可在0.5M NaOH溶液中浸泡10分钟,用水彻底漂洗干净后高压灭菌备用;
5)DNase I处理
配制10μL DNase I处理体系:RNA(1.8μg/μL)1μg,10×Buffer(400mM Tris-HCl(pH7.5)、80mM MgCl2、50mM DTT)1μL,70U/μL(60~80U/μL均可)DNase I(RNase-free)1μL,0.1%DEPC处理水补足至10μL;
处理条件为:37℃水浴30min,65℃水浴10min灭活DNase I;
6)逆转录
配制20μL逆转录反应体系:5×RT buffer(250mM Tris-HCl(pH 8.3)、375mM KCl、15mM MgCl2、50mM DTT)4μL,200U/μL逆转录酶1μL,10μM miR-874-3p的逆转录引物1 0.5μL,10μM U6 snRNA的逆转录引物0.5μL,dNTP(2.5mM each)2.5μL,RNA(1.0μg/μL)1μL,无RNA酶水补足至20μL;
反应条件为:16℃30min,42℃30min,85℃灭活逆转录酶5min;反应结束后将其放在冰上待用或-20℃保存;
7)Real-time PCR
配制20μL荧光定量PCR反应体系:2×SYBR Green PCR Master Mix(购自ABI公司)10μL,1.0μg/μL cDNA 1μL,10μM miR-874-3p的正向引物1和反向引物各0.5μL,dNTP(2.5mM each)2.5μL,10μM U6 snRNA的正、反向引物各0.5μL,双蒸水补足至20μL;
反应条件为:95℃变性5min,40个循环(95℃15s,60℃15s,72℃20s),95℃15s,60℃30s,95℃15s;
8)hsa-miR-874-3p表达量统计分析
采用相对定量法,计算基因的表达量F,公式如下:
F=2—△△ct;
式中,△△ct=(待测样本中目的基因的ct的平均值-待测样本中管家基因的ct的平均值)-(对照样本中目的基因的ct的平均值-对照样本中管家基因的ct的平均值);选取上述2号对VCR敏感的标本hsa-miR-874-3p的表达水平作为对照,设置为1,其他各样板相对2号样本的比值作为hsa-miR-874-3p作为表达水平;
结果表明,hsa-miR-874-3p在VCR耐药的细胞中的表达上调,表达量比敏感细胞样本明显上调(见下表1)。
表1原代结肠癌细胞耐药性及hsa-miR-874-3p的相对表达水平
实施例4
miR-874-3p在制备拮抗肿瘤细胞耐药性药物中的应用,具体为:采用常规方法合成miR-874-3p的反义寡核苷酸序列作为miR-874-3p抑制物,以治疗有效量的miR-874-3p抑制物和药用辅料为原料制备片剂。
实施例5
用于治疗肿瘤的药物组合物,由治疗有效量的长春新碱、miR-874-3p抑制物和药用辅料组成,miR-874-3p抑制物由上海吉满生物科技公司合成。
试验例1
长春新碱在结肠癌的治疗过程中发挥着重要作用,但出现的耐药现象是限制其临床疗效的主要原因。明确miR-874-3p在结肠癌细胞长春新碱耐药中的生物学功能和机制,能够为有效提高结肠癌的临床疗效提供新的生物靶标。
1、miR-874-3p在长春新碱耐药细胞和敏感细胞中的表达
1)构建长春新碱耐药细胞系HCT-8/VCR
采用逐步增加VCR浓度的方法建立结肠癌细胞系HCT-8/VCR:将敏感细胞HCT-8培养于含VCR的培养液中,初始浓度为5ng/mL,此后逐渐增加药物浓度,分别为10ng/mL、20ng/mL、100ng/mL、200ng/mL、1000ng/mL、2000ng/mL、3000ng/mL和4000ng/mL;在每个浓度获得耐药性后,以极限稀释法克隆生长良好的细胞,然后进入下一个浓度的培养,最后HCT-8在2000ng/mL的VCR中持续培养20代以上,于试验前1周停用VCR。
2)细胞对VCR的药敏性测试(MTT法)
分别取对数生长期的耐药株和敏感株细胞,通过培养基稀释法用计数板计数细胞密度为1×105个/mL;以1×104个/孔接种96孔细胞培养板,设立背景对照组(不含细胞的等体积培养液),空白对照组加入不含VCR的培养液,试验组分别加入含10ng/mL、20ng/mL、100ng/mL、200ng/mL、1000ng/mL、2000ng/mL、3000ng/mL、4000ng/mL的长春新碱培养液,100μl/孔。
各组细胞于37℃下温育培养48小时,每孔加入5mg/mL MTT溶液20μL,继续放入37℃细胞培养箱中温育4小时;然后用移液器吸弃培养上清液,每孔加入DMSO 150μL,充分振荡后,将培养板放入酶联免疫检测仪中,设定检测波长为570nm,读取各孔的吸光度值(OD)。
计算背景组平均值,并以此平均值为零点进行调零,计算各组细胞的存活率,然后计算50%细胞存活时的药物浓度,即半数抑制浓度IC50。
细胞存活率/%=(试验组平均OD值-背景组平均OD值)/(空白对照组平均OD值-背景组平均OD值)×100%。
使用不同浓度的VCR处理结肠癌细胞HCT-8及HCT-8/VCR,抑制率见图2。HCT-8细胞和HCT-8/VCR细胞的半抑制浓度IC50分别为140.265和2350.469。
3)检测HCT-8、HCT-8/VCR细胞中hsa-miR-874-3p的表达量
操作同实施例3中步骤2)~6);
结果显示,与HCT-8细胞相比,hsa-miR-874-3p在HCT-8/VCR细胞中的表达上调,表达量比HCT-8细胞上调4.563倍,差异具有统计学意义(P<0.01),如图3所示。
2、细胞增殖-毒性试验检测HCT-8细胞转染hsa-miR-874-3p模拟物后的耐药特性
将生长活跃的HCT-8细胞悬液于转染前一天接种到12孔板中;第二天,转染hsa-miR-874-3p模拟物(25nM),8小时后消化细胞,并分盘到96孔板中;加入长春新碱(终浓度分别为10ng/mL、20ng/mL、100ng/mL、200ng/mL、1000ng/mL和2000ng/mL);48小时后,取出96孔板,向每孔加入10μL CCK8溶液(注意不要在孔中生成气泡,以免影响OD值读数);将培养板在培养箱内孵育3小时,用酶标仪测定450nm处的吸光度值。若暂时不测定OD值,可以向每孔中加入10μL 1%(w/v)SDS溶液,并在室温条件下避光保存,24小时内测定则吸光度不发生变化。
结果显示,转染hsa-miR-874-3p模拟物的HCT-8的细胞对长春新碱的耐药能力显著高于未转染组(见图4),说明hsa-miR-874-3p能够提高结肠癌细胞对长春新碱的耐药能力。
3、细胞增殖-毒性试验检测HCT-8/VCR细胞转染hsa-miR-874-3p抑制物后的耐药特性
将生长活跃的HCT-8/VCR细胞悬液于转染前一天接种到12孔板中;第二天,转染hsa-miR-874-3p抑制物(25nM),8小时后消化细胞,并分盘到96孔板中;加入长春新碱(终浓度分别为100ng/mL、500ng/mL、1000ng/mL、2000ng/mL、3000ng/mL和4000ng/mL);48小时后取出96孔板,向每孔加入10μL CCK8溶液(注意不要在孔中生成气泡,以免影响OD值读数);将培养板在培养箱内孵育3小时,用酶标仪测定450nm处的吸光度值。若暂时不测定OD值,可以向每孔中加入10μL 1%(w/v)SDS溶液,并在室温条件下避光保存,24小时内测定则吸光度不发生变化。
结果显示,相对于对照组未转染细胞,转染hsa-miR-874-3p抑制物的HCT-8/VCR细胞对长春新碱的耐药能力显著降低(见图5),说明hsa-miR-874-3p抑制物能够在一定程度上逆转结肠癌细胞对长春新碱的耐药能力,也进一步证明hsa-miR-874-3p与结肠癌细胞对长春新碱的耐药能力密切相关。
试验例2
选取某医院2013~2015年60例结肠癌病例,提取石蜡标本中的miRNA,采用实施例3中方法检测miR-874-3p的表达量。结果显示,该方法能够特异、有效地扩增出miR-874-3p序列;统计分析结果表明,34例病例标本中miR-874-3p表达量平均为11.218±2.132,其余26例标本中miR-874-3p表达量平均为2.412±2.212,表达量相差4.65倍(P<0.01)。结合临床治疗效果分析,miR-874-3p表达量高的样本采用长春新碱治疗结肠癌的效果较差,而表达量低的样本采用长春新碱治疗的效果较好,这也进一步证实了miR-874-3p的表达与结肠癌对长春新碱的耐药性有关。
上述实施例及试验例中所用细胞系、试剂等均为市售商品。HCT-8细胞购自中国科学院上海细胞库。
本发明提供的试剂盒及检测方法可用于临床判断结肠癌对长春新碱的耐药性,进一步指导临床用药并实现精准治疗,提高疗效,降低副作用。
需要说明的是,说明书中所列实施例仅用于理解发明技术方案,不具有任何限制作用。除了上述实施例外,还可以有其他实施方式。凡是采用等同替换或等效变换形成的任何技术方案,均落在本发明要求的保护范围内。
序列表
SEQUENCE LISTING
<110> 新乡医学院
<120> 用于检测miR-874-3p表达的引物、试剂盒、检测方法及应用
<170> PatentIn version 3.5
<211> 22
<212> RNA
<213> 序列
<221> hsa-miR-874-3p序列
<222> (1)..(22)
<400> 1
CUGCCCUGGC CCGAGGGACC GA 22
<211> 37
<212> DNA
<213> 序列
<221> 逆转录引物1
<222> (1)..(37)
<400> 2
CTCAACTGGT GTCGTGGAGT CGGCAATTCT CGGTCCC 37
<211> 36
<212> DNA
<213> 序列
<221> 逆转录引物2
<222> (1)..(36)
<400> 3
CTCAACTGGT GTCGTGGAGT CGGCAATTCT CGGTCC 36
<211> 35
<212> DNA
<213> 序列
<221> 逆转录引物3
<222> (1)..(35)
<400> 4
CTCAACTGGT GTCGTGGAGT CGGCAATTCT CGGTC 35
<211> 31
<212> DNA
<213> 序列
<221> 荧光定量PCR的正向引物1
<222> (1)..(31)
<400> 5
ACACTCCAGC TGGGCTGCCC TGGCCCGAGG G 31
<211> 30
<212> DNA
<213> 序列
<221> 荧光定量PCR的正向引物2
<222> (1)..(30)
<400> 6
ACACTCCAGC TGGGCTGCCC TGGCCCGAGG 30
<211> 20
<212> DNA
<213> 序列
<221> 荧光定量PCR的反向引物
<222> (1)..(20)
<400> 7
CTCAACTGGT GTCGTGGAGT 20
<211> 17
<212> DNA
<213> 序列
<221> 内参U6 snRNA的正向引物
<222> (1)..(17)
<400> 8
CTCGCTTCGG CAGCACA 17
<211> 20
<212> DNA
<213> 序列
<221> 内参U6 snRNA的反向引物
<222> (1)..(20)
<400> 9
AACGCTTCAC GAATTTGCGT 20
<211> 23
<212> DNA
<213> 序列
<221> 内参U6 snRNA的逆转录引物
<222> (1)..(23)
<400> 10
CGCTTCACGA ATTTGCGTGT CAT 23
- 还没有人留言评论。精彩留言会获得点赞!
- 用于检测AEDs引起的SJS/TEN的引物、试剂盒及方法与制造工艺
- 检测植原体的LAMP引物组及其试剂盒和应用的制造方法与工艺
- 用于多重PCR检测致腹泻寄生虫的引物组及试剂盒的制造方法与工艺
- 使用重叠非等位基因特异性引物和等位基因特异性阻断剂寡核苷酸的组合物进行等位基因特异性扩增的制造方法与工艺
- 一种基于特异性SS-COI引物的丽草蛉PCR快速检测方法与制造工艺
- 一种利用线粒体D-loop区特异区域鉴定鼋的标记引物及方法
- 一种用于检测大豆拟茎点种腐病菌的特异性lamp引物组合物及其应用
- 一种针对膨胀污泥中Eikelboom Type 0092型丝状菌群特异性引物和方法
- 紫苑石斛的分子特异性标记引物及检测方法
- 一种检测牛hcd携带者的特异性pcr引物、试剂盒及检测方法
- 检测植原体的LAMP引物组及其试剂盒和应用的制造方法与工艺
- 用于多重PCR检测致腹泻寄生虫的引物组及试剂盒的制造方法与工艺
- 使用重叠非等位基因特异性引物和等位基因特异性阻断剂寡核苷酸的组合物进行等位基因特异性扩增的制造方法与工艺
- 一种利用线粒体D-loop区特异区域鉴定鼋的标记引物及方法
- 一种用于检测大豆拟茎点种腐病菌的特异性lamp引物组合物及其应用
- 一种针对膨胀污泥中Eikelboom Type 0092型丝状菌群特异性引物和方法
- 紫苑石斛的分子特异性标记引物及检测方法
- 一种检测牛hcd携带者的特异性pcr引物、试剂盒及检测方法
- 用于检测牛源性成分的lamp引物及其设计方法
- 七种不同种属来源细胞的pcr检测引物和检测方法与应用