与激活型肝星状细胞特异性结合的多肽及制备方法和应用与流程
本发明涉及一种与激活型肝星状细胞特异性结合的多肽及其制备方法,具体属于生物技术领域。
背景技术:
肝纤维化(hepatic fibrosis)是由各种致病因子所致肝内结缔组织异常增生,导致肝内弥漫性细胞外基质(extracellular matrix,ECM)过度沉淀的病理过程。病毒性肝炎、酒精肝、脂肪肝、自身免疫性肝病等多种肝病都可导致肝纤维化发生,是肝纤维化的常见病因。在我国,病毒性肝炎的发病率很高,其他肝病也较为常见,这些疾病的慢性发展通常演化为肝纤维化、肝硬化,甚至导致肝癌,已经成为严重影响我国人民健康的重大疾患之一。目前普遍认为慢性肝损伤在肝纤维化阶段是可逆转的,因此如何有效地控制及逆转肝纤维化,防止其进一步演变具有极其重要的意义。
在对肝纤维化发病机制的研究中发现,肝星状细胞(hepatic stellate cells,HSCs)激活在肝纤维化病理过程中扮演着关键性角色。在慢性肝损伤过程中,肝细胞、肝库普弗细胞、血小板、内皮细胞等释放一系列细胞因子使静止型HSCs激活转化为激活型HSCs,即肌成纤维细胞样细胞(myofibroblast-like cells,MFCs)。激活型HSCs分泌大量的胶原蛋白,使Disse间隙的ECM增多;同时上调基质金属蛋白酶抑制剂(matrix metalloproteinase inhibitor,MMPI)和组织金属蛋白酶抑制剂(tissue inhibitor of metalloproteinase,TIMP)的表达,使ECM降解减少,导致ECM不断堆积增加而形成肝纤维化和肝硬化。HSCs的活化是肝纤维化发生发展过程中的中心事件,激活型HSCs是肝纤维化发生发展中的“罪魁祸首”,也是肝纤维化防治的关键靶细胞。因此,筛选出一种与激活型肝星状细胞特异性结合的多肽,显得尤为必要。
技术实现要素:
为解决现有技术的不足,本发明的目的在于提供一种与激活型肝星状细胞特异性结合的多肽及制备方法和应用,所得多肽可以与激活型肝星状细胞特异性结合,其制备方法操作简单,准确度高;所得多肽可用于制备肝纤维化诊断试剂或肝纤维化靶向治疗药物中。
为了实现上述目标,本发明采用如下的技术方案:
与激活型肝星状细胞特异性结合的多肽,所述多肽的氨基酸序列为Thr-Val-Arg-Thr-Ser-Ala-Asp。
一种与激活型肝星状细胞特异性结合的多肽的制备方法,其特征在于:包括以下步骤:(1)静止型肝星状细胞与激活型肝星状细胞培养;(2)以静止型肝星状细胞为吸附细胞、激活型肝星状细胞为靶细胞,采用噬菌体展示技术进行差减筛选;(3)经DNA测序确定目标多肽。
前述与激活型肝星状细胞特异性结合的多肽的制备方法中,步骤(2)以静止型肝星状细胞为吸附细胞、激活型肝星状细胞为靶细胞,采用噬菌体展示技术进行差减筛选,具体为:分别取步骤(1)中培养的生长良好的静止型肝星状细胞以及激活型肝星状细胞,在37℃、体积浓度5%的CO2条件下,置于无血清培养基中培养2h后,备用;分别在所得静止型肝星状细胞以及激活型肝星状细胞培养皿中加入BSA,在37℃、50rpm条件下,恒温培养摇床中封闭;在静止型肝星状细胞中加入噬菌体原始肽库的稀释液,在37℃、50rpm条件下恒温培养摇床中孵育;随后将与静止型肝星状细胞孵育后的上清液加入封闭后的激活型肝星状细胞中,在37℃、50rpm条件下恒温培养摇床中孵育,弃去与激活型肝星状细胞孵育后的上清液,用PBST缓冲液洗涤6次,加入pH=2.2的甘氨酸-盐酸缓冲液,置于37℃、50rpm条件下恒温培养摇床中洗脱;收集洗脱液,加入pH=9.1的Tris-HCl缓冲液进行中和;测定洗脱液所含噬菌体滴度;随后取该洗脱液感染宿主菌E.coli ER2738进行扩增,扩增后噬菌体通过离心以及PEG/NaCl沉淀的方法进行纯化,再次测定扩增、纯化后噬菌体滴度,完成第一轮筛选;重复以上步骤数次,筛选结束。本申请中采用差减筛选的方法,先去除与静止型肝星状细胞结合的噬菌体,随后去除不与激活型肝星状细胞结合的噬菌体,通过逐步的筛选过程,使得最终所得噬菌体具备仅与激活型肝星状细胞特异性结合的特性,保障了最终筛选结果的高效性、准确性。
进一步地,前述与激活型肝星状细胞特异性结合的多肽的制备方法中,步骤(2)以静止型肝星状细胞为吸附细胞、激活型肝星状细胞为靶细胞,采用噬菌体展示技术进行差减筛选,具体为:分别取步骤(1)中培养的生长良好的静止型肝星状细胞以及激活型肝星状细胞,在37℃、体积浓度5%的CO2条件下,置于无血清培养基中培养2h后,备用;分别在所得静止型肝星状细胞以及激活型肝星状细胞培养皿中加入1.5mL质量浓度为1%的BSA,在37℃、50rpm条件下,恒温培养摇床中封闭30min;在静止型肝星状细胞中加入1.5mL滴度为2×1011pfu的噬菌体原始肽库的稀释液,在37℃、50rpm条件下恒温培养摇床中孵育1h;随后将与静止型肝星状细胞孵育后的上清液加入封闭后的激活型肝星状细胞中,在37℃、50rpm条件下恒温培养摇床中孵育1h,弃与激活型肝星状细胞孵育后的上清液,用0.1%~0.3%PBST缓冲液洗涤6次,加入1mL0.2mol/L的pH=2.2的甘氨酸-盐酸缓冲液,置于37℃、50rpm条件下恒温培养摇床中洗脱10min;收集洗脱液,加入150μL1mol/L的pH=9.1的Tris-HCl缓冲液进行中和;测定洗脱液中所含噬菌体滴度;随后取0.5mL该洗脱液感染宿主菌E.coli ER2738进行扩增,扩增后噬菌体通过离心以及PEG/NaCl沉淀的方法进行纯化,再次测定扩增、纯化后噬菌体滴度,完成第一轮筛选;重复以上步骤数次,筛选结束。
进一步地,前述与激活型肝星状细胞特异性结合的多肽的制备方法中,步骤(2)中共完成3~5轮筛选,所用0.1%~0.3%PBST缓冲液是指含Tween-20体积浓度为0.1%~0.3%的PBS缓冲液。
优选地,前述与激活型肝星状细胞特异性结合的多肽的制备方法,步骤(2)中共完成4轮筛选;其中,第一轮筛选中所用0.1%PBST缓冲液为含Tween-20体积浓度为0.1%的PBS缓冲液;第二轮筛选中所用PBST缓冲液为0.2%PBST缓冲液,即含Tween-20体积浓度为0.2%的PBS缓冲液;第三轮和第四轮筛选中所用PBST缓冲液为0.3%PBST缓冲液,即含Tween-20体积浓度为0.3%的PBS缓冲液;第四轮筛选时洗脱液进行滴度测定后不再进行扩增纯化。本申请中优选采用在不同的筛选阶段选用不同浓度的缓冲液进行筛选操作,筛选范围由大到小逐渐收缩,提升了筛选得到合适噬菌体的可能性,提高了筛选成功率。
前述与激活型肝星状细胞特异性结合的多肽的制备方法中,步骤(3)经DNA测序确定目标多肽,具体为:取最后一轮筛选后的洗脱液进行噬菌体滴度测定时,选取若干个阳性噬菌体克隆,分别进行扩增和纯化,随后进行DNA测序,选取测序结果显示插入序列重复次数最多的噬菌体,其所展示的多肽即为目标多肽。测序结果显示插入序列重复次数越多的噬菌体,其与激活型肝星状细胞结合的特异性就越高、亲和力也越高,该噬菌体展示的多肽即为与激活型肝星状细胞特异性结合且亲和力较高的多肽。
前述与激活型肝星状细胞特异性结合的多肽的制备方法中,步骤(1)中静止型肝星状细胞是通过以下步骤培养:将大鼠麻醉后,采用质量浓度为0.05%的Ⅳ胶原酶体外循环消化以及Opetiprep密度梯度离心的方法,分离大鼠原代肝星状细胞,用含20%FBS的高糖DMEM培养基重悬细胞,按3×106接种于6cm培养皿中,置于37℃、体积浓度5%的CO2的二氧化碳培养箱中培养24h,细胞贴壁单层长满皿底,即得静止型肝星状细胞。当采用质量浓度为0.05%的Ⅳ胶原酶和质量浓度为0.1%的链蛋白酶体外循环消化时,链蛋白酶可以特异性地消化肝细胞,减少肝细胞与肝星状细胞的粘附,提高肝星状细胞的纯度。
前述与激活型肝星状细胞特异性结合的多肽的制备方法中,步骤(1)中激活型肝星状细胞是通过以下步骤培养:原代分离的肝星状细胞培养14天后,质量浓度为0.25%的胰酶常规消化传代,用含10%FBS的高糖DMEM培养基重悬细胞沉淀后接种到新的6cm培养皿中,置于37℃、体积浓度5%的CO2条件下培养,待细胞贴壁单层长满皿底,即得激活型肝星状细胞。现有的从肝组织中分离纯化出HSCs的方法,存在酶消耗量大、操作复杂不易控制或者是操作系统体积庞大、结构复杂等问题。采用本申请中方法培养静止型肝星状细胞和激活型肝星状细胞,大幅降低了酶的用量,简化了操作步骤,降低了操作难度,缩短了操作时间,易于培养得到静止型肝星状细胞和激活型肝星状细胞。此外,也有效避免了常规方法培养得到静止型肝星状细胞自发活化的问题。
前述与激活型肝星状细胞特异性结合的多肽在制备肝纤维化诊断试剂或肝纤维化靶向治疗药物中的应用。
为了确保本发明技术方案的科学、有效,发明人进行了一系列的实验。具体如下所示。
1、实验主要材料
1.1、实验动物:雄性Wistar大鼠,购于重庆滕鑫生物技术有限公司,动物合格证号:SCXK(渝)2007-005。
1.2、细胞株:人肝星状细胞株LX-2,大鼠肝星状细胞株HSC-T6,人肝细胞株LO2,人肝癌细胞株HepG2,购于广州吉妮欧生物科技有限公司。
1.3、主要仪器
超净工作台:苏州净化;倒置显微镜:德国ZEISS;CO2培养箱:美国Thermo;高速台式冷冻离心机:Allegar 64R型,美国Beckman;肝组织循环灌流消化仪:本课题组设计并申请专利,专利号:ZL201420633713.7;台式恒温培养摇床:COS-100B型,上海比郎仪器制造有限公司;全波段酶标仪:SYNERGY H4型,美国BioTek;恒温培养箱:HPX-9052MBE型,上海博讯实业有限公司医疗设备厂;生物安全柜:AB2-4S1型,新加坡ESCO;激光共聚焦显微镜:德国ZEISS;Bullet Blender:BB24-AU型,美国Next Advance。
1.4、主要试剂
DMEM(高糖)培养基:Hyclon公司;胎牛血清:Gibico公司;双抗(青链霉素混合液):北京索莱宝科技有限公司;Ⅳ胶原酶:北京索莱宝科技有限公司;链蛋白酶:北京索莱宝科技有限公司;DNaseⅠ:北京索莱宝科技有限公司;Opetiprep密度梯度离心液:挪威Axis-Shield公司;牛血清白蛋白(BSA):sigma公司;Ph.D.-C7C噬菌体展示肽库试剂盒:New England BioLabs公司。(包含①噬菌体随机环七肤文库,文库滴度为2×1013pfu/ml,随机多样性为1.28×109;②–28gIII测序引物5′d(GTATGGGATTTTGCTAAACAAC)3′,–96gIII测序引物5′d(CCCTCATAGTTAGCGTAACG)3′;③E.coli宿主菌ER2738);空白对照噬菌体:New England BioLabs公司;PBS粉剂:北京鼎国昌盛生物技术有限责任公司;酵母提取物:Sigma公司;蛋白胨:Sigma公司;琼脂糖:GENE公司;四环素:北京鼎国生物生物技术责任有限公司;IPTG(异丙基-β-D-硫代半乳糖苷):北京鼎国昌盛生物生物技术责任有限公司;X-gal(5-溴-4-氯-3吲哚-β-半乳糖苷):北京鼎国昌盛生物生物技术责任有限公司;二甲基甲酰胺:北京鼎国昌盛生物生物技术责任有限公司;聚乙二醇8000(PEG 8000):北京鼎国昌盛生物生物技术责任有限公司;PEG 8000:北京索莱宝科技有限公司;甘油:北京鼎国昌盛生物生物技术责任有限公司(121℃、20min高压蒸汽灭菌,常温下保存);HRP-抗M13噬菌体单克隆抗体:美国GE Healthcare公司;TMB底物显色试剂盒:北京康为世纪生物科技有限公司;抗M13噬菌体单克隆抗体:New England BioLabs公司;Rabbit polyclonal Secondary Antibody to Mouse IgG-H&L,Abcam公司;DAPI:上海碧云天生物技术有限公司;488标记的抗组蛋白标签抗体(Anti-6X His antibody,488):Abcam公司。其余所用的各种材料和试剂都是本领域中常用的材料和试剂,可以通过常规的商业途径获得。
1.5、主要试剂的配制
1.5.1、D-Hanks液(不含酚红):精确称取NaCl 8.0g、KCl 0.4g、Na2HPO 4.12g、H2O 0.133g、KH2PO4 0.06g和NaHCO3 0.35g,溶于适量超纯水中,定容至1000mL,0.22μm微孔滤膜过滤除菌,4℃保存。
1.5.2、HBSS液(不含酚红):精确称取NaCl 8.0g、KCl 0.4g、MgSO4·7H2O 0.1g、MgCl2·6H2O 0.1g、Na2HPO4·2H2O 0.06g、KH2PO4 0.06g、C6H12O6 1.0g、CaCl2 0.14g和NaHCO3 0.35g,加超纯水至1000mL,0.22μm微孔滤膜过滤,4℃保存。
1.5.3、全培养基(含20%FBS):无菌条件下准确量取79mL DMEM(高糖培养基),加入20mLFBS(胎牛血清)、1mL 100×双抗,混匀,调整HP值为7.2~7.4,4℃保存。
1.5.4、全培养基(含10%FBS):无菌条件下准确量取89mL DMEM(高糖培养基),加入10mLFBS、1mL 100×双抗,混匀,调整HP值为7.2~7.4,4℃保存。
1.5.5、PBS溶液:1L规格的PBS粉剂,溶于1L超纯水中,溶解完全后,0.22μm微孔滤膜过滤除菌和杂质,移至高温灭菌过的广口瓶中,高压灭菌20min,4℃保存。
1.5.6、质量浓度为0.25%的胰酶消化液:称取0.5g的胰酶溶解于200mL的PBS溶液中(在冰浴中进行),搅拌溶解完全后,0.22μm的微孔滤膜过滤除菌,分装后,-20℃保存。
1.5.7、LB培养基:胰化蛋白胨10g、酵母提取物5g和NaCl 5g加超纯水至lL,用5mol/L NaOH调节pH至7.2~7.6,高压蒸汽灭菌,4℃储存。
1.5.8、LBT培养基:胰化蛋白胨10g、酵母提取物5g和NaCl 5g加超纯水至1L,用5mol/L NaOH调节pH至7.2~7.6,高压蒸汽灭菌,冷却到70℃加入四环素Stoek 10μL,4℃储存。
1.5.9、LB平板:胰化蛋白胨10g、酵母提取物5g、NaCl 5g和Agar15g,加超纯水至1L,用5mol/L NaOH调节pH至7.2~7.6,高压蒸汽灭菌,冷却到70℃后加入到9cm的培养皿中铺制LB平板,4℃避光保存。
1.5.10、四环素储存液:按20mg/ml的浓度溶于无水乙醇中,-20℃冰箱中避光保存。
1.5.11、LBT平板:胰化蛋白胨10g、酵母提取物5g、NaCl 5g和Agar15g,加超纯水至1L,用5mol/L NaOH调节pH至7.2~7.6,高压蒸汽灭菌,冷却到70℃后加入后加入四环素储存液l mL,铺制LBT平板,4℃避光保存。
1.5.12、PEG 8000/NaCl的配制:PEG-8000 60g和NaCl 43.83g,加超纯水至300mL,121℃下,20min高压灭菌,冷却时振荡防止分层,室温下储存。
1.5.13、IPTG/Xgal:称取1.25g IPTG和1g Xgal溶于25mL二甲基甲酰胺中,-20℃避光保存。
1.5.14、LB/IPTG/Xgal平板:LB培养基+15g/L琼脂粉,高压灭菌,冷却至低于70℃时,加入1mL IPTG/Xgal,混匀倒平板,平板4℃避光贮存。
1.5.15、顶层琼脂:胰蛋白胨10g、酵母提取物5g、NaC1 5g、MgCl2·6H2O 1g和Agarose琼脂糖7g,加超纯水至1L,高压灭菌,分装于50mL锥形瓶,室温保存,用时微波炉溶解。
1.5.16、质量浓度为1%的BSA:称取1g BSA,加入100mLPBS,4℃冰箱中保存。
1.5.17、TBS(Tris缓冲盐溶液):NaCl 8g、KCl 0.2g和Tris3g,溶于800mL超纯水,HCl调pH值到7.4,超纯水定容至1000mL,121℃、20min高压蒸汽灭菌,室温保存。
1.5.18、0.2mol/L的甘氨酸-盐酸缓冲液(pH=2.2):50mL 0.2mol/L甘氨酸+44mL 0.2mol/L盐酸,加超纯水稀释至200mL,0.22μm微孔滤膜过滤除菌,4℃保存。
2、实验方法
2.1、细胞准备
2.1.1、大鼠麻醉后,采用质量浓度为0.05%的Ⅳ胶原酶和质量浓度为0.1%的链蛋白酶体外循环消化及Opetiprep密度梯度离心的方法,分离大鼠原代HSCs,用含20%FBS的高糖DMEM培养基重悬细胞,按3×106接种于6cm培养皿中,置于体积浓度5%的CO2、37℃的二氧化碳培养箱中培养24h,细胞贴壁单层长满皿底,该细胞为静止型HSCs,用于筛选。
2.1.2、原代分离的HSCs培养14天后,质量浓度为0.25%的胰酶常规消化传代,用含10%FBS的高糖DMEM培养基重悬细胞沉淀后接种到新的6cm培养皿中,置于37℃、体积浓度5%的CO2条件下培养,待细胞贴壁单层长满皿底,用于筛选。该细胞为激活型HSCs。
前期进行的自发荧光检测、油红O染色、Western blot及细胞免疫荧光检测细胞desmin、α-SMA、CollagenⅠ表达等相关实验已经证实上述方法原代分离培养培养24h的细胞为静止型HSCs,传代培养的细胞为激活型HSCs。
2.2、噬菌体随机肽库差减筛选和富集效应分析
取生长良好的静止型HSCs及激活型HSCs,在37℃、体积浓度5%的CO2条件下,于无血清培养基中培养2h后进行筛选。分别在静止型HSCs及激活型HSCs细胞培养皿中加入1.5mL质量浓度为1%的BSA,37℃、50rpm恒温培养摇床中封闭30min;先在静止型HSCs中加入1.5mL噬菌体原肽库的稀释液(滴度为2×1011pfu),于37℃、50rpm恒温培养摇床中孵育1h;再将与静止型HSCs孵育后的上清液(其中含未与静止型HSCs结合的噬菌体)加入封闭后的激活型HSCs中,37℃、50rpm恒温培养摇床中孵育1h;弃与激活型HSCs孵育后的上清液,用0.1%PBST缓冲液(Tween-20体积浓度为0.1%的PBS缓冲液)洗6次;加入1mL 0.2mol/L的甘氨酸-盐酸缓冲液(pH=2.2),置于37℃、50rpm恒温培养摇床上洗脱10min。收集洗脱液,加入150μL1mol/L的Tris-HCl(pH=9.1)进行中和,此洗脱液中含第一轮筛选出的噬菌体。取10μL洗脱液用LB/IPTG/X-gal平板培养测定噬菌体滴度,并计算回收率(即产出量与投入量比值,投入量为筛选前的噬菌体滴度,产出量为筛选后的噬菌体滴度)。取0.5mL洗脱液感染宿主菌E.coli ER2738进行扩增,扩增后噬菌体用离心及PEG/NaCl沉淀的方法进行纯化(扩增后菌液倒入50mL离心管中,4℃、10000rpm条件下离心10min;将上清液的80%转入新的50mL离心管中,加入1/6体积的PEG/NaCl,4℃沉淀过夜;4℃、12000rpm条件下离心10min,吸弃上清液,沉淀用1mL TBS重悬;重悬液于4℃、10000rpm条件下离心5min;上清液转入1.5ml Epp管内,加入1/6体积的PEG/NaCl,冰上孵育60min;4℃、12000rpm条件下离心10min,吸弃上清液,沉淀用200μL TBS重悬;重悬液于4℃、10000rpm条件下离心5min,弃沉淀;上清转入一个新的无菌0.5mL Epp管内,此为扩增并纯化的噬菌体液,噬菌体液以1∶1的比例与灭菌甘油混匀后,储存于-20℃,备用)。再次测定扩增、纯化后噬菌体滴度,然后进行下一轮筛选。按同样方法进行四轮筛选,四轮筛选中需注意:①其中第二轮筛选时洗脱所用液体为体积浓度为0.2%的PBST缓冲液(含Tween-20体积浓度为0.2%的PBS缓冲液),第三轮筛选时洗脱所用液体为体积浓度0.3%的PBST缓冲液(含Tween-20体积浓度为0.3%的PBS缓冲液),第四轮筛选时洗脱所用液体为体积浓度0.3%的PBST缓冲液(含Tween-20体积浓度为0.3%的PBS缓冲液);②第四轮筛选后的洗脱液只进行滴度测定,不需再扩增纯化。
2.3、阳性噬菌体DNA测序
对第四轮筛选后的洗脱液进行滴度测定时,在LB/IPTG/X-gal平板上随机挑起若干个(本次试验中选择34个)蓝斑(阳性噬菌体克隆),并将每个克隆分别进行扩增和纯化。纯化后的阳性噬菌体克隆保存于50%甘油中,送上海生工采用自动测序仪进行测序。测序引物为:–96gIII测序引物5′d(CCCTCATAGTTAGCGTAACG)3′。根据所测出的碱基系列,在其插入位点(CGA ACA(NNM)7ACG CCA CCT CCA)找到插入系列(该片段中(NNM)7即为编码所展示七肽的碱基序列,(NNM)7两端ACA和ACG是编码环七肽两侧相互连接成环半胱氨酸的密码子)。再按照“碱基互补配对及密码子决定氨基酸”的原理去推导出插入系列展示的多肽系列。
2.4、阳性噬菌体与激活型HSCs结合的亲和力检测
测序结果显示34个阳性克隆对应20种DNA系列,即20种噬菌体。ELISA实验检测20种阳性噬菌体与激活型HSCs结合的亲和力。
取激活型HSCs(传代培养的HSCs),常规消化后用含10%FBS的DMEM(高糖)培养基将细胞密度调整成1×105/mL,按每孔100μL接种于96孔板上;培养至细胞贴壁长满单层,弃培养基,PBS洗3遍,体积浓度为10%的中性福尔马林常温下固定30min;弃福尔马林,PBS洗3遍,滴加体积浓度为3%的过氧化氢(100μL/孔),置于37℃孵箱中30min,阻断内源性过氧化物酶活性;每孔加入质量浓度为1%的BSA 200μL,37℃封闭1h;将20种阳性噬菌体克隆分别加入孔中(1×1010pfu/孔),每个噬菌体克隆设3个复孔,另设空白噬菌体作阴性对照,设PBS为空白对照;37℃温箱中孵育1h,吸弃上清液中未与细胞结合的噬菌体,用0.1%PBST缓冲液(Tween-20体积浓度为0.1%的PBS缓冲液)洗6遍,去除非特异性结合的噬菌体;加入Ⅰ抗(HRP-抗M13单克隆抗体,稀释比例1∶5000)100μL/孔,37℃孵育1h;弃Ⅰ抗,PBS洗涤3次,每孔加入100μL TMB避光反应30min,加入50μL 0.1mol/L H2SO4终止反应;酶标仪上检测各孔450nm处OD值。同时以静止型HSCs(原代刚分离的大鼠HSCs),用含20%FBS的DMEM培养基将细胞密度调整成3×105/mL,按每孔100μL接种于96孔板上;接种24h后,细胞贴壁长满单层,用体积浓度为10%的中性福尔马林常温下固定,用相同方法检测各噬菌体克隆与静止型HSCs结合后的OD450值。比较各阳性噬菌体克隆分别与静止型HSCs及激活型HSCs结合后的OD值差异。
2.5、7号噬菌体与激活型HSCs结合的特异性鉴定
将测序鉴定出的20种噬菌体分别编号为1~20号,测序结果显示其中7号噬菌体重复次数最多,共计10次。ELISA实验结果显示,7号噬菌体与激活型HSCs结合的亲和力亦较高。采用细胞免疫荧光实验鉴定7号噬菌体与激活型HSCs结合的特异性。
分别将传代培养的大鼠HSCs(激活型)、原代分离的大鼠HSCs(静止型)、HSC-T6(大鼠肝星状细胞株,表型为激活型)、LX-2(人肝星状细胞株,表型为激活型)、LO2(人肝细胞株)及HepG2(人肝癌细胞株)细胞接种于多聚赖氨酸包被过的激光共聚焦扫描显微镜专用皿(NEST,15mm)中;培养24h,细胞贴壁生长,体积浓度为10%的中性福尔马林固定;吸去福尔马林,PBS洗2次,每次5min;质量浓度为1%的BSA在37℃下封闭30min;加入7号噬菌体(滴度2×1011puf)37℃孵育1h;吸弃噬菌体,体积浓度为0.1%的PBST缓冲液(Tween-20体积浓度为0.1%的PBS缓冲液)洗6次,每次5min,去除非特异性结合的噬菌体;加入质量浓度为0.1%的NaBH4室温处理10min,消除背景荧光;用Triton X-100体积浓度为0.2%的PBS缓冲液洗2次,每次5min,洗净残存的NaBH4;质量浓度为1%的BSA在37℃下封闭30min;加入Ⅰ抗(抗M13噬菌体单克隆抗体,稀释比例1:100),4℃孵育过夜;弃Ⅰ抗,用Triton X-100体积浓度为0.2%的PBS缓冲液洗3次,每次5min;加入荧光Ⅱ抗(Rabbit polyclonal Secondary Antibody to Mouse IgG-H&L,550,稀释比例为1:100)室温孵育2h;弃Ⅱ抗,用Triton X-100体积浓度为0.2%的PBS缓冲液洗3次,每次5min;加入80μL DAPI染核,37℃孵育15min;PBS洗2次,每次5min;加入500μL PBS,激光共聚焦扫描显微镜观察(检测DAPI以及DyLight 550)并拍照。
另将传代培养的大鼠HSCs、LX-2及HSC-T6(均为激活型HSCs),与空白噬菌共孵育,以同样的方法检测空白噬菌体是否与激活型HSCs结合。
2.6、7号噬菌体在肝纤维化模型大鼠体内的组织特异性检测
取体重180~220g的雄性Wistar大鼠,采用皮下注射CCl4的方法建立CCl4诱导的肝纤维化大鼠模型。取2只肝纤维化模型大鼠及1只正常对照大鼠,腹腔注射质量浓度为8%的水合氯醛0.5mL/100g麻醉;舌下静脉注射1mL灭活空白噬菌体(3×1012puf)循环40min,以封闭非特异性吞噬系统;封闭后,取1只模型大鼠静脉注射7号噬菌体(2×1012puf),1只模型大鼠静脉注射空白噬菌体(2×1012puf),对照大鼠静脉注射7号噬菌体(2×1012puf),让噬菌体在体内循环40min;大鼠胸腹部剃毛,碘伏、75%酒精依次消毒皮肤,剪开胸腔,心脏灌注生理盐水冲净全身血液,分别取心、肝、脾、肺、肾、脑及肌肉组织各一块置于无菌平皿中,无菌生理盐水洗3遍后装入无菌EP管中;用眼科剪将EP管内的组织剪碎,再用无菌生理盐水反复洗涤至肉眼见不到红色(红细胞);准确称取剪碎后各组织100mg,加入新的无菌EP管中,加入400μL PBS,置于Bullet Blender中,制成组织匀浆;将组织匀浆液于4℃、10000rpm下离心10min,弃上清;加入体积浓度为0.1%的PBST缓冲液(Tween-20体积浓度为0.1%的PBS缓冲液)同样条件下离心,洗涤组织沉淀6次,以去除非特异性结合的噬菌体;组织沉淀中加入1mL PBS混匀,制成100mg/mL的组织悬液。从中取出100μL(含组织10mg)进行噬菌体滴度测定。具体方法:100μL组织悬液,4℃、10000rpm离心10min,弃上清,沉淀中加入100μL ER2738大肠杆菌(OD600≈0.5)中静置感染20min,再加入900μL LB培养基中室温孵育30min;从中取出100μL加入3mL顶层琼脂(45℃)混匀,倾注于37℃预温的10cm LB/IPTG/Xgal平板上,37℃孵育过夜;计数平板上的蓝斑数,计算出各组织的噬菌体滴度。若组织中蓝斑过多而无法计数,则需重新取100μL组织悬液适度稀释后再计算其噬菌体滴度。
2.7、Q肽与7号噬菌体克隆的竞争性结合实验
上述实验证实7号噬菌体与激活型HSCs(包括传代培养的大鼠HSCs、大鼠肝星状细胞株HSC-T6及人肝星状细胞株LX-2)的结合具有较高的特异性,且在肝纤维化模型大鼠肝组织中有一定富集。7号噬菌体展示的多肽系列为:Thr-Val-Arg-Thr-Ser-Ala-Asp,命名为Q肽。采用竞争性结合实验来鉴定Q肽是否能抑制7号噬菌体与激活型HSCs的特异性结合,以便考察7号噬菌体是否是通过其表面展示的Q肽与激活型HSCs结合的。
取激活型HSCs(传代培养的大鼠HSCs),按3×105/孔接种到6孔板中,待细胞贴壁长满单层,弃培养基,PBS洗3遍;质量浓度为1%的BSA在37℃封闭30min,在6个孔中分别加入质量浓度为10μg/mL、1μg/mL、0.1μg/mL、0.01μg/mL、0.001μg/mL及0μg/mL(对照组)的Q肽(委托吉尔生化(上海)有限公司合成,Cys-Thr-Val-Arg-Thr-Ser-Ala-Asp-Cys,CC二硫键成环;合成多肽经HPLC纯化和质谱分析鉴定,纯度达98%。),37℃孵育20min;在每孔中加入7号噬菌体2×1011puf,37℃孵育1h;吸弃各孔中含有噬菌体的上清,用体积浓度为0.1%的PBST缓冲液(Tween-20体积浓度为0.1%的PBS缓冲液)洗6遍,去除非特异性结合噬菌体;每孔加入1mL 0.2mol/L的甘氨酸-盐酸缓冲液(pH=2.2),置于37℃、50rpm条件下恒温培养摇床上洗脱10min;收集洗脱液到一洁净无菌的1.5mL Epp管内,加入150μL1mol/L的Tris-HCl(pH=9.1)进行中和;测定各孔洗脱液中噬菌体滴度,计算抑制率[抑制率=(对照组噬菌体滴度-多肽各浓度组噬菌体滴度)/对照组噬菌体滴度×100%)]。同时采用同样的方法检测对照多肽(委托吉尔生化(上海)有限公司合成,Cys-Ser-Thr-Ala-Val-Asp-Thr-Arg-Cys,CC二硫键成环;合成多肽经HPLC纯化和质谱分析鉴定,纯度达98%。)对7号噬菌体与激活型HSCs结合的抑制率,并进行比较。
2.8、Q肽与激活型HSCs结合的特异性鉴定
竞争性结合实验结果显示Q肽可以明显抑制7号噬菌体与激活型HSCs的结合,表明7号噬菌体与激活型HSCs的结合是通过其表明展示的Q肽实现的。采用免疫荧光实验进一步证明Q肽在脱离了噬菌体这个载体后是否还能与激活型HSCs特异性结合。
委托吉尔生化(上海)有限公司合成组氨酸标签标记的Q肽(His-His-His-His-His-Hi s-Cys-Thr-Val-Arg-Thr-Ser-Ala-Asp-Cys,CC二硫键成环)及组氨酸标记的对照多肽(His-His-His-His-His-His-Cys-Ser-Thr-Ala-Val-Asp-Thr-Arg-Cys,CC二硫键成环)合成的两种多肽经HPLC纯化和质谱分析鉴定,纯度达98%。
分别将传代培养的大鼠HSCs(激活型)、原代分离的大鼠HSCs(静止型)、LX-2、HSC-T6、LO2及HepG2细胞接种于多聚赖氨酸包被过的激光共聚焦扫描显微镜专用的玻底皿中;培养24h后,用体积浓度为10%的中性福尔马林固定;弃福尔马林,PBS洗3次,每次5min;质量浓度为1%的BSA在37℃下封闭30min;所有细胞各取一皿加入100μg/mL(质量浓度为1%的BSA配制)的组氨酸标记Q肽100μL,再取传代培养的大鼠HSCs、LX-2、HSC-T6(均为激活型)各一皿,加入100μg/mL的组氨酸标记对照多肽100μL,37℃孵育1h;PBS洗3次,每次5min;加入体积浓度为0.1%的NaBH4,室温处理10min,消除背景荧光;用Triton X-100体积浓度为0.2%的PBS洗2次,每次5min;加入Ⅰ抗(488标记的抗组氨酸标签抗体,稀释比例1:100),4℃孵育过夜;弃抗体,PBS洗3次,每次5min;加入80μL DAPI染核,孵箱内37℃孵育15min;PBS洗2次,每次5min;加入500μL PBS,激光共聚焦扫描显微镜观察(检测DAPI以及DyLight 488)并拍照。
3、实验结果
3.1、细胞培养结果
采用体外循环消化及密度梯度离心的方法分离到的大鼠HSCs培养24h时,细胞贴壁生长,细胞体积较小、折光性强,符合静止型HSCs的特点;经传代培养后,细胞体积明显增大,胞突伸展,符合激活型HSCs的特征。见图1。
3.2、每轮筛选后滴度测定和富集效应结果
取10μL每轮筛选后收集洗脱液,适当倍数稀释,测定其噬菌体滴度。结果显示,经过4轮差减筛选,回收量从第一轮的1.48×104pfu增加到第四轮的1.24×109pfu,回收率从第一轮的7.4×10-6(%)增加到第四轮的6.2×10-1(%),阳性噬菌体克隆得到有效的富集。见表1。
表1每轮筛选回收量及富集倍数
3.3、DNA系列测定结果
随机挑起的34个阳性噬菌体克隆,共对应20种DNA系列,即20种噬菌体,分别编号为1~20号噬菌体。其中7号噬菌体重复次数最多,共计10次。7号噬菌中插入的系列为TGA CAA TCC TGC AGA CGA,所展示的多肽氨基酸系列为Thr-Val-Arg-Thr-Ser-Ala-Asp。7号噬菌体出现频率最高,呈现出高富集性,将其展示的多肽命名为Q肽。
3.4、阳性噬菌体与激活型HSCs结合的亲和力测定结果
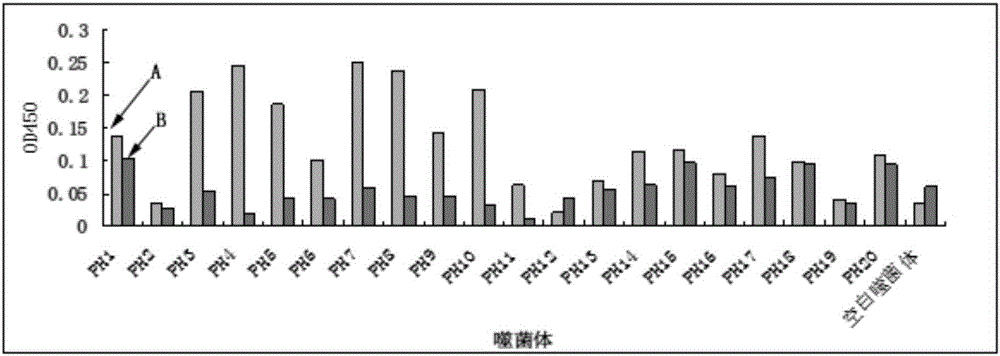
采用ELISA实验对筛选出的20种阳性噬菌体与激活型HSCs特异性结合的亲和力进行鉴定的结果显示,20种噬菌体中绝大部分噬菌体与激活型HSCs结合的OD值均高于与静止型HSCs结合的OD值;其中,7号噬菌体与激活型HSCs结合的OD值最高,且与激活型HSCs结合的OD值较与静止型HSCs结合的OD值高10.95倍。如图2所示。表明7号噬菌体与激活型HSCs有较高的亲和力。
3.5、7号噬菌体与激活型HSCs细胞结合的特异性鉴定结果
实验中所用的荧光Ⅱ抗被DyLight 550标记,被赋予黄色伪色彩;DAPI用于细胞核染色,被赋予蓝色伪色彩。结果显示:7号噬菌体分别与传代培养的大鼠HSCs、大鼠肝星状细胞株HSC-T6及人肝星状细胞株LX-2三种表型为激活型的HSCs共孵育后,激光共聚焦显微镜下可见细胞核呈现较强的蓝色荧光,细胞膜上有较强的黄色荧光;7号噬菌与静止型HSCs(原代分离培养24h的大鼠HSCs)、人肝细胞株LO2和人肝癌细胞株HepG2共孵育后,激光共聚焦显微镜下细胞核呈现较强的蓝色荧光,但基本见不到细胞膜上有黄色荧光;空白噬菌体与传代培养的大鼠HSCs、大鼠肝星状细胞株HSC-T6及人肝星状细胞株LX-2三种表型为激活型的HSCs共孵育后,激光共聚焦显微镜下细胞核呈现较强的蓝色荧光,未见到细胞膜上有明显的黄色荧光。如图3、4和5所示。结果表明,7号噬菌体与传代培养的大鼠HSCs、大鼠肝星状细胞株HSC-T6及人肝星状细胞株LX-2三种表型为激活型的HSCs结合,而与其他细胞不结合,提示7号噬菌体与激活型HSCs的结合具有特异性。
3.6、7号噬菌体在肝纤维化模型大鼠体内的组织特异性检测结果
在肝纤维化模型大鼠及正常大鼠体内分别注入7号噬菌体及空白噬菌体后,分别取3只大鼠的心、肝、脾、肺、肾、脑及肌肉组织进行噬菌体滴度测定。在检测3只大鼠心、肺、肾、脑及肌肉组织的LB/IPTG/Xgal平板上均未见到蓝斑,检测不到相应组织的噬菌体滴度;而3只大鼠的肝、脾组织中均见到了蓝色噬菌体斑。3只大鼠脾组织检测后的蓝斑计算在100以内,按100mg组织计则3只大鼠脾组织的蓝斑数均在103数量级;3只大鼠肝组织检测后的蓝斑均较多,无法计数,逐对肝组织匀浆液进行稀释后再次检测,结果3只大鼠肝脏(100mg)中噬菌体滴度在104~105级,注入7号噬菌体的正常大鼠及注入空白噬菌体的肝纤维化大鼠肝组织(100mg)中噬菌体滴度在104级,注入阳性噬菌体的肝纤维化大鼠肝组织(100mg)内的噬菌体滴度最高,为105级。如表2所示。表明7号噬菌体能在肝纤维模型大鼠的肝组织内有一定富集,提示7号噬菌体对纤维化肝组织具有一定的特异性。
表2各组织中噬菌体滴度检测结果
3.7、Q肽与7号噬菌体的竞争性结合实验结果
竞争性结合实验结果显示:与不加入Q肽的对照组比较,在加入不同浓度Q肽的各组中与激活型HSCs结合的7号噬菌体数明显减少,且Q肽浓度越高,与激活型HSCs结合的7号噬菌体数越少。表明Q肽可以明显抑制7号噬菌体与激活型HSCs的结合,且Q肽浓度越高,其抑制作用越强,呈现出一定的剂量依赖性。如见图6所示。提示7号噬菌体与激活型HSCs的结合是通过其表面展示的Q肽实现的。
3.8、Q肽与激活型HSCs特异性结合的鉴定结果
实验中,Q肽被接上组氨酸标签,所用的抗体为488标记的抗组氨酸标签抗体,被赋予绿色伪色彩;用DAPI染细胞核,被赋予蓝色伪色彩。共聚焦显微镜下观察显示,Q肽分别与传代培养的HSCs、大鼠肝星状细胞株HSC-T6和人肝星状细胞株LX-2三种表型为激活型的HSCs共孵育后,可观察到细胞核显示很强的蓝色荧光,细胞膜上有较强绿色荧光;Q肽分别与原代分离培养24h的大鼠HSCs(表型为静止型的HSCs)、LO2细胞和HepG2细胞共孵育后,可观察到细胞核显示很强的蓝色荧光,细胞膜上有很弱的绿色荧光;无关多肽分别与传代培养的HSCs、大鼠肝星状细胞株HSC-T6和人肝星状细胞株LX-2三种表型为激活型的HSCs共孵育后,可观察到细胞核显示较强的蓝色荧光,细胞膜上有很弱的绿色荧光。如图7、8和9所示。结果表明,Q肽能与传代培养的大鼠HSCs、大鼠肝星状细胞株HSC-T6及人肝星状细胞株LX-2三种表型为激活型的HSCs结合,而与其他细胞不结合,提示Q肽能与激活型HSCs特异性结合。
本发明的有益之处在于:本发明提供的一种与激活型肝星状细胞特异性结合的多肽,能够与激活型肝星状细胞进行特异性结合,亲和力高,且对纤维化肝组织有一定特异性。本发明的多肽为小分子短肽,穿透力强,免疫原性小,适宜作为靶向载体。本发明多肽还可以人工合成,获取方便。本发明的制备方法以静止型肝星状细胞为吸附细胞、激活型肝星状细胞为靶细胞,采用噬菌体展示技术进行差减筛选,并最终得到一种与激活型肝星状细胞结合且具有高度特异性的多肽。本发明制备方法中库容量大,筛选成功率高,操作简单,成本低。本发明的多肽可用于制备肝纤维化诊断试剂或肝纤维化靶向治疗药物中,可以为肝纤维化的早期诊断和靶向治疗提供新的有效手段。
附图说明
图1是本发明的细胞培养结果图;
图2是20种阳性噬菌体与激活型HSCs特异性结合的亲和力鉴定结果图;
图3是7号噬菌体与激活型HSCs特异性结合后激光共聚焦显微镜图;
图4是7号噬菌体与静止型HSCs结合后激光共聚焦显微镜图;
图5是空白噬菌体与激活型HSCs特异性结合后激光共聚焦显微镜图;
图6是Q肽与7号噬菌体的竞争性结合结果图;
图7是Q肽与激活型HSCs特异性结合鉴定结果图;
图8是Q肽与静止型HSCs特异性结合鉴定结果图;
图9是对照多肽与激活型HSCs特异性结合鉴定结果图;
图中附图标记的含义:图1:A1-第一轮筛选所用静止型HSCs,A2-第一轮筛选所用激活型HSCs,B1-第二轮筛选所用静止型HSCs,B2-第二轮筛选所用激活型HSCs,C1-第三轮筛选所用静止型HSCs,C2-第三轮筛选所用激活型HSCs,D1-第四轮筛选所用静止型HSCs,D2-第四轮筛选所用激活型HSCs;图2:A-阳性噬菌体与激活型HSCs结合,B-阳性噬菌体与静止型HSCs结合;图6:A-Q肽,B-对照多肽。
具体实施方式
以下结合具体实施例对本发明作进一步的介绍。
实施例1
与激活型肝星状细胞特异性结合的多肽,其氨基酸序列为Thr-Val-Arg-Thr-Ser-Ala-Asp。
实施例1中与激活型肝星状细胞特异性结合的多肽可以通过实施例2~7中方法制备得到。
实施例2
与激活型肝星状细胞特异性结合的多肽的制备方法,包括以下步骤:
(1)静止型肝星状细胞与激活型肝星状细胞培养
(2)以静止型肝星状细胞为吸附细胞、激活型肝星状细胞为靶细胞,采用噬菌体展示技术进行差减筛选:分别取步骤(1)中培养的生长良好的静止型肝星状细胞以及激活型肝星状细胞,在37℃、体积浓度5%的CO2条件下,置于无血清培养基中培养2h后,备用;分别在静止型肝星状细胞以及激活型肝星状细胞培养皿中加入BSA,在37℃、50rpm条件下,恒温培养摇床中封闭;在静止型肝星状细胞中加入噬菌体原始肽库的稀释液,在37℃、50rpm条件下恒温培养摇床中孵育;随后将与静止型肝星状细胞孵育后的上清液加入封闭后的激活型肝星状细胞中,在37℃、50rpm条件下恒温培养摇床中孵育,弃与激活型肝星状细胞孵育后的上清液,用PBST缓冲液洗涤6次,加入pH=2.2的甘氨酸-盐酸缓冲液,置于37℃、50rpm条件下恒温培养摇床中洗脱;收集洗脱液,加入pH=9.1的Tris-HCl缓冲液进行中和;测定洗脱液中所含噬菌体滴度;随后取该洗脱液感染宿主菌E.coli ER2738进行扩增,扩增后噬菌体通过离心以及PEG/NaCl沉淀的方法进行纯化,再次测定扩增、纯化后噬菌体滴度,完成第一轮筛选;重复以上步骤数次,筛选结束。
(3)经DNA测序确定目标多肽:取最后一轮筛选后的洗脱液进行噬菌体滴度测定时,选取若干个阳性噬菌体克隆,分别进行扩增和纯化,随后进行DNA测序,选取测序结果显示插入序列重复次数最多的噬菌体,其所展示的多肽即为目标多肽。
实施例3
与激活型肝星状细胞特异性结合的多肽的制备方法,包括以下步骤:
(1)静止型肝星状细胞与激活型肝星状细胞培养:静止型肝星状细胞以及激活型肝星状细胞通过常规方法培养;
(2)以静止型肝星状细胞为吸附细胞、激活型肝星状细胞为靶细胞,采用噬菌体展示技术进行差减筛选:分别取步骤(1)中培养的生长良好的静止型肝星状细胞以及激活型肝星状细胞,在37℃、体积浓度5%的CO2条件下,置于无血清培养基中培养2h后,备用;分别在所得静止型肝星状细胞以及激活型肝星状细胞培养皿中加入1.5mL质量浓度为1%的BSA,在37℃、50rpm条件下,恒温培养摇床中封闭30min;在静止型肝星状细胞中加入1.5mL滴度为2×1011pfu的噬菌体原始肽库的稀释液,在37℃、50rpm条件下恒温培养摇床中孵育1h;随后将与静止型肝星状细胞孵育后的上清液加入封闭后的激活型肝星状细胞中,在37℃、50rpm条件下恒温培养摇床中孵育1h,弃与激活型肝星状细胞孵育后的上清液,用0.1%PBST缓冲液洗涤6次,加入1mL0.2mol/L的pH=2.2的甘氨酸-盐酸缓冲液,置于37℃、50rpm条件下恒温培养摇床中洗脱10min;收集洗脱液,加入150μL1mol/L的pH=9.1的Tris-HCl缓冲液进行中和;测定洗脱液中所含噬菌体滴度;随后取0.5mL该洗脱液感染宿主菌E.coli ER2738进行扩增,扩增后噬菌体通过离心以及PEG/NaCl沉淀的方法进行纯化,再次测定扩增、纯化后噬菌体滴度,完成第一轮筛选;重复以上步骤4次,一共进行5轮筛选,筛选结束;其中,筛选中所用0.1%PBST缓冲液为Tween-20体积浓度为0.1%的PBS缓冲液;
(3)经DNA测序确定目标多肽:取最后一轮筛选后的洗脱液进行噬菌体滴度测定时,选取若干个阳性噬菌体克隆,分别进行扩增和纯化,随后进行DNA测序,选取测序结果显示插入序列重复次数最多的噬菌体,其所展示的多肽即为目标多肽。
实施例4
与激活型肝星状细胞特异性结合的多肽的制备方法,包括以下步骤:
(1)静止型肝星状细胞与激活型肝星状细胞培养:所述静止型肝星状细胞是通过以下步骤培养:将大鼠麻醉后,采用质量浓度为0.05%的Ⅳ胶原酶体外循环消化以及Opetiprep密度梯度离心的方法,分离大鼠原代肝星状细胞,用含20%FBS的高糖DMEM培养基重悬细胞,按3×106接种于6cm培养皿中,置于37℃、体积浓度5%的CO2的二氧化碳培养箱中培养24h,细胞贴壁单层长满皿底,即得静止型肝星状细胞;
所述激活型肝星状细胞是通过以下步骤获取:原代分离的肝星状细胞培养14天后,质量浓度为0.25%的胰酶常规消化传代,用含10%FBS的高糖DMEM培养基重悬细胞沉淀后接种到新的6cm培养皿中,置于37℃、体积浓度5%的CO2条件下培养,待细胞贴壁单层长满皿底,即得激活型肝星状细胞;
(2)以静止型肝星状细胞为吸附细胞、激活型肝星状细胞为靶细胞,采用噬菌体展示技术进行差减筛选:分别取步骤(1)中培养的生长良好的静止型肝星状细胞以及激活型肝星状细胞,在37℃、体积浓度5%的CO2条件下,置于无血清培养基中培养2h后,备用;分别在所得静止型肝星状细胞以及激活型肝星状细胞培养皿中加入1.5mL质量浓度为1%的BSA,在37℃、50rpm条件下,恒温培养摇床中封闭30min;在静止型肝星状细胞中加入1.5mL滴度为2×1011pfu的噬菌体原始肽库的稀释液,在37℃、50rpm条件下恒温培养摇床中孵育1h;随后将与静止型肝星状细胞孵育后的上清液加入封闭后的激活型肝星状细胞中,在37℃、50rpm条件下恒温培养摇床中孵育1h,弃与激活型肝星状细胞孵育后的上清液,用0.3%PBST缓冲液洗涤6次,加入1mL0.2mol/L的pH=2.2的甘氨酸-盐酸缓冲液,置于37℃、50rpm条件下恒温培养摇床中洗脱10min;收集洗脱液,加入150μL1mol/L的pH=9.1的Tris-HCl缓冲液进行中和;测定洗脱液中所含噬菌体滴度;随后取0.5mL该洗脱液感染宿主菌E.coli ER2738进行扩增,扩增后噬菌体通过离心以及PEG/NaCl沉淀的方法进行纯化,再次测定扩增、纯化后噬菌体滴度,完成第一轮筛选;重复以上步骤2次,共完成3轮筛选,筛选结束;其中,筛选中所用0.3%PBST缓冲液为Tween-20体积浓度为0.3%的PBS缓冲液;
(3)经DNA测序确定目标多肽:取最后一轮筛选后的洗脱液进行噬菌体滴度测定时,选取若干个阳性噬菌体克隆,分别进行扩增和纯化,随后进行DNA测序,选取测序结果显示插入序列重复次数最多的噬菌体,其所展示的多肽即为目标多肽。
实施例5
与激活型肝星状细胞特异性结合的多肽的制备方法,包括以下步骤:
(1)静止型肝星状细胞与激活型肝星状细胞培养:所述静止型肝星状细胞是通过以下步骤培养:将大鼠麻醉后,采用质量浓度为0.05%的Ⅳ胶原酶体外循环消化以及Opetiprep密度梯度离心的方法,分离大鼠原代肝星状细胞,用含20%FBS的高糖DMEM培养基重悬细胞,按3×106接种于6cm培养皿中,置于37℃、体积浓度5%的CO2的二氧化碳培养箱中培养24h,细胞贴壁单层长满皿底,即得静止型肝星状细胞;
所述激活型肝星状细胞是通过以下步骤培养:原代分离的肝星状细胞培养14天后,质量浓度为0.25%的胰酶常规消化传代,用含10%FBS的高糖DMEM培养基重悬细胞沉淀后接种到新的6cm培养皿中,置于37℃、体积浓度5%的CO2条件下培养,待细胞贴壁单层长满皿底,即得激活型肝星状细胞;
(2)以静止型肝星状细胞为吸附细胞、激活型肝星状细胞为靶细胞,采用噬菌体展示技术进行差减筛选:分别取步骤(1)中培养的生长良好的静止型肝星状细胞以及激活型肝星状细胞,在37℃、体积浓度5%的CO2条件下,置于无血清培养基中培养2h后,备用;分别在所得静止型肝星状细胞以及激活型肝星状细胞培养皿中加入1.5mL质量浓度为1%的BSA,在37℃、50rpm条件下,恒温培养摇床中封闭30min;在静止型肝星状细胞中加入1.5mL滴度为2×1011pfu的噬菌体原始肽库的稀释液,在37℃、50rpm条件下恒温培养摇床中孵育1h;随后将与静止型肝星状细胞孵育后的上清液加入封闭后的激活型肝星状细胞中,在37℃、50rpm条件下恒温培养摇床中孵育1h,弃与激活型肝星状细胞孵育后的上清液,用0.2%PBST缓冲液洗涤6次,加入1mL0.2mol/L的pH=2.2的甘氨酸-盐酸缓冲液,置于37℃、50rpm条件下恒温培养摇床中洗脱10min;收集洗脱液,加入150μL1mol/L的pH=9.1的Tris-HCl缓冲液进行中和;测定洗脱液中所含噬菌体滴度;随后取0.5mL该洗脱液感染宿主菌E.coli ER2738进行扩增,扩增后噬菌体通过离心以及PEG/NaCl沉淀的方法进行纯化,再次测定扩增、纯化后噬菌体滴度,完成第一轮筛选;重复以上步骤3次,共完成4轮筛选,筛选结束;其中,筛选中所用0.2%PBST缓冲液为Tween-20体积浓度为0.2%的PBS缓冲液;
(3)经DNA测序确定目标多肽:取最后一轮筛选后的洗脱液进行噬菌体滴度测定时,选取若干个阳性噬菌体克隆,分别进行扩增和纯化,随后进行DNA测序,选取测序结果显示插入序列重复次数最多的噬菌体,其所展示的多肽即为目标多肽。
实施例6
与激活型肝星状细胞特异性结合的多肽的制备方法,包括以下步骤:
(1)静止型肝星状细胞与激活型肝星状细胞培养:静止型肝星状细胞以及激活型肝星状细胞通过常规方法培养;
(2)以静止型肝星状细胞为吸附细胞、激活型肝星状细胞为靶细胞,采用噬菌体展示技术进行差减筛选:分别取步骤(1)中培养的生长良好的静止型肝星状细胞以及激活型肝星状细胞,在37℃、体积浓度5%的CO2条件下,置于无血清培养基中培养2h后,备用;分别在所得静止型肝星状细胞以及激活型肝星状细胞培养皿中加入1.5mL质量浓度为1%的BSA,在37℃、50rpm条件下,恒温培养摇床中封闭30min;在静止型肝星状细胞中加入1.5mL滴度为2×1011pfu的噬菌体原始肽库的稀释液,在37℃、50rpm条件下恒温培养摇床中孵育1h;随后将与静止型肝星状细胞孵育后的上清液加入封闭后的激活型肝星状细胞中,在37℃、50rpm条件下恒温培养摇床中孵育1h,弃与激活型肝星状细胞孵育后的上清液,用0.1%PBST缓冲液洗涤6次,加入1mL0.2mol/L的pH=2.2的甘氨酸-盐酸缓冲液,置于37℃、50rpm条件下恒温培养摇床中洗脱10min;收集洗脱液,加入150μL1mol/L的pH=9.1的Tris-HCl缓冲液进行中和;测定洗脱液中所含噬菌体滴度;随后取0.5mL该洗脱液感染宿主菌E.coli ER2738进行扩增,扩增后噬菌体通过离心以及PEG/NaCl沉淀的方法进行纯化,再次测定扩增、纯化后噬菌体滴度,完成第一轮筛选;重复以上步骤3次,共完成4轮筛选,筛选结束;其中,第一轮筛选中所用0.1%PBST缓冲液为Tween-20体积浓度为0.1%的PBS缓冲液;第二轮筛选中所用PBST缓冲液为0.2%PBST缓冲液,即Tween-20体积浓度为0.2%的PBS缓冲液;第三轮和第四轮筛选中所用PBST缓冲液为0.3%PBST缓冲液,即Tween-20体积浓度为0.3%的PBS缓冲液;第四轮筛选时洗脱液进行滴度测定后不再进行扩增纯化。
(3)经DNA测序确定目标多肽:取最后一轮筛选后的洗脱液进行噬菌体滴度测定时,选取若干个阳性噬菌体克隆,分别进行扩增和纯化,随后进行DNA测序,选取测序结果显示插入序列重复次数最多的噬菌体,其所展示的多肽即为目标多肽。
实施例7
与激活型肝星状细胞特异性结合的多肽的制备方法,包括以下步骤:
(1)静止型肝星状细胞与激活型肝星状细胞培养:所述静止型肝星状细胞是通过以下步骤培养:将大鼠麻醉后,采用质量浓度为0.05%的Ⅳ胶原酶和质量浓度为0.1%的链蛋白酶体外循环消化以及Opetiprep密度梯度离心的方法,分离大鼠原代肝星状细胞,用含20%FBS的高糖DMEM培养基重悬细胞,按3×106接种于6cm培养皿中,置于37℃、体积浓度5%的CO2的二氧化碳培养箱中培养24h,细胞贴壁单层长满皿底,即得静止型肝星状细胞;
所述激活型肝星状细胞是通过以下步骤培养:原代分离的肝星状细胞培养14天后,质量浓度为0.25%的胰酶常规消化传代,用含10%FBS的高糖DMEM培养基重悬细胞沉淀后接种到新的6cm培养皿中,置于37℃、体积浓度5%的CO2条件下培养,待细胞贴壁单层长满皿底,即得激活型肝星状细胞;
(2)以静止型肝星状细胞为吸附细胞、激活型肝星状细胞为靶细胞,采用噬菌体展示技术进行差减筛选:分别取步骤(1)中培养的生长良好的静止型肝星状细胞以及激活型肝星状细胞,在37℃、体积浓度5%的CO2条件下,置于无血清培养基中培养2h后,备用;分别在所得静止型肝星状细胞以及激活型肝星状细胞培养皿中加入1.5mL质量浓度为1%的BSA,在37℃、50rpm条件下,恒温培养摇床中封闭30min;在静止型肝星状细胞中加入1.5mL滴度为2×1011pfu的噬菌体原始肽库的稀释液,在37℃、50rpm条件下恒温培养摇床中孵育1h;随后将与静止型肝星状细胞孵育后的上清液加入封闭后的激活型肝星状细胞中,在37℃、50rpm条件下恒温培养摇床中孵育1h,弃与激活型肝星状细胞孵育后的上清液,用0.1%PBST缓冲液洗涤6次,加入1mL0.2mol/L的pH=2.2的甘氨酸-盐酸缓冲液,置于37℃、50rpm条件下恒温培养摇床中洗脱10min;收集洗脱液,加入150μL1mol/L的pH=9.1的Tris-HCl缓冲液进行中和;测定洗脱液中所含噬菌体滴度;随后取0.5mL该洗脱液感染宿主菌E.coli ER2738进行扩增,扩增后噬菌体通过离心以及PEG/NaCl沉淀的方法进行纯化,再次测定扩增、纯化后噬菌体滴度,完成第一轮筛选;重复以上步骤3次,共完成4轮筛选,筛选结束;其中,第一轮筛选中所用0.1%PBST缓冲液为Tween-20体积浓度为0.1%的PBS缓冲液;第二轮筛选中所用PBST缓冲液为0.2%PBST缓冲液,即Tween-20体积浓度为0.2%的PBS缓冲液;第三轮和第四轮筛选中所用PBST缓冲液为0.3%PBST缓冲液,即Tween-20体积浓度为0.3%的PBS缓冲液;第四轮筛选时洗脱液进行滴度测定后不再进行扩增纯化。
(3)经DNA测序确定目标多肽:取最后一轮筛选后的洗脱液进行噬菌体滴度测定时,选取若干个阳性噬菌体克隆,分别进行扩增和纯化,随后进行DNA测序,选取测序结果显示插入序列重复次数最多的噬菌体,其所展示的多肽即为目标多肽。
实施例8
与激活型肝星状细胞特异性结合的多肽,其氨基酸序列为Thr-Val-Arg-Thr-Ser-Ala-Asp,能够在制备肝纤维化诊断试剂或肝纤维化靶向治疗药物中应用。
- 还没有人留言评论。精彩留言会获得点赞!