鉴定或辅助鉴定食源性致病菌的GeXP多重PCR方法的成套试剂与应用与流程
本发明涉及生物技术领域中,鉴定或辅助鉴定食源性致病菌的GeXP多重PCR方法的成套试剂与应用。
背景技术:
近年来食源性疾病已成为当今许多国家面临的公共卫生问题,食源性致病菌包括大肠杆菌O157:H7、沙门氏菌、空肠弯曲杆菌、单核细胞增生性李斯特菌、霍乱弧菌、副溶血弧菌、金黄色葡萄球菌等。这些严重危害人类健康和食品安全的重要因素的致病菌是引起肠道细菌性感染和细菌性食物中毒的重要病原体。大肠杆菌O157:H7作为一种重要的食源性致病菌在我国畜禽等与人接触密切的动物粪便中的检出率非常高,感染后可并发溶血性尿毒症;沙门氏菌是目前世界公认引起食源性疾病的重要致病菌,主要通过食物和饮水传播,肉及肉制品的污染率最高,感染后可引起胃肠炎、败血症;霍乱弧菌所致的霍乱为烈性肠道传染病,具有发病急、传播快、流行范围广等特征,曾在世界上发生过几次大流行,至今仍未平息,是我国传染病法规定的甲类传染病,也是当前三种国际检疫传染病之一;单核细胞增生性李斯特菌主要污染肉类、乳制品和蔬菜等,这就使得食品在储运、加工过程中容易被单核细胞增生性李斯特菌污染,感染后主要表现为败血症、脑膜炎和单核细胞增多;空肠弯曲杆菌是二十世纪80年代起受到国内外广泛重视的人畜共患病原菌,该菌广泛存在于家禽类动物的肠道中,污染水源或食物后可引起腹泻的爆发;副溶血弧菌能够引起多种无脊椎动物致病,特别水产品,致病菌株可引起人类腹泻、恶心、呕吐、腹部痉挛,严重的可以引起昏迷、脱水甚至死亡;金黄色葡萄球菌在自然界中无处不在,空气、水、灰尘及人和动物的排泄物中都可找到,因此,食品受其污染的机会很多,金黄色葡萄球菌除了引起感染外,其产生的肠毒素可污染食物而致食物中毒引起呕吐腹泻,为人类带来非常严重的公共卫生负担。这些菌不仅给养殖业带来巨大的经济损失,还严重威胁人类健康,建立快速、准确的检测方法意义重大。
检测7种致病菌的常规方法需要分离培养、生化试验和血清学鉴定等多个步骤,操作也十分繁琐、费时,对多重混合感染的鉴别诊断就更为困难。近年来,随着分子生物学的发展,PCR技术已被广泛应用于这些食源性致病菌的检测,并建立了多重PCR检测技术,同时检测几种病原,但需几对引物组合在一起同时竞争地扩增,引物之间会产生相互干扰,多增加一对引物,敏感性就越低。PCR产物需通过琼脂糖电泳才可观察结果,该电泳难以区分50bp-100bp以内的条带,一般只可做到2-4重PCR,难以达到高通量的检测。多重荧光PCR一般只检测到3重,由于探针要标记不同发光波长的荧光基团,如标记太多的荧光基团,相互会产生干扰,因此,也只能检测到2-4重。由于在多重PCR反应体系中同时存在几对引物,使得形成复杂引物二聚体的概率大大增加,同时检测的目的基因数量有限(多在2-4个基因),使得多重PCR还达不到高通量快速检测和分析的目的。目前急需一种同时可检测多种食源性细菌的试剂或试剂盒。
GeXP系统(Gene Expression Profiler Genetic Analysis System)是美国Beckman Coulter公司研发的用于研究多基因表达定量分析的平台。GeXP多重PCR扩增采用荧光标记通用引物和特异性嵌合引物(即基因特异性引物5’端连接通用引物序列)相结合引发多重体系扩增。PCR反应之初,先由反向特异性嵌合引物与原始模板结合进行逆转录反应,再由正向特异性嵌合引物合成cDNA的第二链,此后,由正、反向嵌合引物的特异性序列以cDNA为模板启动PCR反应,分别扩增出通用引物的互补序列;再由反应体系中占主导地位的荧光标记通用引物,与其互补序列结合,引发后续扩增,通用引物与反应体系中带有荧光标记的碱基序列互补,PCR产物经GeXP毛细管电泳分离,含有荧光标记的PCR产物经GeXP检测窗口检测,依据检测片段与标准分子片段(DNA Size Standard,DSS)迁移时间计算出扩增片段的长度,荧光信号强度代表该分离片段的扩增含量。
技术实现要素:
本发明所要解决的技术问题是如何同时检测大肠杆菌O157:H7、沙门氏菌、霍乱弧菌、单核细胞增生性李斯特菌、空肠弯曲杆菌、副溶血弧菌和金黄色葡萄球菌。
为解决上述技术问题,本发明首先提供了鉴定或辅助鉴定食源性致病菌的成套试剂,所述成套试剂由名称分别为引物对A、引物对B、引物对C、引物对D、引物对E、引物对F和引物对G的引物组成;
所述引物对A由名称分别为A-F和A-R的单链DNA组成;
所述A-F是如下a1)至a4)中的任一种单链DNA:
a1)序列表中序列1的第19-43位所示的单链DNA;
a2)在a1)的5′端和/或3′端添加一个或几个核苷酸得到的单链DNA;
a3)与a1)或a2)限定的单链DNA具有85%以上的同一性的单链DNA;
a4)在严格条件下与a1)或a2)限定的单链DNA杂交的单链DNA;
所述A-R是如下b1)至b4)中的任一种单链DNA:
b1)序列表中序列2的第20-44位所示的单链DNA;
b2)在b1)的5′端和/或3′端添加一个或几个核苷酸得到的单链DNA;
b3)与b1)或b2)限定的单链DNA具有85%以上的同一性的单链DNA;
b4)在严格条件下与b1)或b2)限定的单链DNA杂交的单链DNA;
所述引物对B由名称分别为B-F和B-R的单链DNA组成;
所述B-F是如下c1)至c4)中的任一种单链DNA:
c1)序列表中序列3的第19-36位所示的单链DNA;
c2)在c1)的5′端和/或3′端添加一个或几个核苷酸得到的单链DNA;
c3)与c1)或c2)限定的单链DNA具有85%以上的同一性的单链DNA;
c4)在严格条件下与c1)或c2)限定的单链DNA杂交的单链DNA;
所述B-R是如下d1)至d4)中的任一种单链DNA:
d1)序列表中序列4的第20-39位所示的单链DNA;
d2)在d1)的5′端和/或3′端添加一个或几个核苷酸得到的单链DNA;
d3)与d1)或d2)限定的单链DNA具有85%以上的同一性的单链DNA;
d4)在严格条件下与d1)或d2)限定的单链DNA杂交的单链DNA;
所述引物对C由名称分别为C-F和C-R的单链DNA组成;
所述C-F是如下e1)至e4)中的任一种单链DNA:
e1)序列表中序列5的第19-37位所示的单链DNA;
e2)在e1)的5′端和/或3′端添加一个或几个核苷酸得到的单链DNA;
e3)与e1)或e2)限定的单链DNA具有85%以上的同一性的单链DNA;
e4)在严格条件下与e1)或e2)限定的单链DNA杂交的单链DNA;
所述C-R是如下f1)至f4)中的任一种单链DNA:
f1)序列表中序列6的第20-36位所示的单链DNA;
f2)在f1)的5′端和/或3′端添加一个或几个核苷酸得到的单链DNA;
f3)与f1)或f2)限定的单链DNA具有85%以上的同一性的单链DNA;
f4)在严格条件下与f1)或f2)限定的单链DNA杂交的单链DNA;
所述引物对D由名称分别为D-F和D-R的单链DNA组成;
所述D-F是如下g1)至g4)中的任一种单链DNA:
g1)序列表中序列7的第19-39位所示的单链DNA;
g2)在g1)的5′端和/或3′端添加一个或几个核苷酸得到的单链DNA;
g3)与g1)或g2)限定的单链DNA具有85%以上的同一性的单链DNA;
g4)在严格条件下与g1)或g2)限定的单链DNA杂交的单链DNA;
所述D-R是如下h1)至h4)中的任一种单链DNA:
h1)序列表中序列8的第20-40位所示的单链DNA;
h2)在h1)的5′端和/或3′端添加一个或几个核苷酸得到的单链DNA;
h3)与h1)或h2)限定的单链DNA具有85%以上的同一性的单链DNA;
h4)在严格条件下与h1)或h2)限定的单链DNA杂交的单链DNA;
所述引物对E由名称分别为E-F和E-R的单链DNA组成;
所述E-F是如下i1)至i4)中的任一种单链DNA:
i1)序列表中序列9的第19-37位所示的单链DNA;
i2)在i1)的5′端和/或3′端添加一个或几个核苷酸得到的单链DNA;
i3)与i1)或i2)限定的单链DNA具有85%以上的同一性的单链DNA;
i4)在严格条件下与i1)或i2)限定的单链DNA杂交的单链DNA;
所述E-R是如下j1)至j4)中的任一种单链DNA:
j1)序列表中序列10的第20-40位所示的单链DNA;
j2)在j1)的5′端和/或3′端添加一个或几个核苷酸得到的单链DNA;
j3)与j1)或j2)限定的单链DNA具有85%以上的同一性的单链DNA;
j4)在严格条件下与j1)或j2)限定的单链DNA杂交的单链DNA;
所述引物对F由名称分别为F-F和F-R的单链DNA组成;
所述F-F是如下k1)至k4)中的任一种单链DNA:
k1)序列表中序列11的第19-40位所示的单链DNA;
k2)在k1)的5′端和/或3′端添加一个或几个核苷酸得到的单链DNA;
k3)与k1)或k2)限定的单链DNA具有85%以上的同一性的单链DNA;
k4)在严格条件下与k1)或k2)限定的单链DNA杂交的单链DNA;
所述F-R是如下l1)至l4)中的任一种单链DNA:
l1)序列表中序列12的第20-40位所示的单链DNA;
l2)在l1)的5′端和/或3′端添加一个或几个核苷酸得到的单链DNA;
l3)与l1)或l2)限定的单链DNA具有85%以上的同一性的单链DNA;
l4)在严格条件下与l1)或l2)限定的单链DNA杂交的单链DNA;
所述引物对G由名称分别为G-F和G-R的单链DNA组成;
所述G-F是如下m1)至m4)中的任一种单链DNA:
m1)序列表中序列13的第19-37位所示的单链DNA;
m2)在m1)的5′端和/或3′端添加一个或几个核苷酸得到的单链DNA;
m3)与m1)或m2)限定的单链DNA具有85%以上的同一性的单链DNA;
m4)在严格条件下与m1)或m2)限定的单链DNA杂交的单链DNA;
所述G-R是如下n1)至n4)中的任一种单链DNA:
n1)序列表中序列14的第20-38位所示的单链DNA;
n2)在n1)的5′端和/或3′端添加一个或几个核苷酸得到的单链DNA;
n3)与n1)或n2)限定的单链DNA具有85%以上的同一性的单链DNA;
n4)在严格条件下与n1)或n2)限定的单链DNA杂交的单链DNA;
所述食源性致病菌为大肠杆菌O157:H7、沙门氏菌、霍乱弧菌、单核细胞增生性李斯特菌、空肠弯曲杆菌、副溶血弧菌和/或金黄色葡萄球菌。
上述成套试剂中,
a2)所述单链DNA的序列可为序列表中序列1;
b2)所述单链DNA的序列可为序列表中序列2;
c2)所述单链DNA的序列可为序列表中序列3;
d2)所述单链DNA的序列可为序列表中序列4;
e2)所述单链DNA的序列可为序列表中序列5;
f2)所述单链DNA的序列可为序列表中序列6;
g2)所述单链DNA的序列可为序列表中序列7;
h2)所述单链DNA的序列可为序列表中序列8;
i2)所述单链DNA的序列可为序列表中序列9;
j2)所述单链DNA的序列可为序列表中序列10;
k2)所述单链DNA的序列可为序列表中序列11;
l2)所述单链DNA的序列可为序列表中序列12;
m2)所述单链DNA的序列可为序列表中序列13;
n2)所述单链DNA的序列可为序列表中序列14。
上述成套引物中,每个引物对均可独立包装,每个引物对中的各单链DNA也均可独立包装。每个引物对中的两条单链DNA的摩尔比均可为1:1。
为解决上述技术问题,本发明还提供了鉴定或辅助鉴定食源性致病菌的系统,所述包括所述成套试剂;
所述食源性致病菌为大肠杆菌O157:H7、沙门氏菌、霍乱弧菌、单核细胞增生性李斯特菌、空肠弯曲杆菌、副溶血弧菌和/或金黄色葡萄球菌。
上述系统还可包括利用GeXP遗传分析系统检测DNA片段所需的试剂和/或仪器。
具体来说,所述系统可仅由所述成套试剂组成,所述系统也可由所述成套试剂与所述利用GeXP遗传分析系统检测DNA片段所需的试剂和/或仪器组成。
上述系统还可包括DNA聚合酶。所述DNA聚合酶具体可为Taq DNA聚合酶。所述Taq DNA聚合酶具体可为JumpStart Taq DNA Polymerase(美国SIGMA公司,D4184)。
具体来说,所述系统可仅由所述成套试剂组成,所述系统也可由所述成套试剂与所述DNA聚合酶组成,所述系统也可由所述成套试剂、所述DNA聚合酶与所述利用GeXP遗传分析系统检测DNA片段所需的试剂和/或仪器组成。
所述成套试剂中的各引物对、所述DNA聚合酶以及利用GeXP遗传分析系统检测DNA片段所需的试剂均可独立包装。
利用GeXP遗传分析系统检测DNA片段所需的试剂可包括也可仅为:GenomeLabTM GeXP Start Kit 5×PCR Buffer、25mM MgCl2、DNA size standard Kit-400Base Pairs和/或甲酰胺。所述可为GenomeLabTM GeXP Start Kit美国贝克曼公司产品。所述DNA size standard Kit-400Base Pairs可为美国贝克曼库尔特公司产品。
利用GeXP遗传分析系统检测DNA片段所需的仪器可为GenomeLab GeXP遗传分析系统
所述系统可为仅含有试剂的试剂或试剂盒。
为解决上述技术问题,本发明还提供了非诊断目的的检测食源性致病菌的方法,所述食源性致病菌为大肠杆菌O157:H7、沙门氏菌、霍乱弧菌、单核细胞增生性李斯特菌、空肠弯曲杆菌、副溶血弧菌和/或金黄色葡萄球菌;所述方法包括:利用所述成套试剂对待测样品的核酸进行PCR扩增,根据PCR产物确定所述待测样品是否含有所述食源性致病菌。
所述根据PCR产物确定所述待测样品是否含有所述食源性致病菌可根据所述PCR产物的大小或/和序列进行。所述根据PCR产物确定所述待测样品是否含有所述食源性致病菌可通过GenomeLab GeXP遗传分析系统和/或毛细管电泳进行。
所述根据PCR产物确定所述待测样品是否含有所述食源性致病菌具体可包括:
如所述PCR产物含有138-141bp的DNA片段,所述待测样品含有或候选含有大肠杆菌O157:H7;如所述PCR产物不含有138-141bp的DNA片段,所述待测样品不含有或候选不含有大肠杆菌O157:H7;
如所述PCR产物含有157-160bp的DNA片段,所述待测样品含有或候选含有沙门氏菌;如所述PCR产物不含有157-160bp的DNA片段,所述待测样品不含有或候选不含有沙门氏菌;
如所述PCR产物含有202-205bp的DNA片段,所述待测样品含有或候选含有霍乱弧菌;如所述PCR产物不含有202-205bp的DNA片段,所述待测样品不含有或候选不含有霍乱弧菌;
如所述PCR产物含有234-237bp的DNA片段,所述待测样品含有或候选含有单核细胞增生性李斯特菌;如所述PCR产物不含有234-237bp的DNA片段,所述待测样品不含有或候选不含有单核细胞增生性李斯特菌;
如所述PCR产物含有250-253bp的DNA片段,所述待测样品含有或候选含有空肠弯曲杆菌;如所述PCR产物不含有250-253bp的DNA片段,所述待测样品不含有或候选不含有空肠弯曲杆菌;
如所述PCR产物含有270-273bp的DNA片段,所述待测样品含有或候选含有副溶血弧菌;如所述PCR产物不含有270-273bp的DNA片段,所述待测样品不含有或候选不含有副溶血弧菌;
如所述PCR产物含有315-318bp的DNA片段,所述待测样品含有或候选含有金黄色葡萄球菌;如所述PCR产物不含有315-318bp的DNA片段,所述待测样品不含有或候选不含有金黄色葡萄球菌。
所述PCR扩增可采用所述DNA聚合酶进行。
所述PCR扩增的反应体系中所述成套试剂中各单链DNA的浓度均可为10nM。所述反应体系具体可包括:GenomeLabTM GeXP Start Kit 5×PCR Buffer,所述成套试剂,25mM MgCl2,所述DNA聚合酶,所述待测样品基因组DNAμg。
所述PCR扩增的反应程序可为:95℃30s,55℃30s,72℃30s,10个循环;95℃30s,63℃30s,72℃30s,10个循环;95℃30s,50℃30s,72℃30s,20个循环;4℃终止。
为解决上述技术问题,本发明还提供了所述成套试剂的制备方法,所述方法包括将所述成套试剂中各引物对的所述两条单链DNA分别单独包装。
为解决上述技术问题,本发明还提供了所述系统的制备方法,所述包括将所述成套试剂中各引物对的所述两条单链DNA分别单独包装。
为解决上述技术问题,本发明还提供了所述成套试剂的下述X1或X2的应用:
X1、在制备检测待测样品是否含有食源性致病菌产品中的应用;
X2、在检测待测样品是否含有食源性致病菌中的应用;
所述食源性致病菌为大肠杆菌O157:H7、沙门氏菌、霍乱弧菌、单核细胞增生性李斯特菌、空肠弯曲杆菌、副溶血弧菌和/或金黄色葡萄球菌。
上述产品可为试剂盒。
为解决上述技术问题,本发明还提供了所述系统的下述X1或X2的应用:
X1、在制备检测待测样品是否含有食源性致病菌产品中的应用;
X2、在检测待测样品是否含有食源性致病菌中的应用;
所述食源性致病菌为大肠杆菌O157:H7、沙门氏菌、霍乱弧菌、单核细胞增生性李斯特菌、空肠弯曲杆菌、副溶血弧菌和/或金黄色葡萄球菌。
所述产品可为试剂盒。
本发明的实验证明,使用本发明的鉴定或辅助鉴定食源性致病菌的成套试剂——引物对A、引物对B、引物对C、引物对D、引物对E、引物对F和引物对G同时检测食源性细菌,大肠杆菌O157:H7、沙门氏菌、霍乱弧菌、单核细胞增生性李斯特菌、空肠弯曲杆菌、副溶血弧菌和金黄色葡萄球菌的特异性强,灵敏度分别为10拷贝/μl、100拷贝/μl、10拷贝/μl、10拷贝/μl、10拷贝/μl、100拷贝/μl和100拷贝/μl,与分离培养、血清学鉴定等常规实验方法的鉴定结果相比,符合率达100%。本发明为常见的食源性致病菌的检测提供了简便、高通量的检测试剂盒和检测体系,更符合实际的需要,应用前景广阔。
附图说明
图1为利用鉴定或辅助鉴定食源性致病菌的成套试剂鉴定混合样品的结果。
图2为利用鉴定或辅助鉴定食源性致病菌的成套试剂鉴定混合样品的结果。
图3为利用鉴定或辅助鉴定食源性致病菌的成套试剂鉴定混合样品的结果。
图1-3中,横坐标为PCR扩增产物的碱基数,纵坐标为荧光信号值。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂、仪器等,如无特殊说明,均可从商业途径得到。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
下述实施例中的大肠杆菌O157:H7(CICC 10907菌株)为中国微生物菌种网北京北纳创联生物技术研究院(www.bnbio.com)产品;下述实施例中的另两株大肠杆菌O157:H7RS1菌株和RS1菌株分别记载在文献“广西畜禽大肠杆菌O157:H7流行病学调查”,中国人畜共患病学报,2011,27(12):1151-1155中。
下述实施例中的肠炎沙门氏菌(CVCC2182菌株、CVCC2183菌株、CVCC2184菌株)、鸡沙门氏菌(CVCC533菌株)、马流产沙门氏菌(CVCC514菌株)、猪霍乱沙门氏菌(CVCC2179菌株)、伤寒沙门氏菌(CVCC2213菌株)、雷丁沙门氏菌(CVCC2210菌株)、甲型副伤寒沙门氏菌(CVCC2189菌株)、鼠伤寒沙门氏菌(CVCC2233菌株)、肠炎沙门氏菌亚种(CVCC3374菌株、CVCC3375菌株、CVCC3376菌株)均为中国兽医微生物菌种保藏管理中心产品,
下述实施例中的1株非O1/O139群血清型霍乱弧菌(CICC23794菌株)、2株单核细胞增生性李斯特菌(ATCC 19111菌株、ATCC19115菌株)、1株空肠弯曲菌(ATCC33291菌株)、2株副溶血弧菌(ATCC33847菌株、ATCC17802菌株)均为中国微生物菌种网北京北纳创联生物技术研究院(www.bnbio.com)产品;2株霍乱弧菌(KY448998菌株、KY448999菌株)、2株单核细胞增生性李斯特菌(KY448997菌株、KY449003菌株)、1株空肠弯曲杆菌(KY449002菌株)以及2株副溶血弧菌(KY449000菌株、KY449001菌株)均由广西壮族自治区兽医研究所分离得到。
下述实施例中的金黄色葡萄球菌(ATCC29213菌株、ATCC43300菌株)均为中国普通微生物菌种保藏管理中心产品
实施例1、鉴定或辅助鉴定食源性致病菌的成套试剂的制备
鉴定或辅助鉴定食源性致病菌的成套试剂,由名称分别为引物对A、引物对B、引物对C、引物对D、引物对E、引物对F和引物对G的引物组成;
引物对A由名称分别为A-F和A-R的单链DNA组成;能从大肠杆菌O157:H7的基因组DNA中扩增得到大小为139bp的DNA片段;引物序列如下:
A-F:AGGTGACACTATAGAATATTCGATGAGTTTATCTGCAAGGTGA(序列表序列1);
A-R:GTACGACTCACTATAGGGATAAAGATGTTTTTCACACTTATTGG(序列表序列2);
引物对B由名称分别为B-F和B-R的单链DNA组成;能从沙门氏菌的基因组DNA中扩增得到大小为158bp的DNA片段;引物序列如下:
B-F:AGGTGACACTATAGAATAAAATCGTGCAGTGGCTTA(序列表序列3);
B-R:GTACGACTCACTATAGGGAAAGGCGCGGTCTTTACTATC(序列表序列4);
引物对C由名称分别为C-F和C-R的单链DNA组成;能从霍乱弧菌的基因组DNA中扩增得到大小为203bp的DNA片段;引物序列如下:
C-F:AGGTGACACTATAGAATAACTCGCTGCTACGCCATTT(序列表序列5);
C-R:GTACGACTCACTATAGGGATCAAACCCGCACCAACA(序列表序列6);
引物对D由名称分别为D-F和D-R的单链DNA组成;能从单核细胞增生性李斯特菌的基因组DNA中扩增得到大小为235bp的DNA片段;引物序列如下:
D-F:AGGTGACACTATAGAATAGGGAAATCTGTCTCAGGTGAT(序列表序列7);
D-R:GTACGACTCACTATAGGGAGTTTGTTGTATAGGCAATGGG(序列表序列8);
引物对E由名称分别为E-F和E-R的单链DNA组成;能从空肠弯曲杆菌的基因组DNA中扩增得到大小为251bp的DNA片段;引物序列如下:
E-F:AGGTGACACTATAGAATACTGCCATACCCGCACTATC(序列表序列9);
E-R:GTACGACTCACTATAGGGAAAACCATAAGACAAAGGACGC(序列表序列10);
引物对F由名称分别为F-F和F-R的单链DNA组成;能从副溶血弧菌的基因组DNA中扩增得到大小为271bp的DNA片段;引物序列如下:
F-F:AGGTGACACTATAGAATAAACAATGACGCCTCTRCTAATG(序列表序列11);
F-R:GTACGACTCACTATAGGGAACTCACCAATCTGACGGAACT(序列表序列12);
引物对G由名称分别为G-F和G-R的单链DNA组成;能从金黄色葡萄球菌的基因组DNA中扩增得到大小为316bp的DNA片段;引物序列如下:
G-F:AGGTGACACTATAGAATAGCGATTGATGGTGATACGG(序列表序列13);
G-R:GTACGACTCACTATAGGGAGCCAAGCCTTGACGAACTA(序列表序列14)。
每条引物中的下划线部分为GeXP通用引物,非下划线部分为相应引物的特异部分,用于识别相应细菌。
每个引物对的两条引物均独立包装,每个引物对中两条单链DNA的摩尔比均为1:1。
实施例2、鉴定或辅助鉴定食源性致病菌的成套试剂的特异性
1、待测菌株的选择
所用菌株为:3株大肠杆菌O157:H7(CICC 10907菌株、RS1菌株、RS2菌株);
13株沙门氏菌:肠炎沙门氏菌(CVCC2182菌株、CVCC2183菌株、CVCC2184菌株)、鸡沙门氏菌(CVCC533菌株)、马流产沙门氏菌(CVCC514菌株)、猪霍乱沙门氏菌(CVCC2179菌株)、伤寒沙门氏菌(CVCC2213菌株)、雷丁沙门氏菌(CVCC2210菌株)、甲型副伤寒沙门氏菌(CVCC2189菌株)、鼠伤寒沙门氏菌(CVCC2233菌株)、肠炎沙门氏菌亚种(CVCC3374菌株、CVCC3375菌株、CVCC3376菌株);
3株霍乱弧菌(KY448998菌株、KY448999菌株、CICC23794菌株);
4株单核细胞增生性李斯特菌(KY448997菌株、KY449003菌株、ATCC 19111菌株、ATCC19115菌株);
2株空肠弯曲杆菌(KY449002菌株、ATCC33291菌株);
4株副溶血弧菌(KY449000菌株、KY449001菌株、ATCC33847菌株、ATCC17802菌株);
2株金黄色葡萄球菌(ATCC29213菌株、ATCC43300菌株)。
使用细菌DNA提取试剂盒(北京全式金生物技术有限公司产品,目录号为EE161),提取各菌株的基因组DNA,用NanDrop ND-1000微量核酸检测仪购自赛默飞公司(美国)测定其OD值,得出其浓度与纯度值,并以此控制核酸质量。
2、鉴定或辅助鉴定食源性致病菌的成套试剂中各引物对的特异性检测
2.1引物对A
1)PCR扩增
用实施例1的引物对A对步骤1中各菌株的基因组DNA分别进行PCR扩增,反应体系和反应程序如下:
反应体系(20μL):GenomeLabTM GeXP Start Kit 5×PCR Buffer(含GeXP通用引物对,美国贝克曼公司,PN A85017)4μL,引物对A(每条引物在反应体系中的浓度均为10nM),25mM MgCl2 4μL(美国贝克曼公司,PN A25395),JumpStart Taq DNA Polymerase(美国SIGMA公司,D4184)1.4μL,菌株基因组DNA 0.5pg-0.5μg,加灭菌水至20μL。每个菌株设置3个重复,每个反应体系一种菌株的基因组DNA,以ddH2O替换菌株基因组DNA作为阴性对照。
反应程序:95℃30s,55℃30s,72℃30s,10个循环;95℃30s,63℃30s,72℃30s,10个循环;95℃30s,50℃30s,72℃30s,20个循环;4℃终止。
2)毛细管电泳
使用GenomeLab GeXP遗传分析系统对步骤1)的各PCR产物同时进行毛细管电泳检测,操作步骤如下:将DNA size standard Kit-400Base Pairs(美国贝克曼库尔特公司,目录编号608098)与上样缓冲液按体积比1:100彻底混匀,在样品板上每孔加入39μL混匀好的液体,而后向样品板上每孔中加入步骤1的PCR产物1μL(每孔一种PCR产物),吹打混匀,最后在每孔滴入一滴石蜡油进行封闭,以免甲酰胺氧化和样品蒸发。所用上样缓冲液为甲酰胺(美国贝克曼库尔特公司,目录编号608082)。在缓冲液板上每孔加入2/3的分离缓冲液,进行毛细管电泳。毛细管电泳的条件如下:毛细管升温:温度50℃;变性:90℃,120s;注入样品至毛细管中:2.0KV,30s;分离:6.0KV,35min。利用GenomeLab GeXP遗传分析系统分析步骤1)的各PCR产物大小,由于毛细管电泳分离过程中产生的DNA片段大小漂移现象,经GenomeLab GeXP遗传分析系统毛细管电泳确定的各PCR产物的测定大小与其实际大小的差值在1~2bp以内。
结果:3株大肠杆菌O157:H7(CICC 10907菌株、RS1菌株、RS2菌株)的基因组DNA样品均可扩增得到138-141bp的扩增产物,将扩增产物进行测序,发现这3株大肠杆菌O157:H7的扩增产物的大小均为139bp,且各扩增产物的序列均为引物对A的靶序列。13株沙门氏菌、3株霍乱弧菌、4株单核细胞增生性李斯特菌、2株空肠弯曲杆菌、4株副溶血弧菌、2株金黄色葡萄球菌的DNA样品及阴性对照均无任何扩增产物。结果表明:引物对A的特异性很好,可以特异检出大肠杆菌O157:H7。
2.2引物对B
1)PCR扩增
按照步骤2.1中1)的方法,将“实施例1的引物对A”替换为“实施例1的引物对B”,其他步骤均不变,得到引物对B对各菌株分别进行PCR扩增的PCR产物。
2)毛细管电泳
按照步骤2.1中2)的方法,利用GenomeLab GeXP遗传分析系统分析步骤1)的各PCR产物。
结果:13株沙门氏菌(肠炎沙门氏菌(CVCC2182菌株、CVCC2183菌株、CVCC2184菌株)、鸡沙门氏菌(CVCC533菌株)、马流产沙门氏菌(CVCC514菌株)、猪霍乱沙门氏菌(CVCC2179菌株)、伤寒沙门氏菌(CVCC2213菌株)、雷丁沙门氏菌(CVCC2210菌株)、甲型副伤寒沙门氏菌(CVCC2189菌株)、鼠伤寒沙门氏菌(CVCC2233菌株)、肠炎沙门氏菌亚种(CVCC3374菌株、CVCC3375菌株、CVCC3376菌株))的DNA样品均可扩增得到157-160bp的扩增产物,经测序检测,各沙门氏菌株的扩增产物大小均为158bp,且各扩增产物的序列均为引物对B的靶序列。其余非沙门氏菌(3株大肠杆菌O157:H7、3株霍乱弧菌、4株单核细胞增生性李斯特菌、2株空肠弯曲杆菌、4株副溶血弧菌和2株金黄色葡萄球菌)及阴性对照均无任何扩增产物。结果表明,引物对B的特异性很好,可以特异检出沙门氏菌。
2.3引物对C
1)PCR扩增
按照步骤2.1中1)的方法,将“实施例1的引物对A”替换为“实施例1的引物对C”,其他步骤均不变,得到引物对C对各菌株分别进行PCR扩增的PCR产物。
2)毛细管电泳
按照步骤2.1中2)的方法,利用GenomeLab GeXP遗传分析系统分析步骤1)的各PCR产物。
结果:3株霍乱弧菌(KY448998菌株、KY448999菌株、CICC23794菌株)的DNA样品可扩增得到202-205bp的扩增产物,经测序证实,各霍乱弧菌株的扩增产物均大小为203bp,且各扩增产物的序列均为引物对C的靶序列。其余霍乱弧菌(3株大肠杆菌O157:H7、13株沙门氏菌、4株单核细胞增生性李斯特菌、2株空肠弯曲杆菌、4株副溶血弧菌和2株金黄色葡萄球菌)及阴性对照均无任何扩增产物。结果表明,引物对C的特异性很好,可以特异检出霍乱弧菌。
2.4引物对D
1)PCR扩增
按照步骤2.1中1)的方法,将“实施例1的引物对A”替换为“实施例1的引物对D”,其他步骤均不变,得到引物对D对各菌株分别进行PCR扩增的PCR产物。
2)毛细管电泳
按照步骤2.1中2)的方法,利用GenomeLab GeXP遗传分析系统分析步骤1)的各PCR产物。
结果:4株单核细胞增生性李斯特菌(KY448997菌株、KY449003菌株、ATCC 19111菌株、ATCC19115菌株)的DNA样品均可扩增得到234-237bp的扩增产物,经测序证实,各单核细胞增生性李斯特菌株的扩增产物大小均为235bp,且各扩增产物的序列均为引物对D的靶序列;其余非单核细胞增生性李斯特菌(3株大肠杆菌O157:H7、13株沙门氏菌、3株霍乱弧菌、2株空肠弯曲杆菌、4株副溶血弧菌和2株金黄色葡萄球菌)及阴性对照均无任何扩增产物。结果表明,引物对D的特异性很好,可以特异检出单核细胞增生性李斯特菌。
2.5引物对E
1)PCR扩增
按照步骤2.1中1)的方法,将“实施例1的引物对A”替换为“实施例1的引物对E”,其他步骤均不变,得到引物对E对各菌株分别进行PCR扩增的PCR产物。
2)毛细管电泳
按照步骤2.1中2)的方法,利用GenomeLab GeXP遗传分析系统分析步骤1)的各PCR产物。
结果:2株空肠弯曲杆菌(KY449002菌株、ATCC33291菌株)的DNA样品可扩增得到250-253bp的扩增产物,经测序证实,该空肠弯曲杆菌株的扩增产物大小为251bp,且该扩增产物的序列为引物对E的靶序列;非空肠弯曲杆菌(3株大肠杆菌O157:H7、13株沙门氏菌、3株霍乱弧菌、4株单核细胞增生性李斯特菌、4株副溶血弧菌和2株金黄色葡萄球菌)及阴性对照均无任何扩增产物。结果表明,引物对E的特异性很好,可以特异检出空肠弯曲杆菌。
2.6引物对F
1)PCR扩增
按照步骤2.1中1)的方法,将“实施例1的引物对A”替换为“实施例1的引物对F”,其他步骤均不变,得到引物对F对各菌株分别进行PCR扩增的PCR产物。
2)毛细管电泳
按照步骤2.1中2)的方法,利用GenomeLab GeXP遗传分析系统分析步骤1)的各PCR产物。
结果:4株副溶血弧菌(KY449000菌株、KY449001菌株、ATCC33847菌株、ATCC17802菌株)的DNA样品均可扩增得到270-273bp的扩增产物,经测序证实,各副溶血弧菌株的扩增产物大小均为271bp,且各扩增产物的序列均为引物对F的靶序列;非副溶血弧菌(3株大肠杆菌O157:H7、13株沙门氏菌、3株霍乱弧菌、4株单核细胞增生性李斯特菌、2株空肠弯曲杆菌和2株金黄色葡萄球菌)及阴性对照均无任何扩增产物。结果表明,引物对F的特异性很好,可以特异检出副溶血弧菌。
2.7引物对G
1)PCR扩增
按照步骤2.1中1)的方法,将“实施例1的引物对A”替换为“实施例1的引物对G”,其他步骤均不变,得到引物对G对各菌株分别进行PCR扩增的PCR产物。
2)毛细管电泳
按照步骤2.1中2)的方法,利用GenomeLab GeXP遗传分析系统分析步骤1)的各PCR产物。
结果:2株金黄色葡萄球菌(ATCC29213菌株、ATCC43300菌株)的DNA样品均可扩增得到315-318bp的扩增产物,经测序证实,各金黄色葡萄球菌株的扩增产物大小均为316bp,且各扩增产物的序列均为引物对G的靶序列;非金黄色葡萄球菌(3株大肠杆菌O157:H7、13株沙门氏菌、3株霍乱弧菌、4株单核细胞增生性李斯特菌、2株空肠弯曲杆菌和4株副溶血弧菌)及阴性对照均无任何扩增产物。结果表明,引物对G的特异性很好,可以特异检出金黄色葡萄球菌。
3、鉴定或辅助鉴定食源性致病菌的成套试剂的特异性检测
用实施例1的鉴定或辅助鉴定食源性致病菌的成套试剂在同一个PCR反应体系中分别以步骤1的3株大肠杆菌O157:H7、13株沙门氏菌、3株霍乱弧菌、4株单核细胞增生性李斯特菌、2株空肠弯曲杆菌、4株副溶血弧菌和2株金黄色葡萄球菌的基因组DNA为模板进行PCR扩增,以ddH2O替换基因组DNA作为阴性对照,反应体系和反应程序如下:
反应体系(20μL):GenomeLabTM GeXP Start Kit 5×PCR Buffer(含GeXP通用引物对,美国贝克曼公司,PN A85017)4μL,实施例1的鉴定或辅助鉴定食源性致病菌的成套试剂(各引物对中的每条引物在反应体系中的浓度均为10nM)、25mM MgCl2 4μL(美国贝克曼公司,PN A25395),JumpStart Taq DNA Polymerase(美国SIGMA公司,D4184)1.4μL,菌株基因组DNA 0.5pg-0.5μg,加灭菌水至20μL。每个菌株设置3个重复,每个反应体系一种菌株的基因组DNA。
反应程序:95℃30s,55℃30s,72℃30s,10个循环;95℃30s,63℃30s,72℃30s,10个循环;95℃30s,50℃30s,72℃30s,20个循环;4℃终止。
毛细管电泳:按照步骤2的2.1中2)的方法,利用GenomeLab GeXP遗传分析系统分析各菌株的PCR产物。
结果:利用实施例1的鉴定或辅助鉴定食源性致病菌的成套试剂对各菌株的基因组DNA进行PCR扩增,阴性对照无任何PCR产物,当模板为3株大肠杆菌O157:H7时,这3株大肠杆菌O157:H7的PCR产物均含有138-141bp的目的峰,且均不含有157-160bp、202-205bp、234-237bp、250-253bp、270-273bp和315-318bp中的任一峰,将该PCR产物进行测序,发现这3株大肠杆菌O157:H7的扩增产物的大小均为139bp,且各扩增产物的序列均为引物对A的靶序列;
当模板为13株沙门氏菌时,这13株沙门氏菌的PCR产物均含有157-160bp的目的峰,且均不含有138-141bp、202-205bp、234-237bp、250-253bp、270-273bp和315-318bp中的任一峰,将该PCR产物进行测序,发现这13株沙门氏菌的扩增产物的大小均为158bp,且各扩增产物的序列均为引物对B的靶序列;
当模板为4株霍乱弧菌时,这4株霍乱弧菌的PCR产物均含有202-205bp的目的峰,且均不含有138-141bp、157-160bp、234-237bp、250-253bp、270-273bp和315-318bp中的任一峰,将该PCR产物进行测序,发现这4株霍乱弧菌的扩增产物的大小均为203bp,且各扩增产物的序列均为引物对C的靶序列;
当模板为4株单核细胞增生性李斯特菌时,这4株单核细胞增生性李斯特菌的PCR产物均含有234-237bp的目的峰,且均不含有138-141bp、157-160bp、202-205bp、250-253bp、270-273bp和315-318bp中的任一峰,将该PCR产物进行测序,发现这4株单核细胞增生性李斯特菌的扩增产物的大小均为235bp,且各扩增产物的序列均为引物对D的靶序列;
当模板为2株空肠弯曲杆菌时,这2株空肠弯曲杆菌的PCR产物均含有250-253bp的目的峰,且均不含有138-141bp、157-160bp、202-205bp、234-237bp、270-273bp和315-318bp中的任一峰,将该PCR产物进行测序,发现这2株空肠弯曲杆菌的扩增产物的大小均为251bp,且各扩增产物的序列均为引物对E的靶序列;
当模板为4株副溶血弧菌时,这4株副溶血弧菌的PCR产物均含有270-273bp的目的峰,且均不含有138-141bp、157-160bp、202-205bp、234-237bp、250-253bp和315-318bp中的任一峰,将该PCR产物进行测序,发现这4株副溶血弧菌的扩增产物的大小均为271bp,且各扩增产物的序列均为引物对F的靶序列;
当模板为2株金黄色葡萄球菌时,这2株金黄色葡萄球菌的PCR产物均含有315-318bp的目的峰,且均不含有138-141bp、157-160bp、202-205bp、234-237bp、250-253bp和270-273bp中的任一峰,将该PCR产物进行测序,发现这2株金黄色葡萄球菌的扩增产物的大小均为316bp,且各扩增产物的序列均为引物对G的靶序列。
上述结果表明:在利用鉴定或辅助鉴定食源性致病菌的成套试剂检测待测样品时,引物间无交叉反应,对各引物对的特异性无影响,该成套试剂可用于检测大肠杆菌O157:H7、沙门氏菌、霍乱弧菌、单核细胞增生性李斯特菌、空肠弯曲杆菌、副溶血弧菌和金黄色葡萄球菌:如PCR产物含有139bp的目的峰(可体现为在138-141bp间有目的峰),则待测样品含有大肠杆菌O157:H7;如PCR产物含有158bp的目的峰(可体现为在157-160bp间有目的峰),则待测样品含有沙门氏菌;如PCR产物含有203bp的目的峰(可体现为在202-205bp间有目的峰),则待测样品含有霍乱弧菌;如PCR产物含有235bp的目的峰(可体现为在234-237bp间有目的峰),则待测样品含有单核细胞增生性李斯特菌;如PCR产物含有251bp的目的峰(可体现为在250-253bp间有目的峰),则待测样品含有空肠弯曲杆菌;如PCR产物含有271bp的目的峰(可体现为在270-273bp间有目的峰),则待测样品含有副溶血弧菌;如PCR产物含有316bp的目的峰(可体现为在315-318bp间有目的峰),则待测样品含有金黄色葡萄球菌。
引物对A-G、含有引物对A-G的PCR试剂或含有引物对A-G的试剂盒均可用来对待测样本进行检测,从而判断待测样本是否含有大肠杆菌O157:H7、沙门氏菌、霍乱弧菌、单核细胞增生性李斯特菌、空肠弯曲杆菌、副溶血弧菌和金黄色葡萄球菌。
实施例3、鉴定或辅助鉴定食源性致病菌的成套试剂的灵敏度检测
一、制备含靶基因的单克隆质粒标准品
分别将实施例2步骤2中以大肠杆菌O157:H7(CICC 10907菌株)基因组DNA为模板引物对A的PCR产物、以肠炎沙门氏菌(CVCC2182菌株)基因组DNA为模板引物对B的PCR产物、以霍乱弧菌(CICC23794菌株)基因组DNA为模板引物对C的PCR产物、以单核细胞增生性李斯特菌(ATCC 19111菌株)基因组DNA为模板引物对D的PCR产物、以空肠弯曲杆菌(ATCC33291菌株)基因组DNA为模板引物对E的PCR产物、以副溶血弧菌(ATCC33847菌株)基因组DNA为模板引物对F的PCR产物以及以金黄色葡萄球菌(ATCC29213菌株)基因组DNA为模板引物对G的PCR产物与质粒pMD 18-T vector连接(宝生物工程(大连)有限公司,6011),得到获得7种含有正确序列目的片段的重组质粒,分别命名为PA、PB、PC、PD、PE、PF和PG,每种重组质粒中一个拷贝的质粒含有一个拷贝的相应引物对的靶序列。
利用NanDrop ND-1000微量核酸检测仪测定各含靶基因重组质粒的浓度,并根据重组质粒的分子量和浓度计算相应的拷贝数。调整各质粒的浓度,得到浓度分别为106、105、104、103、102和101拷贝/μL的六种PA溶液,浓度分别为106、105、104、103、102和101拷贝/μL的六种PB溶液,浓度分别为106、105、104、103、102和101拷贝/μL的六种PC溶液,浓度分别为106、105、104、103、102和101拷贝/μL的六种PD溶液,浓度分别为106、105、104、103、102和101拷贝/μL的六种PE溶液,浓度分别为106、105、104、103、102和101拷贝/μL的六种PF溶液,浓度分别为106、105、104、103、102和101拷贝/μL的六种PG溶液。
将七种高浓度质粒混合,调整浓度,得到PA、PB、PC、PD、PE、PF和PG浓度均为105拷贝/μL的质粒混合液,再按10倍比稀释,分别得到PA、PB、PC、PD、PE、PF和PG浓度均为104拷贝/μL、103拷贝/μL、102拷贝/μL和101拷贝/μL的质粒混合液,混合液中每种质粒的浓度均相等。
二、灵敏度检测
实验重复三次,每次重复实验的具体步骤如下:
1.检测单一质粒的灵敏度
1.1 PA溶液
分别以浓度分别为106、105、104、103、102和101拷贝/μL的PA溶液为模板,利用实施例1的成套试剂进行PCR扩增,以ddH2O替换PA溶液作为阴性对照,反应体系和反应程序如下:
反应体系(20μL):GenomeLabTM GeXP Start Kit 5×PCR Buffer(含GeXP通用引物对,美国贝克曼公司,PN A85017)4μL,实施例1的鉴定或辅助鉴定食源性致病菌的成套试剂(各引物对中的每条引物在反应体系中的浓度均为10nM)、25mM MgCl2 4μL(美国贝克曼公司,PN A25395),JumpStart Taq DNA Polymerase(美国SIGMA公司,D4184)1.4μL,PA溶液1μL,加灭菌水至20μL。每种浓度的PA溶液均设置3个重复,每个反应体系一种浓度的PA溶液。
反应程序:95℃30s,55℃30s,72℃30s,10个循环;95℃30s,63℃30s,72℃30s,10个循环;95℃30s,50℃30s,72℃30s,20个循环;4℃终止。
毛细管电泳:按照实施例2步骤2的2.1中2)的方法,利用GenomeLab GeXP遗传分析系统分析各PCR产物。
结果显示,出现目的峰的PA溶液的最低浓度为10拷贝/μL,表明实施例1的鉴定或辅助鉴定食源性致病菌的成套试剂检测大肠杆菌O157:H7的灵敏度为10拷贝/μL。
1.2 PB溶液
按照步骤1.2的方法,分别以浓度分别为106、105、104、103、102和101拷贝/μL的PB溶液为模板,利用实施例1的成套试剂进行PCR扩增,结果显示,出现目的峰的PB溶液的最低浓度为10拷贝/μL,表明实施例1的鉴定或辅助鉴定食源性致病菌的成套试剂检测沙门氏菌的灵敏度为10拷贝/μL。
1.3 PC溶液
按照步骤1.2的方法,分别以浓度分别为106、105、104、103、102和101拷贝/μL的PC溶液为模板,利用实施例1的成套试剂进行PCR扩增,结果显示,出现目的峰的PC溶液的最低浓度为100拷贝/μL,表明实施例1的鉴定或辅助鉴定食源性致病菌的成套试剂检测霍乱弧菌的灵敏度为100拷贝/μL。
1.4 PD溶液
按照步骤1.2的方法,分别以浓度分别为106、105、104、103、102和101拷贝/μL的PD溶液为模板,利用实施例1的成套试剂进行PCR扩增,结果显示,出现目的峰的PD溶液的最低浓度为100拷贝/μL,表明实施例1的鉴定或辅助鉴定食源性致病菌的成套试剂检测单核细胞增生性李斯特菌的灵敏度为100拷贝/μL。
1.5 PE溶液
按照步骤1.2的方法,分别以浓度分别为106、105、104、103、102和101拷贝/μL的PE溶液为模板,利用实施例1的成套试剂进行PCR扩增,结果显示,出现目的峰的PE溶液的最低浓度为10拷贝/μL,表明实施例1的鉴定或辅助鉴定食源性致病菌的成套试剂检测空肠弯曲杆菌的灵敏度为10拷贝/μL。
1.6 PF溶液
按照步骤1.2的方法,分别以浓度分别为106、105、104、103、102和101拷贝/μL的PF溶液为模板,利用实施例1的成套试剂进行PCR扩增,结果显示,出现目的峰的PF溶液的最低浓度为100拷贝/μL,表明实施例1的鉴定或辅助鉴定食源性致病菌的成套试剂检测副溶血弧菌的灵敏度为100拷贝/μL。
1.7 PG溶液
按照步骤1.2的方法,分别以浓度分别为106、105、104、103、102和101拷贝/μL的PG溶液为模板,利用实施例1的成套试剂进行PCR扩增,结果显示,出现目的峰的PG溶液的最低浓度为10拷贝/μL,表明实施例1的鉴定或辅助鉴定食源性致病菌的成套试剂检测金黄色葡萄球菌的灵敏度为100拷贝/μL。
2.检测混合质粒的灵敏度
分别以PA、PB、PC、PD、PE、PF和PG浓度均为105拷贝/μL、104拷贝/μL、103拷贝/μL、102拷贝/μL和101拷贝/μL的五种质粒混合液为模板,利用实施例1的成套试剂进行PCR扩增,以ddH2O替换质粒混合液作为阴性对照,反应体系和反应程序如下:
反应体系(20μL):GenomeLabTM GeXP Start Kit 5×PCR Buffer(含GeXP通用引物对,美国贝克曼公司,PN A85017)4μL,实施例1的鉴定或辅助鉴定食源性致病菌的成套试剂(各引物对中的每条引物在反应体系中的浓度均为10nM)、25mM MgCl2 4μL(美国贝克曼公司,PN A25395),JumpStart Taq DNA Polymerase(美国SIGMA公司,D4184)1.4μL,质粒混合液1μL,加灭菌水至20μL。每种浓度的质粒混合液均设置3个重复,每个反应体系一种浓度的质粒混合液。
反应程序:95℃30s,55℃30s,72℃30s,10个循环;95℃30s,63℃30s,72℃30s,10个循环;95℃30s,50℃30s,72℃30s,20个循环;4℃终止。
毛细管电泳:按照实施例2步骤2的2.1中2)的方法,利用GenomeLab GeXP遗传分析系统分析各PCR产物。
结果显示,以PA、PB、PC、PD、PE、PF和PG浓度均为105拷贝/μL、104拷贝/μL、103拷贝/μL和102拷贝/μL质粒混合液为模板的PCR产物检测结果中均含有引物对A-G的目的峰,即每种质粒混合液的PCR产物均含有七种目的峰;以PA、PB、PC、PD、PE、PF和PG浓度均为101拷贝/μL质粒混合液为模板的PCR产物检测结果中均只含有引物对A和B的目的峰,均不含有引物对C-G的目的峰。表明,实施例1的成套试剂检测检测大肠杆菌O157:H7的灵敏度为10拷贝/μL,检测沙门氏菌的灵敏度为10拷贝/μL,检测霍乱弧菌的灵敏度为100拷贝/μL,检测单核细胞增生性李斯特菌的灵敏度为100拷贝/μL,检测空肠弯曲杆菌的灵敏度为10拷贝/μL,检测副溶血弧菌的灵敏度为100拷贝/μL,检测金黄色葡萄球菌的灵敏度为100拷贝/μL。
实施例4、利用鉴定或辅助鉴定食源性致病菌的成套试剂检测实际样品
1、待测样品的制备
将从市场上采购的鸡肉分成5g/份的鸡肉样品。
将大肠杆菌O157:H7(CICC 10907菌株)分别接种于10份鸡肉中,得到10份感染大肠杆菌O157:H7的鸡肉;将肠炎沙门氏菌(CVCC2182菌株)分别接种于10份鸡肉中,得到10份感染肠炎沙门氏菌的鸡肉;将霍乱弧菌(CICC23794菌株)分别接种于10份鸡肉中,得到10份感染霍乱弧菌的鸡肉;将单核细胞增生性李斯特菌(ATCC19111菌株)分别接种于10份鸡肉中,得到10份感染单核细胞增生性李斯特菌的鸡肉;将空肠弯曲杆菌(ATCC33291菌株)分别接种于10份鸡肉中,得到10份感染空肠弯曲杆菌的鸡肉;将副溶血弧菌(ATCC33847菌株)分别接种于10份鸡肉中,得到10份感染副溶血弧菌的鸡肉;将金黄色葡萄球菌(ATCC29213菌株)分别接种于10份鸡肉中,得到10份感染金黄色葡萄球菌的鸡肉。
2、单独样品的检测
分别提取上述感染不同病菌鸡肉的基因组DNA,以感染每种病菌的每份样品的基因组DNA为模板,利用实施例1的成套试剂进行PCR扩增,按照实施例2步骤3的方法进行检测待测样品。以水代替模板作为阴性对照。
结果显示,阴性对照无任何PCR产物。当模板为感染大肠杆菌O157:H7的鸡肉基因组DNA时,这10份样品的PCR产物均含有138-141bp的目的峰,且均不含有157-160bp、202-205bp、234-237bp、250-253bp、270-273bp和315-318bp中的任一峰;当模板为感染沙门氏菌的鸡肉基因组DNA时,这10份样品的PCR产物均含有157-160bp的目的峰,且均不含有138-141bp、202-205bp、234-237bp、250-253bp、270-273bp和315-318bp中的任一峰;当模板为感染霍乱弧菌的鸡肉基因组DNA时,这10份样品的PCR产物均含有202-205bp的目的峰,且均不含有138-141bp、157-160bp、234-237bp、250-253bp、270-273bp和315-318bp中的任一峰;当模板为感染单核细胞增生性李斯特菌的鸡肉基因组DNA时,这10份样品的PCR产物均含有234-237bp的目的峰,且均不含有138-141bp、157-160bp、202-205bp、250-253bp、270-273bp和315-318bp中的任一峰;当模板为感染空肠弯曲杆菌的鸡肉基因组DNA时,这10份样品的PCR产物均含有250-253bp的目的峰,且均不含有138-141bp、157-160bp、202-205bp、234-237bp、270-273bp和315-318bp中的任一峰;当模板为感染副溶血弧菌的鸡肉基因组DNA时,这10份样品的PCR产物均含有270-273bp的目的峰,且均不含有138-141bp、157-160bp、202-205bp、234-237bp、250-253bp和315-318bp中的任一峰;当模板为感染金黄色葡萄球菌的鸡肉基因组DNA时,这10份样品的PCR产物均含有315-318bp的目的峰,且均不含有138-141bp、157-160bp、202-205bp、234-237bp、250-253bp和270-273bp中的任一峰。表明,利用实施例1的成套试剂检测待测样品是否含有大肠杆菌O157:H7、肠炎沙门氏菌、霍乱弧菌、单核细胞增生性李斯特菌、空肠弯曲杆菌、副溶血弧菌和金黄色葡萄球菌的准确率均达100%。
3、混合样品的检测
实验重复三次,每次重复实验的具体步骤如下:
各取1份感染大肠杆菌O157:H7的鸡肉、感染霍乱弧菌的鸡肉、感染空肠弯曲杆菌的鸡肉和感染副溶血弧菌的鸡肉混合,提取基因组DNA,以该基因组DNA为模板,利用实施例1的成套试剂进行PCR扩增,按照实施例2步骤3的方法进行检测待测样品。结果显示,该组样品可检出138-141bp、202-205bp、250-253bp和270-273bp的四个目的峰(目的峰分别为139.16bp、203.13bp、250.60bp和271.58bp,图1),且无其他杂峰,表明该样品中含有大肠杆菌O157:H7、霍乱弧菌、空肠弯曲杆菌和副溶血弧菌,与实际相符。
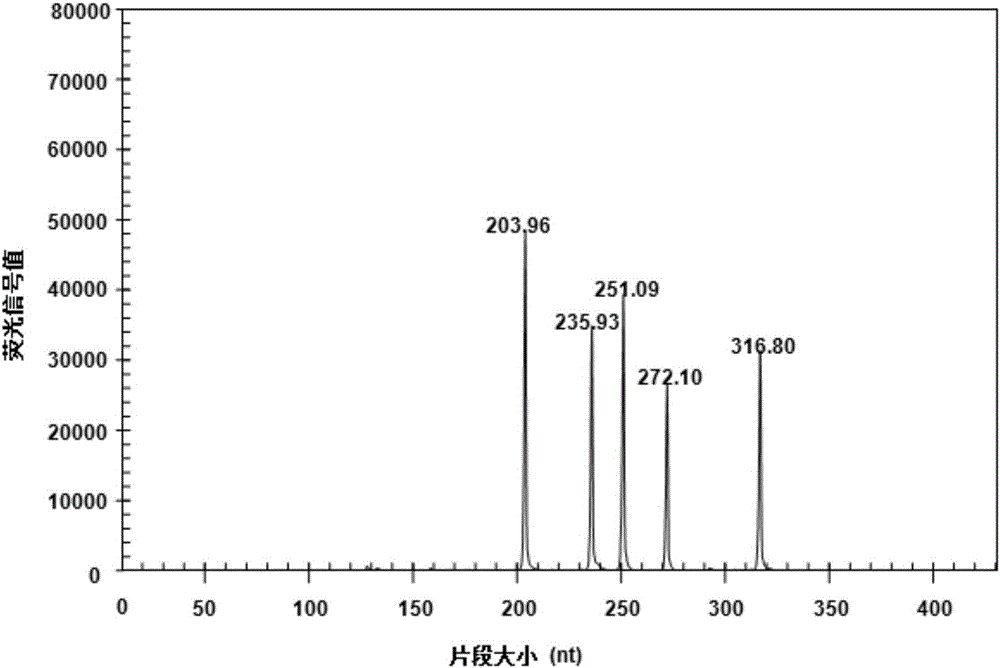
各取1份感染霍乱弧菌的鸡肉、感染单核细胞增生性李斯特菌的鸡肉、感染空肠弯曲杆菌的鸡肉、感染副溶血弧菌的鸡肉和感染金黄色葡萄球菌的鸡肉混合,提取基因组DNA,以该基因组DNA为模板,利用实施例1的成套试剂进行PCR扩增,按照实施例2步骤3的方法进行检测待测样品。结果显示,该组样品可检出202-205bp、234-237bp、250-253bp、270-273bp和315-318bp五个目的峰(203.96bp、235.93bp、251.09bp、272.10bp和316.80bp,图2),且无其他杂峰,表明该样品中含有霍乱弧菌、单核细胞增生性李斯特菌、空肠弯曲杆菌、副溶血弧菌和金黄色葡萄球菌,与实际相符。
各取1份感染大肠杆菌O157:H7的鸡肉、感染沙门氏菌的鸡肉、感染霍乱弧菌的鸡肉、感染单核细胞增生性李斯特菌的鸡肉、感染空肠弯曲杆菌的鸡肉、感染副溶血弧菌的鸡肉和感染金黄色葡萄球菌的鸡肉混合,提取基因组DNA,以该基因组DNA为模板,利用实施例1的成套试剂进行PCR扩增,按照实施例2步骤3的方法进行检测待测样品。结果显示,该组样品可检出138-141bp、157-160bp、202-205bp、234-237bp、250-253bp、270-273bp和315-318bp的七个目的峰(目的峰分别为139.45bp、158.79bp、203.70bp、235.96bp、251.23bp、271.82bp和316.44bp,图3),且无其他杂峰,表明该样品中含有大肠杆菌O157:H7、沙门氏菌、霍乱弧菌、单核细胞增生性李斯特菌、空肠弯曲杆菌、副溶血弧菌和金黄色葡萄球菌,与实际相符。
<110> 广西壮族自治区兽医研究所
<120> 鉴定或辅助鉴定食源性致病菌的GeXP多重PCR方法的成套试剂与应用
<160> 14
<170> PatentIn version 3.5
<210> 1
<211> 43
<212> DNA
<213> 人工序列
<400> 1
aggtgacact atagaatatt cgatgagttt atctgcaagg tga 43
<210> 2
<211> 44
<212> DNA
<213> 人工序列
<400> 2
gtacgactca ctatagggat aaagatgttt ttcacactta ttgg 44
<210> 3
<211> 36
<212> DNA
<213> 人工序列
<400> 3
aggtgacact atagaataaa atcgtgcagt ggctta 36
<210> 4
<211> 39
<212> DNA
<213> 人工序列
<400> 4
gtacgactca ctatagggaa aggcgcggtc tttactatc 39
<210> 5
<211> 37
<212> DNA
<213> 人工序列
<400> 5
aggtgacact atagaataac tcgctgctac gccattt 37
<210> 6
<211> 36
<212> DNA
<213> 人工序列
<400> 6
gtacgactca ctatagggat caaacccgca ccaaca 36
<210> 7
<211> 39
<212> DNA
<213> 人工序列
<400> 7
aggtgacact atagaatagg gaaatctgtc tcaggtgat 39
<210> 8
<211> 40
<212> DNA
<213> 人工序列
<400> 8
gtacgactca ctatagggag tttgttgtat aggcaatggg 40
<210> 9
<211> 37
<212> DNA
<213> 人工序列
<400> 9
aggtgacact atagaatact gccatacccg cactatc 37
<210> 10
<211> 40
<212> DNA
<213> 人工序列
<400> 10
gtacgactca ctatagggaa aaccataaga caaaggacgc 40
<210> 11
<211> 40
<212> DNA
<213> 人工序列
<400> 11
aggtgacact atagaataaa caatgacgcc tctrctaatg 40
<210> 12
<211> 40
<212> DNA
<213> 人工序列
<400> 12
gtacgactca ctatagggaa ctcaccaatc tgacggaact 40
<210> 13
<211> 37
<212> DNA
<213> 人工序列
<400> 13
aggtgacact atagaatagc gattgatggt gatacgg 37
<210> 14
<211> 38
<212> DNA
<213> 人工序列
<400> 14
gtacgactca ctatagggag ccaagccttg acgaacta 38
- 还没有人留言评论。精彩留言会获得点赞!