一种检测待测样本中目标miRNA的含量的方法与流程
本发明涉及生物技术领域,具体涉及一种检测待测样本中目标mirna的含量的方法。
背景技术:
microrna(mirna)是一类长度约为18-25个核苷酸的非编码内源性单链rna分子,它通过与靶mrna特异性的碱基互补配对,引起靶mrna的降解或者抑制其翻译,从而实现对靶基因转录后的调控。现有研究表明,mirna可作为癌症标志物用于癌症早期诊疗。
传统的mirna定量检测依赖于pcr等扩增手段,该类手段虽然检测灵敏,然而也有高成本、操作复杂、检测耗时长、需借助大型仪器等不足。传统的mirna定量检测主要有三类:第一类是基于直接杂交的定量检测技术,优点是通量高(即一次可以检测多个mirna的表达情况),缺点是成本高,还存在同一mirna家族成员之间互相错配杂交的噪音信号,且不适合表达量较低的mirna检测;第二类是结合pcr与探针的定量检测技术,需要使用mirna特异的探针,这类方法的突出优点是特异性强,常常能区分同一mirna家族的不同变体,缺点是探针的设计与合成需借助于商业公司,方便性与特异性很难得到统一的解决;第三类是基于pcr与荧光染料的定量检测技术,优点是灵敏度高,但检测耗时长且需借助大型仪器。
随着生物传感器的快速发展,以核酸等生物材料作为信号识别元件,可以在短时间内不基于扩增技术实现对mirna的定量检测。基于mirna核酸材料的特异性杂交性能,一种经典的mirna生物传感模式是利用固定于传感界面的捕获探针(cp)和荧光标记的信号探针(sp)分别与mirna两端进行杂交的夹心型生物传感器,可以快速、高灵敏度和高选择性的定量检测复杂基质中的mirna。但是,夹心型生物传感器在开发中面临如下挑战:对于固载捕获探针数目有限的界面而言,当mirna的量超过溶液中的信号探针时,mirna与mirna/sp杂交体一起竞争界面捕获探针的杂交位点,产生假阴性信号,极大程度上干扰检测结果。一种抑制假阴性信号的形成的策略是采用大量的信号探针(如2013年yanliwen,gangliu,haopei等人在《methods》上发表的基于dna纳米结构的超灵敏电化学夹心型mir生物传感器中,使用高于mirna浓度500倍以上的信号探针进行检测),但超高浓度的信号探针将提升单次检测成本,且可能对界面形成非特异性吸附,引发假阳性信号,不利于提升检测的准确性。
技术实现要素:
本发明所要解决的技术问题是如何检测待测样本中目标mirna的含量。
为解决上述技术问题,本发明首先提供了一种检测待测样本中目标mirna的含量的方法,即生物传感器检测方法:将捕获探针固定在传感界面上,信号探针与目标mirna的复合物被捕获探针捕获,通过检测荧光信号即检测出被捕获的目标mirna的量。
本发明所提供的检测待测样本中目标mirna的含量的方法,可包括步骤(a)、步骤(b)和步骤(c):
所述步骤(a)可包括如下步骤:
(a-1)信号探针、封锁dna和待测样本混匀,孵育;
(a-2)完成步骤(a-1)后,采用捕获探针检测荧光信号值;
所述步骤(b)可包括如下步骤:
(b-1)所述信号探针、所述封锁dna和目标mirna标准溶液混匀,孵育;
(b-2)完成步骤(b-1)后,采用所述捕获探针检测荧光信号值;
所述步骤(c):根据所述目标mirna标准溶液中目标mirna的浓度和相应荧光信号值绘制标准曲线,将所述步骤(a-2)得到的荧光信号值代入所述标准曲线,得到待测样本中目标mirna的含量;
所述目标mirna可为单链rna分子,自5’末端到3’末端依次可包括如下元件:a1片段和a2片段;
所述信号探针可为单链dna分子,可包括如下元件:s1片段;所述s1片段的核苷酸序列与所述a1片段的核苷酸序列反向互补;所述信号探针具有荧光基团;
所述封锁dna可为单链dna分子,自5’末端到3’末端依次可包括如下元件:b1片段、b2片段和b3片段;所述b1片段的核苷酸序列可与所述a2片段的核苷酸序列反向互补;所述b3片段的核苷酸序列可与所述a1片段的核苷酸序列反向互补;所述b2片段可由n3个脱氧核糖核苷酸组成,且不能与所述目标mirna、所述信号探针和所述捕获探针进行杂交;n3可为大于等于6且小于等于12的自然数;
所述捕获探针为单链dna分子,可包括如下元件:e2片段;所述e2片段的核苷酸序列可与所述a2片段的核苷酸序列反向互补。
上述方法中,所述信号探针的3’末端可具有荧光基团。
上述方法中,所述信号探针自5’末端到3’末端依次可包括如下元件:所述s1片段和s2片段;所述s2片段由n1个脱氧核糖核苷酸组成,且不能与所述目标mirna和所述捕获探针进行杂交;n1为大于等于5且小于等于12的自然数。所述s2片段具体可由n1个a组成。
上述方法中,所述捕获探针自5’末端到3’末端依次包括如下元件:e1片段和所述e2片段;所述e1片段由n2个脱氧核糖核苷酸组成,且不能与所述目标mirna和所述信号探针进行杂交;n2为大于等于6且小于等于12的自然数。
上述方法中,所述信号探针和所述目标mirna形成的组装体的稳定性大于所述封锁dna和所述目标mirna形成的组装体的稳定性。所述封锁dna和所述目标mirna形成的组装体的稳定性大于所述捕获探针和所述目标mirna形成的组装体的稳定性。
上述方法中,所述步骤(a-1)或(b-1)中,所述孵育的体系中还可含有杂交缓冲液;所述杂交缓冲液可为含0.20-0.30mmgcl2的ph7.5-8.0、9-11mmtris-hcl缓冲液。
所述杂交缓冲液具体可为含0.25mmgcl2的ph7.94、10mmtris-hcl缓冲液。
上述方法中,所述目标mirna可由所述a1片段和所述a2片段组成。所述信号探针可由所述s1片段和所述s2片段组成。所述封锁dna可由所述b1片段、所述b2片段和所述b3片段组成。所述捕获探针可由所述e1片段和所述e2片段组成。
上述方法中,所述捕获探针的核苷酸序列如序列表中序列1所示(即n2为8)。所述信号探针的核苷酸序列如序列表中序列2所示(即n1为5)。所述封锁dna的核苷酸序列如序列表中序列3所示(即n3为7)。此时检测的目标mirna为与人类癌症密切相关let-7a,其核苷酸序列为:5’-ugagguaguagguuguauaguu-3’。
上述方法中,所述荧光基团具体可为cy5.5荧光基团。
上述方法中,所述步骤(a-1)或(b-1)中,所述孵育的体系中,所述信号探针浓度可为3nm-7nm。所述封锁dna的浓度可为15-25nm。
上述方法中,所述步骤(a-1)或(b-1)中,所述孵育的体系中,所述信号探针浓度具体可为5nm。所述封锁dna的浓度具体可为20nm。
上述方法中,所述待测样本可为待测液相样本。
为解决上述技术问题,本发明还提供了一种检测待测样本中目标mirna的含量的试剂盒。
本发明所提供的检测待测样本中目标mirna的含量的试剂盒,可包括上述任一所述封锁dna、所述捕获探针和所述信号探针。
上述试剂盒中,还可包括上述任一所述杂交缓冲液。
上述试剂盒中,还可包括光纤。所述光纤具体可为南京春辉科技实业有限公司的产品。
上述试剂盒中,所述待测样本可为待测液相样本。
上述任一所述试剂盒在检测待测样本中目标mirna的含量中的应用也属于本发明的保护范围。
上述应用中,所述待测样本可为待测液相样本。
实验证明,采用本发明提供的封锁dna可对目标mirna进行结构封锁,形成locker/mirna组装体。locker/mirna组装体不与mirna/sp杂交体竞争界面捕获探针位点,同时在信号探针存在的情况下仍可以形成mirna/sp杂交体,即可抑制假阴性信号的形成,保障检测结果的准确性。因此,采用本发明提供的方法检测待测样本中目标mirna的含量成本低且准确率高,具有重要的应用价值。
附图说明
图1为不同浓度let-7a的检测结果图。
a为不同浓度let-7a的检测图;b为let-7a检测的标准曲线图。
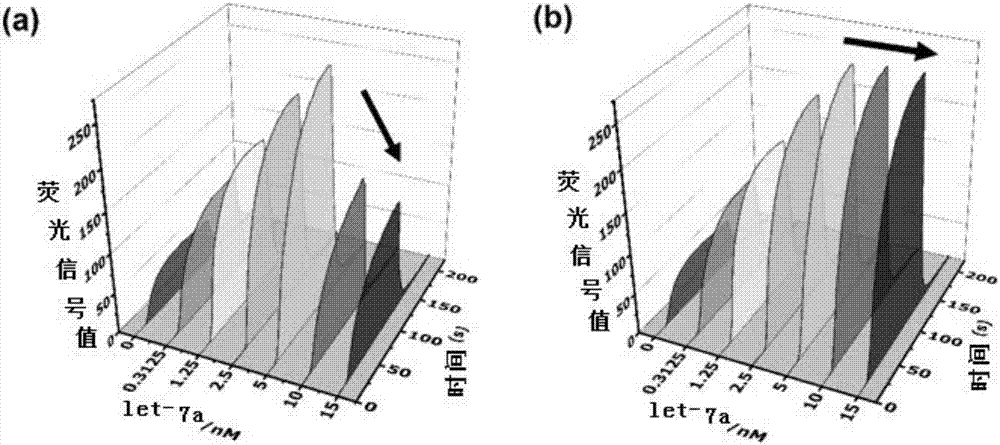
图2为反应体系中有无封锁dna对荧光信号值的影响。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
piraha溶液:由98.3%(m/m)的硫酸水溶液和30%(m/m)过氧化氢水溶液按体积比3:1混合而成。
apts溶液:含1%(v/v)3-氨基丙基三乙氧基硅烷(3-aminopropyltriethoxysilane,apts)的无水甲苯溶液。
杂交缓冲液:含0.25mmgcl2的ph7.94、10mmtris-hcl缓冲液。
短链掺杂溶液:含100nm捕获探针和100nmdna短链的50mmnacl水溶液。
实施例1、检测待测样本中目标mirna的含量的方法
考虑到假阴性信号出现的实质是反应体系中游离mirna比例的增加,因此设计了封锁dna(locker)。封锁dna可对目标mirna进行结构封锁,形成locker/mirna组装体。locker/mirna组装体不与mirna/sp杂交体竞争界面捕获探针位点,同时在信号探针存在的情况下仍可以形成mirna/sp杂交体,即可抑制假阴性信号的形成,保障检测结果的准确性。
本实施例以与人类癌症密切相关的mirna—let-7a作为目标mirna,然后设计并合成了相应的捕获探针、信号探针、封锁dna和dna短链。捕获探针、信号探针、封锁dna、dna短链和let-7a均为单链核酸分子,核苷酸序列信息依次见表1中第2行、第3行、第4行、第5行和第6行。
表1
信号探针自5’末端起第1至12位所示的dna分子与let-7a自5’末端起第1至12位所示的dna分子反向互补。
捕获探针自5’末端起第9至18位所示的dna分子与let-7a自5’末端起第13至22位所示的dna分子反向互补。
封锁dna自5’末端起第1至6位所示的dna分子与let-7a自5’末端起第17至22位所示的dna分子反向互补。封锁dna自5’末端起第14至17位所示的dna分子与let-7a自5’末端起第3至6位所示的dna分子反向互补。
一、制备修饰捕获探针的光纤
1、将光纤(南京春辉科技实业有限公司的产品;光纤规格:600μm芯径)浸泡于piraha溶液,110℃静置1h。
2、完成步骤1后,取所述光纤,用超纯水冲洗3次(每次冲洗时间为1min),然后用氮气吹干。
3、完成步骤2后,将所述光纤浸泡于apts溶液中,然后置于摇床,37℃、150rpm振荡1h。
4、完成步骤3后,取所述光纤,先用甲苯冲洗3次(每次冲洗时间为1min),再用氮气吹干,然后200℃烘烤2h。
5、完成步骤4后,将所述光纤自然降温,浸泡于1%(v/v)戊二醛水溶液中,然后置于振荡器,37℃、150rpm振荡12h。
6、完成步骤5后,将所述光纤浸泡于短链掺杂溶液,然后置于摇床,37℃、150rpm振荡1h。
7、完成步骤6后,将所述光纤浸泡于20mm的甘氨酸水溶液中,室温静置1h。
8、完成步骤7后,将所述光纤浸泡于含20mg/ml的nacnbh3的50mmnacl溶液中,25℃静置1h。
9、完成步骤8后,将所述光纤浸泡于浓度为2mg/ml的bsa水溶液,37℃、150rpm6h(目的为减少非特异性吸附),得到修饰捕获探针的光纤。
二、制备locker组装体
1、在锡纸包裹避光下制备反应体系甲。反应体系甲由信号探针、封锁dna、let-7a和杂交缓冲液组成。反应体系甲中,信号探针的浓度为5nm,封锁dna的浓度为20nm,let-7a的浓度为1pm(即1e-3nm)、0.01nm、0.04nm、0.08nm、0.15nm、0.3nm、0.5nm、1nm、2.5nm、5nm、10nm或15nm。
2、完成步骤1后,取反应体系甲,先90℃水浴3min,再室温水浴3min,得到locker组装体。
三、检测
1、将步骤一制备的修饰捕获探针的光纤装入全光纤倏逝波生物传感器。
2、完成步骤1后,将修饰捕获探针的光纤先用ph1.9、浓度为0.05%(0.05mg/100ml)的sds水溶液冲洗,再用ph7.4、10mmpbs缓冲液冲洗直至基线平稳。
3、完成步骤2后,开启蠕动泵,将步骤二制备的locker组装体通入全光纤倏逝波生物传感器,然后停止蠕动泵,进行mirna检测,收集不同let-7a浓度下产生的荧光信号值。
实验结果见图1中a。结果表明,随着let-7a浓度的增加,荧光信号值逐渐增大。
4、完成步骤3后,向全光纤倏逝波生物传感器中通入ph1.9、浓度为0.05%(0.05mg/100ml)的sds水溶液冲洗,再用ph7.4、10mmpbs缓冲液冲洗直至基线平稳。
5、以let-7a浓度为横坐标,荧光信号值为纵坐标,绘制标准曲线。
标准曲线如图1中b所示,let-7a浓度在180pm-2.38nm线性范围良好。
根据最低检测限为仪器信噪比3倍的原则,let-7a的最低检测限为24pm。
6、按照上述步骤,将步骤二中的let-7a替换为待测样本,其它步骤均不变,得到待测样本的荧光信号值。进一步根据标准曲线,即可获得待测样本中目标mirna的含量。
四、反应体系中有无封锁dna对荧光信号值的影响
按照上述步骤三中1至4,将步骤3中“步骤二制备的locker组装体”替换为“非locker组装体”,其它步骤均不变,进行mirna检测,收集不同let-7a浓度下产生的荧光信号值。
非locker组装体的制备方法如下:
(1)在锡纸包裹避光下制备反应体系丙。反应体系丙由信号探针、let-7a和杂交缓冲液组成。反应体系丙中,信号探针的浓度为5nm,let-7a的浓度为1pm(即1e-3nm)、0.01nm、0.04nm、0.08nm、0.15nm、0.3nm、0.5nm、1nm、2.5nm、5nm、10nm或15nm。
(2)完成步骤1后,取反应体系丙,先90℃水浴3min,再室温水浴3min,得到非locker组装体。
实验结果见图2((a)为非locker组装体,(b)为locker组装体)。结果表明,如果反应体系中不加封锁dna,随着let-7a浓度的增加,出现假阴性信号(图2中(a)箭头标注);而反应体系中加入封锁dna,则没有出现假阴性信号(图2中(b)箭头标注)。因此,本发明提供的方法可以在不提高信号探针的前提下,准确的检测目标mirna的含量。
<110>清华大学
<120>一种检测待测样本中目标mirna的含量的方法
<160>3
<170>patentinversion3.5
<210>1
<211>18
<212>dna
<213>人工序列
<220>
<223>
<400>1
aaaaaattaactatacaa18
<210>2
<211>17
<212>dna
<213>人工序列
<220>
<223>
<400>2
cctactacctcaaaaaa17
<210>3
<211>18
<212>dna
<213>人工序列
<220>
<223>
<400>3
aactatgggggcaaccta18
- 还没有人留言评论。精彩留言会获得点赞!