一种检测猪丹毒杆菌的实时定量LAMP引物、试剂盒及方法与流程
本发明涉及微生物检测
技术领域:
,具体说是涉及一种快速、可实时定量检测猪丹毒杆菌的环介导等温扩增试剂盒及其应用。
背景技术:
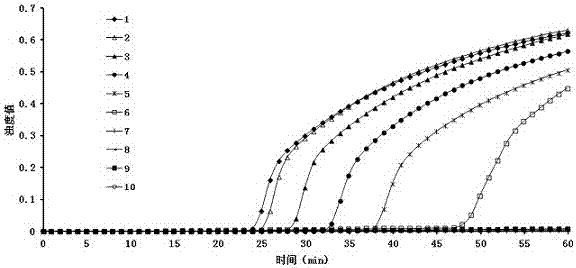
:猪丹毒丝菌(erysipelothrixrhusiopathiae)俗称猪丹毒杆菌或丹毒丝菌,属丹毒丝菌属(erysipelothrix),是一种纤细的小杆菌,革兰染色阳性,为人兽共患病原菌。该菌于1882年被pasteur首次分离到,1886年loffler首次精确的描述了引起猪丹毒病的病原。该菌血清型复杂,目前已发现1、1a、2、2a、2b、3~24及n型等26种之多。猪丹毒是由猪丹毒杆菌引起的一种急性、热性传染病,临床上表现为急性败血性、亚急性疹块型及慢性关节炎和心内膜炎。丹毒杆菌还可感染包括哺乳动物、禽和鱼类等70多种动物,其中猪最敏感,er主要感染3~12月龄猪,一年四季均可发病,发病率一般为10%~15%,严重时死亡率可达50%,给养猪业带来严重的经济损失。本病通过消化道感染,进入血液,临床症状与其他细菌感染很相似,尤其与李氏杆菌病易混淆,要确诊还须进行细菌的分离和鉴定。目前,猪丹毒杆菌的检测技术主要有常规方法和分子生物学方法。常规方法有血清学诊断方法和细菌分离鉴定。但是血清学的诊断方法主要适用于亚急性和慢性的诊断,由于急性型发病快,死亡率高,对急性败血型的诊断意义不大。细菌分离鉴定的方法是通过对细菌的表型特征和生化指标进行鉴定。从样品中分离病原菌需要耗费大量的时间和相对苛刻的操作环境条件,且分离率低。鉴定猪丹毒杆菌的生化指标主要包括:革兰氏染色、氧化酶实验、过氧化氧酶实验、v-p反应(福格斯-普利斯考尔)产物实验。该菌在血平板上需要48小时以上才长出明显菌落,再进行生化试验,又需要耗时24-72小时,做出正确的鉴定将花费4-5天时间。目前也有pcr检测方法报道。通常以猪丹毒杆菌spa基因的保守序列作为靶基因。但需要复杂的仪器设备,成本较高,不适合基层和现场检测,pcr检测方法的敏感度相对lamp方法较低,由此可能造成结果判断不正确,此外,在结果判定上pcr方法需将其扩增产物进行琼脂糖凝胶电泳,再使用紫外透射仪照射进行判定,且通过肉眼判定具有人为主观因素,还容易造成实验室污染。技术实现要素:本发明的目的是提供一种快捷准确的检测猪丹毒杆菌的方法,公开一种快速、实时定量的检测猪丹毒杆菌的lamp方法。为实现本发明目的所使用的技术方案为:一种检测猪丹毒杆菌的实时定量lamp引物,所述引物如seqidno:1~4所示。优选的,所述的引物seqidno:1和seqidno:2还可用于pcr检测,用于pcr检测的引物seqidno:1和seqidno:2为外引物f3和b3,其扩增片段大小为220bp。本发明还公开了一种检测猪丹毒杆菌的实时定量lamp试剂盒,所述试剂盒包括以上所述的检测猪丹毒杆菌的实时定量lamp引物。优选的,所述的试剂盒还包括2×反应缓冲液、bstdna聚合酶、超纯水和猪丹毒杆菌dna。优选的,所述试剂盒的反应温度为63℃,反应在20-35分钟出现扩增。一种检测猪丹毒杆菌的实时定量lamp试剂盒的方法,所述方法包括材料的准备、lamp引物的设计与合成、反应模板的提取、lamp反应体系建立以及采用lamp检测方法进行特异性检测、敏感性检测和定量检测。优选的,所述lamp反应体系建立以25μl计,2×反应缓冲液12.5μlbstdna聚合酶1μl引物seqidno:15pmol引物seqidno:25pmol引物seqidno:340pmol引物seqidno:440pmol猪丹毒杆菌dna2μl超纯水补足25μl。优选的,所述的lamp检测方法是采用特异性检测、敏感性检测和定量检测的方法。优选的,所述的lamp检测方法采用loopamp实时浊度仪密闭进行,全程监控反应管的扩增情况。本发明的实质性特点和显著进步是:1)特异性强所检测的阴性对照细菌和水对照均无阳性结果出来,与pcr检测结果一致。2)灵敏度高普通的pcr检测方法的灵敏度为1.68×10-2ng/μl,而使用本发明检测方法,检测限约为1.68×10-3ng/μl,是普通pcr的10倍。3)迅速得出结果猪丹毒杆菌在血平板上需要36小时以上才长出明显菌落,生化试验通常耗时24-72小时,做出正确的鉴定将花费4-5天时间。普通的pcr整个过程在24小时左右才能得出结果,本发明提供的lamp检测方法反应在20-35分钟间出现扩增,60分钟内即可完成扩增,且结果判定方式简便—扩增结束即可判断结果,不需要再进行琼脂糖凝胶电泳紫外线分析,从样品的基因组dna提取到获得最终结果可在2-3小时内完成。4)准确性高本lamp方法检测敏感度比常规pcr方法高,因此在鉴定结果更为准确。此外,目前lamp方法用于直接观察的荧光染料为反应后加入,但显色法只能是反应结束后开盖加入荧光染料进行显色反应,观察是否有显色来判读试验结果,或者通过跑电泳的方法进行结果判定,无法区分特异性扩增与非特异性扩增,因此增加了假阳性诊断结果的几率;而且对于弱阳性反应,通过人为肉眼判读的方式很可能误判为阴性,本方法通过浊度仪实时监控反应管的扩增情况,能够避免上述的缺陷,具有更高的准确性。5)不造成污染常规的lamp方法在反应结束后通过凝胶电泳的方法来判读结果,或者开盖加入荧光染料进行判断,增加了试验成本、耗时间,凝胶电泳使用的染料对环境也造成污染,且打开反应管容易造成实验室气溶胶污染。本方法通过浊度仪实时监控反应管的扩增情况,反应结束即可获得结果,不需要打开反应管的盖子,能有效避免气溶胶污染。6)可实时定量本发明利用tubidimeterreal-timela-320浊度仪来实时分析lamp反应的结果,不同标准样品浓度的负对数及其对应的浊度值达到0.1所需的时间成线性关系,由此绘制标准曲线,获得标准曲线方程,即可进行定量检测。附图说明图1是本发明lamp方法特异性检测结果:只有猪丹毒杆菌的反应管出现浊度的上升曲线,为阳性结果,5株对照菌反应管和水对照反应均无扩增,为阴性结果。图2和图3是本发明lamp方法及pcr方法的敏感性检测结果;其中1:1.68×102ng/μl;2:1.68×101ng/μl;3:1.68×100ng/μl;4:1.68×10-1ng/μl;5:1.68×10-2ng/μl;6:1.68×10-3ng/μl;7:1.68×10-4ng/μl;8:1.68×10-5ng/μl;9:1.68×10-6ng/μl;10:水对照。猪丹毒杆菌dna的起始浓度为1.68×102ng/μl,经10倍倍比稀释后进行lamp和pcr扩增,结果显示lamp法检测限约为1.68×10-3ng/μl,而pcr法检测限为1.68×10-2ng/μl。图4是本发明定量检测猪丹毒杆菌lamp方法的标准曲线:不同标准样品浓度的负对数及其对应反应管的浊度值达到0.1所需的时间成线性关系,由此绘制标准曲线,获得标准曲线方程y=0.1766x-5.3619,相关系数r2=0.9961,呈良好的线性关系,即可进行定量检测。具体实施方式1、材料的准备猪丹毒杆菌、大肠杆菌、副猪嗜血杆菌、隐秘杆菌、沙门氏菌、巴氏杆菌,为广西壮族自治区兽医所分离鉴定和保存。bstdna聚合酶购自北京蓝谱生物科技有限公司,细菌基因组dna提取试剂盒购自康为世纪生物科技有限公司。2、lamp引物的设计与合成根据genbank中的猪丹毒杆菌spa基因序列,进行spa基因序列比对,选取保守区域,设计特异性lamp引物,其中f3、b3为外引物,fip、bip为内引物,其中f3、b3为猪丹毒杆菌pcr检测引物,其中f3cagatttagaatcgcttgtcaa(seqidno:1)b3ctgatttctcaatatagaaccact(seqidno:2)fipactggtttttctactttaacgggactcattccaaaatgaagaaagtgac(seqidno:3)bipacctaaagatcaaaagaagccagtttatctttcttaatccacccttc(seqidno:4)。3、细菌基因组dna提取使用细菌基因组dna提取试剂盒提取猪丹毒杆菌和检测样品的基因组dna。4、lamp反应体系建立按25μl体系配置:2×反应缓冲液12.5μlbstdna聚合酶1μlf35pmolb35pmolfip40pmolbip40pmol猪丹毒杆菌dna2μl超纯水补足25μl。lamp反应在实时浊度仪(la-320c,日本荣研公司)密闭进行,浊度仪实时监控扩增情况,反应温度为63℃,反应时间为1小时。5、lamp检测方法1)特异性检测分别提取猪丹毒杆菌、大肠杆菌、副猪嗜血杆菌、隐秘杆菌、沙门氏菌、巴氏杆菌的基因组dna作为lamp反应的模板,检验lamp方法的特异性。2)敏感性检测以猪丹毒杆菌dna为模板,以本lamp方法设计的外引物f3和b3为pcr扩增引物,将pcr扩增得到的目的基因片段连接于载体pmd18-t,转化大肠杆菌感受细胞dh5a,氨苄西林抗性筛选获得单克隆菌,提取重组的质粒dna,经测序确认后,测定重组质粒pmd18-t-spa的起始浓度,作为标准样品,用rna-freewater进行连续10倍倍比稀释8个稀释度,取各稀释度2μl作为模板进行lamp扩增和pcr扩增,对比两种检测方法的敏感性。3)定量检测设置对照:浓度为1.68×101ng/μl、1.68×100ng/μl、1.68×10-1ng/μl、1.68×10-2ng/μl、1.68×10-3ng/μl的重组质粒pmd18-t-spa标准样品各一个,因为标准样品浓度的负对数值与其扩增浊度值为0.1的时间值成线性关系,所以可以将样品浓度负对数和浊度仪捕捉到的时间值做成标准曲线,获得标准曲线方程,即可对检测样品的拷贝数进行定量。实施例1lamp检测方法的特异性结果对1株猪丹毒杆菌、5株阴性对照菌和水对照进行lamp扩增,结果如图1所示,猪丹毒杆菌反应管在40分钟左右出现浊度的上升曲线,为阳性结果,5株阴性对照菌反应管和水对照反应管曲线均无扩增情况出现,为阴性结果。实施例2lamp检测方法的敏感性结果猪丹毒杆菌dna起始浓度为1.68×102ng/μl,经10倍倍比稀释后进行lamp和pcr扩增,结果如图2和图3所示,结果显示lamp法检测限约为1.68×10-3ng/μl,而pcr法检测限为1.68×10-2ng/μl。实施例3猪丹毒杆菌定量标准曲线的绘制测定重组质粒pmd18-t-spa的起始浓度,作为标准样品,用rna-freewater进行连续10倍倍比稀释8个稀释度,取各稀释度2μl作为模板进行lamp扩增。设置对照:浓度为1.68×101ng/μl、1.68×100ng/μl、1.68×10-1ng/μl、1.68×10-2ng/μl、1.68×10-3ng/μl的重组质粒pmd18-t-spa标准样品各一个,因为标准样品浓度的负对数值与其扩增浊度值为0.1的时间值成线性关系,所以可以将样品浓度负对数和浊度仪捕捉到的时间值(如表1)做成标准曲线,获得标准曲线方程,y=0.1766x-5.3619,如图4所示,相关系数r2=0.9961,呈良好的线性关系。以时间为x值,可求出y值即浓度的负次方数,则浓度为10-y,再乘以基数1.68,即为1.68×10-yng/μl。依据拷贝数换算公式copies/μl=(6.02×1023×(ng/ul×10-9))/(dnalength×660),dnalength为载体序列大小加上目的基因序列大小,为2693+220=2913bp,将其换算成拷贝数(copies/μl):6.02×1023×(1.68×10-y×10-9)/(2913×660),简化之后为:5.26×108×10-y。如某试验样品达到浊度值为0.1的时间为30分钟时,带入所建立的标准曲线方程,求出y等于-0.064,则该样品拷贝数为:5.26×108×100.064=5.26×108.064copies/μl,从而达到定量的效果。表1标准样品浓度负对数与对应反应管浊度值为0.1的时间时间(min)25.329.935.941.147.9标准值(-log)-10123<110>广西壮族自治区兽医研究所<120>一种检测猪丹毒杆菌的实时定量lamp引物、试剂盒及方法<160>4<210>1<211>22<212>dna<213>人工序列<400>1cagatttagaatcgcttgtcaa<210>2<211>24<212>dna<213>人工序列<400>2ctgatttctcaatatagaaccact<210>3<211>49<212>dna<213>人工序列<400>3actggtttttctactttaacgggactcattccaaaatgaagaaagtgac<210>4<211>47<212>dna<213>人工序列<400>4acctaaagatcaaaagaagccagtttatctttcttaatccacccttc当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 兔中型艾美耳球虫荧光定量pcr检测引物和试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测屎肠球菌的dpo引物、方法及试剂盒的制作方法
- 荧光定量pcr法检测top2a基因表达的引物、探针及试剂盒的制作方法
- 对虾tsv和imnv荧光定量检测引物和探针及试剂盒的制作方法
- 牛乳中沙门氏菌的直接荧光定量pcr的检测引物、探针及检测方法
- 一种鉴定光慈菇的方法及其专用引物对的制作方法
- 基于dpo引物的实时荧光pcr检测植物乳杆菌的方法、引物及试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测鼠李糖乳杆菌的方法、引物及试剂盒的制作方法
- 一种貉的荧光pcr检测方法及其扩增引物和探针的制作方法
- 鉴定白木香的荧光定量pcr方法、引物和探针及其应用
- 兔中型艾美耳球虫荧光定量pcr检测引物和试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测屎肠球菌的dpo引物、方法及试剂盒的制作方法
- 荧光定量pcr法检测top2a基因表达的引物、探针及试剂盒的制作方法
- 对虾tsv和imnv荧光定量检测引物和探针及试剂盒的制作方法
- 牛乳中沙门氏菌的直接荧光定量pcr的检测引物、探针及检测方法
- 一种鉴定光慈菇的方法及其专用引物对的制作方法
- 基于dpo引物的实时荧光pcr检测植物乳杆菌的方法、引物及试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测鼠李糖乳杆菌的方法、引物及试剂盒的制作方法
- 一种貉的荧光pcr检测方法及其扩增引物和探针的制作方法
- 鉴定白木香的荧光定量pcr方法、引物和探针及其应用
- 兔中型艾美耳球虫荧光定量pcr检测引物和试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测屎肠球菌的dpo引物、方法及试剂盒的制作方法
- 荧光定量pcr法检测top2a基因表达的引物、探针及试剂盒的制作方法
- 对虾tsv和imnv荧光定量检测引物和探针及试剂盒的制作方法
- 牛乳中沙门氏菌的直接荧光定量pcr的检测引物、探针及检测方法
- 一种鉴定光慈菇的方法及其专用引物对的制作方法
- 基于dpo引物的实时荧光pcr检测植物乳杆菌的方法、引物及试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测鼠李糖乳杆菌的方法、引物及试剂盒的制作方法
- 一种貉的荧光pcr检测方法及其扩增引物和探针的制作方法
- 鉴定白木香的荧光定量pcr方法、引物和探针及其应用