lncRNA‑D63785及其干扰物的应用和应用其的产品的制作方法
本发明涉及医学工程技术领域,尤其是涉及一种lncrna-d63785及其干扰物的应用和应用其的产品。
背景技术:
胃癌是威胁人类健康的一种常见病,全球范围内胃癌的死亡率很高,其中男性约为14.3/10万,女性约为6.9/10万。胃癌是源自胃黏膜上皮的恶性肿瘤,占全部恶性肿瘤的第3位,占消化道恶性肿瘤的首位,占胃恶性肿瘤的95%。胃癌的发病率有明显的地域差异:东亚、东欧和南美最高,非洲南北部最低。我国的胃癌发病率以西北最高、东北及内蒙古次之、华东及沿海又次之、中南及西南最低,每年约有17万人死于胃癌,且每年还有2万以上新的胃癌病人产生出来。
lncrna是新近研究发现的一类内源性长链非编码rna分子,许多研究表明lncrna对于维持胃正常生理功能具有重要作用,胃中的lncrna异常表达与许多胃部疾病的发生相关。
细胞增殖、细胞分化和细胞凋亡是任何一个多细胞生物在个体发育过程中的三项基本活动,相互依存,缺一不可。它们是一个主动的、高度有序的、由基因控制及一系列酶参与的过程,对正常胚胎发育,维持细胞群体及恶性病变过程中均起重要作用,在保证多细胞生物的健康生存过程中扮演着关键的角色。恶性肿瘤的两大特征,一是细胞无休止分裂,二是恶性分化。如何促使肿瘤停止分裂,并走向死亡(凋亡)和“改邪归正”(诱导分化)是肿瘤治疗的关键问题。
目前关于胃癌的发病机理尚不完全清楚,胃癌的预防、诊断和治疗尚不能达到让人满意的效果,急需开发新的技术、方法用于胃癌的诊断、防治。寻找胃癌组织中特异表达的、参与肿瘤细胞增殖和凋亡的lncrna,阐明其作用机理,对于开发以lncrna为策略的胃癌的诊断、治疗具有及其重要的意义和应用前景。
有鉴于此,特提出本发明。
技术实现要素:
本发明的第一个目的在于提供lncrna-d63785在制备用于诊断和/或预后评估胃癌的试剂盒中的应用;
本发明的第二个目的在于提供一种用于诊断和/或预后评估胃癌的试剂盒;
本发明的第三个目的在于提供lncrna-d63785的干扰物在制备具有抑制胃癌功能的产品中的应用;
本发明的第四个目的在于提供一种用于预防和/或治疗胃癌的药物。
本发明提供的lncrna-d63785在制备用于诊断和/或预后评估胃癌的试剂盒中的应用,所述lncrna-d63785含有seqidno.1所示的序列。
进一步地,所述胃癌包括隆起型、局限溃疡型、浸润溃疡型和弥漫浸润型中的一种或多种。
本发明还提供了一种用于诊断和/或预后评估胃癌的试剂盒,所述试剂盒包括用于特异性检测lncrna-d63785的引物。
本发明还提供了如下(1)-(4)中任一项所述的lncrna-d63785的干扰物在制备具有抑制胃癌功能的产品中的应用:
(1)sirna-d63785;
(2)含有sirna-d63785的编码基因的重组载体;
(3)含有sirna-d63785的编码基因的重组病毒;
(4)含有sirna-d63785的编码基因的重组病毒载体;
所述sirna-d63785含有seqidno.2所示的序列。
进一步地,所述抑制胃癌功能为如下(a)或(b):
(a)抑制胃癌细胞的增殖和/或侵袭和/或迁移;
(b)促进胃癌细胞与药物结合,诱导所述胃癌细胞的凋亡。
进一步地,所述胃癌包括隆起型(息肉型)、局限溃疡型、浸润溃疡型和弥漫浸润型中的一种或多种。
进一步地,所述产品为药物。
另外,本发明还提供了一种用于预防和/或治疗胃癌的药物,所述药物包括上述的lncrna-d63785的干扰物。
进一步地,所述药物还包括药学上可接受的载剂或辅料。
进一步地,所述药物的给药方式包括口服给药或注射给药。
本发明提供的lncrna-d63785通过实验发现在人类胃癌组织和胃癌细胞系中的表达显著上调,通过对lncrna-d63785进行特异性的检测能达到到诊断和/或预后评估胃癌的目的;同时,lncrna-d63785的干扰物通过抑制lncrna-d63785的表达,能够起到抑制胃癌细胞增殖、侵袭和迁移,以及促进细胞凋亡起到抗肿瘤作用;将lncrna-d63785的干扰物作为药物,导入胃组织或体内,对胃癌将具有预防及治疗作用。因此,lncrna-d63785可以作为一种新的生物标志物,应用于胃癌的诊断和/或预后评估;而与之相应的lncrna-d63785的干扰物,可以作为一种新型的药物,对多种类型胃癌具有潜在的预防和治疗价值。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1a为本发明实施例1提供的临床胃癌组织和胃癌细胞系中lncrna-d63785的表达水平结果图;
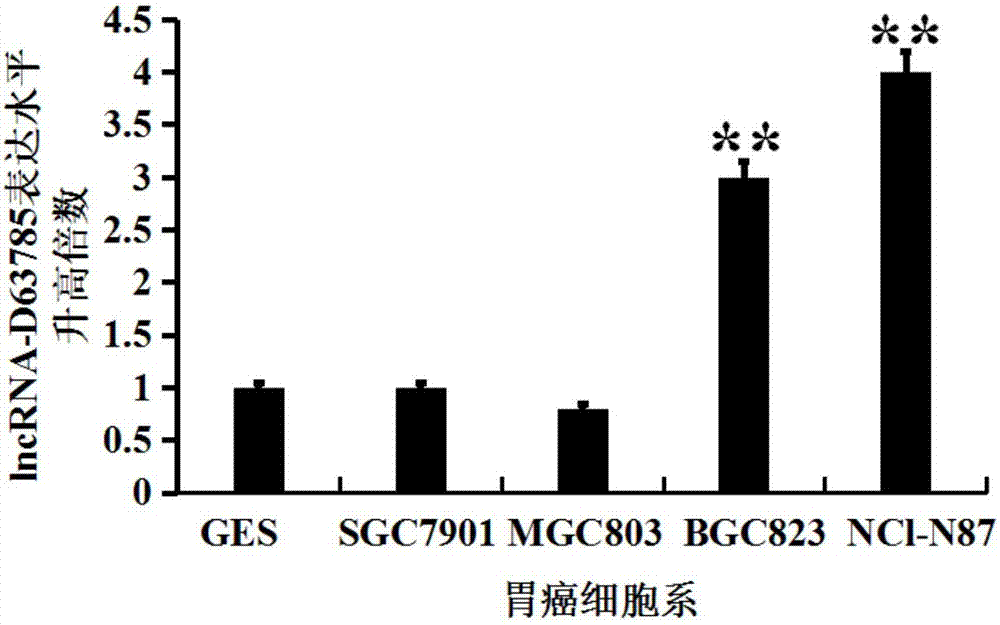
图1b为本发明实施例1提供的胃癌细胞系中lncrna-d63785表达水平结果图;
图2为本发明实施例2提供的采用mtt方法检测的bgc823细胞增殖情况结果图;
图3a为本发明实施例2提供的采用hoechst染色法检测空白组细胞增殖情况结果图;
图3b为本发明实施例2提供的采用hoechst染色法检测对照组细胞增殖情况结果图;
图3c为本发明实施例2提供的采用hoechst染色法检测实验组细胞增殖情况结果图;
图3d为本发明实施例2提供的采用edu染色法检测空白组细胞增殖情况结果图;
图3e为本发明实施例2提供的采用edu染色法检测对照组细胞增殖情况结果图;
图3f为本发明实施例2提供的采用edu染色法检测实验组细胞增殖情况结果图;
图3g为本发明实施例2提供的采用hoechst染色法和edu染色法叠加检测空白组细胞增殖情况结果图;
图3h为本发明实施例2提供的采用hoechst染色法和edu染色法叠加检测对照组细胞增殖情况结果图;
图3i为本发明实施例2提供的采用hoechst染色法和edu染色法叠加检测实验组细胞增殖情况结果图;
图4a为本发明实施例3提供的空白组细胞的侵袭能力结果图;
图4b为本发明实施例3提供的对照组细胞的侵袭能力结果图;
图4c为本发明实施例3提供的实验组细胞的侵袭能力结果图;
图4d为本发明实施例3提供的空白组细胞的迁移能力结果图;
图4e为本发明实施例3提供的对照组细胞的迁移能力结果图;
图4f为本发明实施例3提供的实验组细胞的迁移能力结果图;
图5a为本发明实施例4提供的dox-空白组细胞凋亡水平结果图;
图5b为本发明实施例4提供的dox-对照组细胞凋亡水平结果图;
图5c为本发明实施例4提供的dox-实验组细胞凋亡水平结果图;
图5d为本发明实施例4提供的dox+空白组细胞凋亡水平结果图;
图5e为本发明实施例4提供的dox+对照组细胞凋亡水平结果图;
图5f为本发明实施例4提供的dox+实验组细胞凋亡水平结果图。
具体实施方式
下面将结合附图对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明提供了lncrna-d63785在制备用于诊断和/或预后评估胃癌的试剂盒中的应用,其中,lncrna-d63785的核苷酸序列如下(seqidno.1):
5’-ttgctgctgacacgccgaccgcctgctgcttcagctacacctcccggcagattccacagaatttcatggctgactactttgagacgagcagccagtgctccaagcccagtgtcatcttcctaaccaagagaggccggcaggtctgtgctgaccccagtgaggagtgggtccagaaatacgtcagt-3’。
在本发明中,胃癌包括隆起型(又名息肉型)、局限溃疡型、浸润溃疡型和弥漫浸润型中的一种或多种。
本发明还提供了一种用于诊断和/或预后评估胃癌的试剂盒,包括用于特异性检测lncrna-d63785的引物。
其中,lncrna-d63785的上游引物为:
5’-ttgctgctgacacgccg-3’(seqidno.3);
lncrna-d63785的下游引物为:
5’-actgacgtatttctaagcccac-3’(seqidno.4)。
本发明还提供了如下(1)-(4)中任一项lncrna-d63785的干扰物在制备具有抑制胃癌功能的产品中的应用:
(1)sirna-d63785;
(2)含有sirna-d63785的编码基因的重组载体;
(3)含有sirna-d63785的编码基因的重组病毒;
(4)含有sirna-d63785的编码基因的重组病毒载体;
其中,sirna-d63785的核苷酸序列如下(seqidno.2):
5’-acagaatttcatggctgacta-3’。
在本发明中,抑制胃癌功能为如下(a)或(b):
(a)抑制胃癌细胞的增殖和/或侵袭和/或迁移;
(b)促进胃癌细胞与药物结合,诱导胃癌细胞的凋亡。
其中,胃癌细胞例如可以为,但不限于bgc823;药物是胃癌治疗药物,例如可以为,但不限于dox(阿霉素)。
另外,本发明还提供了一种用于预防和/或治疗胃癌的药物,包括上述的lncrna-d63785的干扰物。
在本发明中,药物还包括药学上可接受的载剂或辅料。
其中,载剂例如可以为,但不限于壳聚糖、胆固醇、脂质体和纳米颗粒中的一种或多种。
在本发明中,药物的给药方式包括口服给药或注射给药。
其中,注射给药的方式例如可以为,但不限于静脉注射、肌肉注射、或直接胃内注射。
为了有助于更清楚的理解本发明的内容,现结合具体的实施例详细介绍如下。如未明确指出,以下实施例中采用的细胞系均为胃癌细胞系bgc823,涉及的实验操作方法为本领域常规的分子生物学操作方法,涉及的试剂均为分析纯级试剂,涉及的试剂或仪器均可从正规渠道商购获得。
除非特别指出,以下各实施例中涉及的各种实验方法和操作,包括细胞培养,rna的提取,rcr扩增,荧光定量pcr,细胞染色等等,均可参见以下文献:wangjx,zhangxj,liq,etal.,microrna-103/107regulateprogrammednecrosisandmyocardialischemia/reperfusioninjurythroughtargetingfadd.circres.2015jul31;117(4):352-363.上述文献在此全文引入作为参考。
实施例1lncrna-d63785表达情况检测
在本实施例中,采用的临床胃癌组织及其癌旁组织均来源于解放军四零一医院,为新鲜分离的肿瘤组织,经切割成小组织块后冻于-80℃备用。
利用trizol试剂法提取胃癌组织及其癌旁组织和细胞总rna,并利用实时荧光定量pcr技术检测lncrna-d63785的表达水平,pcr扩增lncrna-d63785全长为185bp,具体为seqidno.1所示序列。
pcr反应体系以50μl计,pcr条件如下:95℃3min,一个循环;95℃30sec,56℃30sec,72℃1min,共30个循环;最后72℃延伸5min;
pcr引物设计如下:
上游引物:5’-ttgctgctgacacgccg-3’(seqidno.3);
下游引物:5’-actgacgtatttctaagcccac-3’(seqidno.4)。
检测到的lncrna-d63785表达水平如图1a所示,其中,纵坐标表示以癌旁组织为基准,胃癌组织中lncrna-d63785的表达水平,从图1a中可以看出,相对于癌旁组织,胃癌组织中lncrna-d63785的表达水平显著上调。
在本实施例中,采用的正常胃黏膜上皮细胞和胃癌细胞系均来自本实验室,在常规正常培养条件下培养和冻存。其中,胃癌细胞系为sgc7901、mgc803、bgc823、nci-n87。
本实施例采用trizol试剂法提取正常胃黏膜上皮细胞和胃癌细胞系总rna,并利用实时荧光定量pcr技术检测lncrna-d63785的表达水平(检测方法及条件同上)。结果如图1b所示,其中,纵坐标表示以正常胃粘膜上皮细胞系ges为基准,表明相对于胃黏膜上皮细胞ges,lncrna-d63785在胃癌细胞bgc823和nci-n87中的表达水平显著上升。
实施例2lncrna-d63785的干扰物抑制胃癌细胞增殖的实验
本实施例中将实施例1提供的胃癌细胞系bgc823随机分为三组,分别为空白组,对照组及实验组,每组三个重复(细胞量约为1×106)。
其中,空白组bgc823只使用正常细胞培养液进行培养。
实验组对胃癌细胞进行lncrna-d63785的干扰物转染处理(通过脂质体lipfectin2000按照试剂盒操作说明书进行转染,购自invitrogen公司),转染4h后换正常培养基(培养体系为200μl),继续培养12h、24h、48h和48h。
对照组与实验组的处理方法相同,仅将lncrna-d63785的干扰物替换为无意义序列的阴性对照rna。
将上述各组细胞于培养箱中孵育不同时间后弃去100μl培养基,加入10μlmtt(终浓度500μg/ml),继续培养4h后加入100μl10%sds溶解形成甲瓒颗粒,37℃过夜孵育后用酶标仪检测od490nm光吸收值。
实验结果如图2所示,表明抑制内源性lncrna-d63785可以显著抑制胃癌细胞的增殖能力。
在本实施例中,采用edu染色法检测lncrna-d63785的干扰物抑制胃癌细胞增殖的影响(细胞量约为1×106)。
空白组bgc823只使用正常细胞培养液进行培养。
实验组对胃癌细胞进行lncrna-d63785的干扰物转染处理(通过脂质体lipfectin2000按照试剂盒操作说明书进行转染,购自invitrogen公司),转染4h后换正常培养基,继续培养20h。
对照组与实验组的处理方法相同,仅将lncrna-d63785的干扰物替换为无意义序列的阴性对照rna。
用细胞培养基按1000:1的比例稀释edu溶液(购自广州锐博),制备适量50μmedu培养基,将上述各组细胞每孔加入100μl50μmedu培养基孵育2h,弃培养基;pbs清洗细胞1-2次,每次5min;每孔加入100μl细胞固定液(即含4%多聚甲醛的pbs)室温孵育30min;弃固定液,pbs清洗细胞1-2次,每次5min;每孔加入2mg/ml甘氨酸,脱色摇床孵育5min后,弃甘氨酸溶液;每孔加入100μlpbs,脱色摇床清洗5min,弃pbs;每孔加入100μl渗透剂(0.5%tritonx-100的pbs)脱色摇床孵育10min;pbs清洗1次,孵育5min;用去离子水按100:1的比例稀释100×hoechst33342储存液,制备适量1×hoechst33342反应液,避光保存;每孔加入100μl1×hoechst33342反应液,避光、室温、脱色摇床孵育30min后,弃染色反应液;每孔每次加入100μlpbs清洗1-3次;每孔加入100μlpbs保存待用,最后进行图像获取及分析,调试仪器时,请将曝光时间调整为30ms左右,尽量不要多于1s。
实验结果如图3a、3b、3c、3d、3e、3f、3g、3h和3i所示,其中,实验组荧光数量最少,表明抑制内源性lncrna-d63785可以显著抑制胃癌细胞的增殖能力。
实施例3lncrna-d63785的干扰物抑制胃癌细胞的侵袭和迁移能力
在本实施例中,采用transwell法检测细胞的侵袭能力。本实施例中将bgc823随机分为三组,分别为空白组,对照组及实验组,每组三个重复(细胞量约为1×106)。
其中,空白组bgc823只使用正常细胞培养液进行培养。
实验组用50mg/lmatrigel1:8稀释液包被transwell小室底部膜的上室面,4℃风干;将lncrna-d63785的干扰物处理12h后,进行细胞消化,用pbs和无血清培养基先后洗涤一次,用无血清培养基悬浮细胞,计数,调整浓度为2×105/ml。
对照组与实验组的处理方法相同,仅将lncrna-d63785的干扰物替换为无意义序列的阴性对照rna。
将上述各组细胞在transwell下室(即24孔板底部)加入600-800μl含10%血清的培养基,上室加入100-150μl细胞悬液,继续在孵箱培养24h;用镊子小心取出上室,吸干上室液体,移到预先加入约800μl甲醇的孔中,室温固定30min;取出上室,吸干上室固定液,移到预先加入约800μlgiemsa染液的孔中,室温染色15-30min;轻轻用清水冲洗浸泡数次,取出上室,吸去上室液体,用湿棉棒小心擦去上室底部膜表面上的细胞;每孔每次加入100μlpbs清洗1-3次。显微镜下取5个随机视野计数,统计结果。
实验结果如图4a、4b、4c、4d、4e和4f所示,表明抑制内源性lncrna-d63785可以显著抑制胃癌细胞的侵袭及迁移能力。
实施例4lncrna-d63785的药干扰物增强胃癌细胞对化疗药物dox诱导细胞凋亡的的敏感性
在本实施例中,将nci-n87细胞随机分为三组,分别为空白组,对照组及实验组,每组六个重复(细胞量约为1×106)。
其中,空白组nci-n87只使用正常细胞培养液进行培养。
实验组nci-n87进行lncrna-d63785的干扰物转染处理(通过脂质体lipfectin2000按照试剂盒操作说明书进行转染,购自invitrogen公司),转染4h后换正常培养基。
对照组与实验组的处理方法相同,仅将lncrna-d63785的干扰物替换为无意义序列的阴性对照rna。
将上述各组细胞随机分为两大组,分别为dox+组和dox-组。
其中,dox+组中的各组细胞在处理12h后,加入0.5mdox,继续孵育24h后收集细胞,用预冷的pbs洗两遍;重悬细胞于100μlannexinv结合缓冲液中,利用annexinv-fitc/pi细胞凋亡检测试剂盒(购自上海七海)对细胞进行染色和孵育,facs检测和分析细胞的调亡水平。
dox-组中的各组细胞在处理12h后,加入正常细胞培养液,继续孵育24h后收集细胞,用预冷的pbs洗两遍;重悬细胞于100μlannexinv结合缓冲液中,利用annexinv-fitc/pi细胞凋亡检测试剂盒(购自上海七海)对细胞进行染色和孵育,facs检测和分析细胞的调亡水平。
实验结果如图5a、5b、5c、5d、5e和5f所示,表明抑制内源性lncrna-d63785可以显著增强dox对胃癌细胞诱导的细胞凋亡。
综上所述,本发明提供的lncrna-d63785通过实验发现在人类胃癌组织和胃癌细胞系中的表达显著上调,通过对lncrna-d63785进行特异性的检测能达到到诊断和/或预后评估胃癌的目的;同时,lncrna-d63785的干扰物通过抑制lncrna-d63785的表达,能够起到抑制胃癌细胞增殖、侵袭和迁移,以及促进细胞凋亡起到抗肿瘤作用;将lncrna-d63785的干扰物作为药物,导入胃组织或体内,对胃癌将具有预防及治疗作用。因此,lncrna-d63785可以作为一种新的生物标志物,应用于胃癌的诊断和/或预后评估;而与之相应的lncrna-d63785的干扰物,可以作为一种新型的药物,对多种类型胃癌具有潜在的预防和治疗价值。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
sequencelisting
<110>青岛大学
<120>lncrna-d63785及其干扰物的应用和应用其的产品
<160>4
<170>patentinversion3.5
<210>1
<211>185
<212>dna
<213>智人种(homosapiens)
<400>1
ttgctgctgacacgccgaccgcctgctgcttcagctacacctcccggcagattccacaga60
atttcatggctgactactttgagacgagcagccagtgctccaagcccagtgtcatcttcc120
taaccaagagaggccggcaggtctgtgctgaccccagtgaggagtgggtccagaaatacg180
tcagt185
<210>2
<211>21
<212>dna
<213>人工序列
<400>2
acagaatttcatggctgacta21
<210>3
<211>17
<212>dna
<213>人工序列
<400>3
ttgctgctgacacgccg17
<210>4
<211>22
<212>dna
<213>人工序列
<400>4
actgacgtatttctaagcccac22
- 还没有人留言评论。精彩留言会获得点赞!