一种RNA制剂及在CIK细胞培养方面的应用的制作方法
本发明属于细胞免疫领域,涉及cik细胞,具体涉及一种rna制剂及在cik细胞培养方面的应用。
背景技术:
肿瘤的生物免疫治疗作为第四种治疗手段日益受到重视。细胞因子诱导的杀伤细胞(cytokine-inducedkillercell,cik)是近年来发现的一种非常有前景的过继免疫细胞,具有增殖迅速、杀瘤活性广谱且高效、毒副作用微小等优点,已经成为肿瘤生物免疫治疗的主力军。cik细胞的主要效应细胞为cd3+cd56+表型t淋巴细胞,兼有nk细胞和t细胞的特征。在功能上,cik一方面拥有t淋巴细胞强大的抗肿瘤活性,另一方面还拥有nk细胞非mhc限制性的杀伤肿瘤的特点,其增殖迅速、对正常造血影响轻微。
cik细胞的增殖和细胞毒活性依赖于培养条件的刺激。培养高纯度cd3+cd56+细胞是提高cik细胞毒活性、增强对肿瘤细胞杀伤的关键。
现有技术通常都是通过在培养基中添加多种外源性细胞因子进行诱导刺激。
技术实现要素:
本发明的目的在于提供一种rna制剂,以替代组合复杂、成本较高的外源性细胞因子,以诱导制备具有高效杀瘤活性的cik细胞。
本发明通过如下技术方案得以实现:
一种rna制剂,为树突状细胞的总rna,在提取所述树突状细胞的总rna之前,对树突状细胞进行高浓度co2刺激;所述高浓度指co2占空气体积分数>5%。
优选地,高浓度指co2占空气体积分数25-45%。
优选地,高浓度co2刺激时间为2-4小时。
上述rna制剂在培养扩增cik细胞方面的应用。
本发明优点:
本发明提供的rna制剂可以用于诱导制备具有高效杀瘤活性的cik细胞,可以用于替代组合复杂、成本较高的外源性细胞因子,提高培养便捷性,降低成本。
附图说明
图1为dc细胞总rna电泳图(a、b、c分别对应实施例1-3制备的总rna);
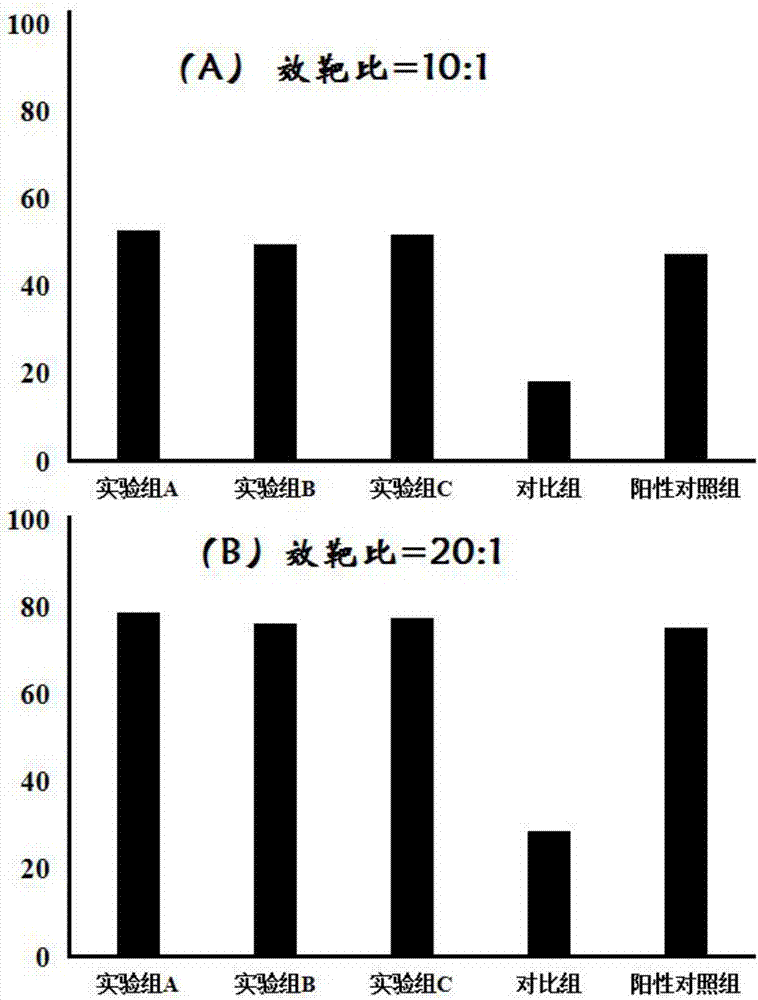
图2为各组cik细胞对smmc-7721细胞的杀伤率(a为效靶比10:1,b为效靶比20:1)。
具体实施方式
为了更好地解释本发明的技术方案,下面结合具体实施例进一步介绍。实施例中未特别强调的实验材料均为常规实验材料,属于本领域技术人员易于获得的范畴。
实施例1:rna制剂的制备
一、实验材料
trizol总rna抽提试剂盒,invitrogen,购于thermofisherscientific。
rpmi-1640培养基和胎牛血清均为gibco产品。
二、实验方法
1、单个核细胞的分离:采集健康志愿者外周血20ml,预冷的pbs1:1稀释,缓慢加入淋巴细胞分离液上层,650g,4℃离心20min,收集白色细胞层,分离单个核细胞,1640培养基重悬细胞后置于37℃、5%co2孵箱中孵育2h。
2、树突状细胞(dc细胞)的培养:单个核细胞培养2h后收集贴壁细胞,在完全培养基(1640+10%fbs)中添加gm-csf(1000u/ml)、il-4(1000u/ml)诱导dc生成,于37℃、5%co2孵育箱中培养,每2天半量换液一次,换液后补充gm-csf、il-4,于第6d在培养基中添加tnf-α诱导dc成熟(100ng/ml),连续培养7d。
3、总rna提取:提取前3小时,将成熟dc置于37℃、35%co2孵育箱中培养3小时。3小时后,按照trizol总rna抽提试剂盒说明书提取总rna,经分光光度计检测od260值及od260/od280,计算总rna含量和纯度,琼脂糖电泳检测rna完整性,-80℃冻存备用。
三、实验结果
用trizol总rna抽提试剂盒提取的成熟dc总rna,经分光光度计检测,od260/od280介于1.8-2.0之间,1.2%琼脂糖电泳可见28s、18s和5s三条带,其中28s的亮度是18s的2倍,提示总rna完好未降解(如图1a所示)。
实施例2:rna制剂的制备
一、实验材料
trizol总rna抽提试剂盒,invitrogen,购于thermofisherscientific。
rpmi-1640培养基和胎牛血清均为gibco产品。
二、实验方法
1、单个核细胞的分离:采集健康志愿者外周血20ml,预冷的pbs1:1稀释,缓慢加入淋巴细胞分离液上层,650g,4℃离心20min,收集白色细胞层,分离单个核细胞,1640培养基重悬细胞后置于37℃、5%co2孵箱中孵育2h。
2、树突状细胞(dc细胞)的培养:单个核细胞培养2h后收集贴壁细胞,在完全培养基(1640+10%fbs)中添加gm-csf(1000u/ml)、il-4(1000u/ml)诱导dc生成,于37℃、5%co2孵育箱中培养,每2天半量换液一次,换液后补充gm-csf、il-4,于第6d在培养基中添加tnf-α诱导dc成熟(100ng/ml),连续培养7d。
3、总rna提取:提取前2小时,将成熟dc置于37℃、45%co2孵育箱中培养2小时。2小时后,按照trizol总rna抽提试剂盒说明书提取总rna,经分光光度计检测od260值及od260/od280,计算总rna含量和纯度,琼脂糖电泳检测rna完整性,-80℃冻存备用。
三、实验结果
用trizol总rna抽提试剂盒提取的成熟dc总rna,经分光光度计检测,od260/od280介于1.8-2.0之间,1.2%琼脂糖电泳可见28s、18s和5s三条带,其中28s的亮度是18s的2倍,提示总rna完好未降解(如图1b所示)。
实施例3:rna制剂的制备
一、实验材料
trizol总rna抽提试剂盒,invitrogen,购于thermofisherscientific。
rpmi-1640培养基和胎牛血清均为gibco产品。
二、实验方法
1、单个核细胞的分离:采集健康志愿者外周血20ml,预冷的pbs1:1稀释,缓慢加入淋巴细胞分离液上层,650g,4℃离心20min,收集白色细胞层,分离单个核细胞,1640培养基重悬细胞后置于37℃、5%co2孵箱中孵育2h。
2、树突状细胞(dc细胞)的培养:单个核细胞培养2h后收集贴壁细胞,在完全培养基(1640+10%fbs)中添加gm-csf(1000u/ml)、il-4(1000u/ml)诱导dc生成,于37℃、5%co2孵育箱中培养,每2天半量换液一次,换液后补充gm-csf、il-4,于第6d在培养基中添加tnf-α诱导dc成熟(100ng/ml),连续培养7d。
3、总rna提取:提取前4小时,将成熟dc置于37℃、25%co2孵育箱中培养4小时。4小时后,按照trizol总rna抽提试剂盒说明书提取总rna,经分光光度计检测od260值及od260/od280,计算总rna含量和纯度,琼脂糖电泳检测rna完整性,-80℃冻存备用。
三、实验结果
用trizol总rna抽提试剂盒提取的成熟dc总rna,经分光光度计检测,od260/od280介于1.8-2.0之间,1.2%琼脂糖电泳可见28s、18s和5s三条带,其中28s的亮度是18s的2倍,提示总rna完好未降解(如图1c所示)。
实施例4:rna制剂的制备,与实施例1对比
与实施例1相比,除总rna提取之前不进行35%co2孵育刺激外,其他完全相同。检测结果证明,总rna完好未降解,电泳结果与实施例1基本相同。
实施例5:效果实施例,对cik细胞杀瘤活性的影响
一、实验方法
1、cik细胞的原代培养和分组
单个核细胞的分离:采集健康志愿者外周血20ml,预冷的pbs1:1稀释,缓慢加入淋巴细胞分离液上层,650g,4℃离心20min,收集白色细胞层,分离单个核细胞,1640培养基重悬细胞后置于37℃,5%co2孵箱中孵育2h。
收集单核细胞中的悬浮细胞,分成5组:实验组a-c、对比组、阳性对照组。
实验组a:调整悬浮细胞密度至1×106/ml,在完全培养基(1640+10%fbs)中加入inf-γ(1000u/ml),并于24h后添加实施例1制备的rna制剂(50μg/ml),每2-3d进行换液,并补充等量的rna制剂和inf-γ。
实验组b:调整悬浮细胞密度至1×106/ml,在完全培养基(1640+10%fbs)中加入inf-γ(1000u/ml),并于24h后添加实施例2制备的rna制剂(50μg/ml),每2-3d进行换液,并补充等量的rna制剂和inf-γ。
实验组c:调整悬浮细胞密度至1×106/ml,在完全培养基(1640+10%fbs)中加入inf-γ(1000u/ml),并于24h后添加实施例3制备的rna制剂(50μg/ml),每2-3d进行换液,并补充等量的rna制剂和inf-γ。
对比组:调整悬浮细胞密度至1×106/ml,在完全培养基(1640+10%fbs)中加入inf-γ(1000u/ml),并于24h后添加实施例4制备的rna制剂(50μg/ml),每2-3d进行换液,并补充等量的rna制剂和inf-γ。
阳性对照组(现有技术):调整悬浮细胞密度至1×106/ml,在完全培养基(1640+10%fbs)中加入inf-γ(1000u/ml),并于24h后添加il-2(300u/ml)、il-1α(l00u/ml)和抗人cd3单抗(50μg/ml)。每2-3d进行换液,并补充等量细胞因子。
2、肿瘤细胞培养
在37℃、5%co2的细胞培养箱中用rpmi-1640完全培养液(含10%胎牛血清和100mg/l青-链霉素溶液)培养smmc-7721细胞。
3、肿瘤杀伤实验
在cik细胞培养11d时,将培养至对数生长期的smmc-7721细胞调整细胞密度为1×105个/ml,于96孔板中铺板每孔100μl细胞悬液,培养箱中培养24h。cik培养至第12天进行cik杀伤肿瘤细胞实验,弃去smmc-7721旧的培养液,分别按n(效应细胞)/n(靶细胞)为10:1和20:1调整各组cik细胞至相应数目加入smmc-7721细胞孔中,每个比例3个复孔,同时设单独靶细胞和单独效应细胞对照组,于细胞培养箱中培养4h。4h后每孔加入10μlcck-8溶液,细胞培养箱中孵育4h,酶标仪测定od450值(a值),按如下公式计算杀伤率:
杀伤率(%)=[1-(实验组a值-单独效应细胞组a值)/单独靶细胞组a值]×100%。
二、实验结果
各组cik细胞对smmc-7721细胞的杀伤率见表1和图2。从表1和图2可以看出,实验组a-c所得cik细胞具有与现有技术接近的杀瘤活性,且显著优于对比组。本发明提供的rna制剂可以诱导制备具有高效杀瘤活性的cik细胞。
表1各组cik细胞对smmc-7721细胞的杀伤率
上述实验证明,本发明提供的rna制剂可以用于诱导制备具有高效杀瘤活性的cik细胞,可以用于替代组合复杂、成本较高的外源性细胞因子,提高培养便捷性,降低成本。
上述实施例仅用于进一步解释本发明的技术方案,本领域技术人员应当明白,任何简单替换或修改均不脱离本发明,本发明的保护范围并不受限于上述具体实施例。
- 还没有人留言评论。精彩留言会获得点赞!