一种重组腈水解酶、基因、载体、工程菌及应用的制作方法
(一)技术领域
本发明涉及一种重组腈水解酶、载体及应用,以及利用表达该腈水解酶的重组大肠杆菌进行生物催化亚氨基二乙腈(iminodiacetonitrile,idan)制备亚氨基二乙酸(iminodiaceticacid,ida)的方法。
(二)
背景技术:
腈水解酶是一类功能多样的生物催化剂,可在温和的条件下,通过一步反应催化有机腈类化合物水解得到相应的羧酸和氨。腈水解酶是一类具有广泛底物谱的生物催化剂,具有独特的催化特性,在有机合成中表现出巨大的工业应用潜力。
亚氨基二乙酸,分子式为hn(ch2cooh)2,易溶于水,难溶于乙醇、丙酮和乙醚等有机溶剂,是一种重要的化工中间体,广泛用于螯合剂、表面活性剂、农药等的合成,特别是全球性的除草剂草甘膦的中间体的制备。目前,一般采用化学方法进行亚氨基二乙酸的制备,主要包括:氯乙酸法、氯乙酸-氨基乙酸法、氮川三乙酸法、氯乙酸-甘氨酸法、二乙醇胺法和氢氰酸法等。以上化学方法存在生产成本高、污染严重、对设备要求高等不足。生物酶法催化亚氨基二乙腈生产亚氨基二乙酸,具有高效、高选择、反应条件温和、环境污染少、成本低、产物光学纯度高等的优点,符合原子经济学和绿色化学的发展方向,具有化学法无可比拟的优势。
有关以亚氨基二乙腈为底物通过生物酶法生产亚氨基二乙酸的方法已经得到研究,相关的技术得到开发已经有所报道,包括菌株筛选(cn101629192a)、生物酶法(cn101392276a、cn102286409a、cn102277320a、cn102277322a)和产物亚氨基二乙酸的检测方法(cn101398413a)。生物催化亚氨基二乙腈生产亚氨基二乙酸的过程如下:
在菌株筛选专利cn101629192a中报道:取1g湿菌体,置于500ml三角瓶中,加入50ml2%(w/w)的反应底物亚氨基二乙腈水溶液,30℃摇床150r/min条件下反应60min,筛选到具有催化活性的15株菌,其中粪产碱杆菌(alcaligenesfaecaliszjb09138)的转化率达54.8%。在生物酶法合成亚氨基二乙酸的专利(cn101392276a、cn102286409a、cn102277320a、cn102277322a)中,分别介绍了四种菌株为粪产碱杆菌(alcaligenesfaecaliszjutb10)、紫红红球菌(rhodococcusrhodochrouszjb09125)、藤黄微球菌(micrococcusluteuszjb09131)和节杆菌(arthrobacternitroguajacolicuszjutb0699)。alcaligenesfaecaliszjutb10湿细胞为30g/l,在100ml0.2m亚氨基二乙腈的水溶液中,30℃200rpm条件下反应24h后,可得亚氨基二乙酸105.5mm,即产率可达52.8%;rhodococcusrhodochrouszjb09125、micrococcusluteuszjb09131和arthrobacternitroguajacolicuszjutb0699湿细胞分别为50g/l,在100ml3%(w/w)亚氨基二乙腈的水溶液(ph7.0)中,30℃200rpm条件下反应10h后,转化率分别可达26.2%、24.8%和26.5%。在产物亚氨基二乙酸的检测方法(cn101398413a)专利报道了其色谱条件:elitec18色谱柱,流动相:甲醇:0.05mol/l乙酸-乙酸钠溶液(甲醇与乙酸-乙酸钠溶液体积比55:45),流速:1.2ml/min。
然而,目前报道的生物酶法生产亚氨基二乙酸技术尚存在产率不高、底物耐受性低等问题,不能达到规模化工业生产的要求。
(三)
技术实现要素:
本发明目的是提供一种重组腈水解酶及该酶在催化水解亚氨基二乙腈制备亚氨基二乙酸中的应用。本发明获得的重组腈水解酶具有较高的底物耐受性和催化活力,催化过程对环境友好。
本发明采用的技术方案是:
本发明涉及一种重组腈水解酶,所述重组腈水解酶的氨基酸序列为seqidno.1所示。
由于氨基酸序列的特殊性,任何含有seqidno.1所示氨基酸序列的肽蛋白的片段或其变体,如其保守性变体、生物活性片段或衍生物,只要该肽蛋白的片段或肽蛋白变体与前述氨基酸序列同源性在90%以上,均属于本发明保护范围之列。具体的所述改变可包括氨基酸序列中氨基酸的缺失、插入或替换;其中,对于变体的保守性改变,所替换的氨基酸具有与原氨基酸相似的结构或化学性质,如用亮氨酸替换异亮氨酸,变体也可具有非保守性改变,如用色氨酸替换甘氨酸。
本发明还提供一种所述重组腈水解酶的编码基因,所述编码基因的核苷酸序列为seqidno.2所示。
由于核苷酸序列的特殊性,任何seqidno.2所示多核苷酸的变体,只要其与该多核苷酸具有90%以上同源性,均属于本发明保护范围之列。所述多核苷酸的变体是指一种具有一个或多个核苷酸改变的多核苷酸序列。此多核苷酸的变体可以使生的变位变异体或非生的变异体,包括取代变异体、缺失变异体和插入变异体。如本领域所知的,等位变异体是一个多核苷酸的替换形式,它可能是一个多核苷酸的取代、缺失或插入,但不会从实质上改变其编码的肽蛋白的功能。
本发明还提供一种由所述重组腈水解酶编码基因构建的重组载体。
本发明提供一种由所述重组载体转化得到的重组基因工程菌。
本发明所述重组腈水解酶编码基因在构建能够催化亚氨基二乙腈制备亚氨基二乙酸的重组腈水解酶中的应用,所述的应用为:构建含有重组腈水解酶编码基因的重组载体,将所述重组载体转化至大肠杆菌中,获得的重组基因工程菌进行诱导培养,培养液分离纯化获得含重组腈水解酶的菌体细胞。
本发明涉及一种所述重组腈水解酶在制备亚氨基二乙酸中的应用,所述的应用为:将含有重组腈水解酶编码基因的重组基因工程菌经发酵培养后的发酵液离心,以湿菌体或湿菌体破碎分离纯化后的纯酶作为催化剂,以亚氨基二乙腈为底物,以ph值为3.0~10.0(优选7.0~7.5)的50mm磷酸盐缓冲液为反应介质构成反应体系,在25~70℃(优选30~35℃)转化反应,反应结束后,将反应液分离纯化,获得亚氨基二乙酸。
所述底物初始浓度为0.02~0.63mol/l,优选0.315~0.63mol/l,所述湿菌体的用量为10~100g/l,优选50~100g/l,所述酶的用量为0.3~1g/l(即50~200u/l,优选127~200u/l)。
本发明所述催化剂的制备方法为:(1)斜面培养:将含有重组腈水解酶编码基因的重组基因工程菌接种至斜面培养基,在28~37℃培养12~24小时,获得斜面菌体;所述斜面培养基终浓度组成为:10g/l蛋白胨,5g/l酵母提取物,10g/l氯化钠,20g/l琼脂,溶剂为水,ph值为7.0;
(2)种子培养:从斜面菌体挑取一接种环菌体接种至含终浓度50mg/l卡那霉素(kan)的lysogeny-broth(lb)液体培养基中,37℃培养10-12小时,获得种子液;lb液体培养基终浓度组成:10g/l蛋白胨,5g/l酵母提取物,10g/l氯化钠,溶剂为水,ph值为7.0;
(3)发酵培养:以体积浓度2%的接种量将种子液接种至含有终浓度50mg/l的kan的lb液体培养基进行发酵培养,37℃培养至培养液的od600为0.6-0.8之间,加入异丙基-β-d-硫代吡喃半乳糖苷(iptg)至终浓度为0.1mm,28℃诱导培养10小时,4℃、5000rpm离心10min,弃去上清液,收集湿菌体;
(4)分离纯化:将收集的湿菌体在超纯水(100g/l(w/v))中重悬,进行超声波破碎(400w,15min),取破碎后的上清液经nickel-nta柱纯化,上柱之前先用缓冲液(终浓度300mmnacl,溶剂为20mmnah2po4(ph8.0)进行平衡;接着用洗脱缓冲液(终浓度300mmnacl、终浓度50mm咪唑,溶剂为20mmnah2po4(ph8.0))洗脱不具有吸附性的蛋白;最后,用蛋白洗脱液(终浓度300mmnacl和终浓度500mm咪唑,溶剂为20mmnah2po4(ph8.0)解吸目的蛋白,收集蛋白洗脱液洗脱产生的流出液,获得重组腈水解酶纯酶。
能够提供本发明所述重组腈水解酶及其编码基因的原始菌株为敏捷食酸菌(acidovoraxfacilis)zjb09122,该菌种保藏在中国典型培养物保藏中心,保藏编号为cctccno.m209044,已在先前申请的专利cn101629192b中披露,同时编码基因的克隆内容已在专利cn104212784a中披露。
本发明的要点在于提供了seqidno.1所示的氨基酸序列和seqidno.2所示的核苷酸序列,在已知该氨基酸序列和核苷酸序列的情况下,该氨基酸序列和核苷酸序列的获得,以及相关载体、宿主细胞的获得,对于本领域技术人员来说均是显而易见的。
以专利cn104212784a披露的e.colibl21(de3)/pet-28b(+)-acn1为基础进行点饱和突变,以6%(w/v)亚氨基二乙腈为底物,应用突变后的菌株为催化剂生产亚氨基二乙酸,最终,将此菌株应用于工业化生产。
与现有技术相比,本发明的有益效果主要体现在:本发明提供一种水解亚氨基二乙酸的重组腈水解酶,在催化上述反应时,可以耐受630mm亚氨基二乙腈,比酶活可达159.90u/g,具有良好的底物耐受性和催化活力,生产过程对环境友好;可有效解决传统的化学法水解亚氨基二乙腈制备亚氨基二乙酸工艺中,存在的反应条件苛刻,需要消耗大量的有机溶剂,成本较高,收率较低,环境污染较为严重等问题。
(四)附图说明
图1腈水解酶sds-page图,maker(kda):130、95、72、55、43、34、26和17;条带1:纯化后的acnmut6;
图2acnmut6腈水解酶的最适温度分析;
图3acnmut6腈水解酶的最适ph分析;
图4acnmut6腈水解酶的动力学分析;
图5acnmut6细胞催化的反应进程曲线。
(五)具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
实施例1
含有表达载体pet-28b(+)-acn1的e.colibl21(de3)/pet28b(+)-acn1的构建已经在专利cn104212784a中披露,以此为基础,为提高底物亚氨基二乙腈的耐受性和产物亚氨基二乙酸的产率,对其进行点饱和突变,设计突变引物如下:
tyr(y)54:
上游引物1:5’-gttttcatccctggtnnnccgtattg-3’,
下游引物2:5’-caatacggnnnaccagggatgaaaac-3’
thr(t)134:
上游引物3:5’-aaaccannncacgttgaacgtacg-3’,
下游引物4:5’-cgtacgttcaacgtgnnntggttt-3’,
trp(w)165:
上游引物:5:5’-tctgaactgcnnngagcacgttc-3’
下游引物6:5’-tgaacgtgctcnnngcagttcagacc-3’
phe(f)168:
上游引物7:5’-gagcacnnncagccgctgtccaaattc-3’
下游引物8:5’-cggctgnnngtgctcccagcagttc-3’
met(m)191:
上游引物9:5’-ccggctnnntccccgctgcaac-3’
下游引物10:5’-gttgcagcggggannnagccgg-3’
ser(s)192:
上游引物11:5’-ttcttggccggctatgnnnccgctgc-3’
下游引物12:5’-cagcggnnncatagccggccaagaag-3’
leu(l)201:
上游引物13:5’-tgtttcaannntccatcgaggctaatgcg-3’
下游引物14:5’-cgcattagcctcgatggannnttgaaac-3’
以acn1的基因序列为模板进行pcr扩增(pcr反应参数为:94℃4min;98℃10s,55℃15s,72℃6min,重复30个循环;72℃继续延伸10min)。将扩增后回收的pcr产物用dpni酶切3h,应用纯化试剂盒将酶切产物纯化后转化至e.colijm109受体菌,涂布于含终浓度50mg/lkan的lb固体平板上,37℃培养过夜后,平板上长出许多白色菌落。随机挑取白色克隆提取质粒进行测序。测序后对突变后的阳性菌落进行纯培养,提取质粒后转入e.colibl21(de3)中表达,获得含有重组腈水解酶基因(该核苷酸序列如seqidno:2所示)的e.colibl21(de3)。
实施例2
依据在实施例1的方法,经过六轮突变,最终得到最优突变体acnmut6(y54f/t134s/f168v/l201n/m191t/f192s),对其进行培养:
(1)诱导培养:将含有表达载体pet28b(+)-acnmut6的e.colibl21(de3),接种至含终浓度50mg/lkan的lysogeny-broth(lb)液体培养基中,37℃培养10-12小时,随即以体积浓度2%的接种量接种至含有终浓度50mg/lkan的lb液体培养基进行扩大培养,37℃培养至培养液的od600为0.6-0.8之间,加入终浓度为0.1mm的iptg,28℃诱导培养10小时,4℃、5000rpm离心10min,收集经过诱导后的湿菌体(即催化剂),进行sds-page检测。
(2)分离纯化:同时,进行ni柱分离纯化,纯化步骤如下:将收集的湿菌体1g进行超声波破碎(400w,15min),4℃、8000rpm离心10min,取10ml的上清液作为粗酶液,进行nickel-nta柱纯化,上柱之前先用缓冲液(终浓度300mmnacl,溶剂为20mmnah2po4(ph8.0))进行平衡;接着用洗脱缓冲液(终浓度300mmnacl、终浓度50mm咪唑,溶剂为20mmnah2po4(ph8.0))洗脱不具有吸附性的蛋白;最后,用蛋白洗脱液(终浓度300mmnacl和终浓度500mm咪唑,溶剂为20mmnah2po4(ph8.0)解吸目的蛋白,收集蛋白洗脱液洗脱产生的流出液,获得重组腈水解酶acnmut6纯酶液,浓度为1.0mg/ml,将纯酶液稀释10倍后,用sds-page凝胶电泳对重组腈水解酶的表达进行验证(见图1)。
实施例3
将实施例2经iptg诱导后所得到的含重组腈水解酶突变体的大肠杆菌工程菌全细胞进行催化反应,以e.colibl21(de3)、未诱导的e.colibl21(de3)/pet-28b(+)-acnmut6和经诱导的e.colibl21(de3)/pet-28b(+)-acn1作为对照组,催化反应体系为10ml:以终浓度630mm亚氨基二乙腈为底物,以实施例2步骤(1)制备的湿菌体为催化剂,以ph值为7.0的50mm的磷酸盐为反应介质。转化体系中湿菌体的加入量为10g/l,在35℃进行转化反应6h,反应结束后,取1ml样品,用100μl2m盐酸终止反应,4℃、12,000rpm离心3min取上清进行高效液相色谱分析。酶活(u)定义为:在35℃,ph7.0条件下,每小时催化产生1μmol亚氨基二乙酸所需的湿菌体量(酶量)为一个活力单位,比酶活(u/g或u/mgprotein)定义为:1g湿菌体或1mg纯酶含有的酶活单位。
亚氨基二乙酸的液相色谱shimadzulc-20ad的分析检测方法:色谱柱类型:anionexchangecolumnhypersilsax;色谱条件:柱温30℃,检测波长:210nm,流动相:20mm(nh4)2hpo4(用磷酸调至ph4.0),流速:1.0ml/min。
从表1可以看出,未经iptg诱导的野生型菌株和突变菌株的酶活均为零,经iptg诱导后,发现e.colibl21(de3)/pet28b(+)-acnmut6已成功构建,并能够表达具有催化活性的腈水解酶,比酶活为159.90u/g,是原始菌株e.colibl21(de3)/pet-28b(+)-acn1的2.46倍。
表1腈水解酶湿菌体的酶活比较
实施例4
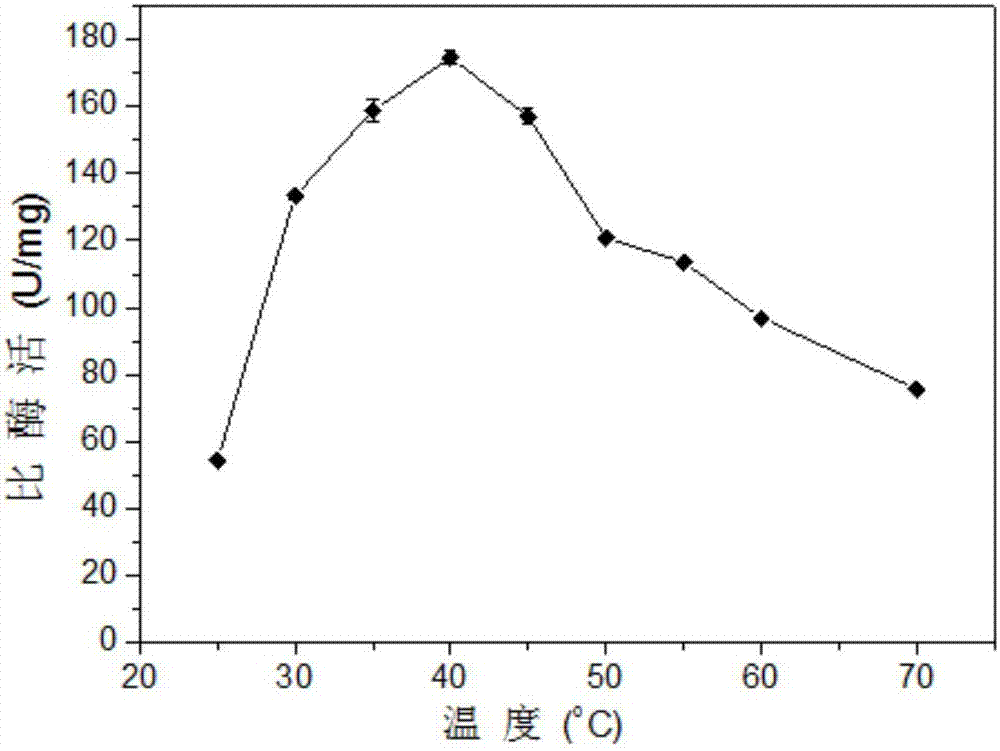
将实施例2制备的重组腈水解酶acnmut6纯酶(158.9u/g(mmol/g/h))在不同温度25-70℃范围内(25℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃、70℃)进行活力检测。反应体系为10ml:底物亚氨基二乙腈的终浓度为630mm,纯酶加入量为0.8g/l(即127.1u/l),缓冲体系为ph7.5、50mm磷酸盐缓冲液,在上述九个温度梯度150rpm条件下,各转化反应6h,反应结束后,取1ml样品,用100μl2mhcl以终止反应,4℃、12,000rpm离心3min取上清进行高效液相色谱分析,检测方法见实施例3。以没有加入纯酶的反应体系作为空白对照。实验结果(见图2)表明:未加入纯酶的反应中,没有检测到有产物亚氨基二乙酸的生成,含有纯酶的催化反应中,优选温度为40℃时,腈水解酶mut6的比酶活最高,为174.65u/mg,算法见实施例3。
实施例5
将实施例2制备的重组腈水解酶acnmut6纯酶(158.9u/g(mmol/g/h))在不同ph3.0-10.0范围内进行活力检测,反应体系为10ml:底物亚氨基二乙腈的终浓度为630mm,纯酶加入量为0.8g/l(即127.1u/l),以不同ph值的缓冲液为反应介质,在35℃转化反应6h,4℃、12,000rpm离心3min取上清进行高效液相色谱分析,检测方法在实施例3。
缓冲体系为:柠檬酸-柠檬酸钠(ph3.0、4.0、5.0、6.0),磷酸二氢钾-磷酸氢二钾(ph7.0),tris-hcl(ph8.0、9.0)和甘氨酸-氢氧化钠(ph10.0)。以没有加入纯酶的反应体系作为空白对照。实验结果(见图3):未加入纯酶的反应中,没有检测到有产物亚氨基二乙酸的生成,有纯酶的催化反应中,腈水解酶mut6的最适ph为7.0,对应的比酶活为137.41u/mg。
实施例6
将实施例2制备的重组腈水解酶acnmut6纯酶(158.9u/g(mmol/g/h))在35℃温浴5min,获得预处理的酶液。反应体系为10ml:底物亚氨基二乙腈的终浓度为21-315mm(21mm、52.5mm、84mm、105mm、126mm、157.5mm、189mm、210mm、262.5mm、315mm),以ph7.050mm的磷酸盐缓冲液为反应介质,纯酶加入量为0.8g/l(即127.1u/l),在35℃、150rpm水浴转化反应,每30min取样1ml,同时向样品中加入200μl2mhcl水溶液终止反应制成样品混合液,20μl样品混合液进行高效液相色谱分析,检测方法在实施例3。以未加入纯酶的反应体系作为空白对照。
起始速率用米氏方程vo=vmax[s]/([s]+km)来拟合,其中,vo表示初速度,vmax表示最大反应速率,[s]表示底物浓度,km表示米氏常数,通过origin8.0软件进行作图,通过倒数曲线计算出动力学常数vmax和km。实验结果(见图4)表明:未加入纯酶的反应中,没有检测到有产物亚氨基二乙酸的生成,有纯酶的催化反应中,重组腈水解酶acnmut6的km和vmax分别为536.2mm和769.2μmol/mg/h。
实施例7
将实施例2制备的重组腈水解酶acnmut6纯酶(158.9u/g(mmol/g/h))的活力分别在终浓度5mm金属离子、edta、表面活性剂中检测,并以无金属离子、edta和表面活性剂条件下的反应作为空白对照(其酶的活力作为100%)。反应体系为10ml:亚氨基二乙腈(630mm),纯酶加入量为0.8g/l(即127.1u/l),终浓度分别为5mm金属离子、edta和表面活性剂(sorbitol、sds、tween20、tween80)的ph7.050mm磷酸盐缓冲液作为反应介质。在35℃条件下,反应6h,反应结束后,将反应液4℃、12,000rpm离心3min取上清进行高效液相色谱分析,检测方法见实施例3。acnmut6实验结果(见表2、表3)表明:co2+和edta2+可以增强重组腈水解酶acnmut6纯酶的活力,而cu2+、zn2+等会显著抑制酶活acnmut6表面活性剂sorbitol、sds、tween20和tween80的加入对重组腈水解酶acnmut6的活力都存在不同程度的抑制作用。
表2acnmut6腈水解酶的金属离子分析
表3表面活性剂
实施例8
将实施例2得到的湿菌体进行生物催化,反应体系200ml,包括湿菌体用量100g/l(以没有加入湿菌体的反应体系作为空白对照),亚氨基二乙腈终浓度630mm,反应介质为ph7.0、50mm磷酸盐缓冲液,反应时间:0-6h(具体取样点为0h、0.5h、1h、2h、3h、4h、5h和6h),反应温度:35℃,反应结束后,取反应液进行高效液相分析检测,实验结果(见图5)表明:未加入湿菌体的反应中,没有检测到有产物亚氨基二酸的生成,有湿菌体的催化在反应5h后,突变体acnmut6的转化率达90%以上,产率达80%以上。
sequencelisting
<110>浙江工业大学
<120>一种重组腈水解酶、基因、载体、工程菌及应用
<130>
<160>2
<170>patentinversion3.5
<210>1
<211>376
<212>prt
<213>unknown
<220>
<223>人工序列
<400>1
metvalsertyrasnserlyspheleualaalathrvalglnalaglu
151015
provaltrpleuaspalaaspalathrileasplysserileglyile
202530
ilegluglualaalaglnlysglyalaserleuilealapheproglu
354045
valpheileproglypheprotyrtrpalatrpleuglyaspvallys
505560
tyrserleuserphethrserargtyrhisgluasnserleugluleu
65707580
glyaspaspargmetargargleuglnleualaalaargargasnlys
859095
ilealaleuvalmetglytyrsergluargglualaglyserargtyr
100105110
leuserglnvalpheileaspgluargglygluilevalalaasnarg
115120125
arglysleulysproserhisvalgluargthriletyrglyglugly
130135140
asnglythrasppheleuthrhisaspphealapheglyargvalgly
145150155160
glyleuasncystyrsertrpgluhisvalglnproleuserlysphe
165170175
metmettyrserleuglygluglnvalhisvalalasertrpproala
180185190
thrserproleuglnproaspvalpheglnasnserileglualaasn
195200205
alathrvalthrargsertyralailegluglyglnthrphevalleu
210215220
cystyrserserthrglnvalileglyproseralailegluthrphe
225230235240
cystyrserleuasnaspgluglnargalaleuleuproglnglycys
245250255
tyrserglytrpalaargiletyrglyproaspglysergluleuala
260265270
lysproleualagluaspalagluglyileleutyralagluileasp
275280285
leugluglnileleuleualalysalaglyalaaspprovalglyhis
290295300
tyrserargproaspvalleuservalglnpheaspproargasnhis
305310315320
thrprovalhisargileglyileaspglyargleuaspvalasnthr
325330335
argserargvalgluasnpheargleuargglnalaalagluglnglu
340345350
argglnalaserlysargleuglythrlysleuphegluglnserleu
355360365
leualaglugluprovalproala
370375
<210>2
<211>1131
<212>dna
<213>unknown
<220>
<223>人工序列
<400>2
atggtatcttacaactccaaatttctggctgctaccgtacaggctgaaccggtttggctg60
gacgcggacgcaactatcgataaatctattggtatcatcgaggaggcggcccagaaaggt120
gcgtctctgattgccttcccggaagttttcatccctggttttccgtattgggcctggctg180
ggtgacgtaaagtactccctgtccttcacctcccgttaccacgaaaactccctggaactg240
ggtgacgaccgtatgcgccgtctgcaactggctgcgcgtcgtaacaaaatcgcgctggtt300
atgggttacagcgagcgtgaggcaggcagccgctacctgtcccaggtctttatcgacgaa360
cgtggtgaaatcgttgctaaccgtcgtaaactgaaaccatctcacgttgaacgtacgatt420
tatggtgaaggcaacggtaccgactttctgacgcatgacttcgcatttggtcgtgttggt480
ggtctgaactgctgggagcacgttcagccgctgtccaaattcatgatgtactccctgggt540
gaacaggtacacgtcgcttcttggccggctacatccccgctgcaaccggacgtgtttcaa600
aactccatcgaggctaatgcgaccgtaacccgctcctatgctattgaaggccaaaccttc660
gttctgtgctctacgcaggttatcggtccgtctgcaattgaaaccttctgtctgaacgat720
gagcaacgtgcactgctgccgcagggttgcggttgggcgcgtatctacggcccggacggc780
agcgaactggccaagccgctggctgaagacgcagagggtattctgtacgcagaaatcgat840
ctggaacagattctgctggccaaggctggcgctgatccggttggtcactacagccgccct900
gatgtcctgtccgtgcagttcgacccgcgtaaccacaccccggtacaccgcattggtatc960
gatggccgtctggatgttaacacgcgttcccgtgtagaaaactttcgcctgcgtcaggca1020
gcagaacaggaacgtcaggccagcaaacgtctgggcacgaaactgtttgaacagtctctg1080
ctggcggaggagccggtaccagccaaactcgagcaccaccaccaccaccac1131
- 还没有人留言评论。精彩留言会获得点赞!