TM9SF1蛋白的应用和重组TM9SF1慢病毒表达载体及其构建方法与流程
本发明涉及生物技术领域,具体而言,涉及tm9sf1蛋白的应用和重组tm9sf1慢病毒表达载体及其构建方法。
背景技术:
九次跨膜超家族蛋白(transmembrane9superfamilyprotein,tm9sf,又称nonaspanins蛋白)结构上均含有一个大的非胞质区和9个跨膜区,在进化过程中高度保守。该家族蛋白在细菌、酵母、果蝇、哺乳动物等多个物种均有表达,与细胞免疫、细胞粘附、自噬、肿瘤侵袭和预后等多种生物功能密切相关,迄今为止尚未发现该家族成员在内质网应激方面功能的研究报道。
九次跨膜超家族蛋白1(transmembrane9superfamilyproteinmember1,tm9sf1)别称mp70,属于九次跨膜超家族成员之一,于1997年被初次克隆,在人体组织(尤其是肺、肾和胰腺表达水平较高)和多种细胞系广谱表达,人类tm9sf1蛋白与相应酵母蛋白具有大约30%的同源性,提示其可能与某些古老而重要的生物功能有关。现阶段关于tm9sf1的研究多数集中在表达方面:根据schlegel等报道,在对6-羟基多巴胺耐受和敏感的pc12细胞株中tm9sf1展现出表达差异性,相关机制和生理意义尚无研究;wang等通过蛋白质组学方法发现tm9sf1在破裂的颅内动脉瘤血管壁高表达,随后在组织学方面进行验证,推测tm9sfl持续高表达参与颅内动脉瘤形成和破裂过程相关的炎性和血管壁蛋白质降解过程。he等通过高通量筛选发现tm9sf1可以诱导宫颈癌细胞系hela细胞发生自噬现象,然而并未揭示其相关分子机制。而目前关于tm9sf1蛋白在其他细胞或组织内的功能研究尚未见诸报道。
鉴于此,特提出本发明
技术实现要素:
本发明的目的在于提供tm9sf1蛋白的在抑制细胞生长、引起细胞发生自噬、诱导细胞发生内质网应激等方面的应用。
本发明的另一目的在于提供一种重组tm9sf1慢病毒表达载体。
本发明的另一目的在于提供上述重组tm9sf1慢病毒表达载体的构建方法。
本发明的另一目的在于提供一种tm9sf1病毒的制备方法。
本发明的另一目的在于提供由上述制备方法得到tm9sf1病毒。
本发明的另一目的在于提供一种慢病毒表达系统。
本发明是这样实现的:
tm9sf1蛋白在制备用于抑制细胞生长的抑制剂中的应用。
tm9sf1蛋白在制备用于诱导细胞发生自噬的诱导剂中的应用。
tm9sf1蛋白制备用于诱导细胞发生内质网应激的诱导剂中的应用。
一种重组tm9sf1慢病毒表达载体,其由用于编码tm9sf1蛋白的核苷酸片段插入至plvx-ires载体上得到。
上述的重组tm9sf1慢病毒表达载体的构建方法,其包括:
用seqidno.1-2所示的引物进行pcr扩增得到用于编码tm9sf1蛋白的核苷酸片段;
用限制性内切酶speⅰ和bamhⅰ分别对所述核苷酸片段和plvx-ires载体进行双酶切;
将双酶切后的所述核苷酸片段和所述plvx-ires载体进行连接。
一种tm9sf1病毒的制备方法,其包括:用慢病毒包装质粒pspax2和pmd2g对权利要求4所述的重组tm9sf1慢病毒表达载体进行包装,转染293t细胞后,得到tm9sf1病毒。
上述的tm9sf1病毒的制备方法得到的tm9sf1病毒。
一种慢病毒表达系统,其包括上述的重组tm9sf1慢病毒表达载体和慢病毒包装质粒。
本发明的有益效果包括:
本发明的研究结果显示,tm9sf1蛋白作为九次跨膜超家族成员之一具有抑制细胞生长甚至引起细胞死亡的作用,且研究结果还显示tm9sf1蛋白引起细胞发生自噬和引起细胞发生内质网应激的作用。基于此,本发明提供的tm9sf1蛋白在制备用于抑制细胞生长的抑制剂、用于诱导细胞发生自噬的诱导剂以及用于诱导细胞发生内质网应激的诱导剂等领域中的应用,丰富了对九次跨膜超家族蛋白的认识,扩展了对tm9sf1的功能性研究,补充了tm9sf1蛋白在细胞或组织内的功能研究空白。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为本发明实施例1提供的重组tm9sf1慢病毒表达载体上的tm9sf1基因的部分测序结果;
图2为本发明实施例3提供的重组tm9sf1慢病毒表达载体表达tm9sf1蛋白的western印迹检测结果和免疫荧光检测结果;
图3为本发明实施例4提供的过表达tm9sf1蛋白对293t细胞形态和生长的影响结果;
图4为本发明实施例4提供的过表达tm9sf1蛋白引起293t细胞发生自噬和内质网应激的检测结果。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
下面对本发明实施例的tm9sf1蛋白的应用和重组tm9sf1慢病毒表达载体及其构建方法进行具体说明。
tm9sf1蛋白在进化过程中高度保守,在人体组织和多种细胞系广泛表达。目前关于该蛋白质的功能研究十分有限和初步。本发明采用慢病毒介导的tm9sf1表达系统,研究了重组tm9sf1蛋白的生化特点及其对细胞生长的调控作用。慢病毒感染的293t全细胞裂解液的蛋白质免疫印迹结果揭示,tm9sf1蛋白具有表观分子质量约为70kd的单体及寡聚体两种主要形式;在室温及加热37℃时蛋白质相对稳定,随变性温度升高(56℃以上)逐渐失去其稳定性。cck8法显示,与慢病毒空载体感染的293t细胞比较,tm9sf1慢病毒表达载体感染的293t细胞在感染2d后增殖明显减缓(p<0.001)。western印迹实验证明,过表达tm9sf1引起lc3ⅱ表达明显上调,lc3ⅱ/lc3ⅰ比例升高,说明tm9sf1可引起293t细胞发生自噬。荧光实时定量pcr结果显示,过表达tm9sf1的293t细胞内质网应激标志分子chop、gadd34和xbp1(s)表达水平是对照细胞的3~4倍,提示发生了内质网应激反应。以上结果提示,tm9sf1具有抑制293t细胞生长的功能,该功能可能与其引起的内质网应激和自噬有关,本发明的研究结果利于进一步加深对tm9sf1在细胞生长调控中的功能的认识。
基于上述发现,容易理解到,对于本领域技术人员来说,细胞外添加tm9sf1也具有引起细胞发生自噬、产生内质网应激以及抑制细胞生长的效果。
基于此,一方面,本发明提供了tm9sf1蛋白在制备用于抑制细胞生长的抑制剂中的应用。
另一方面,本发明提供了tm9sf1蛋白在制备用于诱导细胞发生自噬的诱导剂中的应用。
另一方面,本发明提供了tm9sf1蛋白制备用于诱导细胞发生内质网应激的诱导剂中的应用。
进一步地,上述细胞为293t细胞。
为研究tm9sf1在细胞环境中的潜在生物功能,本发明研建立了tm9sf1慢病毒过表达系统,并首次发现该蛋白质的理化特性和在293t细胞中特有的生物功能。即在293t细胞过表达tm9sf1蛋白,可引起细胞发生内质网应激、诱导细胞发生自噬以及抑制细胞生长的功能。
另一方面,本发明还提供了一种重组tm9sf1慢病毒表达载体,其由用于编码tm9sf1蛋白的核苷酸片段插入至plvx-ires载体上得到。
另一方面,本发明提供了上述重组tm9sf1慢病毒表达载体的构建方法,其包括:用seqidno.1-2所示的引物进行pcr扩增得到用于编码tm9sf1蛋白的核苷酸片段;
用限制性内切酶speⅰ和bamhⅰ分别对上述核苷酸片段和plvx-ires载体进行双酶切;
将双酶切后的上述核苷酸片段和上述plvx-ires载体进行连接。
另一方面,本发明还提供了tm9sf1病毒的制备方法,其包括:用慢病毒包装质粒pspax2和pmd2g对上述的重组tm9sf1慢病毒表达载体进行包装,转染293t细胞后,得到tm9sf1病毒。
可选地,在本发明的一些实施方案中,上述重组tm9sf1慢病毒表达载体、上述pspax2和上述pmd2g的质量比为(2.8-3.2):(1.8-2.2):(0.8-1.2)。
优选地,在本发明的一些实施方案中,上述重组tm9sf1慢病毒表达载体、上述pspax2和上述pmd2g的质量比为3:2:1。
另一方面,本发明还提供了由上述tm9sf1病毒的制备方法所得到的tm9sf1病毒。
另一方面,本发明提供了一种慢病毒表达系统,其包括上述的重组tm9sf1慢病毒表达载体和慢病毒包装质粒。
可选地,在本发明的一些实施方案中,上述慢病毒包装质粒包括pspax2和pmd2g质粒中一种或两种的组合。
本发明提供的重组tm9sf1慢病毒表达载体和慢病毒表达系统大大提高了转染效率,并在蛋白水平验证了tm9sf1蛋白的表达情况,为后续的功能和分子机制研究提供了有力的技术支撑。
综上,本发明提供的tm9sf1蛋白在制备用于抑制细胞生长的抑制剂、用于诱导细胞发生自噬的诱导剂以及用于诱导细胞发生内质网应激的诱导剂等领域中的应用,丰富了对九次跨膜超家族蛋白的认识,扩展了对tm9sf1的功能性研究,补充了tm9sf1蛋白在细胞或组织内的功能研究空白。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
慢病毒表达系统由plvx-ires-puro、pspax2和pmd2g三种质粒构成,购买自吉凯基因公司;限制性内切酶spei和bamhi、t4dna连接酶、碱性磷酸酶由neb公司生产;2xcobuddymastermix(含超高保真dna聚合酶)、琼脂糖凝胶回收试剂盒、感受态细菌、质粒小提和大提试剂盒购买自康为世纪有限公司;hek293细胞和293t细胞购买自atcc(美国标准生物品收藏中心);dmem培养基和胰酶来自gibco公司;胎牛血清(fbs)由sciencell公司生产;转染试剂vigofect购买自维格拉斯公司;trizol试剂由invitrogen公司生产,逆转录试剂盒购买自thermoscientific公司;tm9sf1和gapdh抗体由abclonal公司生产,lc3抗体、羊抗兔二抗和羊抗鼠二抗为abcam公司生产。
实施例1
重组tm9sf1慢病毒过表达载体的构建1.1经ncbi数据库检索,获取tm9sf1基因mrna的编码区序列,碱基序列如seqidno.1所示,其编码的tm9sf1蛋白的氨基酸序列如seqidno.4所示。
1.2由primerpremier软件设计出扩增tm9sf1编码区全长的引物,上下游引物序列分别为:
f:5′-gactagtatgacagtcgtagggaaccct-3′(下划线为spei酶切位点,seqidno.1)和r:5′-cgggatcctcagtccatcttgaggttaacatag-3′(下划线为bamhi酶切位点,seqidno.2)。
1.3提取hek293细胞总rna,逆转录获得cdna文库。
1.4以cdna为模板,利用上下游引物f和r以及高保真cobuddymastermix进行pcr扩增。
pcr扩增体系:2×cobuddymastermix25μl、引物f和r各0.5μl、cdna模板2.5μl、去离子水21.5μl。
pcr扩增程序:首先98℃预变性1min;然后98℃10s、58℃20s、72℃1min,32cycles;最后延伸10min。
1.5利用琼脂糖凝胶回收试剂盒回收的pcr产物与plvx-ires-puro质粒同时分别进行speⅰ和bamhⅰ双酶切,37℃孵育1h。、
1.6切胶回收的双酶切pcr片段与质粒片段按照5∶1的比例通过t4dna连接酶进行连接反应,连接产物转化dh5α感受态细菌。
1.7待长出单菌落后,随机挑单克隆10个,37℃摇床孵育8h进行扩增。用小提试剂盒提取质粒,琼脂糖凝胶电泳挑选比空载体大的克隆送往擎科公司测序,最后挑选1个经测序证明插入片段完全正确的克隆进行大量扩增和质粒提取,该质粒为重组tm9sf1慢病毒过表达载体,记为plvx-ires-tm9sf1。
测序的鉴定结果如图1所示(图中:(a)为plvx-ires-tm9sf1载体插入序列测序峰图(部分)。(b)为plvx-ires-tm9sf1载体插入序列与ncbi数据库公布的标准序列比对结果(部分)),峰图清晰锐利(图1-a),所插入片段与ncbi数据库中的tm9sf1cds序列一致性为100%(图1-b),说明载体构建成功。
实施例2
tm9sf1慢病毒的包装
2.1293t细胞于高糖dmem培养基(含10%胎牛血清)中培养。待细胞汇合度至40%~60%之间时,转染病毒质粒。
2.2取5μg质粒dna(plvx-ires-tm9sf1∶pspax2∶pmd2g=3∶2∶1)加入pbs稀释液中至总体积为100μl,轻轻混匀。
2.3取vigofect2μl加入pbs稀释液中至总体积为100μl,轻轻混匀,室温放置5min。
2.4将稀释的vigofect逐滴加入稀释的dna溶液中,轻轻混匀,所得的转染工作液室温放置15min。
2.5将转染工作液逐滴加入培养基(步骤2.1中的培养有293t细胞的dmem培养基)中,轻轻混匀,置于37℃,5%co2孵箱中培养。转染后6h换液,48~72h之间收获上清,2000r/min离心10min去掉细胞碎片,即为含tm9sf1慢病毒的病毒液。
2.6空载体系统慢病毒制备同上。
实施例3
重组tm9sf1慢病毒表达鉴定以及蛋白特性分析
3.1待293t细胞密度达到50%左右时,进行病毒感染,感染液成分包含两份完全培养基和一份病毒液,另加感染促进剂polybrene至终浓度为10μg/ml。
3.2感染后24h换液,48h观察细胞形态,收集细胞进行western印迹表达鉴定。
3.3用含蛋白酶抑制剂cocktail的ripa裂解液裂解细胞获取总蛋白质,bca定量试剂盒检测蛋白浓度,取50μg总蛋白质进行sds-page电泳。
3.4电泳结束后将蛋白质转印至硝酸纤维素(nc)膜上,用含5%脱脂牛奶的tbst室温封闭2h,之后用兔抗tm9sf1抗体(1∶1000)4℃摇床孵育过夜。
3.5tbst充分洗涤nc膜后用alexa
3.6洗涤后用odyssey红外成像系统扫描。
3.7免疫荧光:细胞爬片感染慢病毒后48h,用4%多聚甲醛固定30min,0.5%tritonx-100打孔30min,山羊血清封闭1h,兔抗tm9sf1(1∶200)4℃孵育过夜。充分洗涤爬片后用alexafluor488标记的羊抗兔二抗(1∶500)室温孵育40min。充分洗涤后,激光共聚焦扫描显微镜(confocal)拍照。
结果如图2所示(图中:(a)为western免疫印迹技术检测全细胞裂解液中的tm9sf1蛋白。ripa制备全细胞裂解液,加入上样缓冲液后于不同温度条件下孵育(如图所示),总蛋白通过sds-page分离并转印至nc膜,然后与抗tm9sf1抗体进行杂交,gapdh作为内参提示上样量的一致性。nc:阴性对照;rt:室温。(b)为免疫荧光技术鉴定tm9sf1在293t细胞中的表达。细胞与tm9sf1特异性一抗杂交后,再与alexafluor488标记的荧光二抗(绿色)进行孵育。dapi(蓝色)特异性染核。同型抗体组作为阴性对照。红色箭头指示tm9sf1过表达阳性细胞。比例尺=20μm。),通过tm9sf1特异性抗体杂交,在预定分子质量位置(70kd)有特异性差异带(图2-a),说明重组慢病毒成功过表达。有意思的是除了在预定信号位置有特异性条带外,还有相当一部分蛋白质滞留在免疫印迹膜上分子质量大于170kd以上的位置,推测是形成蛋白质寡聚体(图2-a)。通过不同温度下变性处理,发现37℃生理温度下变性后,tm9sf1蛋白寡聚体形成量最少,即无论是室温(rt)还是随着温度不断升高(56℃,75℃,98℃)条件下变性蛋白质寡聚体形成比例均高于37℃生理温度下的形成量。另外,在超过37℃变性时该蛋白质单体和寡聚体含量均随着温度升高逐渐减少,说明在37℃以上其稳定性随温度升高而逐渐降低(图2-a)。
免疫荧光实验结果显示(图2-b),tm9sf1慢病毒过表达的293t细胞特异性抗体染色阳性(箭头所示),而同型对照组无明显染色,说明tm9sf1慢病毒成功过表达,且该蛋白质主要表达于细胞质,既有弥散性亦有聚集性表达。
实施例4
tm9sf1过表达抑制293t细胞生长
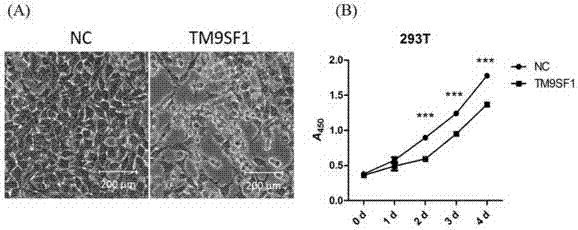
cck8细胞增殖实验:tm9sf1慢病毒感染293t细胞24h后,消化细胞,计数,铺到96孔板中,每孔2000个细胞,每组3个复孔,当天记为第0天。待细胞贴壁后加cck8,4h后酶标仪检测450nm吸光度a450,每天检测一次,连续检测至第4d。结果如图3所示。
图3的结果显示(图中:(a)293t细胞形态学改变。细胞感染plvx-ires-tm9sf1慢病毒后48h,相差显微镜下拍照。比例尺=200μm。nc:阴性对照组细胞;tm9sf1:过表达组293t细胞。(b)为cck8实验检测细胞生长的结果。plvx-ires-tm9sf1慢病毒感染后24h,细胞被消化,铺到96孔板中,进行cck8实验检测0-4天内的生长情况。数据以均值±标准差表示(n=3)。***表示p<0.001。),发现感染后48h过表达组293t细胞较阴性对照组生长受到明显抑制,甚至发生了死亡,而阴性对照组生长状态良好。相差显微镜下观察,过表达组较阴性对照组细胞密度降低,细胞碎片明显增多,阴性对照组细胞形态饱满,汇合度接近饱和(图3-a)。cck8增殖实验结果显示,随着时间延长,过表达组较阴性对照组细胞生长曲线受到一定程度的抑制(图3-b)。由此表明,tm9sf1蛋白具有抑制细胞生长的作用。
实施例5
tm9sf1过表达引起293t细胞自噬和内质网应激反应
5.1利用western印迹检测自噬最常用的指标lc3,结果发现lc3ii表达明显增多,lc3ii/lc3i比例明显升高(如图4-a所示),说明tm9sf1可以引起293t细胞发生自噬。
5.2利用实时荧光定量pcr技术检测一系列内质网应激的标志分子,具体操作如下:
5.2.1慢病毒感染293t细胞48h后,trizol裂解细胞,提取总rna,取3μg逆转录得cdna,用sbrygreen染料法实时定量pcr检测相关基因的表达水平。
5.2.2扩增条件为:95℃10min,95℃15s,60℃1min,40个循环。各基因的表达量用内参基因gapdh进行校正。利用荧光定量pcr溶解曲线确定引物的特异性。
相关基因的荧光定量pcr引物的上下游引物的序列见表1如下:
表1
结果图如4所示(图中:(a)为western免疫印迹检测自噬标志分子lc3ii表达水平。gapdh作为上样内参。右图为左图的灰度分析结果。(b)为实时定量pcr技术检测内质网应激标志分子chop,gadd34和xbp1(s)的表达水平。(c)为实时定量pcr技术检测增殖相关基因bcl-2,bcl-xl和cyclind1。gapdh作为定量pcr内参,阴性对照组(puro)被标准化为1。数据以均值±标准差表示(n=3)。***表示p<0.001。),结果显示chop、gadd34和xbp1(s)表达水平是阴性对照组的3~4倍(图4-b),提示发生了内质网应激反应。细胞增殖相关基因bcl-2、bcl-xl和cyclind1则无明显变化(图4-c)。
综上,九次跨膜超家族蛋白(tm9sf)进化保守、表达谱广,尽管目前关于该家族蛋白的功能性研究比较有限,但根据目前已知研究成果,其成员涉及的生物功能非常重要。为了进一步探索该基因潜在生物功能,本研究首先建立了重组tm9sf1慢病毒过表达系统,大大提高了转染效率,并在蛋白水平验证了其表达情况(图2),为后续的功能和分子机制研究提供了有力的技术支撑。本发明首次发现tm9sf1蛋白作为九次跨膜超家族成员之一具有抑制293t细胞生长甚至引起细胞死亡的作用(图3)。由于自噬是细胞在应激时的一种防御反应,其结局可能是使细胞度过暂时难关而恢复正常状态,当应激过强或持续时间过久也可能导致细胞走向死亡。
利用western印迹技术检测了研究自噬最常用的指标lc3,发现lc3ⅱ表达明显增多,提示tm9sf1同样可以引起293t细胞发生自噬(图4-a),这可能是其引起细胞生长抑制的原因之一。
为了探索内质网应激在tm9sf1抑制293t细胞生长过程中的作用,利用定量pcr技术检测了内质网应激相关分子,发现chop、gadd34和xbp1(s)表达水平较阴性对照组明显升高(图4-b),说明的确发生了内质网应激。bcl-2和bcl-xl是bcl-2家族重要的抗凋亡成员,对细胞的存活和增殖发挥着重要作用。细胞周期相关蛋白控制着细胞周期进程,对细胞生长起到重要调节作用。本发明检测了与细胞增殖相关的几个重要基因bcl-2、bcl-xl和cyclind1,结果无显著变化(图4-c),说明在该过程中相关分子无转录水平的调节或者并未发挥作用。因此,根据本发明结果,又充足的理由推测是tm9sf1导致293t细胞发生了内质网应激,进而引起自噬,最终导致细胞生长抑制甚至死亡。
总之,本发明通过所构建的慢病毒过表达系统对tm9sf1进行了初步的功能性探究,发现其具有抑制293t细胞生长的作用,该作用可能与其导致的内质网应激和自噬有关。该结果丰富了对九次跨膜超家族蛋白的认识,扩展了对tm9sf1的功能性研究。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
sequencelisting
<110>湖北文理学院
<120>tm9sf1蛋白的应用和重组tm9sf1慢病毒表达载体及其构建方法
<160>4
<170>patentinversion3.5
<210>1
<211>28
<212>dna
<213>人工序列
<400>1
gactagtatgacagtcgtagggaaccct28
<210>2
<211>33
<212>dna
<213>人工序列
<400>2
cgggatcctcagtccatcttgaggttaacatag33
<210>3
<211>1821
<212>dna
<213>人工序列
<400>3
atgacagtcgtagggaaccctcgaagttggagctgccagtggttgccaatcctgatactg60
ttgctgggcacaggccatgggccaggggtggaaggcgtgacacactacaaggccggcgac120
cctgttattctgtatgtcaacaaagtgggaccctaccataaccctcaggaaacttaccac180
tactatcagcttccagtctgctgccctgagaagatacgtcacaaaagccttagcctgggt240
gaagtgctggatggggaccgaatggctgagtctttgtatgagatccgctttcgggaaaac300
gtggagaagagaattctgtgccacatgcagctcagttctgcacaggtggagcagctgcgc360
caggccattgaagaactgtactactttgaatttgtggtagatgacttgccaatccggggc420
tttgtgggctacatggaggagagtggtttcctgccacacagccacaagataggactctgg480
acccatttggacttccacctagaattccatggagaccgaattatatttgccaatgtttca540
gtgcgggacgtcaagccccacagcttggatgggttacgacctgacgagttcctaggcctt600
acccacacttatagcgtgcgctggtctgagacttcagtggagcgtcggagtgacaggcgc660
cgtggtgacgatggtggtttctttcctcgaacactggaaatccattggttgtccatcatc720
aactccatggtgcttgtgtttttactggtgggttttgtggctgtcattctaatgcgtgtg780
cttcggaatgacctggctcggtacaacttagatgaggagaccacctctgcaggttctggt840
gatgactttgaccagggtgacaatggctggaaaattatccatacagatgtcttccgcttc900
cccccataccgtggtctgctctgtgctgtgcttggcgtgggtgcccagttcctggccctt960
ggcactggcattattgtcatggcactgctgggcatgttcaatgtgcaccgtcatggggcc1020
attaactcagcagccatcttgttgtatgccctgacctgctgcatctctggctacgtgtcc1080
agccacttctaccggcagattggaggcgagcgttgggtgtggaacatcattctcaccacc1140
agtctcttctctgtgcctttcttcctgacgtggagtgtggtgaactcagtgcattgggcc1200
aatggttcgacacaggctctgccagccacaaccatcctgctgcttctgacggtttggctg1260
ctggtgggctttcccctcactgtcattggaggcatctttgggaagaacaacgccagcccc1320
tttgatgcaccctgtcgcaccaagaacatcgcccgggagattccaccccagccctggtac1380
aagtctactgtcatccacatgactgttggaggcttcctgcctttcagtgccatctctgtg1440
gagctgtactacatctttgccacagtatggggtcgggagcagtacactttgtacggcatc1500
ctcttctttgtcttcgccatcctgctgagtgtgggggcttgcatctccattgcactcacc1560
tacttccagttgtctggggaggattaccgctggtggtggcgatctgtgctgagtgttggc1620
tccaccggcctcttcatcttcctctactcagttttctattatgcccggcgctccaacatg1680
tctggggcagtacagacagtagagttcttcggctactccttactcactggttatgtcttc1740
ttcctcatgctgggcaccatctcctttttttcttccctaaagttcatccggtatatctat1800
gttaacctcaagatggactga1821
<210>4
<211>606
<212>prt
<213>人工序列
<400>4
metthrvalvalglyasnproargsertrpsercysglntrpleupro
151015
ileleuileleuleuleuglythrglyhisglyproglyvalglugly
202530
valthrhistyrlysalaglyaspprovalileleutyrvalasnlys
354045
valglyprotyrhisasnproglngluthrtyrhistyrtyrglnleu
505560
provalcyscysproglulysilearghislysserleuserleugly
65707580
gluvalleuaspglyaspargmetalagluserleutyrgluilearg
859095
phearggluasnvalglulysargileleucyshismetglnleuser
100105110
seralaglnvalgluglnleuargglnalaileglugluleutyrtyr
115120125
phegluphevalvalaspaspleuproileargglyphevalglytyr
130135140
metglugluserglypheleuprohisserhislysileglyleutrp
145150155160
thrhisleuaspphehisleugluphehisglyaspargileilephe
165170175
alaasnvalservalargaspvallysprohisserleuaspglyleu
180185190
argproaspglupheleuglyleuthrhisthrtyrservalargtrp
195200205
sergluthrservalgluargargseraspargargargglyaspasp
210215220
glyglyphepheproargthrleugluilehistrpleuserileile
225230235240
asnsermetvalleuvalpheleuleuvalglyphevalalavalile
245250255
leumetargvalleuargasnaspleualaargtyrasnleuaspglu
260265270
gluthrthrseralaglyserglyaspasppheaspglnglyaspasn
275280285
glytrplysileilehisthraspvalpheargpheproprotyrarg
290295300
glyleuleucysalavalleuglyvalglyalaglnpheleualaleu
305310315320
glythrglyileilevalmetalaleuleuglymetpheasnvalhis
325330335
arghisglyalaileasnseralaalaileleuleutyralaleuthr
340345350
cyscysileserglytyrvalserserhisphetyrargglnilegly
355360365
glygluargtrpvaltrpasnileileleuthrthrserleupheser
370375380
valprophepheleuthrtrpservalvalasnservalhistrpala
385390395400
asnglyserthrglnalaleuproalathrthrileleuleuleuleu
405410415
thrvaltrpleuleuvalglypheproleuthrvalileglyglyile
420425430
pheglylysasnasnalaserpropheaspalaprocysargthrlys
435440445
asnilealaarggluileproproglnprotrptyrlysserthrval
450455460
ilehismetthrvalglyglypheleupropheseralaileserval
465470475480
gluleutyrtyrilephealathrvaltrpglyarggluglntyrthr
485490495
leutyrglyileleuphephevalphealaileleuleuservalgly
500505510
alacysileserilealaleuthrtyrpheglnleuserglygluasp
515520525
tyrargtrptrptrpargservalleuservalglyserthrglyleu
530535540
pheilepheleutyrservalphetyrtyralaargargserasnmet
545550555560
serglyalavalglnthrvalgluphepheglytyrserleuleuthr
565570575
glytyrvalphepheleumetleuglythrileserphepheserser
580585590
leulyspheileargtyriletyrvalasnleulysmetasp
595600605
- 还没有人留言评论。精彩留言会获得点赞!
- 用于检测EB病毒Rta/IgG抗体的化学发光试剂盒及其应用
- 表达猪传染性胃肠炎病毒s蛋白a位点的重组猪痘病毒载体疫苗的制作方法
- 一种口蹄疫病毒2c3abc重组蛋白及其制备方法和应用
- 抗草鱼出血病病毒工程蛋白tat-vp7-tat及制备方法和应用
- 一种重组猪流行性腹泻病毒n蛋白及其制备方法
- 表达西尼罗热病毒PrM/E蛋白的重组新城疫LaSota疫苗株的制作方法
- 一种抗乙型肝炎病毒x蛋白抗体酶联免疫测定试剂盒及其制备方法
- 蓝舌病病毒ns2蛋白单克隆抗体btv-4d4及其识别的b细胞表位和应用的制作方法
- 一种检测黄热病毒抗体的重组抗原蛋白、试剂盒及其应用的制作方法
- 一种同步检测十二种病原抗体的蛋白悬浮芯片系统的制作方法