蜜蜂肽聚糖识别蛋白的制备方法与流程
本发明涉及分子生物学领域,具体而言,涉及一种蜜蜂肽聚糖识别蛋白的制备方法。
背景技术:
昆虫作为地球上种类最多的动物,目前已知的约有100万种,它们大多生活在充满病原微生物的恶劣环境中,在长期的进化选择压力作用下,昆虫形成了一套免疫防御体系来抵御这些病原微生物的入侵。
昆虫缺乏获得性免疫,仅依赖于先天免疫作为其防御机制。对于外来入侵的病原微生物来说,昆虫通过先天免疫系统进行抵抗,第一步是通过模式识别受体识别病原相关分子模式,从而激活下游反应。在昆虫中作为模式识别受体的有:肽聚糖识别蛋白(peptidoglycanrecognitionproteins,pgrps)、β-葡聚糖识别蛋白(β-glucanrecognitionproteins,β-grp)以及革兰氏阴性菌结合蛋白(gram-neg-ativebindingprotein,gnbp),但其中最主要的模式识别受体是肽聚糖识别蛋白。
pgrps最初于家蚕的血淋巴中被发现,此蛋白结合细菌肽聚糖并激活酚氧化酶原级联反应-昆虫宿主抗菌防御机制。pgrp-sa为分泌型pgrps,识别革兰氏阳性菌或真菌细胞壁肽聚糖(pgn)活化toll信号通路诱导抗菌肽的表达,抵御细菌与真菌等病原微生物的入侵。蜜蜂基因组测序揭示了蜜蜂拥有4个pgrps蛋白,在细菌感染刺激后其pgrp-sa蛋白的表达量显著上调。果蝇、小菜蛾与家蝇等昆虫的肽聚糖识别蛋白pgrp-sa已分别于昆虫hi-5细胞、果蝇s2细胞、大肠杆菌(pet28a+载体)进行了表达;小菜蛾pgrp-sa蛋白的专利已申请专利并授权(公开号cn103484468a,公开日2014年1月1日);上述昆虫pgrp-sa的研究中仅有果蝇pgrp-sa表达后,经纯化后,蛋白纯度达到90%以上。然而上述研究并没有形成昆虫的pgrp-sa蛋白规模化制备以及高纯度蛋白纯化的有效方法。
蜜蜂是众多野生植物与农作物的有效授粉昆虫,具有重要的经济价值与生态价值;同时,蜜蜂的健康受到细菌等多种病原微生物的威胁,其先天免疫系统中重要免疫分子肽聚糖识别蛋白pgrp-sa的体外制备尚未见有报道,这严重阻碍了蜜蜂新型抗菌免疫药物的研究与应用。
有鉴于此,特提出本发明。
技术实现要素:
本发明的目的在于,提供一种蜜蜂肽聚糖识别蛋白的制备方法,该方法能够高效制备并复性获得高纯度、高均一性的活性目标蛋白。
为了实现本发明的上述目的,特采用以下技术方案:
一种蜜蜂肽聚糖识别蛋白的制备方法,包括如下步骤:
1)、将蜜蜂pgrp-sa的基因片段连接表达载体并转化至大肠杆菌进行表达,收集表达得到的包涵体蛋白;
2)、将所述包涵体蛋白洗涤后加入蛋白变性剂溶解,随后用复性液进行复性处理;
3)、将蛋白浓缩后依次经分子筛柱和阴离子交换柱洗脱纯化。
在蛋白质的表达纯化过程中,复性问题一直是生物工程中的一个难点和热点。其关键问题来自于复性过程中聚集体的形成。当蛋白在高浓度下折叠复性时,伸展的肽链由于疏水基团的外露,更加容易由于疏水相互作用或者分子间的错配的二硫键形成聚集体。经典的复性方法一般采用稀释法和透析法,前者将变性蛋白直接加入复性缓冲液,高蛋白浓度下往往形成大量沉淀,因而复性时要求很低的蛋白浓度;而后者操作繁琐,不利于放大。超滤法复性可以将变性剂用复性缓冲液连续置换,使变性剂浓度缓慢降低,而蛋白浓度不会明显降低,而且便于自动化操作,但剪切力可能导致复性好的蛋白质重新变性而降低活性收率。其它改进的经典复性方法还有脉冲复性、滴加复性和膜管流加复性,它们均不能从根本上解决聚集沉淀的问题。
本发明采用的层析法复性是近年来基于层析分离原理的基础上发展起来的一种新的复性方法。这种方法对蛋白比较温和,处理的蛋白浓度可以很高,操作简单、周期短,被广泛用于进行蛋白质复性,因此逐渐发展成一种将纯化和复性结合起来的复合式纯化方法。
与现有技术相比,本发明的有益效果为:
对蜜蜂pgrp-sa蛋白表达条件进行了优化,优选了各过程中重要试剂的配方,结合采用层析法复性,方法简单快速,操作过程温和,对蛋白损伤小,获得了高纯度的活性蛋白质。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
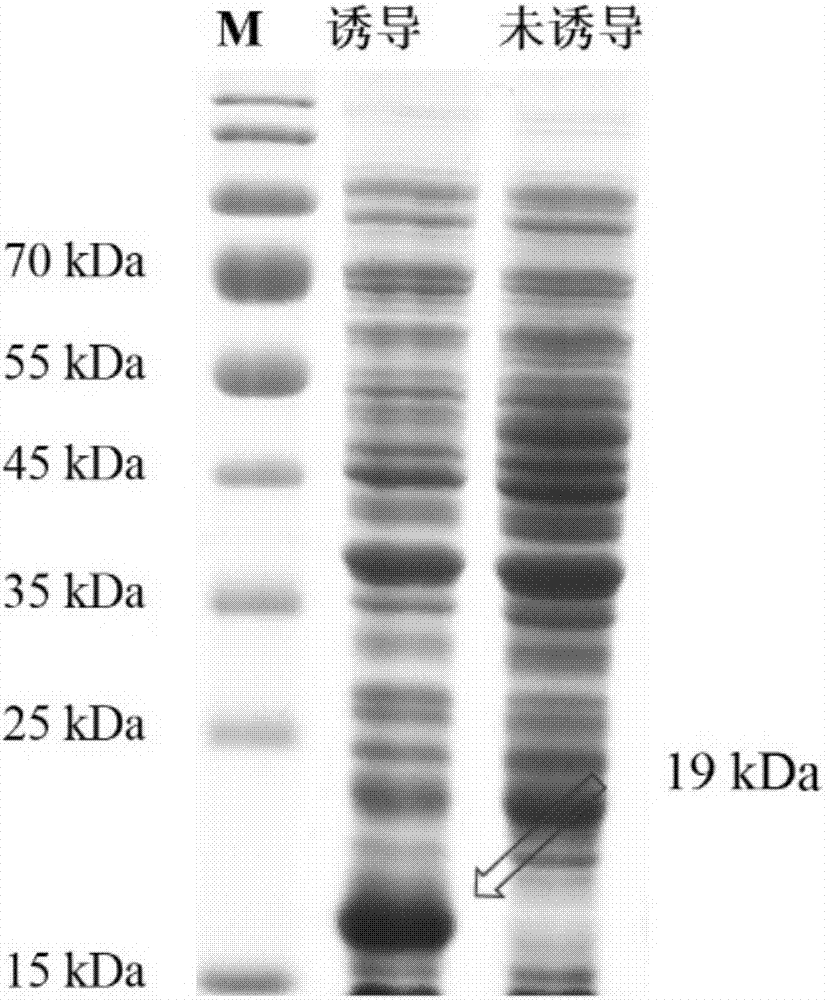
图1为蜜蜂pgrp-sa(mpgrp-sa)诱导表达后收集的包涵体蛋白电泳图;
图2为蜜蜂pgrp-sa(mpgrp-sa)包涵体经过洗涤液洗涤后的包涵体蛋白电泳图;
图3为蜜蜂pgrp-sa(mpgrp-sa)superdex200increase纯化图;
图4为蜜蜂pgrp-sa(mpgrp-sa)resourceq纯化图;
图5为蜜蜂pgrp-sa(mpgrp-sa)纯化后sds-page鉴定图。
具体实施方式
本发明涉及一种肽聚糖识别蛋白pgrp-sa的体外表达、折叠复性以及多步骤纯化方法的建立;特别是涉及野生植物与农作物重要授粉昆虫-蜜蜂先天抗菌免疫反应中重要识别分子pgrp-sa蛋白的体外制备方法。
一种蜜蜂肽聚糖识别蛋白的制备方法,包括如下步骤:
1)、将蜜蜂pgrp-sa的基因片段连接表达载体并转化至大肠杆菌进行表达,收集表达得到的包涵体蛋白;
2)、将所述包涵体蛋白洗涤后加入蛋白变性剂溶解,随后用复性液进行复性处理;
3)、将蛋白浓缩后依次经分子筛柱和阴离子交换柱洗脱纯化。
优选的,如上所述的制备方法,所述蜜蜂pgrp-sa的基因片段如seqidno:1所示。
在蛋白表达时,所选取的片段的大小及带电荷情况对表达效率有着很大的影响。
优选的,如上所述的制备方法,所述蜜蜂pgrp-sa的基因片段的获取方法为:
以蜜蜂cdna为模板,以seqidno:2所示的上游引物和seqidno:3所示的下游引物进行扩增;
优选的,退火温度为53℃~57℃,循环次数为28~32次;
在一些实施方式中,扩增时采用takara公司lataq酶进行扩增;
在一些实施方式中,扩增时pcr反应的条件为:
①92℃~95℃变性3~8min;
②92℃~95℃变性25~35s;
③53℃~57℃退火0.5~2min;
④70℃~73℃延伸20~40s;
重复②~④28~32次;
⑤70℃~73℃延伸7~12min;
可选的,⑥0~6℃持续保温。
更优选的,在一些实施方式中,扩增时pcr反应的条件为:
①93℃~95℃变性3~6min;
②93℃~95℃变性27~32s;
③53℃~57℃退火1~1.5min;
④71℃~73℃延伸25~35s;
重复②~④29~31次;
⑤71℃~73℃延伸8~11min;
可选的,⑥2~6℃持续保温。
优选的,如上所述的制备方法,所述表达载体为pet21a+载体。
优选的,如上所述的制备方法,在步骤2)中,洗涤所述包涵体蛋白时所用的洗涤液选自洗涤液a和/或洗涤液b;
所述洗涤液a的成分包括0.4%~0.6%(v/v)triton-100,45~55mmtris-cl,280~320mmnacl,8~12mmedta-na2,8~12mmdtt,ph=7.8~8.2;
所述洗涤液b的成分包括45~55mmtris-cl,80~120mmnacl,8~12mmedta-na2,8~12mmdtt,ph=7.8~8.2;
优选的,所述洗涤液a的成分包括5%(v/v)triton-100,47~52mmtris-cl,290~310mmnacl,9~11mmedta-na2,9~11mmdtt,ph=7.8~8.2;
所述洗涤液b的成分包括47~52mmtris-cl,90~110mmnacl,9~11mmedta-na2,9~11mmdtt,ph=7.8~8.2;
优选的,用洗涤液a洗涤1~3次后再用洗涤液b洗涤1~2次;
更优选的,用洗涤液a洗涤2~3次后再用洗涤液b洗涤1次。
优选的,如上所述的制备方法,所述蛋白变性剂中包含5~7mol的盐酸胍;
更优选的,所述蛋白变性剂的成分包括:
5~7m盐酸胍,8%~12%(v/v)甘油,45~55mmtris,90~110mmnacl,8~12mmedta-na2,8~12mmdtt,ph=7.8~8.2;
5.5~6.5m盐酸胍,9%~11%(v/v)甘油,47~53mmtris,95~105mmnacl,9~11mmedta-na2,9~11mmdtt,ph=7.9~8.1。
优选的,当将包涵体溶解如所述蛋白变性剂时,调整包涵体的浓度至25~35mg/ml;太高的浓度容易形成聚体沉淀,太低的浓度不经济。
优选的,如上所述的制备方法,所述复性液的成分包括:
80~110mmtris,380~420mml-arghcl(精氨酸盐酸),1.8~2.2mmedta,4.5~5.5mmgsh(还原型谷胱甘肽),0.4~0.6mmgssg(氧化型谷胱甘肽),ph=7.8~8.2;
更优选的,所述复性液的成分包括:
90~105mmtris,390~410mml-arghcl,1.9~2.1mmedta,4.8~5.2mmgsh,0.4~0.6mmgssg,ph=7.9~8.1。
本发明采用氧化还原电对(redox)的方法进行复性,通过调整gssg/gsh的比例来控制较精确的氧化还原电势。
优选的,如上所述的制备方法,所述用复性液进行复性处理的条件为:
按16~20mg包涵体蛋白:100ml复性液的比例将包涵体蛋白加入复性液搅拌复性10h~14h;
更优选的,包涵体蛋白加入复性液时逐滴加入;
更优选的,搅拌的速率为1~3转/s,转子长度为3.0cm,于2℃~6℃搅拌。
优选的,如上所述的制备方法,在步骤3)中,所述浓缩为将500ml含有包涵体蛋白的复性液浓缩至3.5~4.5ml。
优选的,如上所述的制备方法,所述分子筛柱为superdex200increase;
更选的,所述分子筛柱洗脱的条件为:
室温,洗脱液的成分包括18~22mmtris,45~55mmnacl,ph=7.8~8.2,以0.8~1.2ml/min的流速连续洗脱;
更优选的,洗脱液的成分包括19~21mmtris,47~52mmnacl,ph=7.9~8.1,以0.9~1.1ml/min的流速连续洗脱。
优选的,如上所述的制备方法,所述阴离子交换柱为resourceq;
更优选的,所述阴离子交换柱的结合液为8~12mmtris,8~12mmnacl,ph=7.8~8.2;
更优选的,所述阴离子交换柱的结合液为9~11mmtris,9~11mmnacl,ph=7.9~8.1;
优选的,所述阴离子交换柱洗脱的条件为:
室温,洗脱液的成分包括8~12mmtris,180~220mmnacl,ph=7.8~8.2,连续梯度洗脱,40~60min内连续流入45%~55%浓度的洗脱液;
更优选的,洗脱液的成分包括9~11mmtris,190~210mmnacl,ph=7.9~8.1,连续梯度洗脱,45~55min内连续流入47%~53%浓度的洗脱液。
离子交换层析可以利用蛋白质的电荷将其吸附,通过改变洗脱剂的变性剂浓度使其复性,不仅可以纯化蛋白,也能进一步进行复性,有效地防止蛋白质的聚集。
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
实施例1
本实施例所表达蛋白的序列通过以下方法获得:
通过常规方法提取火红蜜蜂的总rna,然后进行反转录得到cdna,以cdna为模板扩增蜜蜂pgrp-sa基因,该基因片段大小约500bp,序列如seqidno:1所示。
扩增时所用的上游引物如seqidno:2所示,下游引物如seqidno:3所示。
采用takara公司lataq酶进行扩增,扩增条件为:
①95℃变性5min;
②95℃变性30s;
③55℃退火1min;
④72℃延伸30s;
重复②~④30次;
⑤72℃延伸10min;
⑥4℃持续保温。
将上述基因片段连接pet21a+载体(内切酶ecori/xhoi),转化大肠杆菌工程菌transetta(de3)。挑取单克隆菌落,37℃200rpm培养12小时后作为母液,之后进行大量的细菌培养同时加工作浓度为1mg/ml的iptg进行蛋白的大量诱导表达;经4℃,8000×g高速离心3min收集沉淀物、超声破碎(输出功率360w,间隔时间6sec,工作时间12sec,工作次数99次)后收集沉淀中的包涵体蛋白,包涵体蛋白的电泳结果如图1所示。
将收集得到的包涵体蛋白用洗涤液a洗涤2次后再用洗涤液b洗涤1次,一共3次。
所述洗涤液a的配方为:
5%(v/v)triton-100,50mmtris-cl,300mmnacl,10mmedta-na2,10mmdtt,ph=8.0;
所述洗涤液b的配方为:
50mmtris-cl,100mmnacl,10mmedta-na2,10mmdtt,ph=8.0;
sds-page鉴定包涵体的收集量以及纯度(图2),然后以30mg/ml的浓度计算加入6mol的盐酸胍(6mgua-hcl,10%甘油,50mmtrisph8.0,100mmnacl,10mmedta-na2,10mmdtt)溶解。
配置500ml复性液:
100mmtris,400mml-arghcl,2.0mmedta,5.0mmgsh,0.5mmgssg,ph=8.0。
逐滴向复性液中加入90mg的包涵体蛋白,搅拌复性,搅拌速率:2转/s,转子长度为3.0cm,于4℃搅拌12小时。
将复性后的溶液500ml经过4℃冰箱进行,压力≤0.4mpa减压浓缩后稀释,再于4℃,3500×g离心浓缩,浓缩蛋白于4ml。
首先以分子量为依据经分子筛柱superdex200increase纯化(图3);
分子筛柱洗脱的条件为:
室温,洗脱液的成分为:
20mmtris,40mmnacl,ph=8.0,以1.0ml/min的流速连续洗脱;
收集纯化后的蛋白,然后以蛋白表面带电荷量为依据再经阴离子交换柱resourceq纯化(图4):
所述阴离子交换柱的结合液为10mmtris,10mmnacl,ph=8.0;
所述阴离子交换柱洗脱的条件为:
室温,洗脱液的成分包括10mmtris,200mmnacl,ph=8.0,连续梯度洗脱,50min内连续流入50%浓度的洗脱液。
将阴离子交换柱洗脱后的蛋白使用sds-page鉴定(图5),蛋白纯度达到90%以上。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,但本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
sequencelisting
<110>中国农业科学院蜜蜂研究所
<120>蜜蜂肽聚糖识别蛋白的制备方法
<160>3
<170>patentinversion3.3
<210>1
<211>519
<212>dna
<213>人工序列
<400>1
gaattcgatgaaaattgctccgaaattatcaaacggaacgaatggactaatgtacaagca60
aaaaatataaattatttaattattcccattccatatgttataattcatcatacagttagt120
ttagaatgtaattccaaagatacatgtatttctaatatcgaaaatattcgttcttatcat180
atggataccctaaattggcatgatatcggatattcatttttaattggtggagatggaaat240
atatacgaaggttgtggctggaatcatgaaggtgctcatacatatggatataataaaaaa300
tctatttcaattgctttcataggaaattttcaaaataagagtgcaagtaacaaaatgcta360
aatgctgcacataaattaattctttgtggtaaatcaaaagggatacttagggaagatgtt420
cgggtaatcggaggtaaacaagttatagctacgctaagtcctggatttgaactttataaa480
cagattcaaaattggcctgaatgggtttctactccataa519
<210>2
<211>37
<212>dna
<213>人工序列
<400>2
cggaattctctgttcatgagacgcctgtgcgtccaag37
<210>3
<211>35
<212>dna
<213>人工序列
<400>3
ccgctcgagttaaatcgaggaccagtgtggccatg35
- 还没有人留言评论。精彩留言会获得点赞!