结合稀土材料的肽及其用途的制作方法
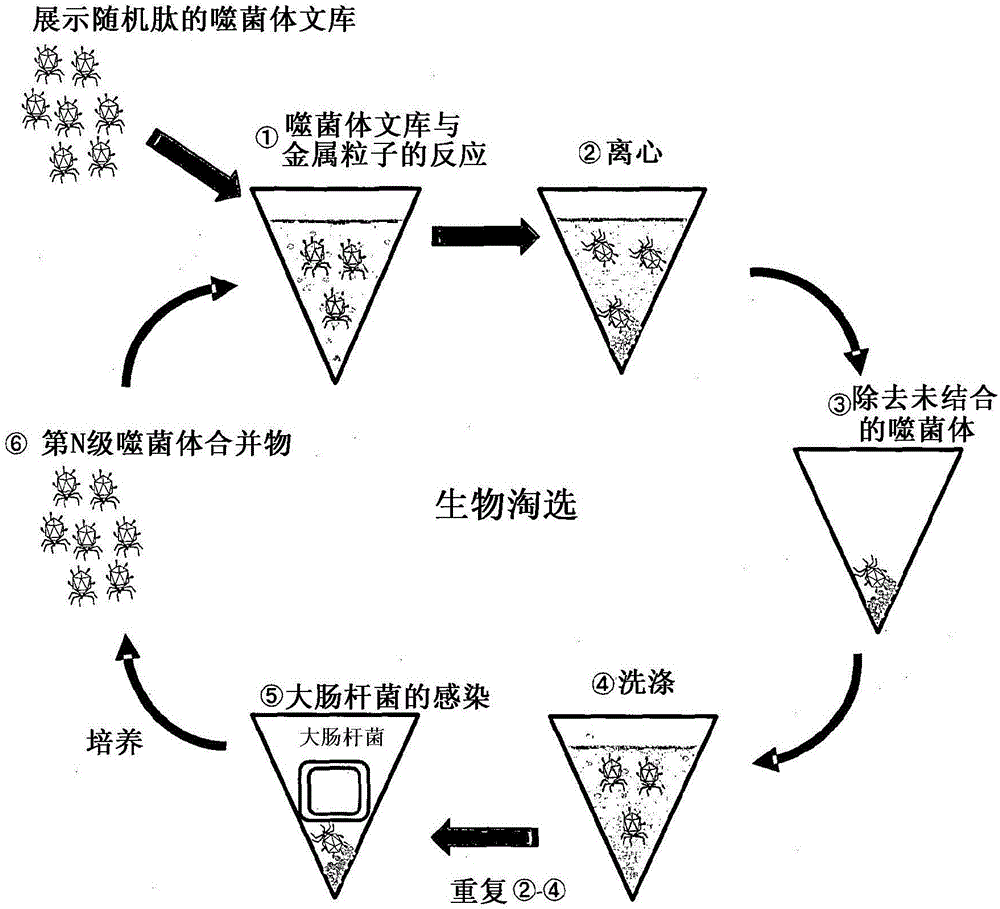
本说明书涉及稀土材料肽及其用途。
背景技术:
近年中,主要包括稀土的无机元素的开发利用已变得不可或缺。同时,稀土的稳定供应和稀土的环境影响也引起关注。因此,对于开发允许从自然界有效收集稀土的技术,以及对于允许低能耗、选择性且有效地回收和再循环以微量包含在废弃产品和废水中的稀土的技术的建立,存在着需求。
已报道的用于回收稀土的方法是通过利用N,N-二辛基二甘醇酰胺酸(DODGAA)等的溶剂萃取或通过利用还原性微生物来回收稀土元素的方法。此外,结合氧化铈的肽已被描述(专利文献1)。结合金属氧化物例如氧化锌的肽也已被描述(专利文献2)。另外,结合金、银、铂等的肽已被描述(专利文献1以及非专利文献1和2)。已知所述结合金属的肽具有在正常温度下通过还原形成金属纳米粒子的能力(矿化活性)。
例如,镝是一种镧系稀土,并且是用于混合动力车中的永磁体和用于磁光盘的氧化镝的组分金属。
引用列表
专利文献
[专利文献1]日本专利申请公布号2012-193155
[专利文献2]日本专利申请公布号2013-509452
非专利文献
[非专利文献1]Nature Chemistry,Vol.29,p.393-399,2011
[非专利文献2]Advanced Materials,Vol.19,p.2492-2498,2007
技术实现要素:
上述利用溶剂萃取和还原性微生物的方法在成本方面不总是有利可图。此外,识别稀土或结合稀土金属氧化物例如氧化镝的肽尚未被描述。
本公开提供了结合稀土材料例如稀土金属和含有稀土金属的含稀土无机化合物的肽及其用途。
本发明的发明人使用由噬菌体展示的随机肽文库来搜索结合氧化镝的肽,并获得了关于可用于结合氧化镝的肽的特点的信息。本发明人还证实了所述肽结合除了氧化镝之外的稀土无机化合物和镝离子。在这些知识的基础上,本公开可以提供下述方面:
(1)一种稀土材料结合剂,其包含能够结合稀土材料的肽,所述稀土材料包括稀土和稀土无机化合物。
(2)(1)的结合剂,其中所述肽包含一个或多个酸性氨基酸残基。
(3)(2)的结合剂,其中所述肽包含2个以上的酸性氨基酸残基。
(4)(2)或(3)的结合剂,其中所述氨基酸残基选自谷氨酸和天冬氨酸。
(5)(1)至(4)任一项的结合剂,其中所述肽是具有10个以上至20个以下的氨基酸残基的肽。
(6)(1)至(5)任一项的结合剂,其中所述肽是环状肽。
(7)(1)至(6)任一项的结合剂,其中所述肽具有下列(1)和(2)任一项的氨基酸序列:
(1)-X1-X2-X3-A1-X4-X5-A2-X6-A3-X7-X8-(SEQ ID NO:1)
其中A1是酸性氨基酸、酪氨酸、丙氨酸、甲硫氨酸或甘氨酸;A2是酸性氨基酸或亮氨酸;A3是酸性氨基酸、甘氨酸、脯氨酸、谷氨酰胺或丙氨酸;X1是亮氨酸、异亮氨酸、缬氨酸或苏氨酸;X2是色氨酸、半胱氨酸、天冬氨酸、甘氨酸或缬氨酸;X3是甘氨酸、异亮氨酸、半胱氨酸、丝氨酸或精氨酸;X4是缬氨酸、丝氨酸、精氨酸、甲硫氨酸、苯丙氨酸或亮氨酸;X5是丝氨酸、亮氨酸、精氨酸、甘氨酸、半胱氨酸、天冬酰胺或赖氨酸;X6是亮氨酸、赖氨酸、缬氨酸、丝氨酸或甘氨酸;X7是苯丙氨酸、甘氨酸、亮氨酸、苏氨酸、异亮氨酸、缬氨酸、色氨酸或组氨酸;并且X8是亮氨酸、缬氨酸、苏氨酸、丝氨酸、天冬酰胺、苯丙氨酸或谷氨酸,前提是包含至少一个酸性氨基酸;
(2)-X11-X12-X13-X14-X15-X16-A4-X17-X18-X19-(SEQ ID NO:2)
其中A4是酸性氨基酸;X11是亮氨酸、苏氨酸、谷氨酸、异亮氨酸、缬氨酸、苯丙氨酸、半胱氨酸或酪氨酸;X12是酪氨酸、天冬氨酸、天冬酰胺、谷氨酸、精氨酸、苯丙氨酸或缬氨酸;X13是脯氨酸、丝氨酸、甘氨酸、亮氨酸、丙氨酸、苏氨酸、缬氨酸或苯丙氨酸;X14是丝氨酸、谷氨酸、精氨酸或异亮氨酸;X15是色氨酸、丙氨酸、甘氨酸、半胱氨酸、甲硫氨酸或酪氨酸;X16是丝氨酸、甘氨酸、苏氨酸、丙氨酸、精氨酸或半胱氨酸;X17是酪氨酸、半胱氨酸、丝氨酸、异亮氨酸、天冬氨酸、丝氨酸、甘氨酸、赖氨酸或组氨酸;X18是丙氨酸、甘氨酸、苏氨酸、脯氨酸、半胱氨酸或丝氨酸;并且X19是苯丙氨酸、精氨酸、缬氨酸、亮氨酸、半胱氨酸、丙氨酸或丝氨酸。
(8)(7)的结合剂,其具有由Leu-Trp-Gly-Asp/Glu-Val-Ser/Asn-Asp/Glu-Leu/Val-Asp/Glu-Phe/Leu-Leu表示的氨基酸序列。
(9)(7)的结合剂,其具有由Leu-Tyr-Pro/Ala-Ser/Arg-Trp-Ser/Gly/Thr/Arg-Asp/Glu-Tyr/Asp-Ala/Gly-Phe/Leu表示的氨基酸序列。
(10)(1)至(9)任一项的结合剂,其中所述稀土是选自镧(La)、铈(Ce)、钕(Nd)、钐(Sm)、钆(Gd)、铽(Tb)、镝(Dy)、钬(Ho)和铒(Er)的一者或多者。
(11)(1)至(10)任一项的结合剂,其中所述稀土是镝,并且 所述结合剂结合镝离子和镝的氧化物。
(12)(1)至(11)任一项的结合剂,其中所述肽包含标记物质。
(13)一种肽,其具有下列(1)或(2)的氨基酸序列:
(1)-X1-X2-X3-A1-X4-X5-A2-X6-A3-X7-X8-(SEQ ID NO:1)
其中A1是酸性氨基酸、酪氨酸、丙氨酸、甲硫氨酸或甘氨酸;A2是酸性氨基酸或亮氨酸;A3是酸性氨基酸、甘氨酸、脯氨酸、谷氨酰胺或丙氨酸;X1是亮氨酸、异亮氨酸、缬氨酸或苏氨酸;X2是色氨酸、半胱氨酸、天冬氨酸、甘氨酸或缬氨酸;X3是甘氨酸、异亮氨酸、半胱氨酸、丝氨酸或精氨酸;X4是缬氨酸、丝氨酸、精氨酸、甲硫氨酸、苯丙氨酸或亮氨酸;X5是丝氨酸、亮氨酸、精氨酸、甘氨酸、半胱氨酸、天冬酰胺或赖氨酸;X6是亮氨酸、赖氨酸、缬氨酸、丝氨酸或甘氨酸;X7是苯丙氨酸、甘氨酸、亮氨酸、苏氨酸、异亮氨酸、缬氨酸、色氨酸或组氨酸;并且X8是亮氨酸、缬氨酸、苏氨酸、丝氨酸、天冬酰胺、苯丙氨酸或谷氨酸,前提是包含至少一个酸性氨基酸;
(2)-X11-X12-X13-X14-X15-X16-A4-X17-X18-X19-(SEQ ID NO:2)
其中A4是酸性氨基酸;X11是亮氨酸、苏氨酸、谷氨酸、异亮氨酸、缬氨酸、苯丙氨酸、半胱氨酸或酪氨酸;X12是酪氨酸、天冬氨酸、天冬酰胺、谷氨酸、精氨酸、苯丙氨酸或缬氨酸;X13是脯氨酸、丝氨酸、甘氨酸、亮氨酸、丙氨酸、苏氨酸、缬氨酸或苯丙氨酸;X14是丝氨酸、谷氨酸、精氨酸或异亮氨酸;X15是色氨酸、丙氨酸、甘氨酸、半胱氨酸、甲硫氨酸或酪氨酸;X16是丝氨酸、甘氨酸、苏氨酸、丙氨酸、精氨酸或半胱氨酸;X17是酪氨酸、半胱氨酸、丝氨酸、异亮氨酸、天冬氨酸、丝氨酸、甘氨酸、赖氨酸或组氨酸;X18是丙氨酸、甘氨酸、苏氨酸、脯氨酸、半胱氨酸或丝氨酸;并且X19是苯丙氨酸、精氨酸、缬氨酸、亮氨酸、半胱氨酸、丙氨酸或丝氨酸。
(14)(13)的肽,其具有由Leu-Trp-Gly-Asp/Glu-Val-Ser/Asn-Asp/Glu-Leu/Val-Asp/Glu-Phe/Leu-Leu表示的氨基酸序列。
(15)(13)的肽,其具有由Leu-Tyr-Pro/Ala-Ser/Arg-Trp-Ser/Gly/Thr/Arg-Asp/Glu-Tyr/Asp-Ala/Gly-Phe/Leu表示的氨基酸序列。
(16)一种能够结合稀土材料的肽与所述稀土材料的复合物,所述稀土材料包括稀土和稀土无机化合物。
(17)一种用于生产能够结合稀土材料的肽与所述稀土材料的复合物的方法,所述稀土材料包括稀土和稀土无机化合物,所述方法包括下列步骤:
使所述肽与所述稀土材料发生接触,以形成所述复合物。
(18)一种用于回收稀土或其无机化合物的方法,所述方法包括下列步骤:
使能够结合稀土材料的肽与所述稀土材料发生接触,以形成所述肽与所述稀土材料的复合物,所述稀土材料包括稀土和稀土无机化合物;以及
回收所述复合物。
(19)一种用于检测稀土或其无机化合物的方法,所述方法包括下列步骤:
使能够结合稀土材料的肽与所述稀土材料发生接触,以形成所述肽与所述稀土材料的复合物,所述稀土材料包括稀土和稀土无机化合物;以及
检测所述复合物。
(20)一种用于筛选能够结合稀土材料的肽的方法,所述稀土材料包括稀土或稀土无机化合物,所述方法包括下列步骤:
使一种或多种稀土材料与一种或多种试验肽发生接触,以评估所述一种或多种试验肽结合所述一种或多种稀土材料的能力。
(21)一种用于生产含有稀土的无机化合物的方法,所述方法包括下列步骤:
使充当所述含有稀土的无机化合物的起始原料的稀土离子与所述含有稀土的无机化合物的另一种起始原料在液体介质中并在能够结合稀土材料的肽存在下发生接触,以生产所述含有稀土的无机化合物,所述稀土材料包括稀土和稀土无机化合物。
附图说明
[图1]图1示出了通过噬菌体展示进行的生物淘选的概述。
[图2]图2示出了结合氧化镝的噬菌体滴度相对于生物淘选的循环次数的测量结果。
[图3]图3示出了单克隆噬菌体结合氧化镝的能力的评估结果。
[图4]图4示出了LOB2肽结合氧化镝的能力的评估结果。
[图5]图5示出了LOB2肽的结合特异性的评估结果。
[图6]图6示出了LOB1肽的结合特异性的评估结果。
[图7]图7示出了LOB2肽的丙氨酸置换物的氨基酸序列。
[图8]图8示出了LOB2肽的丙氨酸置换物与氧化镝的结合的评估结果。
[图9]图9示出了使用氧化镝结合能力作为指标从LOB2肽的部分突变体文库筛选到的肽的氨基酸序列分析的结果。
[图10]图10示出了使用氧化镝结合能力作为指标从LOB1肽的部分突变体文库筛选到的肽的氨基酸序列分析的结果。
[图11]图11示出了在使LOB2肽与镝离子发生接触后产生的粒子的TEM观察的结果。
[图12]图12示出了在使LOB2肽与镝离子发生接触后产生的粒子的EDX分析的结果。
[图13A]图13A示出了温育pH对LOB2肽的矿化活性的影响。
[图13B]图13B示出了温育pH对LOB2肽的矿化活性的影响。
[图14A]图14A示出了温育温度对LOB2肽的矿化活性的影响。
[图14B]图14B示出了温育温度对LOB2肽的矿化活性的影响。
[图15]图15示出了使用LOB2肽通过矿化获得的氧化镝的TEM观察的结果。
具体实施方式
本公开涉及能够结合稀土或其无机化合物的肽以及所述肽的用途。
本公开的肽可以结合稀土材料以形成复合物,所述稀土材料是稀 土或其金属氧化物。因此,根据本发明的结合剂,可以用所述肽持留、检测和回收稀土材料。
当在本文中使用时,“稀土材料”包括稀土及其无机化合物。
当在本文中使用时,“稀土”包括钪(Sc)和钇(Y)两者以及镧系元素镧(La)、铈(Ce)、镨(Pr)、钕(Nd)、钷(Pm)、钐(Sm)、铕(Eu)、钆(Gd)、铽(Tb)、镝(Dy)、钬(Ho)、铒(Er)、铥(Tm)、镱(Yb)和镥(Lu)。
当在本文中使用时,稀土包括金属单质以及具有等于相应稀土的可能氧化数的价数的离子。
当在本文中使用时,稀土的无机化合物包括具有其可能的氧化数的相应稀土的氧化物、氢氧化物、无机酸盐和有机酸盐。
(结合稀土材料的肽)
本文中所公开的结合稀土材料的肽(在后文中仅仅被称为“本发明的肽”)与稀土材料之间的结合意味着所述肽与稀土材料利用共价键合之外的相互作用相结合以便它们作为复合物被获得的状态。通常,所述结合包括本发明的肽在液体介质中结合于稀土离子或稀土无机化合物的状态。所述相互作用一般包括静电结合、离子结合、氢键结合等;然而,当在本文中使用时,“结合”不限于此。
本发明的肽可以结合稀土或其阳离子或稀土的无机化合物。本发明的肽可以结合一种稀土或其阳离子和/或所述稀土的无机化合物例如氧化物。本发明的肽可以结合两种以上稀土或其阳离子和/或所述两种以上稀土的无机化合物。本发明的肽可以结合3种以上、优选地4种以上、更优选地5种以上稀土或其阳离子和/或所述稀土的无机化合物。
本发明的肽能够结合稀土材料。本发明人相信,所述肽中酸性氨基酸残基的羧基促成了其与稀土材料的结合。
当在本文中使用时,术语“肽”是通常几个或更多个天然氨基酸和/或非天然氨基酸通过酸酰胺键相连的聚合物。肽通常具有100个以下的氨基酸残基。优选地,本发明的肽的结合稀土的序列具有例如5个以上、更优选地7个以上、还更优选地8个以上的氨基酸残基。对氨基酸残基的上限没有特别限制,并且考虑到与稀土材料的结合能力,可以为25个以下、20个以下或15个以下。
本发明的肽优选为L-氨基酸残基的聚合物。然而,不排除D-氨基酸的聚合物。
肽通常是线性的。本发明的肽可以是线性的,或者可以利用分子内二硫键等成为环状。在这种情况下,所述肽优选地在可能促成与稀土材料的结合的氨基酸序列(在后文中仅仅称为“稀土结合序列”;例如包含酸性氨基酸残基及其上游和下游适当数目的氨基酸残基的氨基酸序列)之外的位置处环化。通常,包含两侧有半胱氨酸残基的稀土结合序列的肽在氧化剂例如碘或过氧化氢存在下可以被环化。
本发明的肽所结合的稀土或其无机化合物中的稀土优选为选自镧(La)、铈(Ce)、钕(Nd)、钐(Sm)、钆(Gd)、铽(Tb)、镝(Dy)、钬(Ho)和铒(Er)的一者或多者。更优选地,所述稀土是镧、铈、钕、钐、钆、铽、镝、钬或铒,更优选为镧、铈、钕、钐、钆、铽或镝。
本发明的肽可以结合一种或多种稀土和/或其无机化合物。本发明的肽对稀土及其无机化合物的结合能力随着氨基酸序列而变。因此,一种稀土结合序列可能以高选择性结合铈,而另一种稀土结合序列可能以高选择性结合镧。可能存在特异性结合无机化合物的稀土结合序 列。因此,本发明的肽所应用的稀土可以根据所使用的稀土结合序列的结合能力来选择。据推断,稀土结合序列对稀土的结合能力由包含酸性氨基酸残基来确保,并且据信结合强度、所述序列结合的稀土或其无机化合物的类型,可能在一定程度上随着包含所述酸性氨基酸残基的氨基酸序列而变。
本发明的肽中的稀土结合序列优选地包括一个或多个酸性氨基酸残基,更优选地两个或三个以上酸性氨基酸残基。酸性氨基酸残基的实例包括谷氨酸、天冬氨酸、异天冬氨酸、异谷氨酸、2-氨基己二酸、2-氨基辛二酸等。天冬氨酸或谷氨酸是优选的。两个以上酸性氨基酸残基可以相同或不同。
当本发明的肽包含两个以上酸性氨基酸残基时,所述酸性氨基酸残基在最邻近的情况下可以彼此直接相邻,或者可以在中间插有一个或多个氨基酸残基。对居间氨基酸残基没有特别限制,并且优选为中性氨基酸残基、芳香族氨基酸残基等。所述居间氨基酸残基更优选地包括中性氨基酸残基。
当在本文中使用时,中性氨基酸残基包括甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、丝氨酸、苏氨酸和正缬氨酸。碱性氨基酸残基包括赖氨酸、正亮氨酸、2-氨基丁酸、甲硫氨酸、o-甲基丝氨酸、叔丁基甘氨酸、叔丁基丙氨酸和环己基丙氨酸。酸酰胺氨基酸残基包括天冬酰胺和谷氨酰胺。碱性氨基酸残基包括赖氨酸、精氨酸、鸟氨酸、2,4-二氨基丁酸和2,3-二氨基丙酸。环状氨基酸残基包括脯氨酸、3-羟基脯氨酸和4-羟基脯氨酸。含有OH的氨基酸残基包括丝氨酸、苏氨酸和高丝氨酸。芳香族氨基酸残基包括苯丙氨酸、酪氨酸和色氨酸。
本发明的肽可以具有例如包含下列(1)或(2)的稀土结合序列:
(1)-X1-X2-X3-A1-X4-X5-A2-X6-A3-X7-X8-(SEQ ID NO:1)
其中A1是酸性氨基酸、酪氨酸、丙氨酸、甲硫氨酸或甘氨酸; A2是酸性氨基酸或亮氨酸;A3是酸性氨基酸、甘氨酸、脯氨酸、谷氨酰胺或丙氨酸;X1是亮氨酸、异亮氨酸、缬氨酸或苏氨酸;X2是色氨酸、半胱氨酸、天冬氨酸、甘氨酸或缬氨酸;X3是甘氨酸、异亮氨酸、半胱氨酸、丝氨酸或精氨酸;X4是缬氨酸、丝氨酸、精氨酸、甲硫氨酸、苯丙氨酸或亮氨酸;X5是丝氨酸、亮氨酸、精氨酸、甘氨酸、半胱氨酸、天冬酰胺或赖氨酸;X6是亮氨酸、赖氨酸、缬氨酸、丝氨酸或甘氨酸;X7是苯丙氨酸、甘氨酸、亮氨酸、苏氨酸、异亮氨酸、缬氨酸、色氨酸或组氨酸;并且X8是亮氨酸、缬氨酸、苏氨酸、丝氨酸、天冬酰胺、苯丙氨酸或谷氨酸,前提是包含至少一个酸性氨基酸;
(2)-X11-X12-X13-X14-X15-X16-A4-X17-X18-X19-(SEQ ID NO:2)
其中A4是酸性氨基酸;X11是亮氨酸、苏氨酸、谷氨酸、异亮氨酸、缬氨酸、苯丙氨酸、半胱氨酸或酪氨酸;X12是酪氨酸、天冬氨酸、天冬酰胺、谷氨酸、精氨酸、苯丙氨酸或缬氨酸;X13是脯氨酸、丝氨酸、甘氨酸、亮氨酸、丙氨酸、苏氨酸、缬氨酸或苯丙氨酸;X14是丝氨酸、谷氨酸、精氨酸或异亮氨酸;X15是色氨酸、丙氨酸、甘氨酸、半胱氨酸、甲硫氨酸或酪氨酸;X16是丝氨酸、甘氨酸、苏氨酸、丙氨酸、精氨酸或半胱氨酸;X17是酪氨酸、半胱氨酸、丝氨酸、异亮氨酸、天冬氨酸、丝氨酸、甘氨酸、赖氨酸或组氨酸;X18是丙氨酸、甘氨酸、苏氨酸、脯氨酸、半胱氨酸或丝氨酸;并且X19是苯丙氨酸、精氨酸、缬氨酸、亮氨酸、半胱氨酸、丙氨酸或丝氨酸。
稀土结合序列(1)对镧、铈、钕、钐、钆、镝、钬、铒或任何上述元素的氧化物具有高的结合能力,对尤其是铈、钕、钆、镝和铒或任何上述元素的氧化物具有高的结合能力,并且对铈和钕或任何上述元素的氧化物具有更高的结合能力。
稀土结合序列(2)对镧、铈、钕、钐、钆、铽、镝、钬、铒或任何上述元素的氧化物具有高的结合能力,对尤其是镧、铈、钬或任何上述元素的氧化物具有高的结合能力,并且对镧和铈或任何上述元素 的氧化物具有更高的结合能力。
所述稀土结合序列优选地具有天冬氨酸或谷氨酸作为酸性氨基酸。
在稀土结合序列(1)中,X1优选为亮氨酸、异亮氨酸或缬氨酸;X2优选为色氨酸或半胱氨酸;X3优选为甘氨酸;A1优选为天冬氨酸或谷氨酸;X4优选为缬氨酸;A2优选为谷氨酸或天冬氨酸;X5优选为丝氨酸、精氨酸、天冬酰胺或赖氨酸;X6优选为亮氨酸或缬氨酸;X7优选为苯丙氨酸或亮氨酸;并且X8优选为亮氨酸、缬氨酸或苏氨酸。
在稀土结合序列(2)中,X11优选为亮氨酸、异亮氨酸、缬氨酸或苏氨酸;X12优选为酪氨酸、天冬酰胺、天冬氨酸、精氨酸或谷氨酸;X13优选为脯氨酸、丙氨酸、丝氨酸或甘氨酸;X14优选为丝氨酸、精氨酸或异亮氨酸;X15优选为色氨酸;X16优选为丝氨酸、甘氨酸或苏氨酸;X17优选为酪氨酸、天冬氨酸或丝氨酸;X18为丙氨酸、苏氨酸或甘氨酸;并且X19优选为苯丙氨酸或亮氨酸。
稀土结合序列(1)优选地由Leu/Val-Trp/Cys-Gly/Arg-Asp/Glu-Val-Ser/Asn/Lys/Arg-Asp/Glu-Leu/Va l-Asp/Glu-Phe/Leu/Val-Leu/Val/Thr表示,更优选地由Cys-Leu/Val-Trp/Cys-Gly/Arg-Asp/Glu-Val-Ser/Asn/Lys/Arg-Asp/Glu-Le u/Val-Asp/Glu-Phe/Leu/Val-Leu/Val/Thr-Cys表示,还更优选地由Ser-Cys-Leu/Val-Trp/Cys-Gly/Arg-Asp/Glu-Val-Ser/Asn/Lys/Arg-Asp/Gl u-Leu/Val-Asp/Glu-Phe/Leu/Val-Leu/Val/Thr-Cys-Ser表示。
所述稀土结合序列对铈、钕、钆、镝和任何上述元素的氧化物具有高的结合能力,并且进一步对铈、钕和任何上述元素的氧化物具有高的结合能力。所述稀土结合序列对镝(离子)也具有结合能力。
稀土结合序列(2)优选地由Leu-Tyr-Pro/Ala-Ser/Arg-Trp-Ser/Gly/Thr/Arg-Asp/Glu-Tyr/Asp-Ala/Gly/Ser/Thr-Phe/Leu表示,更优选地由Cys-Leu-Tyr-Pro/Ala-Ser/Arg-Trp-Ser/Gly/Thr/Arg-Asp/Glu-Tyr/Asp-Ala/Gly/Ser/Thr-Phe/Leu-Cys表示,还更优选地由Ser-Cys-Leu-Tyr-Pro/Ala-Ser/Arg-Trp-Ser/Gly/Thr/Arg-Asp/Glu-Tyr/Asp-Ala/Gly/Ser/Thr-Phe/Leu-Cys-Ser。所述稀土结合序列对镧、铈、钬和任何上述元素的氧化物具有高的结合能力,并且进一步对镧、铈和任何上述元素的氧化物具有高的结合能力。
所述稀土结合序列可以进一步在所述序列的N-末端或C-末端处包含一个或多个附加氨基酸。例如,可以添加1个或2个氨基酸,可以添加1个以上且3个以下的氨基酸,可以添加1个以上且5个以下的氨基酸,可以添加1个以上且7个以下的氨基酸,可以添加1个以上且9个以下的氨基酸,并且可以添加1个以上且10个以下的氨基酸。
可以添加到所述稀土结合序列末端的氨基酸的实例包括丝氨酸、半胱氨酸、天冬酰胺等。通过在两个末端处引入半胱氨酸,可以将本发明的肽环化。
含有稀土结合序列(1)的肽的实例包括含有下述稀土结合序列的肽。在下面描述的每个肽中,稀土结合序列优选为在N-末端和C-末端两者处的一个氨基酸残基被移除的序列,更优选为在两个末端处的两个氨基酸残基即SC-和-CS被移除的序列。
SerCys-LeuTrpGlyAspValSerGluLeuAspPheLeu-CysSer(SEQ ID NO:3)
SerCys-LeuTrpIleGluSerLeuAspLeuAspGlyLeu-CysSer(SEQ ID NO:4)
SerCys-LeuCysCysGluValSerAspLeuGlyLeuVal-CysSer(SEQ ID NO:5)
SerCys-ValCysIleGluArgArgGluLeuAspLeuLeu-CysSer(SEQ ID NO:6)
SerCys-IleAspSerTyrValGlyGluLeuGluThrLeu-CysSer(SEQ ID NO:7)
SerCys-LeuTrpArgAlaValCysAspLeuGlyIleGlu-CysSer(SEQ ID NO:8)
SerCys-LeuGlyGlyAspMetSerAspLysProValSer-CysSer(SEQ ID NO:9)
SerCys-ThrCysGlyMetValAsnAspValAspLeuThr-CysSer(SEQ ID NO:10)
SerCys-IleValGlyGluValArgLeuSerAspLeuVal-CysSer(SEQ ID NO:11)
SerCys-ThrCysGlyMetValAsnAspValAspLeuThr-CysSer(SEQ ID NO:12)
SerCys-ValTrpArgGlyPheLysAspGlyGlnTrpPhe-CysSer(SEQ ID NO:13)
SerCys-ValCysArgGlyLeuArgAspLeuAlaHisAsn-CysSer(SEQ ID NO:14)
含有稀土结合序列(2)的肽的实例包括含有下述稀土结合序列的肽。在下面描述的每个肽中,稀土结合序列优选为在N-末端处的3个氨基酸残基和在C-末端处的2个氨基酸残基被移除的序列,更优选为在两个末端处的SC-和-CS被移除的序列。
SerCys-LeuTyrProSerTrpSerAspTyrAlaPhe-CysSer(SEQ ID NO:15)
SerCys-ThrAspProSerTrpGlyGluTyrGlyPhe-CysSer(SEQ ID NO:16)
SerCys-GluTyrSerSerAlaSerGluTyrAlaArg-CysSer(SEQ ID NO:17)
SerCys-IleTyrGlyGluTrpArgAspTyrAlaPhe-CysSer(SEQ ID NO:18)
SerCys-ValTyrLeuSerGlySerGluCysThrPhe-CysSer(SEQ ID NO:19)
SerCys-LeuAsnAlaArgTrpSerAspSerProVal-CysSer(SEQ ID NO:20)
SerCys-LeuAsnThrIleTrpAlaAspTyrGlyLeu-CysSer(SEQ ID NO:21)
SerCys-LysAspValSerTrpGlyAspIleAlaCys-CysSer(SEQ ID NO:22)
SerCys-PheGluPheSerTrpSerGluAspCysAla-CysSer(SEQ ID NO:23)
SerCys-GluArgGlySerTrpCysGluAspAlaCys-CysSer(SEQ ID NO:24)
SerCys-ValTyrThrGlyTrpArgGluAspAlaSer-CysSer(SEQ ID NO:25)
SerCys-CysPheAlaSerCysThrAspSerAlaLeu-CysSer(SEQ ID NO:26)
SerCys-ThrArgSerArgCysGlyAspGlyAlaPhe-CysSer(SEQ ID NO:27)
SerCys-TyrValAlaIleMetSerGluLysSerPhe-CysSer(SEQ ID NO:28)
SerCys-IleGluAlaArgTyrThrAspHisAlaLeu-CysSer(SEQ ID NO:29)
本发明的肽可以通过本领域技术人员公知的任何方法(包括公知的化学合成方法以及遗传工程方法)来获得。
本发明的肽可以包含标记物质。标记物质的包含对于回收等来说是方便的,这是因为可以鉴定结合到稀土的本发明的肽。对标记物没有特别限制,并且可以是任何公知的标记物质。标记物质可以目测鉴别或者可以通过具有某种波长的光的照射而发光。标记物质可以本身有色,或者可以通过与另一种化合物的反应产生颜色。标记物质可以被承载在支持物例如珠子上。这样的标记物质的实例包括有色珠子、金胶体、荧光化合物、酶蛋白等。标记物质涵盖了结合标记物的物质,例如利用抗体-抗体反应的那些物质和利用生物素-亲和素相互作用的那些物质。结合标记物的物质是结合到标记物质并且也可以充当标记物质的物质。
标记物质按照任何公知的方法来连接。通常,将标记物质通过适当数目的连接肽连接在本发明的肽的N-末端和/或C-末端。
当使用对稀土材料具有不同结合性质(结合选择性等)的两种以上本发明的肽时,每种肽可以包含不同的标记物质。
本发明的肽可以包含标签,以便可以通过亲和层析等回收本发明的肽。标签可以是抗原(表位)等,或者可以是公知的His标签、生物素等。标签可以通过适合的连接物连接到所述肽。
通过使用针对本发明的肽的抗体,不用标记即可鉴定本发明的肽。
如上所述,本发明的肽也可以用作能够结合稀土材料的稀土结合剂。
(矿化活性)
除了对稀土材料的结合能力之外,本发明的肽还具有用于从稀土离子生产含有稀土的无机化合物的矿化活性。所述矿化活性被具体描述在后文的段落中。
根据本说明书,还提供了包括本发明的肽或所述稀土结合序列和另一种肽的融合肽或融合蛋白(在后文中仅仅称为“融合蛋白”)。在所述融合蛋白中,本发明的肽或稀土结合序列被融合以便至少基本上保留对稀土的结合能力。对稀土的结合能力的基本保留是指保留对稀土的原始结合能力的特异性,同时保留优选地50%以上、更优选地60%以上、仍然更优选地70%以上、还更优选地80%以上、进一步更优选地90%以上的原始结合强度。融合蛋白是否保留对稀土的原始结合能力,可以通过在下文的实施例中所描述的方式等来证实。
所述融合蛋白中的另一种肽可以具有所需性质或功能。可以根据需要选择各种不同的公知蛋白例如抗体、酶和膜蛋白中的任一种。本领域技术人员可以通过任何公知的遗传工程方法或化学方法获得这种融合蛋白。
本文中的融合蛋白可以具有与本发明的肽相当的性质或功能,并且可以应用于类似的应用。
根据本说明书,还提供了编码本发明的肽或本发明的融合蛋白的DNA例如核苷酸,或者用于表达本发明的肽或所述融合蛋白的包含所述DNA的载体。本领域技术人员可以在上面描述的稀土结合序列等的基础上容易地获得DNA,并按照任何公知的方法构建所述表达载体。所述表达载体含有根据用于表达本发明的肽或融合蛋白的宿主细胞而选择的元件。
(固定有肽的固相支持物)
本发明的肽可以被承载在固相支持物上。本发明的肽可以被承载在例如由各种不同材料制成的颗粒如各种珠子或片上。这样的固相支持物是公知的,并且本领域技术人员可以选择并使用适合的固相支持物。将所述肽固定在固相支持物上的方式和方法是公知的。本领域技术人员可以选择适合的固定化方法,选择所需方式(在采取片形式的固相支持物上的固定化模式),并获得固定有肽的固相支持物。采取颗粒形式的固相支持物通常可以通过浸泡等在所述固相支持物的整个表面携带本发明的肽。采取片形式的固相支持物可以通过浸泡、涂布、点样等携带本发明的肽以便形成薄膜或采取任何其他任意模式。
当对稀土材料具有不同结合性质(结合选择性等)的两种以上本发明的肽被固定在固相支持物上时,所述肽可以被分别固定在可以鉴别开的颗粒状固相支持物上,或者所述肽可以作为斑点被分别固定在采取片形式的固相支持物上的不同位置处。
此外,本发明的肽可以伴有生物支持物。具体来说,本发明的肽可以被递呈在生物支持物例如细胞的表面层上,或者可以形成所述表面层。所述生物支持物的实例包括各种不同微生物、植物细胞、动物细胞、病毒、噬菌体等。本发明的肽可以被递呈在例如微生物如酵母和大肠杆菌(Escherichia coli)的表面层上,或者可以形成噬菌体或病毒的外壳蛋白。
如上所述,在对稀土材料的结合能力的基础上,本发明的肽可以用作稀土材料的结合剂、稀土材料的检测剂(探针)和稀土材料的回收剂(分离剂)。例如,所述固定有肽的固相支持物可用于任何所述应用。固定有本发明的肽的固相支持物也可用作用于回收或检测稀土材料的装置(阵列)。
在矿化活性的基础上,本发明的肽可用作从稀土离子生产稀土的无机化合物的试剂。所述固定有肽的固相支持物也可用作所述试剂。
在上述内容的基础上,本发明的肽、含有标记物质等的本发明的肽和携带本发明的肽的固定有肽的固相支持物(包括生物支持物)本身是有用的。
(本发明的肽与稀土材料之间的结合)
为了允许本发明的肽结合稀土材料,可以使本发明的肽与所述稀土材料发生接触。对本发明的肽与稀土材料结合的条件没有特别限制,只要本发明的肽可以表现出对所述稀土材料的结合能力即可。在pH、温度和盐浓度方面的各种不同条件下观察所述稀土材料与本发明的肽之间的结合状态,并由此确立结合条件。例如,本发明人已证实,本发明的肽在5以上且8以下的pH和4℃以上且80℃以下的范围内的温度下结合稀土材料。
为了允许本发明的肽结合稀土材料,可以通过混合等使本发明的肽与含有稀土的材料在液体介质中发生接触。所述液体介质可以是任何液体介质,只要它允许本发明的肽表现出对所述稀土材料的结合能力即可。所述液体介质可以是水性介质或有机介质或上述介质的混合介质。通常,可以使用具有中性附近pH的缓冲液或含有所述缓冲液的混合溶液。例如,pH可以为5以上且8以下,但不具体限制于此。盐浓度可以为10mM以上且1M以下,但同样不具体限制于此。温度同样不被具体限制,并且结合可以在没有温度控制的情况下容易地获得。通常,温度可以为4℃以上且80℃以下,更优选为10℃以上且40℃以下,还更优选为15℃以上且30℃以下。本发明的肽与稀土材料之间的接触的效率可以通过适当搅拌来提高。使本发明的肽与稀土材料发生接触的时间长度可以从约10分钟至几小时,优选为30分钟以上且8小时以下,但不具体限制于此。所述时间长度的上限更优选地可以是6小时以下,还更优选为约4小时以下。所述时间长度更优选地可以是约1小时以上且3小时以下。
为了允许本发明的肽表现出对所述稀土材料的结合能力,对所述液体介质中本发明的肽的浓度和所述稀土材料的浓度没有具体限制。例如,本发明的肽的浓度优选为20nM以上,所述稀土材料的浓度优选为100uM(微摩尔)以上。
(使用本发明的肽的矿化)
根据本发明的肽,可以从本发明的肽和含有稀土的无机化合物的起始原料(矿化起始原料)获得所述含有稀土的无机化合物。所述含有稀土的无机化合物在产生时可以是结晶或无定形的。当所述含有稀土的无机化合物是无定形的时,它可以通过任选地进行煅烧步骤而转变成晶体。
为了进行矿化,可以将本发明的肽与稀土无机化合物的起始原料(矿化起始原料)在液体介质中温育。所述矿化起始原料包括稀土离子。所述稀土离子可以以在用于矿化的介质中可溶的形式例如硝酸盐和盐酸盐的形式使用。所述矿化起始原料还包含稀土无机化合物例如氧化物、氢氧化物和无机酸的组成材料。取决于所述液体的性质,氧化物和氢氧化物的组成材料可以存在于水性介质中,并且无机酸的组成材料可以作为阴离子提供在水性介质等中。
对温育的条件没有具体限制,只要它们允许本发明的肽表现出所述矿化活性即可。通常,所使用的条件可以是上文中描述的本发明的肽可以表现出对稀土材料的结合能力的条件。由于无机化合物的产生和沉积随着pH、温度和/或温育时间长度而变,因此优选地通过适当延长或缩短温育时间长度等适当地调整pH、温度和/或温育时间长度。例如,本发明人已证实了本发明的肽在pH 5以上且8以下和4℃以上且80℃以下温度下的矿化活性。
在使用本发明的肽的矿化期间,本发明的肽和所述矿化起始原料可以被静态温育,或者可以以一定的程度搅拌,使得所述搅拌不抑制 所述矿化。从矿化得到的所述含有稀土的无机化合物可以作为在用于温育的液体介质中不可溶的物质(沉淀物)获得。可以通过离心以回收固相和使用表面活性剂等分离本发明的肽,来将所述含有稀土的无机化合物与本发明的肽分离开。如有必要,可以通过进一步进行干燥和/或煅烧,来获得所述稀土无机化合物。
为了允许本发明的肽表现出矿化活性,对所述液体介质中本发明的肽的浓度和所述矿化起始原料的浓度同样没有具体限制。例如,优选地,本发明的肽的浓度为5uM以上,所述矿化起始原料稀土离子的浓度为100uM以上。除了所述稀土之外的所述无机化合物的矿化起始原料的浓度也可以与所述稀土离子的浓度相近。
本发明的肽的温育对于矿化是有利的,这是因为可以在低成本条件下方便地进行矿化。
在后文中描述了从矿化获得的含有稀土的无机化合物的干燥和为了结晶而煅烧无定形的含有稀土的无机化合物。
(复合物及其生产方法)
本文中描述的复合物是本发明的肽与稀土材料(稀土和/或其无机化合物例如氧化物)的复合物(在后文中也被称为“本发明的复合物”)。本发明的复合物包含本发明的肽和稀土和/或其无机化合物。对两种物质的复合物形成的方式没有特别限制。所述肽可以与上文中描述的标记物质、标签、固相支持物或生物支持物结合。所述稀土可以采取离子和/或金属无机化合物的形式。
所述复合物可以包括与两种以上类型的稀土结合的一种类型的本发明的肽,或与一种类型的稀土结合的两种以上类型的本发明的肽。
用于生产所述复合物的方法可以包括使本发明的肽与稀土材料发 生接触以形成其复合物的步骤。复合物形成步骤可以如上文中所述,通过使本发明的肽与所述稀土材料在本发明的肽的变性被抑制的条件下发生接触来进行。
用于生产所述复合物的方法可以是下文中所描述的用于生产含有稀土的无机化合物的方法。
所述复合物的产生可用于稀土材料的回收和检测以及稀土结合序列的鉴定(本发明的肽的筛选)。
(用于回收稀土材料的方法)
用于回收本文中所描述的稀土材料的方法可以包括上述的复合物形成步骤和回收所述复合物的步骤。在所述复合物回收后,可以根据所述稀土材料的性质进行分离,或者可以利用本发明的肽回收所述复合物。例如,通过使本发明的肽与可能含有稀土的资源物质(各种不同的再循环材料例如煤灰和石油灰分、矿物资源、海洋资源)发生接触而获得的复合物,可以通过依赖于本发明的肽本身、连接到本发明的肽的标记物质或结合到本发明的肽的稀土材料的性质的方法来回收。为了利用本发明的肽本身来回收所述复合物,可以使用特异性识别本发明的肽的抗体。适合的回收步骤也可以依赖于本发明的肽中的标签来进行。也可以根据所述复合物中的稀土材料进行分离。由于本发明的肽和所述稀土材料被用作回收指标,因此所述复合物可以被有效回收。
例如,可以如下所述从所述复合物回收所述稀土材料:将本发明的肽在异丙醇中或甲醇与丙酮(例如1:1)的混合溶液中或表面活性剂溶液中变性,或者使所述复合物与阻断本发明的肽与稀土材料之间的相互作用的溶剂发生接触,以便从本发明的肽分离并回收所述稀土。用于消除所述复合物中本发明的肽与所述稀土材料之间的相互作用的处理和消除的程度,可以根据所述稀土材料的类型及其与本发明的肽 的结合强度来适合地选择。
(用于检测稀土材料的方法)
用于检测本文中所描述的稀土材料的方法可以包括上述的复合物形成步骤和检测所述复合物的步骤。所述复合物可以根据稀土材料的性质或利用本发明的肽来检测。例如,通过使本发明的肽与可能含有稀土的资源物质(各种不同的再循环材料例如煤灰和石油灰分、矿物资源、海洋资源)发生接触而获得的复合物,可以通过依赖于本发明的肽本身、连接到本发明的肽的标记物质或结合到本发明的肽的稀土材料的性质的方法来检测。为了利用本发明的肽本身来检测所述稀土材料,可以使用特异性识别本发明的肽的抗体。适合的检测步骤也可以依赖于本发明的肽中的标记物质来进行。也可以根据所述复合物中的稀土材料进行检测。由于本发明的肽和所述稀土材料被用作检测指标,因此所述复合物可以被可靠地检测。
(用于筛选能够结合稀土材料的肽的方法)
用于筛选本文中所描述的稀土结合肽的方法可以包括使稀土材料与一种或多种试验肽发生接触并评估所述一种或多种试验肽对所述稀土材料的结合能力的步骤。根据本公开的筛选方法,可以筛选对稀土材料具有结合性质的肽。换句话说,可以筛选或鉴定稀土结合序列。
如上文中所述,稀土材料的实例包括稀土单质、稀土离子和稀土的无机化合物例如氧化物。这些物质可以独立地作为稀土材料用于评估试验肽的结合性质。当使用稀土离子时,它可以是硝酸盐、盐酸盐等的溶液。当使用稀土无机化合物或稀土单质时,由于它不可溶,因此它可以以分散体的形式使用。
所述试验肽的实例包括但不限于具有天然氨基酸序列的肽以及具有人造氨基酸序列的肽。对所述肽的长度没有特别限制。如上文中所述,所述长度一般可以是100个以下的氨基酸残基,通常优选为5个 以上、更优选为7个以上、还更优选为8个以上的氨基酸残基。所述长度可以为25个以下、20个以下或15个以下的氨基酸残基。所述试验肽可以是环状肽。所述环状肽可以利用两个以上的半胱氨酸残基之间的二硫键来形成。
所述试验肽可以是天然的L-型聚合物或非天然的D-型聚合物。所述试验肽可以包括人造氨基酸残基。
所述试验肽可以通过将各种不同的肽进行展示的方法例如噬菌体展示、核糖体展示、体外病毒等,通过化学合成或遗传工程合成(包括无细胞蛋白质合成等)来获得和筛选。所述试验肽可能属于通过公知的方法在某个氨基酸序列的基础上制备的突变体文库。此外,所述试验肽可以像本发明的肽一样被承载在固相支持物或生物支持物上。
如上文中对本发明的肽所述,试验肽可以连接到标记物质或标签,以便方便地评估对稀土材料的结合性质。当试验肽的氨基酸序列已知时,可以事先制备特异性结合所述试验肽的抗体。使用具有这种添加物的本发明的肽,适合于二次筛选以用于进一步评估对稀土材料的结合能力。
如上文中所述,可以使试验肽与稀土材料发生接触,并在同时抑制所述试验肽的变性。通常,使试验肽与稀土材料在溶液系统中发生接触。
对一种或多种稀土材料与试验肽之间的接触方式没有特别限制。具体来说,在用于以高准确度评估对所述稀土材料的结合能力的二次筛选中,可以使用固定有稀土材料的固相支持物,例如包括被固定在固相支持物上的稀土材料的阵列。通过使用这种固定有稀土材料的固相支持物,可以集体评估超过一种稀土材料和超过一种试验肽的结合能力。所述固定有稀土材料的固相支持物可以是例如包含孔的片(板) 形固相支持物,稀土材料被固定在所述孔中。可以例如通过向表面例如玻璃或塑料供应稀土材料的分散体并将其在真空下干燥来固定所述稀土材料。
通过将稀土材料结合到试验肽而获得的复合物可以利用试验肽本身或连接到所述肽的标记物质来鉴定和回收。不形成复合物的稀土材料和试验肽具有比复合物低的质量,因此根据利用质量差的分离方法例如离心,可以作为上清液等被除去,导致所述复合物的纯化。在这种情形中,如上文中所述,剩余的复合物可以添加有表面活性剂溶液等以消除由非特异性结合形成的所述试验肽与稀土材料的复合物,再次进行离心以除去上清液等,由此除去非特异性结合到所述稀土材料的试验肽。通过重复这种洗涤程序,可以以高准确度筛选结合稀土材料的试验肽。
通过在所述复合物形成步骤后进行超过一组的一个或多个洗涤步骤,可以将所述试验肽相对于所述稀土材料浓缩,并且筛选到的试验肽可以对所述稀土材料具有高的结合能力。优选地将所述洗涤步骤组重复3次以上,更优选地4次以上,仍然更优选地5次以上,还更优选地6次以上。洗涤的效果一般可以在最多约10次时看到。
通过任选地鉴定和回收复合物或复合物中的试验肽并确定所述试验肽的氨基酸序列,可以鉴定或筛选能够结合所使用的稀土材料的稀土结合序列。当所述试验肽的氨基酸序列未知例如在噬菌体展示中时,分析所述试验肽的序列以鉴定所述稀土结合序列。
当执行所述筛选方法作为针对特定稀土材料的初次筛选时,优选地按照噬菌体文库等进行所述方法。在这种情形中,如上所述的洗涤步骤组的重复对应于实施例中的淘选。
在用于评估试验肽对特定稀土材料或超过一种稀土材料的结合能 力的二次筛选中,使用包含被固定在固相支持物上的稀土材料的固相支持物(阵列等)等对于准确评估来说是有用的。
根据本发明的筛选方法,可以鉴定和筛选特异性结合特定稀土材料或两种以上稀土材料的稀土结合序列。
(用于生产含有稀土的无机化合物的方法)
根据本说明书,提供了用于生产含有稀土的无机化合物的方法。本发明的生产方法包括使充当所述含有稀土的无机化合物的起始原料的稀土离子与所述含有稀土的无机化合物的另一种起始原料在液体介质中并在本发明的肽存在下发生接触以生产所述含有稀土的无机化合物的步骤。根据本发明的生产方法,可以以低成本容易地获得含有稀土的无机化合物。
如上文中所述的使用本发明的肽的矿化条件可以应用于所述含有稀土的无机化合物的生产步骤。
本发明的生产方法还可以包括含有稀土的无机化合物的回收步骤。当产生的含有稀土的无机化合物不可溶时,可以通过固液分离技术分离和回收所述含有稀土的无机化合物。在固液分离之前、期间或之后,可以通过本发明的肽的变性等除去含有稀土的无机化合物与本发明的肽之间的结合,以便回收未形成复合物的含有稀土的无机化合物。
本发明的生产方法还可以包括回收的含有稀土的无机化合物的干燥步骤。所述干燥步骤可以是通用的干燥步骤,对此没有限制。
本发明的生产方法还可以包括回收的含有稀土的无机化合物的煅烧步骤。可以进行所述煅烧步骤以便例如促进无定形的含有稀土的无机化合物的结晶。或者,可以进行所述煅烧步骤以便将氢氧化物通过 脱水转变成氧化物。
用于结晶的煅烧步骤可以在用于公知的无定形化合物的结晶的条件的基础上进行。所述煅烧步骤可以例如在300℃以上且1500℃以下的温度下进行。当通过矿化获得的含有稀土的无机化合物是无机盐例如碳酸盐时,所使用的加热温度可以是所述无机盐结晶并同时维持所述无机盐的状态的温度。当通过消除无机酸例如脱二氧化碳获得氧化物时,如果适合的话,所选择的温度可以是所述消除发生的温度。
本发明的生产方法的另一个有利之处在于可以生产具有nm量级尺寸的含有稀土的无机化合物的粒子。本发明的生产方法也可以充当用于生产本发明的肽与含有稀土的无机化合物的复合物的方法。
实施例
本文的公开内容通过实施例进行具体解释,所述实施例不限制本发明。
实施例1
(展示随机肽的T7噬菌体文库的构建)
使用两个寡核苷酸引物进行PCR反应:T7-Libup(ATG ATT ACC AGG ATC CGA ATT CAG GTG GAG GTT CG;SEQ ID NO:30)和T7-Libdownt(ACT ATC GTC GGC CGC AAG CTT TTA GCT;SEQ ID NO:31),以扩增模板DNA(CGA ATT CAG GTG GAG GTT CGT GT(NNK)9-12TGT AGC TAA AAG CTT GCG GCC GA;SEQ ID NO:32)。
N=A:25%,T:25%,G:25%,C:25%(A/T/G/C以相等量混合的碱基)
K=混合的碱基,其中A:0%,T:50%,G:50%,C:0%
按照常规流程对扩增的DNA片段进行苯酚处理和丁醇浓缩,然后 使用QIAquick PCR纯化试剂盒(QIAGEN)进行纯化。将纯化的DNA用限制性酶Hind III和EcoRI(TaKaRa Bio Inc.)处理并连接到T7select10-3载体臂(Novagen),以构建T7噬菌体基因组。
将构建的噬菌体基因组与T7select包装溶液(Novagen)混合,以构建具有引入了随机肽的T7基因组DNA的T7噬菌体。将获得的噬菌体取样并对噬菌体群体进行计数。发现构建的噬菌体文库具有1.0x106至4.0x107的序列多样性。
在通过感染培养到OD660nm=0.6至1.0的大肠杆菌BLT5403以扩增所构建的噬菌体群体后,将噬菌体浓缩并通过将噬菌体在8%聚乙二醇中通过0.22um(微米)滤器进行纯化。在纯化后计数噬菌体的数量,由此发现每个文库含有约1.0x1012pfu/ml的噬菌体,并且一个肽噬菌体被扩增100,000至1,000,000倍。
实施例2
(使用展示随机肽的T7噬菌体文库进行针对氧化镝的生物淘选)
使用在实施例1中制备的展示随机肽的T7噬菌体文库,试图分离展示了结合氧化镝的肽的T7噬菌体。方案被示出在图1中。
将氧化镝(Sigma-Aldrich)在甲醇和丙酮的混合溶液(1:1)中洗涤,然后在异丙醇中洗涤,并分散在TBS中。
将含有500ug(微克)氧化镝的分散体与所述T7噬菌体文库混合,并允许反应在室温下进行1小时。然后通过离心(6000rpm,3分钟)来沉淀粒子并移除上清液,由此除去未结合的噬菌体。
在移除上清液后,向沉淀物添加TBST以分散氧化镝。将分散体再次离心以便除去非特异性结合到所述粒子的噬菌体。通过重复该程序(洗涤程序)3到10次,除去非特异性结合到氧化镝的肽噬菌体。
在通过洗涤除去未结合的噬菌体和非特异性结合的噬菌体后,将剩余的噬菌体与培养到OD660nm=0.6至1.0的大肠杆菌BLT 5403的溶液(10ml)混合,并在37℃下温育直至大肠杆菌完全裂解。
在大肠杆菌完全裂解后,以培养基的1/10的量加入5M NaCl,将混合物离心(3500rpm,15分钟)以沉淀包括大肠杆菌细胞壁等的不溶性级分,并回收上清液。
以回收的上清液的1/6的量添加50%的聚乙二醇6000溶液,将混合物搅拌并以3500rpm离心15分钟,以沉淀T7噬菌体。将沉淀的T7噬菌体群体溶解在TBS溶液中,通过0.22um滤器进行过滤处理,并储存在4℃下直至使用。
实施例3
(通过生物淘选浓缩的结合氧化镝的噬菌体的确认)
在将实施例2中描述的一系列程序重复5次后,在所述程序的每个循环后确定结合氧化镝的噬菌体的数目。
首先,将氧化镝在甲醇和丙酮的混合溶液(1:1)中洗涤,在异丙醇中洗涤,并分散在TBS中。
将含有500ug氧化镝的分散体与每个循环后合并的噬菌体混合,并允许反应在室温下进行1小时。然后将反应溶液离心(6000rpm,3分钟)并移除上清液。将沉淀物在TBST中洗涤10次。
在洗涤后,通过噬菌斑测定法确定结合氧化镝粒子的噬菌体的数目。结果示出在图2中。如图2中所示,结合氧化镝粒子的噬菌体的数目随着淘选的进展而增加。从这些结果发现,淘选的重复允许筛选对氧化镝具有出色结合能力的展示肽的噬菌体。
实施例4
将在5个淘选循环后合并的噬菌体用于获得噬菌体的单克隆,并对随机选择的35种噬菌体进行由其展示的肽序列的分析。结果,确认了31个不同序列。代表性的7个不同氨基酸序列在下文中示出。
[表1]
在单克隆噬菌体上展示的肽的氨基酸序列分析
如表1中所示,序列9-4(LOB1)和10-20(LOB2)分别在4个和2个克隆中发现,并且与其他氨基酸序列不同,序列9-4(LOB1)和10-20(LOB2)不含碱性氨基酸(K、R和H)。
实施例5
(展示结合氧化镝的肽的单克隆噬菌体的筛选)
在实施例4中鉴定到的肽噬菌体中,评估了具有表1中示出的特征性序列的噬菌体克隆对氧化镝的结合能力。
将洗涤过并分散在TBS中的氧化镝(500ug)与每种噬菌体混合,并允许反应在室温下进行1小时。然后将反应溶液离心(6000rpm,3分钟)并移除上清液。将沉淀物在TBST中洗涤10次。在洗涤后,通过噬菌斑测定法确定结合到氧化镝粒子的噬菌体的数目。结果示出在图3中。如图3中所示,对于冗余的序列9-4(LOB1)和10-20(LOB2) 来说,结合的噬菌体数目比野生型高约100倍。
实施例6
(合成肽的制备)
通过Fmoc固相合成法合成由噬菌体展示的结合到氧化镝的肽LOB1和LOB2。将合成的肽通过源自于g10序列的GGG在N-末端处用生物素标记。
将每个肽从树脂上切下并去保护,使用适合的氧化剂例如碘形成分子内二硫键。然后将所述肽通过反相HPLC纯化并冷冻干燥。
实施例7
(合成肽与氧化镝的结合的评估)
评估在实施例6中制备的合成肽(LOB2)与被固定在微孔板上的氧化镝的结合。
将氧化镝(5ug)洗涤,分散在异丙醇中,添加到微孔板,并在真空下干燥1小时。
在干燥和固定化后将微孔板用超纯水洗涤,在室温下与400ul(微升)0.5%BSA温育90分钟进行阻断,并用TBST洗涤3次。
将合成肽LOB2(终浓度:80nM)与SA-HRP(终浓度:20nM)混合,允许反应10分钟,并将混合物用TBST洗涤5次。
在洗涤微孔板后,向每个孔加入TMB溶液。在确认一定程度的产色后,向每个孔加入1N HCl以终止反应,并在微孔板读板器Spectra max plus 384上测定450nm处的吸光度。由此评估合成肽对氧化镝粒子的结合能力。使用的阴性对照是结合镧系元素离子的肽(La-BP,氨基酸序列:GGGSFIDTNNDGDWIEGDELLA,SEQ ID NO:38)。结果 示出在图4中。
如图4中所示,LOB2以浓度依赖性方式显示出特异性针对氧化镝的结合能力。
实施例8
(合成肽的结合特异性的评估)
以与实施例7中相同的方式,对合成肽LOB1和LOB2以及被固定在微孔板上的稀土金属氧化物粒子(La2O3、CeO2、Nd2O3、Sm2O3、Gd2O3、Tb4O7、Dy2O3、Ho2O3、Er2O3、Yb2O3、Y2O3、TiO2、羟基磷灰石和Ag)进行总体评估。LOB1和LOB2的结果分别示出在图6和5中。
如图5中所示,LOB2对La2O3、CeO2、Nd2O3、Sm2O3、Gd2O3、Dy2O3、Ho2O3和Er2O3具有高的结合能力。其中,LOB2对CeO2、Nd2O3、Gd2O3和Dy2O3显示出高的结合能力,对CeO2和Nd2O3显示出更高的结合能力,并且对Nd2O3显示出最高的结合能力。La-BP对La2O3显示出很少结合,并对CeO2显示出一定结合,其程度不能与LOB2的结合能力相比。
如图6中所示,LOB1对La2O3、CeO2、Nd2O3、Sm2O3、Gd2O3、Tb4O7、Dy2O3、Ho2O3和Er2O3具有高的结合能力。其中,LOB1对CeO2、Nd2O3、Gd2O3和Dy2O3显示出高的结合能力,对La2O3、CeO2和Ho2O3显示出更高的结合能力,并且对La2O3和CeO2显示出最高的结合能力。
根据上述结果,发现合成肽LOB1和LOB2对超过一种属于镧系元素的稀土的氧化物具有结合能力,同时对所述氧化物分别显示出不同的结合特异性。
实施例9
(LOB2肽的丙氨酸置换试验)
以与实施例1中相同的方式,使用在实施例1中注明的T7-Libup和T7-Libdown以及表2中示出的寡核苷酸引物,制备了展示出在LOB2肽的氨基酸序列中的每个氨基酸位置处进行了丙氨酸置换的肽序列的T7噬菌体。由制备的噬菌体展示的肽序列示出在图7中。
[表2]
用于构建丙氨酸置换噬菌体的引物
以与实施例7中相同的方式评估制备的LOB2-ala置换物噬菌体对Dy2O3的结合。结果示出在图8中。
如图8中所示,在位置3、4、10和12至14处置换为丙氨酸具有显著影响,并且结合的量显著减少。在位置2、6和9处置换为丙氨酸 也有显著影响。基于上述结果,发现位置3、4、10和12至14优选地分别为亮氨酸、色氨酸、亮氨酸、苯丙氨酸、亮氨酸和半胱氨酸。还发现位置2、6和9优选地分别为半胱氨酸、天冬氨酸和谷氨酸。
实施例10
(部分突变体文库的构建)
在LOB1和LOB2之后,制备了14或15个残基的肽文库,其展示的序列在位置1和2处具有固定的氨基酸Ser和Cis,并且在位置13和14处或位置14和15处具有Cis和Ser,其他位置以约30%的概率具有源自于所述结合氧化镝的肽的氨基酸。
以与实施例1中相同的方式,使用两种类型的DNA模板(LOB1-2nd和LOB2-2nd)制备部分突变体文库。
LOB1-2nd:CGA ATT CAG GTG GAG GTT CGT GTN JFJ OOE ONO FNE JNF ONO FNN JFO FNJ JNN JFT GTA GCT AAA AGC TTG CGG CCG A(SEQ ID NO:54)
LOB2-2nd:CGA ATT CAG GTG GAG GTT CGT GTN JFJ OOE ONO FNE JNF ONO FNN JFO FNJ JNN JFT GTA GCT AAA AGC TTG CGG CCG A(SEQ ID NO:55)
在两个DNA模板中,F、J、O、X、N、B、E和P分别表示随机合成的DNA序列,以便具有如下所述偏倚的碱基序列:
F=混合的碱基,其中A:70%,T:10%,G:10%,C:10%
J=混合的碱基,其中A:10%,T:70%,G:10%,C:10%
O=混合的碱基,其中A:10%,T:10%,G:70%,C:10%
X=混合的碱基,其中A:10%,T;10%,G:10%,C:70%
N=混合的碱基,其中A、T、G和C的量相等
B=混合的碱基,其中T、G和C的量相等
E=混合的碱基,其中A:20%,T:20%,G:40%,C:20%
P=混合的碱基,其中A:20%,T:20%,G:20%,C:40%
对构建的噬菌体群体进行计数,并且确认了LOB1部分突变体文库具有3.0x107的多样性,LOB2部分突变体文库具有8.0x107的多样性。
实施例11
(使用部分突变体文库的生物淘选和由分离的噬菌体展示的肽的序列分析)
以与实施例2中相同的方式,对在实施例10中制备的部分突变体文库进行5次针对氧化镝的生物淘选。随后,使用获得的合并噬菌体来获得单克隆,并以与实施例4中相同的方式分析所展示的肽的氨基酸序列。由LOB2和LOB1文库中的噬菌体克隆展示的肽的氨基酸序列分别示出在图9和10中。
如图9中所示,在LOB2肽的部分突变体文库中,存在着维持最初包含在LOB2中的酸性氨基酸残基的倾向。其中,在11个克隆中的10个克隆中,第9位残基处的酸性氨基酸残基(谷氨酸)被维持为谷氨酸或天冬氨酸。此外,在11个克隆中的6个克隆中,第11位残基处的酸性氨基酸残基(天冬氨酸)被维持为天冬氨酸或谷氨酸。在11个克隆中的5个克隆中,第6位残基处的酸性氨基酸残基(天冬氨酸)也被维持为天冬氨酸或谷氨酸。在其他位置处,也存在着维持LOB2肽中的氨基酸残基的性质(中性氨基酸、酸性氨基酸、碱性氨基酸、芳香族氨基酸、环状氨基酸、含硫氨基酸、酸酰胺氨基酸)的倾向。
如图10中所示,在LOB1肽的部分突变体文库中,存在着维持最初包含在LOB1中的酸性氨基酸残基的倾向。即,在所有克隆(14个克隆)中,第9位残基处的酸性氨基酸残基(谷氨酸)被维持为谷氨酸或天冬氨酸。在其他位置处,也存在着维持LOB1肽中的氨基酸残基的性质(中性氨基酸、酸性氨基酸、碱性氨基酸、芳香族氨基酸、环状氨基酸、含硫氨基酸、酸酰胺氨基酸)的倾向。
(LOB2肽的矿化活性的评估)
评估了LOB2肽与镝离子的结合。在HEPES缓冲液(HEPES 1mM,pH 6.2)中,将硝酸镝(镝作为离子存在)和溶解在DMSO中的所述肽稀释以便分别为1mM和10uM(DMSO 5%),并将含有稀释后的溶液的Eppendorf管在室温下静态温育。
5小时后,将所述管以15000rpm离心10分钟,除去上清液,然后向管加入100ul超纯水,以通过振摇洗涤沉淀物。在将这种离心和振摇洗涤重复两次后,将沉淀物彻底分散在20ul超纯水中,并通过TEM和EDX(Hitachi High Technologies Corporation)进行分析。结果示出在图11和12中。
如图11中所示,通过TEM分析确认了,通过使LOB2肽与镝离子发生接触产生了一些粒子。如图12中所示,通过EDX分析发现,产生的粒子含有镝。
根据上述结果发现,LOB2肽能够结合氧化镝并从镝离子沉淀出镝无机化合物。
实施例12
(温育pH对LOB2肽的矿化活性的影响)
在HEPS缓冲液(HEPES 1mM,pH 7.5)中将LOB2肽稀释以便为10uM(DMSO 3%),使用0.1N HCl或0.1M NaOH将pH调整到3.9至8.0,加入作为硝酸镝的镝离子,并将溶液在室温下在振摇的同时温育。
在温育5小时后,将每个溶液以15000rpm离心10分钟,除去上清液,然后向管加入100ul超纯水,以通过振摇洗涤沉淀物。在将这种离心和振摇洗涤重复两次后,将沉淀物分散在20ul超纯水中,将10 ul分散体滴加在碳带上,然后将碳带留在干净的工作台上直至干燥,并通过SEM/EDX分析。结果示出在图13A和13B中。
如图13A和13B中所示,发现在宽的pH范围内表现出矿化活性,导致镝无机化合物的产生。在本实施例中,确认了在pH 5.0以上且pH8.0以下的范围内获得优选的矿化。
实施例13
(反应温度对LOB2肽的矿化活性的影响)
在HEPS缓冲液(HEPES 1mM,pH 7.5)中将LOB2肽稀释以便为10uM(DMSO 3%),加入作为硝酸镝的镝离子,并将溶液在4℃、10℃、20℃、30℃、40℃、50℃、60℃和80℃下静态温育。
在温育5小时后,以与实施例12中相同的方式将每个溶液离心和搅拌洗涤,并通过SEM/EDX对最终获得的沉淀物进行分析。结果示出在图14A和14B中。
如图14A和14B中所示,发现在宽的温度范围内表现出矿化活性,导致氧化镝的产生。在本实施例中,确认了在4℃以上且8℃以下的范围内获得优选的矿化。
实施例14
(通过LOB2肽的矿化活性产生的粒子的粒径)
在HEPS缓冲液(HEPES 1mM,pH 7.5)中将LOB2肽稀释以便为10uM(DMSO 3%),加入作为硝酸镝的镝离子,并将溶液在室温下在振摇的同时温育5小时。
在5小时后,以与实施例12中相同的方式将所述溶液离心和搅拌洗涤,并通过TEM对最终获得的沉淀物进行分析。结果示出在图15中。
如图15中所示,得到的镝无机化合物粒子一般具有5nm以下的粒径,确认了获得纳米量级的粒子。
序列表自由文本
SEQ ID NO:1-29,33-38:合成的肽
SEQ ID NO:30-32,39-55:合成的核苷酸。
- 还没有人留言评论。精彩留言会获得点赞!