一种用于二泛素合成的新型辅基连接臂及其合成方法与流程
本发明属泛素领域,尤其涉及一种用于二泛素合成的新型辅基连接臂及其合成方法。
背景技术:
泛素(ub,ubiquitin)除了调节蛋白质的降解外,还参与了细胞的分裂、生长、细胞间的信号转导、细胞的运动及凋亡等关键过程。基于泛素的重要性,对泛素链的合成研究也很重要。在泛素链中一个泛素单体通过其主链羧基与另一个泛素单体的主链氨基或七个赖氨酸残基(lys6、lys11、lys27、lys29、lys33、lys48、lys63)之一的侧链氨基形成酰胺键相连。不同类型的泛素链修饰具有不同的功能,保证了泛素化修饰功能的多样性和特异性。
为了研究不同位点的二泛素在生化和结构上的差异,发展一种高效合成二泛素的方法是必要的。strieter课题组成功地将基于巯基-烯烃的自由基偶联(thiol-enecoupling,tec)运用于泛素链的合成中,以锂酰基亚磷酸盐(lap)为自由基引发剂获取了几类不同赖氨酸位点连接的多聚泛素链(j.am.chem.soc.2012,134,6916-6919)。然而,该方法的不足在于大分子间的tec偶联效率较低。
技术实现要素:
本发明的目的是提出一种克服了前人所用的大分子与大分子之间通过tec偶联反应效率低的缺点,通过小分子与大分子进行高效反应用于二泛素合成的新型辅基连接臂及其合成方法。
为了实现上述目的本发明采用如下技术方案:
一种新型辅基连接臂的合成方法,其特征在于,所述的新型辅基连接臂结构式如下式所示:
所述的一种用于二泛素合成的新型辅基连接臂的合成方法,其特征在于,该方法分为四步反应,第一步反应是将化合物i与三苯甲基硫醇(trtsh)在含有碱的有机溶剂的反应体系下反应2h,生成化合物ii;第二步反应是将生成的化合物与甘氨酸在加入还原剂的有机溶剂回流反应72h,获得化合物iii;第三步反应是将生成的化合物用切割液反应1h脱去三苯甲基(trt)基团,再与甲醛在碱性的条件下反应2h,生成化合物iv;第四步反应是将生成的化合物与丙烯胺在含有缩合剂的有机溶剂中反应2h得到目标产物。如下式所示:
第一步反应中三苯甲基硫醇trtsh的摩尔量是化合物i摩尔量的1-1.2倍,碱的摩尔量是化合物i摩尔量的1-1.2倍;
第二步反应中甘氨酸的摩尔量是化合物ii摩尔量的19-21倍,还原剂的摩尔量是化合物ii的1.4-1.6倍;
第三步反应中切割液的体积是反应体系的0.1-0.3倍,甲醛的摩尔量是化合物iii摩尔量的1-1.2倍;
第四步反应中缩合剂的摩尔量是化合物iv摩尔量的0.9-1倍,丙烯胺的摩尔量是化合物iv摩尔量的1.5-2倍,碱的摩尔量是化合物iv摩尔量的2.8-3.2倍。
所述的用于二泛素合成的新型辅基连接臂的合成方法,其特征在于:
第一步反应中所述的碱为n,n-二异丙基乙胺;
第一步反应中所述的有机溶剂为n,n-二甲基甲酰胺溶液。
所述的用于二泛素合成的新型辅基连接臂的合成方法,其特征在于:第二步反应中所述的加入的还原剂为氰基硼氢化钠。
所述的用于二泛素合成的新型辅基连接臂的合成方法,其特征在于:第二步反应中所述的有机溶剂为甲醇溶液。
所述的用于二泛素合成的新型辅基连接臂的合成方法,其特征在于:第三步反应中所述的切割液为三氟乙酸与三异丙基硅烷按体积比1:0.8-1.2组成的混合溶液。
所述的用于二泛素合成的新型辅基连接臂的合成方法,其特征在于:第三步反应中所述的碱性条件为ph8。
所述的用于二泛素合成的新型辅基连接臂的合成方法,其特征在于:第四步反应中所述的缩合剂为2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯、1-羟基苯并三唑中的一种或几种。
所述的用于二泛素合成的新型辅基连接臂的合成方法,其特征在于:第四步反应中所述的碱为n,n-二异丙基乙胺;第四步反应中所述的有机溶剂为n,n-二甲基甲酰胺溶液。
本发明的原理为:
本发明提供了一种用于二泛素合成的新型辅基连接臂及其合成方法,该辅基连接臂通过tec反应装载到蛋白上后再通过ncl与第一段泛素偶联,最后脱除辅基即可获得基于表达泛素单元的泛素链。该方法克服了前人所用的大分子与大分子之间通过tec偶联反应效率低的缺点,通过小分子与大分子进行高效反应;并且形成的酰胺键和天然异肽键最接近,以便于后续的生化机理研究。
附图说明
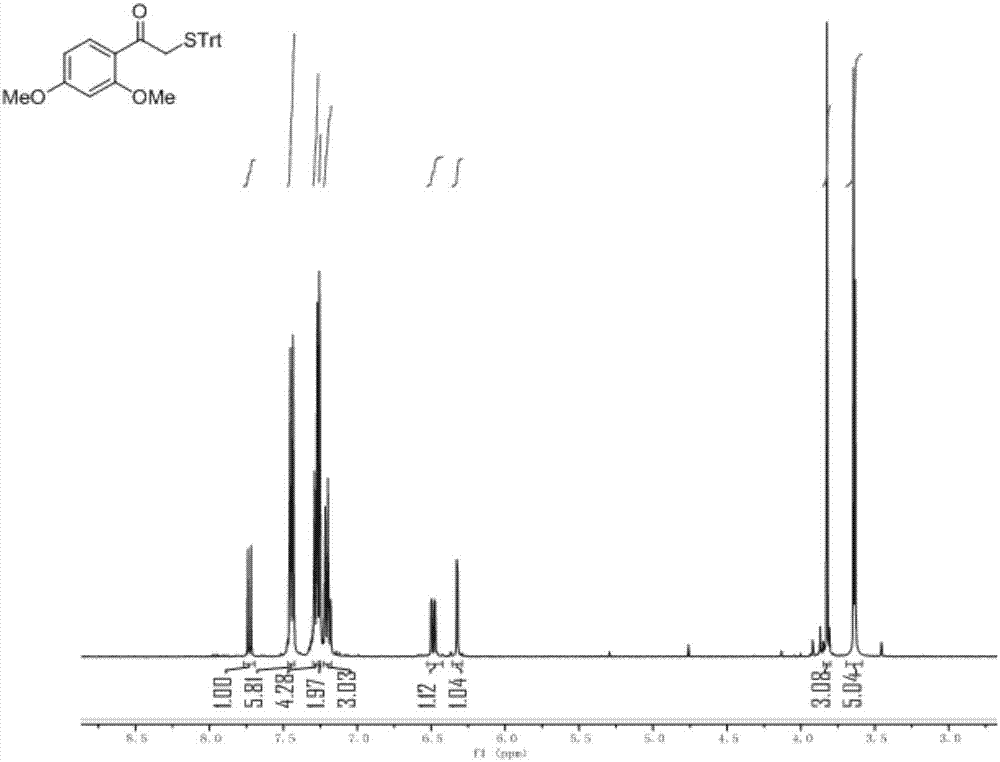
图1是化合物i的核磁共振氢谱图;
图2是化合物ii的核磁共振氢谱图;
图3是化合物iii的核磁共振氢谱图;
图4是化合物iv的核磁共振氢谱图;
图5是新型辅基连接臂的核磁共振氢谱图;
图6是新型辅基连接臂的核磁共振碳谱图;
图7是新型辅基连接臂的高分辨质谱图;
图8是新型辅基连接臂装载到泛素k48c的质谱图;
图9是新型辅基连接臂装载到泛素k48c脱除thz基团的质谱图;
图10是运用新型辅基连接臂得到二泛素k48c脱除辅基前的质谱图;
图11是运用新型辅基连接臂得到二泛素k48c脱除辅基后的质谱图。
具体实施方式
为了便于理解本发明,下面结合具体实施例对本发明实施过程作进一步说明,这些描述只是为进一步说明本发明的特征和优点,而不是对本发明权利要求的限制。
实施例1:辅基连接臂的合成
反应式如下所示:
具体步骤为:
化合物ii:取1.0g化合物i(3.86mmol)、1.28gtrtsh(4.63mmol)于100ml装有磁子的圆底烧瓶中,加入25mln,n-二甲基甲酰胺(dmf)溶解,缓慢滴加808uln,n-二异丙基乙胺(diea,4.64mmol),于室温下搅拌反应,反应2h,向烧瓶中加入大量水稀释,用乙酸乙酯(ea)萃取3次,再用水洗3次,收集有机相,无水硫酸钠干燥,将干燥后的有机相过滤,旋转蒸发仪旋干溶剂,得到产物白色固体1.55g,产率88.35%。
化合物iii:取0.9g化合物ii(2.0mmol)于150ml装有磁子的圆底烧瓶中,加入15ml无水甲醇溶解,加入1.5g甘氨酸(20mmol)、90mg氰基硼氢化钠(nabh3cn,1.43mmol),将烧瓶放入70摄氏度的油浴锅中加热回流,反应72h,旋转蒸发仪旋干溶剂,加入乙酸乙酯溶解,粗硅胶(100-200目)拌样,旋转蒸发仪旋干溶剂。柱层析分离法(硅胶柱)分离目的产物,得到产物0.7g,产率68.25%。
化合物iv:取0.54g化合物iii(1.05mmol)于150ml装有圆底烧瓶中,加入15mln,n-二甲基甲酰胺溶解,加入1.5ml三氟乙酸(tfa),反应15min,加入1.5ml三异丙基硅烷(tips),反应20min,旋转蒸发仪旋干溶剂,冷冻干燥机抽干溶剂;接着加入15ml混合溶剂(无水乙醇:水=3:1)溶解,加入83ul的37%甲醛水溶液,调ph为8,室温下反应2h,旋转蒸发仪旋干溶剂,加入ea溶解,粗硅胶(100-200目)拌样,旋转蒸发仪旋干溶剂。柱层析分离法(硅胶柱)分离目的产物,得到产物0.23g,产率77%。
辅基连接臂:取212mg化合物iv(0.75mmol)、256.65mg2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(hatu,0.675mmol)、101.34mg1-羟基苯并三唑(hobt,0.75mmol)于装有磁子的100ml圆底烧瓶中,加入5mldmf溶解,加入112.2ul烯丙胺(1.5mmol),搅拌反应2h,加过量dcm稀释,再用水洗3次,收集有机相,无水硫酸钠干燥,将干燥后的有机相过滤,旋转蒸发仪旋干溶剂,加入dcm溶解,粗硅胶(100-200目)拌样,旋转蒸发仪旋干溶剂。柱层析分离法(硅胶柱)分离目的产物,得到产物136.5mg,产率86.4%。
实施例2:二泛素k48c的合成
反应式如下所示:
具体步骤为:
装载小分子:在装有磁子的50ml反应管中,加入蛋白ub(1-76)k48c(3umol,26mg)、辅基连接臂(240ul的500mmol储液)、引发剂2,2-二羟甲基丁酸(dmpa,150ul的200mmol储液)、叔丁基硫醇(27ul),用混合溶剂(水:n-甲基吡咯烷酮=1:1)补至3ml。在365nm的光波长下搅拌反应2h,透析过夜,半制备柱分离,分离产物冻干得18mg,产率67.7%。
脱保护:在装有磁子的50ml反应管中,加入上述步骤的装有辅基连接臂的泛素18mg(2umol),用2ml的buffer(6m盐酸胍、0.2mnah2po4、0.2m甲氧胺、ph4)溶解,室温下搅拌反应5h,透析过夜,半制备柱分离,分离产物冻干得12.5mg,产率70.6%。
ncl连接:在装有磁子的50ml反应管中,加入上述步骤的装有辅基连接臂的泛素并脱除thz保护基12.5mg(1.4umol),ub(1-75)-mesna(2umol,1.7mg),三(2-羧乙基)膦(tcep,10mg,35umol),4-巯基苯基乙酸(mpaa,5.89mg,35umol),磷酸缓冲盐溶液(phosphatebuffersaline,pbs)1.5ml,调ph为7.0,室温下搅拌反应2h,半制备柱分离,分离产物冻干得8mg,产率33%。
辅基移除:取3mg(1.7umol)上述步骤未脱除辅基的二泛素于反应管中,加入切割液tfa/tis/h2o(95/2.5/2.5)500ul,放于冰上反应20min,反应结束。色谱分离获得终产物2.4mg(1.4umol),产率82%。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,也不因各实施例之间的前后次序对本发明造成任何局限,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!