食源性致病菌可视化检测探针及可视化检测方法与流程
本发明涉及食源性致病菌检测技术领域,具体涉及一种食源性致病菌可视化检测探针及可视化检测方法。
背景技术:
食源性致病菌的检测手段多种多样,可概括分为以下三大类:
1、传统的培养方法,通过细菌的选择性分离,将平板上肉眼可见的特征性菌落进行确认,并对该菌落分离物采用三糖铁琼脂、赖氨酸脱羧酶试验、蛋白胨水、尿素琼脂、氰化钾等进行生化试验和多价菌体抗原(o)、多价鞭毛抗原(h)等血清学检测,以最终做出鉴定。一般全过程需时至少4~7天,才能得出明确的诊断结果。虽然,此方法耗时繁琐,但因其成本较低且较为稳定,已作为检验检疫行业的金标准。
2、基于免疫学的检测方法,一般作为初筛方法,所检测出的阳性样品最终还需经过传统的培养方法进行进一步确证,并且受到环境因素影响较大,批次之间的结果可能差异较大,其检测灵敏度也往往较低。胶体金免疫层析技术在快速检测上有自身的优势,其方法得到了美国官定分析化学家协会(aoacinternational)官方认可,能够对样品中的沙门氏菌、大肠杆菌o157等进行快速的检测。该法比起传统的培养法、elisa等更加地快捷,但其灵敏度不如pcr方法,且基于免疫学方法的检测,受环境、样品基质等影响较大,只能作为一种初筛方法。
3、基于分子生物学的检测方法,本方法首先需要对检测样品进行核酸提取,即便有全自动核酸提取仪的应用,在进行大量样品的前处理过程中仍然有些繁琐,而且这种仪器价格昂贵,操作起来不够简单,应用起来有诸多不便。pcr技术在食源性致病菌检测是比较成功的,已开发出一系列商品试剂盒,如霍乱弧菌、沙门氏菌、志贺氏菌、蜡样芽胞杆菌、大肠埃希氏菌等pcr检测试剂盒,部分已经得到aoac官方认可。除常规pcr技术外,多重荧光pcr技术的应用也日渐增加。
目前,检测食源性致病菌的方法虽有多种,但是在易操作、灵敏度等方面仍然存在一些不足:如需要贵重的仪器、繁琐的操作步骤、复杂的样品前处理、检测周期比较长、较高的假阳性、实际样品检测存在灵敏度不足等。尤其对于基层实验室,还停留在传统选择性培养方法对致病菌进行检测,缺少一种简便准确、高灵敏的快速检测技术。
因此,毋需繁琐的样品前处理,即能实现致病菌的快速、高灵敏、高特异性检测,且不需要贵重的仪器,能在基层实验室进行推广应用的快速检测方法成为了本领域研究的重点方向。若要解决上述问题需具备几个因素:1)样品的简化处理,无需进行核酸的提取与纯化;2)检测方法的高灵敏与高特异;3)能够同时检测多种致病菌;4)无需贵重仪器,能够在基层实验室开展相关工作。
2007年,mitani等在《naturemethods》上报道了一种新型的等温扩增技术,即smartamp技术(smartamplificationprocesstechnology),它采用5条引物和dna错配结合蛋白(muts)进行目标产物的扩增,能保证扩增产物的“绝对特异”,目前该技术主要用于单核苷酸多态性(singlenucleotidepolymorphisms,snps)分型以及突变的检测。2013年,军事医学科学院刘雪林、宋宏彬等人发表了一篇介绍smartamp技术的综述,该文指出在食物、环境中病原体检测方法,虽然尚未见相关研究报道,但smartamp方法的原理同样适用。smartamp技术从样品的粗制备到扩增的结束,整个检测过程20~60分钟,不会出现非特异性,只要有扩增信号就表示目标物的存在,而且smartamp技术的扩增能力是普通pcr技术的100倍[14,15]。其“绝对”特异性归功于引物设计的独特性(5条引物tp、fp、op1、op2、bp),而dna错配结合蛋白(muts)更是加强了扩增过程的绝对特异,而不会继续扩增造成非特异信号的出现。
smartamp技术与其他类型的等温扩增技术,如环介导等温扩增(loop-mediatedisothermalamplification,lamp)、依赖核酸序列的扩增(nucleicacidsequence-basedamplification,nasba)、链替代扩增(stranddisplacementamplification,sda)、滚环扩增(rollingcircleamplification,rca)等是完全不同的概念。和smartamp技术最为相似的就是lamp等温扩增,smartamp技术最大的优势是可避免引物二聚体的出现,使背景信号降到最低,达到理论上的“绝对”特异,而lamp技术使用2个tp引物对,造成产生哑铃状的产物,易造成引物二聚体。当前的等温扩增技术已广泛的应用到基于核酸模板的各种类型的检测技术中,但始终和常规pcr一样就是对模板纯度要求相对较高,同样会产生非特异性扩增等问题,而smartamp技术对样品质量要求低,dna只需简单纯化,甚至不用纯化,它能弥补对以上常规类型等温扩增技术的不足。
传统的smartamp技术是采用荧光染料,直接观察检测信号。虽然smartamp技术可以最大程度上避免引物二聚体的产生,但遇到复杂的样品基体,采用荧光染料模式就易产生假阳,导致检测结果准确性不足。
技术实现要素:
本发明实施例要解决的技术问题在于,提供一种食源性致病菌可视化检测探针,以简化检测流程,并提高检测效率、灵敏度及准确性。
本发明实施例进一步要解决的技术问题在于,提供一种食源性致病菌可视化检测方法,以简化检测流程,并提高检测效率、灵敏度及准确性。
为解决上述技术问题,本发明实施例采用的技术方案是:提供一种食源性致病菌可视化检测探针,包括:
在预先选定的作为目标菌候选检测位点的基因的第一区域设计及合成的smartamp引物探针,所述引物探针的5’端引入有第一活性基团并通过所述第一活性基团连接金纳米粒子以及预先确定的与所述目标菌相对应的荧光粒子;以及
在预先选定的作为目标菌候选检测位点的基因的第二区域设计及合成的荧光编码纳米探针,所述荧光编码纳米探针的5’端引入有第二活性基团并通过所述第二活性基团连接金纳米粒子以及预先确定的与所述目标菌相对应的荧光纳米粒子。
进一步地,在所述候选检测位点的基因的设计荧光编码纳米探针的第二区域设计有多个荧光编码纳米探针结合位点,在每一个结合位点均设计及合成一个荧光编码纳米探针而构成多位点荧光编码纳米探针。
进一步地,所述第一活性基团和第二活性基团选自如下基团:氨基、巯基或羧基。
进一步地,所述多位点荧光编码纳米探针的碱基数为10-30个。
进一步地,所述荧光纳米粒子采用稀土荧光纳米粒子。
另一方面,本发明实施例还提供一种食源性致病菌可视化检测方法,包括:
预先选定作为目标菌的食源性致病菌的候选检测位点的基因;
在所述候选检测位点的基因的不同区域分别设计及合成smartamp引物探针和荧光编码纳米探针获得可视化检测探针,所述smartamp引物探针的5’端借助于第一活性基团连接金纳米粒子以及预先确定的与所述目标菌相对应的荧光纳米粒子,所述荧光编码纳米探针的5’端借助于第二活性基团连接有金纳米粒子以及预先确定的与所述目标菌相对应的荧光纳米粒子;
利用可视化检测探针对待检样品进行smartamp扩增,然后在紫外灯照射下进行观察,根据观察到的荧光信号,确定所述待检样品中是否含有所述食源性致病菌;
在进行扩增后未能检测出含有食源性致病菌时,进一步利用所述可视化检测探针与待检样品进行杂交,然后再次在紫外灯照射下进行观察,根据观察到的荧光信号,确定所述待检样品中是否含有所述食源性致病菌。
采用上述技术方案,本发明实施例至少具有以下有益效果:本发明通过改进smartamp技术,创新性引入荧光编码纳米探针,可实现食源性致病菌的超灵敏可视化检测。通过在smartamp引物探针的5’端标记荧光纳米粒子,即作为引物也作为探针,这样扩增之后,其产物带有荧光基团,从而无需加入荧光染料即能通过紫外灯观察结果。而在基因另一区域还设计荧光编码纳米探针,通过荧光编码纳米探针与待检测样品杂交,实现信号放大,可进一步提高食源性致病菌检测灵敏度以及检测通量。本发明实施例通过两次信号放大,建立一种新型的引物探针型smartamp-荧光编码纳米探针技术实现快速“pcr式”的信号放大,进行超灵敏高特异的致病菌可视化检测。
本发明实施例的技术方案能够同步检测食品中可能存在的多种食源性致病菌,可以将各致病菌对应的探针分别在不同的反应管实现检测,也还可将各致病菌对应的探针混在一起进行检测,由于无需繁琐的样本前处理过程,只需对检测样本进行通用培养基的预扩增,简单处理即可进行信号的放大,并且扩增的过程即是检测的过程,即该技术扩增信号的“绝对特异”。因smartamp扩增和可视化检测无需贵重仪器,一般实验室的水浴锅和紫外灯即可满足,非常适合在基层实验室开展大量的致病菌筛查工作。
此外,本发明实施例设计引物探针及荧光编码纳米探针用于smartamp扩增体系,因二次信号放大策略,对于含量极低的致病菌以能够实现可视化检测。而对于含量较高的致病菌,无需与荧光编码纳米探针杂交,因基于引物探针型smartamp扩增即可实现可视化检测。
本发明实施例还可进一步采用多位点多标记在检测区域形成多个荧光编码纳米探针,通过杂交能够实现终点产物的定量分析,能够进一步提高检测灵敏度与检测通量。以此衍生出的多位点纳米探针设计理念,可推广应用到其他检测体系,进一步提高检测灵敏度。
附图说明
图1是本发明食源性致病菌可视化检测探针一个实施例的设计结构示意图。
图2是本发明食源性致病菌可视化检测方法一个实施例的流程示意图。
图3是本发明食源性致病菌可视化检测探针在设计过程中筛选候选引物中效果比较好的引物的流程示意图。
具体实施方式
下面结合附图和具体实施例对本发明作进一步详细说明。应当理解,以下的示意性实施例及说明仅用来解释本发明,并不作为对本发明的限定,而且,在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互结合。
如图1所示,本发明一个实施例提供一种食源性致病菌可视化检测探针,包括:
在预先选定的作为目标菌候选检测位点的基因的第一区域设计及合成的smartamp引物探针,所述smartamp引物探针的5’端引入有第一活性基团并通过所述第一活性基团连接金纳米粒子以及预先确定的与所述目标菌相对应的荧光粒子;以及
在预先选定的作为目标菌候选检测位点的基因的第二区域设计及合成的荧光编码纳米探针,所述荧光编码纳米探针的5’端引入有第二活性基团并通过所述第二活性基团连接金纳米粒子以及预先确定的与所述目标菌相对应的荧光纳米粒子。
在具体实施例,所述第一活性基团和第二活性基团选自如下基团:氨基、巯基或羧基。所述第一活性基团和第二活性基团可以为相同的基团从而可以构建完整的荧光探针。而所述荧光纳米粒子采用稀土荧光纳米粒子,而且,可以通过调整eu/tb的混合比例,实现颜色调整功能。
本发明通过改进smartamp技术,创新性引入荧光编码纳米探针,可实现食源性致病菌的超灵敏可视化检测。通过在smartamp引物探针的5’端标记荧光纳米粒子,即作为引物也作为探针,这样扩增之后,其产物带有荧光基团,从而无需加入荧光染料即能通过紫外灯观察结果。而在基因另一区域还设计荧光编码纳米探针,通过荧光编码纳米探针与待检测样品杂交,实现信号放大,可进一步提高食源性致病菌检测灵敏度以及检测通量。本发明实施例通过两次信号放大,建立一种新型的引物探针型smartamp-荧光编码纳米探针技术实现快速“pcr式”的信号放大,进行超灵敏高特异的致病菌可视化检测。
在图1中,示出有分别以肠出血性大肠杆菌(ecoli)o157:h7、沙门氏菌(salmonella)特异基因和单增李斯特菌(listeria)特异基因设计出对应的可视化检测探针的结构示意图。
结合图1所示,在一个实施例中,在所述候选检测位点的基因的设计荧光编码纳米探针的第二区域设计有多个荧光编码纳米探针结合位点,在每一个结合位点均设计及合成一个荧光编码纳米探针而构成多位点荧光编码纳米探针。在具体实施时,所述多位点荧光编码纳米探针的碱基数可控制为10-30个,碱基数目具体根据与目的产物杂交温度(45-60℃)来确定。碱基数少,可简化探针的设计。
本实施例通过形成多个荧光编码纳米探针,在使用时通过杂交能够实现终点产物的定量分析,能够进一步提高检测灵敏度与检测通量。以此衍生出的多位点纳米探针设计理念,可推广应用到其他检测体系,进一步提高检测灵敏度。
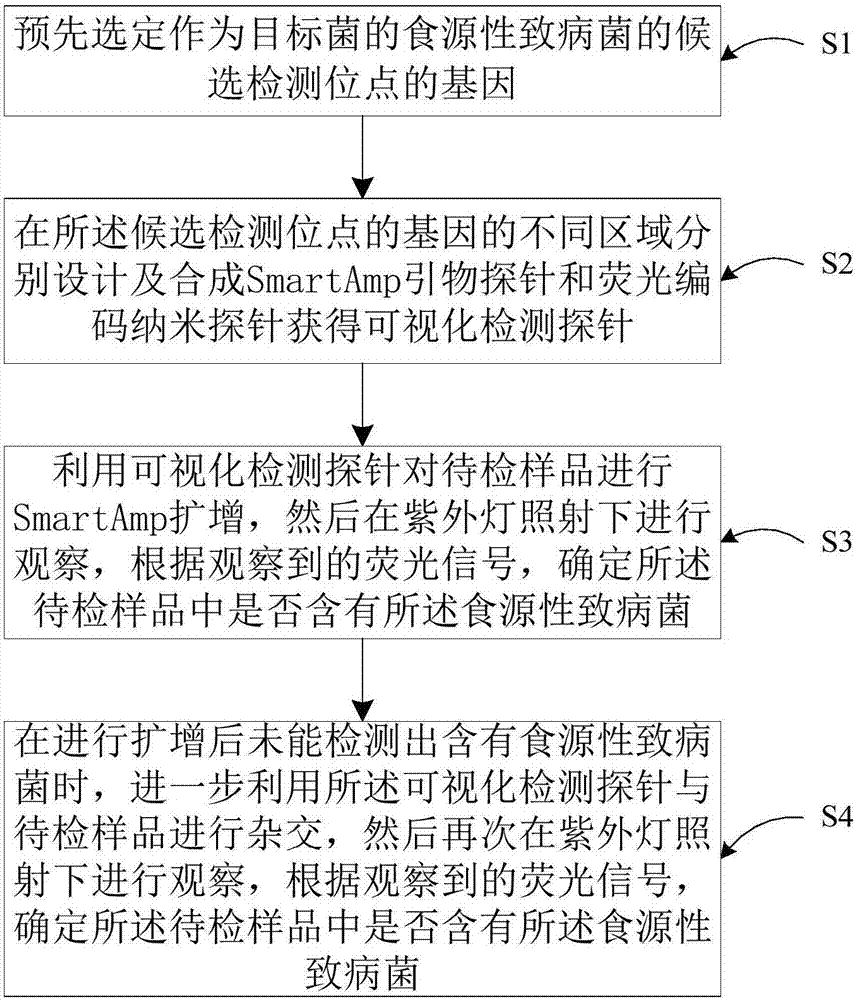
另一方面,如图2所示,本发明实施例还提供一种基于上述食源性致病菌可视化检测探针的可视化检测方法,包括:
s1,预先选定作为目标菌的食源性致病菌的候选检测位点的基因;
s2,在所述候选检测位点的基因的不同区域分别设计及合成smartamp引物探针和荧光编码纳米探针获得可视化检测探针,所述smartamp引物探针的5’端借助于第一活性基团连接金纳米粒子以及预先确定的与所述目标菌相对应的荧光纳米粒子,所述荧光编码纳米探针的5’端借助于第二活性基团连接有金纳米粒子以及预先确定的与所述目标菌相对应的荧光纳米粒子;
s3,利用可视化检测探针对待检样品进行smartamp扩增,然后在紫外灯照射下进行观察,根据观察到的荧光信号,确定所述待检样品中是否含有所述食源性致病菌;
s4,在进行扩增后未能检测出含有食源性致病菌时,进一步利用所述可视化检测探针与待检样品进行杂交,然后再次在紫外灯照射下进行观察,根据观察到的荧光信号,确定所述待检样品中是否含有所述食源性致病菌。
以下以实例方式说明本发明食源性致病菌可视化检测探针的设计及合成过程以及进行可视化检测的方法步骤。
一、smartamp引物的设计与合成
1)选取常见食源性致病菌为研究对象,例如:沙门氏菌、肠出血性大肠杆菌o157:h7、单增李斯特菌等,沙门氏菌参照gb/t4789.4、大肠杆菌o157:h7按照gb/t4789.6、单增李斯特菌按照gb/t4789.30方法进行。
根据文献的报道及ncbi公布的上述食源性致病菌的特异基因,选择出目标菌的候选检测位点,即靶基因,例如:肠出血性大肠杆菌o157:h7的rfbe基因(编码产物:o157抗原,genbank序列号s83460)、hlya基因(编码产物:溶血素,genbank序列号x94129)、slt1基因(编码产物:志贺样毒素1,genbank序列号m19473)、slt2基因(编码产物:志贺样毒素2,genbank序列号z37725)等。部分食源性致病菌的常见靶基因及其引物序列可如下表所示:
2)根据选定的靶基因,采用smartamp引物设计软件,设计出候选引物。根据软件评分可以获得多对引物,从高分到低分依次获得多对引物后,进行初步的筛选。筛选到的引物及其互补序列设计成引物探针,在其5’端引入第一活性基团,例如:氨基、巯基、羧基等,再通过所述第一活性基团与金纳米、荧光纳米、传统荧光染料(例如:fam、texasred、tamra等)结合。
二、多位点荧光编码纳米探针的设计与合成
多位点荧光编码纳米探针设计与smartamp引物设计区域一致,在选定靶基因后,即可在此靶基因区域进行设计,多位点荧光编码纳米探针的设计比传统的分子信标、taqman探针更加简单,可选地,多位点荧光编码纳米探针碱基数控制在10-30之内,具体根据与目的产物杂交温度(45-60℃)来确定其碱基数目。获得其序列及其互补序列后,进行荧光编码纳米探针合成,并在荧光编码纳米探针的5’端引入第二活性基团,并通过所述第二活性基团连接金纳米及荧光纳米。荧光编码功能的实现通过多色荧光纳米与所设计的多位点核酸序列进行结合。多色荧光纳米采用稀土荧光纳米,通过调整eu/tb的混合比例,实现多色功能,针对沙门氏菌、大肠杆菌o157:h7、单增李斯特菌等致病菌的专属基因设计出特异荧光编码纳米探针,在靶基因区域设计多个探针结合位点。多位点荧光编码纳米探针与待检测样品经过杂交后,既能分离出荧光报告序列,从而能够在紫外灯照射下,实现二次放大,能够用肉眼观察到的荧光信号,实现可视化检测。
三、免核酸提取直接扩增体系的研究
smartamp技术的优势在于“扩增过程即检测结果”,并且smartamp体系对样本的纯度要求不高,这样对于食源性致病菌的检测尤其重要,能够大大简化检测步骤,增强技术的实际应用潜力。在smartamp技术优势之上,本发明实施例改进的smartamp技术相比文献报道的smartamp技术具有更好的环境耐受性。主要从以下几个方面着手:1)在对上述引物对进行简单的试验后,选取扩增速度较快、产物量较大的那组引物(tp、fp)作为直接扩增体系的优化引物,对每次试验采取经纯化的菌液dna及未经纯化的菌液dna分别进行对比试验;2)以不同的pcr添加剂进行分组,分为dmso组、betaine组、mgcl2组、海藻糖组、甲酰胺组、tween20组等,分别配制系列的稀释浓度,进行同步扩增;3)取经纯化的菌液dna、未经纯化的菌液、经简单离心的菌液以及纯水组进行试验,结合上述的pcr添加剂,在简单的tp、fp引物对条件下,采用正交法进行试验的优化。
四、smartamp技术检测食源性致病菌单重体系
采用引物探针型smartamp检测体系进行初步验证,并检测相对应的致病菌:
1)对设计出的引物探针,进行系列的试验,筛选出候选引物中效果比较好的引物进行后续的试验,如图3所示,筛选的步骤包括:
a、候选目标引物的筛选;
b、合成和试验所设计的引物探针,在没有taqmuts存在情况下,先对fp和tp引物进行试验,之后测试所有引物,包括bp、op1、op2;
c、选择产率和速度最快的引物进行试验;
d、进一步优化试验条件,如果有必要从步骤(b)从新开始;
e、使用taqmuts,测试反应体系的特异性;
f、回到步骤(d),进一步优化体系的特异性。
2)结合直接扩增体现试验的结果,把其优化出较为理想的添加剂加入到smartamp体系中,包括所有的对引物存在的情况下,进行初步的试验,并根据情况微调相应的浓度。
五、多重同步检测体系
通过引物探针及多位点荧光编码纳米探针所标记的纳米颜色不同,来实现不同种类致病菌的识别。如对于大肠杆菌o157:h7,其引物探针及多位点荧光编码纳米探针上均标记有绿色荧光的纳米粒子,而猝灭基团均为金纳米。不管是引物探针还是多位点荧光编码纳米探针,当在静态体系中时,因金纳米与荧光纳米距离较近而发生荧光共振能量转移,绿色荧光被金纳米猝灭。当体系中产物扩增,其产物结合能力更强于引物探针及多位点荧光编码纳米探针,从而使金纳米脱离探针,使探针发光,实现检测。
六、实际样品检测评价
对于所建立体系意在能够用于实际工作之中,对样品的实际检测从验证灵敏度、特异性、重现性、准确度等方面着手,采用经典的选择性培养法、荧光pcr法、自动荧光酶标测定法mini-vidas进行比对试验。与以往基于核酸扩增的检测技术不同,本发明实施例提供的smartamp引物探针结合多位点荧光编码纳米探针的技术方案能大大简化样品的前处理过程,在对样品进行预扩增,进行增菌之后无需进行核酸的提取,只需简单的离心处理,即能进行样品的smartamp扩增。简化处理的样品操作程序,能够在实际样品检测中节约人力、物力成本,大大提高检测效率。
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同范围限定。
- 还没有人留言评论。精彩留言会获得点赞!