从AAV制剂中去除污染病毒的制作方法
本申请为分案申请,其原申请的申请日为2012年9月7日,申请号为201280049899.5,名称为“从aav制剂中去除污染病毒”。
本发明涉及病毒学和基因治疗的领域。具体地,本发明涉及一种将形状为杆状的污染病毒(例如杆状病毒)从形状基本为球形的病毒(例如腺伴随病毒基因治疗载体)的制剂中去除的方法。
背景技术:
在产生用于基因治疗的病毒载体中,由于安全性的缘故而使用复制缺陷型病毒。复制缺陷型病毒能够在体内感染人细胞并将转基因转移到所述细胞中,但其不能在所述细胞中自行复制。通常,这可以通过删除对病毒复制很重要的病毒基因例如rep和cap基因来完成。这还使得能够纳入目的基因产物来替换病毒基因。为了在宿主细胞内生成病毒颗粒,需要单独提供从所述复制缺陷型病毒中删除的病毒基因,例如通过提供辅助病毒。
腺伴随病毒(aav)是非自主复制的病毒,其属于细小病毒科,构成外面有直径为约18-26nm的二十面体结构蛋白外壳的单链dna分子。野生型aav病毒可以整合到宿主细胞的基因组中,或者在辅助病毒的存在下在宿主细胞中复制。腺病毒最先被鉴定为可能的辅助病毒。然而,其他对人和动物有致病性的基本为球形的哺乳动物辅助病毒例如疱疹病毒也是适合的。最近这些年,在昆虫细胞中借助于基于杆状病毒的表达系统产生腺伴随病毒(aav)载体(urabeetal.[2002]humgenether.13(16):1935-43)已经日益普遍,这是因为可以容易地放大所述系统的规模,用于基因治疗的工业应用。在该生成系统中,通常使用编码aavrep基因、aavcap基因和侧翼有aav末端反向重复(itr)的目的基因产物(转基因dna)的三种重组杆状病毒。
与使用辅助病毒或基于病毒的表达系统进行的病毒载体制备相关的显著缺点是形成产物病毒颗粒与辅助病毒的混合群,所述混合群必须要进行进一步纯化。由于污染病毒例如腺病毒或杆状病毒的潜在致病性和/或免疫原性,因此当在基因治疗中使用病毒载体时,必须要避免存在所述病毒或使其减到最少。
一些除去辅助病毒的方法目前是本领域已知的,然而,它们都各有缺点。这些方法的实例为密度梯度离心或热灭活或其结合。然而,密度梯度离心仅对于相对小的体积是经济上可行的,因此该方法对于工业规模是不可行的。热灭活基于aav和辅助病毒的热稳定性不同。例如,将腺病毒和aav的混合群加热到56-65℃,可导致大致上选择性地热灭活所述辅助病毒,而aav的活性仅有轻微的损失。不幸的是,在样品中仍存在的变性的辅助病毒蛋白,一旦在基因治疗中使用,就能够在患者中引起细胞免疫应答(smith,c.a.etal.(1996)j.virol.,70,6733-6740)。
另外,已经发展了柱色谱方法(包括离子交换色谱(基于阴离子和/或阳离子)和亲和色谱)用于纯化aav载体。这些方法可导致高度富集的aav载体制剂,但是不能单独地确认它们表现出足以满足销售的医药产品的监管要求的辅助病毒耗尽。
最后,在美国专利6,479,273中公开了通过使含有重组的aav和腺病毒(即,两种基本为球形而直径相当不同的病毒)的溶液一次或多次过滤通过孔径为约50nm的滤膜或孔径为约35nm的滤膜,来实现两种病毒的分离。据公开raav具有约25nm的直径,而腺病毒可以说是具有约65-90nm的直径,但更大的直径例如接近100nm已经在文献[kennedyandparks(2009)moleculartherapy17(10):1664-1666;berkowitz(2003)wcbp7thannualmeetingjanuary7-102003,sanfrancisco,ca]中有报道。然而,污染病毒是在昆虫细胞中借助基于杆状病毒表达系统来生成aav载体的过程中所产生的,其衍生自所述杆状病毒(baculoviridae),因此是杆状的,长度为约260nm,直径为约20nm。因为(重组的)aav是基本为球形的,直径为约18-26nm,因此所述杆状病毒部分地(在两个维度中)具有与所述靶病毒相似的大小。
监管要求,例如由欧洲药品管理局(europeanmedicineagency,ema)对衍生自人或动物来源的细胞系的生物技术产品进行的病毒安全评价(ichq5a(r1)),要求生物制药的纯化过程能够去除任何非产品的病毒。去除病毒污染物是通过“病毒清除”或“病毒去除”工艺步骤来进行的,通常通过色谱和/或病毒过滤实现。同样,“病毒灭活”工艺步骤用于减弱潜在的由非产物病毒引起的致病效应。这通常含有极端的物理条件(例如ph、温度)和/或化学条件(例如去污剂、溶剂)。药物产品通常为小于约200kda的蛋白质,并且“病毒去除”方法很完善。然而,相对新型的产品涉及包含大小为几千kda的病毒的基因治疗产品,对于该产品“病毒去除”方法还未有据可查。具体地,其中药物产品是球形病毒而病毒污染物是杆状病毒的“病毒去除”方法尚未有记载。
因此,本领域需要另外的分离/纯化方法,以工业规模应用所述方法在技术上和经济上是可行的,并且所述方法能够从含有aav的样品(优选获得自基于杆状病毒的表达系统的重组aav样品)中部分或完全去除基于病毒的表达系统中的非产物病毒。从而降低非产物病毒的潜在致病性和/或免疫原性。具体地,本领域需要另外的分离/纯化方法,其中所述非产物病毒的形状为杆状,其长度是aav直径的几倍,而直径与所述aav相似。
技术实现要素:
发明的简要说明
在第一方面,本发明涉及将细小病毒病毒体群与杆状病毒病毒体群分离的方法,其中所述方法包括在过滤器上过滤包含细小病毒和杆状病毒病毒体的群的样品的步骤,只有所述细小病毒病毒体可以通过所述过滤器。优选地,所述过滤器的额定孔径为30-70nm,更优选30-40nm,又更优选32-38nm,最优选(约)35nm。在优选的实施方案中,所述细小病毒为腺伴随病毒,更优选所述杆状病毒为苜蓿银纹夜蛾多衣壳核型多角体病毒(autographacalifornicamulticapsidnucleopolyhedrovirus,acmnpv)。
在优选的实施方案中,在样品过滤过程中使用的过滤器是病毒过滤器或超滤器。优选地,所述过滤器为表面式过滤器(surfacefilter)和/或深度式过滤器(depthfilter)。本发明的方法中使用的过滤器优选包含选自如下的材料:铜铵再生纤维素、聚偏二氟乙烯、聚砜(例如聚醚砜,例如修饰的或未修饰的聚醚砜)、聚四氟乙烯、聚丙烯、修饰的或未修饰的聚醚砜、乙酸纤维素、硝酸纤维素、聚酰胺或再生纤维素。在特别优选的实施方案中,本发明的方法中使用的过滤器包含铜铵再生纤维素,优选铜铵再生纤维素中空纤维,更优选其中所述过滤器是planovatm35膜(asahikasei;www.planovafilters.com)。在另一优选的实施方案中,本发明的方法中使用的过滤器为ultiportmvf级dv50病毒去除过滤器(pallcorp.;www.pall.com)。
在本发明方法的实施方案中,使用两个或多个过滤器过滤所述样品。
在本发明的方法中,所述样品可在过滤步骤之前使用选自如下的方法进行预纯化:密度梯度、预过滤、色谱步骤(优选亲和色谱和/或离子交换色谱),以及这些方法的结合。优选利用孔径为70-200nm的过滤器来实现预过滤。优选地,要对其实施本发明的方法的样品的ph为6-10,优选7-9,更优选7.5-8.5,最优选约8。在本发明的实施方案中,每1cm2的病毒过滤器表面可过滤1-200ml的样品,优选每1cm2过滤80-120ml。
本发明的方法优选导致洗脱至少85%的所述细小病毒,并使所述杆状病毒减少至少5log,即10*105。
定义
本文使用的术语“病毒”或“多种病毒”不仅包括天然存在的病毒或者已经被遗传操作改变的病毒即所谓的重组病毒,还包括病毒颗粒即感染性的和非感染性的病毒、病毒样颗粒(“vlp”)例如wo96/11272中的乳头瘤病毒(papillomavirus)样颗粒,和含有核酸但也可以是空的的衣壳,以及其部分,具体是一个或多个优选若干个亚单位或壳粒,尤其是当若干个壳粒连接或结合使得它们组成所述衣壳的至少约50%、优选至少80%、尤其约90%时。具体地,从所述混合物除去的病毒具有基本上非球状的杆状结构,而作为所述药物产品的病毒基本上具有球状优选二十面体的形状。可进一步地理解,术语“病毒”可指该病毒的病毒体群,优选所述病毒的同种群。因此,术语“细小病毒”可指细小病毒体的群体,优选细小病毒体的同质群。因此,术语“细小病毒”可指细胞病毒病毒体的群,优选细小病毒的同质群。
细小病毒科的病毒是小dna动物病毒。细小病毒科可被分为两个亚科:感染脊椎动物的细小病毒亚科(parvovirinae)和感染昆虫的浓核病毒亚科(densovirinae)。细小病毒亚科的成员在本文中被称为细小病毒并包括依赖病毒属。正如可从其属名所推断出的,依赖病毒的成员很独特之处在于它们通常需要与辅助病毒如腺病毒或疱疹病毒共感染以进行细胞培养中的生产性感染。
依赖病毒属包括通常感染人(如血清型1、2、3a、3b、4、5和6)或灵长类(如血清型1和4)的腺伴随病毒(aav),和感染其他温血动物的相关病毒(例如,牛、狗、马和羊腺伴随病毒)。现在,可以区分在血清学上可区别的类型,所述类型至少包括aav-1、aav-2、aav-3、aav-4、aav-5、aav-6、aav-7、aav-8和aav-9。aav载体构成外面有直径为18-26nm(通常约25nm)的二十面体结构蛋白外壳的单链dna。关于细小病毒和细小病毒科的其他成员的更多信息在kennethi.berns,fieldsvirology(3ded.1996)第69章"parvoviridae:thevirusesandtheirreplication,"中有描述。为方便起见,本文将参考aav进一步例证和描述本发明。然而,应理解,本发明不限于aav,而是可同样地应用于其他细小病毒。还应理解,本发明扩展到aav嵌合病毒(含有嵌合的衣壳蛋白)和/或大小同样与野生型细小病毒大小相似(18-26nm的直径)的aav杂交病毒(或假型病毒)。在wo0028004中给出了描述和一些实例。aav嵌合病毒和/或杂交病毒的实例为例如aav2/1、aav2/3、aav2/4、aav2/5、aav2/5.2、aav2/6、aav2/7、aav2/8和aav2/9。
aav基因组由编码所述病毒复制所需的蛋白的rep基因和编码所述病毒结构蛋白的cap基因组成。例如,当制备腺伴随载体时,一个或多个复制所需的rep基因(例如rep40、rep52、rep68和/或rep78)或衣壳结构所需的cap基因(例如vp-1、vp-2和/或vp-3)在所述病毒中可用转基因代替。需要仍存在于5’和3’末端的itr区域作为顺式作用元件,用于将所述转基因包装到感染性的重组aav颗粒中,以及用于复制所述重组aav基因组的dna(kotin,r.m.(1994)humgenether.5(7):793-801)。本文中的“重组细小病毒或aav载体”(或“raav载体”)是指包含一个或多个侧翼有细小病毒或aav末端反向重复序列(itr)的目的多核苷酸序列、目的基因或“转基因”的载体。当这种raav载体在表达aavrep和cap基因产物(即aavrep和cap蛋白)的昆虫宿主细胞中存在时,它们可以被复制并包装到感染性的病毒颗粒中。当raav载体被纳入到更大的核酸构建体(例如在染色体或另一用于克隆或转染的载体例如质粒或杆状病毒)中时,那么raav载体通常被称为“前载体(pro-vector)”,其可在存在aav包装功能和必要辅助功能的情况下通过复制和壳体化被“拯救”。
本文使用的“昆虫细胞”是指使重组细小病毒(raav)载体能够复制并且可在培养中维持的昆虫细胞。例如,使用的细胞系可来自草地贪夜蛾(spodopterafrugiperda)、果蝇细胞系或蚊子细胞系,例如白纹伊蚊(aedesalbopictus)衍生细胞系。优选的昆虫细胞或细胞系是来自易被杆状病毒感染的昆虫物种的细胞,包括例如se301、seizd2109、seucr1、sf9、sf900+、sf21、bti-tn-5b1-4、mg-1、tn368、hzam1、ha2302、hz2e5、highfive(invitrogen,ca,usa)和
具体实施方式
可以使用基于杆状病毒的表达系统在昆虫细胞中产生重组raav,在所述表达系统中,用三种带有aav载体以及rep和cap功能的重组杆状病毒感染所述昆虫细胞。当培养所述感染的昆虫细胞时,所述aav非结构蛋白基因和所述aav结构蛋白基因被表达,所述转基因dna被复制,并且所述重组aav颗粒(raav颗粒)被包装和组装。所述raav颗粒含有一种或多种在两个末端的侧翼有itr区域的单链dna形式的目的基因产物(转基因)。同时,所述重组杆状病毒在这些细胞中复制,该复制过程通常在几天后所述被感染的细胞裂解和死亡时结束。所得的病毒(杆状病毒和raav颗粒)或者部分地释放到细胞培养上清物中,不然就保留在所述裂解的细胞中。由于这一原因,通常使用本领域技术人员已知的细胞破碎方法将所述细胞破碎,例如交替冻融或借助于酶法水解(例如用胰蛋白酶),目的是实现基本上完全释放所述病毒,或者通过洗涤剂裂解。
与使用基于病毒的表达系统例如基于杆状病毒的表达系统或使用辅助病毒系统制备病毒载体相关的明显缺点是形成产物病毒颗粒和非产物病毒的混合群,该混合群必须进行进一步的纯化。为方便起见,本文使用的词“辅助病毒”是指在aav的产生中使用的“真正的”辅助病毒例如腺病毒或疱疹病毒,或者是指杆状病毒,即使尚不清楚所述杆状病毒是否确实提供辅助功能或只是在所述昆虫细胞中递送所述aav基因。由于杆状病毒的潜在致病性或免疫原性,因此当在基因治疗中使用病毒载体时,应该避免有杆状病毒污染。
因此,本发明提供了一种分离/纯化的方法,所述方法适用于例如获得经监管部门批准的细小病毒产物,以工业规模应用所述方法在技术上和经济上是可行的,并且所述方法能够展示出包含杆状外形的病毒颗粒和基本为球形的病毒颗粒的病毒样品中的杆状病毒的减少(优选耗尽),尤其是当所述杆状病毒颗粒与所述细小病毒颗粒具有相似的直径(即所述杆状病毒颗粒在两个维度上相似,但在第三个维度上不相似并且必须更大)时,使得能够降低所述辅助病毒的潜在致病性和/或免疫原性。本领域技术人员应理解,通过过滤技术使非产物病毒和产物病毒的混合物(两种病毒在两个维度上具有相似的大小)分离(优选高水平地分离),是具有挑战性的并且是不太可能的。
因此,在第一个方面,本发明涉及一种将样品中的两种病毒体群分离的方法,优选其中一种病毒体群包含形状基本为球形的病毒体,另一种病毒体群包含形状为杆状的病毒体,所述方法包括将包含两种病毒体群的样品在只有所述形状基本为球形的病毒体能通过的过滤器上过滤的步骤。优选地,所述形状为杆状的病毒的纵横比为至少4:1。还优选所述形状为杆状的病毒的直径与所述基本球状的病毒的直径相差不多于12nm。优选所述基本为球形的病毒是细小病毒,所述形状为杆状的病毒是杆状病毒。特别地,本发明涉及一种用于将细小病毒病毒体群与杆状病毒病毒体群分离的方法,其中所述方法包括将包含细小病毒病毒体群和杆状病毒病毒体群的样品在只有所述细小病毒病毒体能通过的过滤器上过滤的步骤。
本文中使用的术语“分离”不暗示将待分离的两种颗粒从所述样品中回收。本文中使用的术语“分离”是指将杆状外形的病毒颗粒从所述样品中部分或完全除去,从而减少基本为球形的病毒颗粒的样品中杆状外形病毒的污染。因此,分离可理解为意指纯化所述样品中的基本为球形的病毒颗粒。在杆状病毒和细小病毒的情形中,可以说本文中使用的术语“分离”是指从所述样品部分或完全除去所述杆状病毒,从而减少包含细小病毒的样品中所述杆状病毒的污染。在该情形中,分离意指纯化所述样品中的细小病毒。
过滤是物理操作,其用于通过引入介质将例如固体与大小不同的固体或与流体分离,所述介质只有尺寸小于给定的尺寸限制的固体或只有流体能够通过。样品中过大的固体保留在进料中。流体,包括已经通过过滤器的固体,可被称为滤出物或渗透物。
应用于本发明的“病毒除去”方法是通过“过滤”来实施的,也被称为“病毒过滤”。“病毒过滤”应理解为借助于过滤器例如病毒过滤器或超滤器将药物产品与病毒污染物分离。应理解,所述药物产品本身也可为病毒,例如病毒(基因治疗)载体。
病毒过滤是其中使用纳米级额定孔径的膜的过滤技术。病毒过滤器和超滤器通常包含额定孔径的范围为30纳米-1微米或截留分子量(mwco)范围为10000-750000道尔顿,优选范围为10000-500000道尔顿,更优选范围为10000-100000道尔顿的膜。过滤器的类型分类取决于膜结构、材料和供应商。用途的类型也可确定所述分类。可以在正切流动过滤(tff)型式(也称为交叉流过滤;在再循环过程中包含样品的进料流体与过滤器平行,并且只有一部分所述包含样品的进料流体用于渗透物产生,最大部分的所述进料流体会离开所述模块而不穿过所述过滤器)中使用超滤器,或者使用所述超滤器作为死端过滤器(deadendfilter)(样品全部通过所述过滤器)。术语是本领域技术人员非常熟知的。
病毒过滤通常在膜上方使用压力差:跨膜压(跨膜压降)为0.02-0.8mpa、优选0.02-0.1mpa。压力差可由施加给样品的流速(即通过泵)产生。当在tff型式中操作过滤器时,还可通过如下方法给样品加压:在膜前通过压缩渗余物管线(line)或者在膜后(即在渗透物中)通过使用泵。这些操作可被本领域技术人员很容易地确定。
在本发明的一个优选的实施方案中,形状基本为球形的病毒体群是二十面体对称并且直径约为18-25nm的病毒体。因此,在本发明的一个优选的实施方案中,形状基本为球形的病毒体的群是细小病毒优选腺伴随病毒的群。
形状的“纵横比”是其较长的维与其较短的维的比值。因此,对于对称的物体,其可仅用2个测量值来描述,例如杆的长度和直径。作为替代或者与本发明的任何其他实施方案结合,在本发明的优选实施方案中,形状为杆状的病毒的纵横比为至少4:1、优选至少5:1、更优选至少6:1、至少7:1、至少8:1、至少9:1、至少10:1、至少11:1、至少12:1或约13:1。在使用本发明的方法分离的杆状外形的病毒体(例如杆状病毒)的群中,优选所述病毒体的直径为18-30nm,更优选20-27nm、更优选20-25nm、更优选20-23nm,长度为70nm-300nm、优选80nm-280nm、90nm-260nm、100nm-260nm、120nm-260nm、140nm-260nm、160nm-260nm、180nm-260nm、200nm-260nm、220nm-260nm、240nm-260nm。更优选地,所述病毒体的直径为20-23nm,长度为180-280nm,尤其直径为约20nm,长度为约120-260nm。
本发明的杆状外形病毒体的群优选为属于杆状病毒科的病毒体群。杆状病毒科名称的提出是由于它们的病毒体是杆状的,该名称衍生自拉丁文baculum=手杖、拐杖、探杆。研究得最透彻的杆状病毒是苜蓿银纹夜蛾单核型多角体病毒(acmnpv),其形状不对称,直径为大约20至120-260nm(即,在两个维度上为约20nm,在第三个维度上为约120-260nm,或替代地并且更优选地表达为:直径为约20nm,长度为约120-260nm)。被分类为杆状病毒科的属的病毒为α杆状病毒(alphabaculoviruses)、β杆状病毒(betabaculoviruses)、δ杆状病毒(deltabaculoviruses)和γ杆状病毒(gammabaculoviruses),它们的成员各自是鳞翅目昆虫npv(lepidopterannpv)、ledidopterangv、膜翅目昆虫npv(hymenopterannpv)和双翅目昆虫npv(dipterannpv)。因为一些杆状病毒已经被确定具有不同的基因组长度,这表明了,作为对在80kb-160kb之间变化的基因组长度的响应,衣壳长度可以是灵活的。可使用本发明的方法从如本文别处所定义的细小病毒病毒体群分离的杆状细菌的实例在表1中提供(基于g.f.rohrmann的baculovirusmolecularbiology;第二版;2011年1月26日;第1章:"introductiontothebaculovirusesandtheirtaxonomy")。
表1.选择的杆状病毒的基因组大小和预测的orf含量*
*选自超过40个基因组序列(2008);**括号中的数字指示该类别中基因组的总数;组1:两个主要的鳞翅目昆虫npv谱系之一;通过使用不同的包膜融合蛋白gp64将它与其他杆状病毒区分开。几个其他的基因也是该谱系所特有的;组2:两个主要的鳞翅目昆虫npv谱系之一;认为成员使用融合蛋白(f)来起始感染;gv:颗粒体病毒(granulosisviruses):对鳞翅目有致病性的杆状病毒谱系,其通常每个卵形的包含体(occlusionbody)具有单个病毒体;npv:核型多角体病毒:分布最广泛的杆状病毒类型。npv在核中复制并且通常产生含有多于一个的病毒体的多角体形包含体。
在本发明的优选的实施方案中,杆状病毒病毒体群是苜蓿银纹夜蛾多衣壳核型多角体病毒(acmnpv)群。在aav生成系统中,苜蓿银纹夜蛾多核型多角体病毒(acmnpv)是上选的杆状病毒类型。acmnpv是研究最多的杆状病毒。所述病毒最初分离自苜蓿环纹夜蛾(alfalfalooper)(鳞翅目昆虫),含有具有154个开放阅读框的134kbp基因组。主要的衣壳蛋白vp39与一些较小的蛋白一起形成杆状的核衣壳(21nm×260nm),所述核衣壳用p6.9蛋白围住所述dna。在所述杆状病毒介导的aav生成方法中,目前筛选的用于aav复制的基因中的7个似乎与杆状病毒复制相关(lef-1、lef-2、lef-11、dna-pol、lef-3、lef-7和dbp),3个已经被描述为是编码反式激活因子(p35、ie-1、ie-2)。
在本发明的优选实施方案中,所述杆状外形的病毒体的直径与所述基本为球状的病毒体的直径尺寸相差小于12nm,优选小于11、10、9、8、7、6、5nm,因此所述球状病毒体优选具有所述两种病毒中较大的直径。因此,例如,在其中将细小病毒病毒体群(优选腺伴随病毒)与杆状病毒病毒体群分离的本发明的优选实施方案中,因为细小病毒(例如aav)和杆状病毒(在两个维度中)相差小于5nm,所以所述两种病毒体类型的大小部分相似。
在本发明中使用的过滤器是具有额定孔径的膜,所述孔径优选为形状为杆状的病毒的直径(即,杆状形状病毒的较短维度的直径,而不是长度)的1.2-3.3倍。被不同过滤器制造商所使用的术语“孔径”、“去除率”、“有效尺寸”、“额定孔径”或“使得能够除去具有具体最小尺寸的颗粒的孔径”对于本发明的目的而言是等价的术语,在本文中可以互换使用。
优选地,所述膜的孔径为所述形状为杆状的病毒的直径的至少1.3、1.4、1.5倍,但小于所述形状为杆状的病毒的直径的3.2、3.1、3.0、2.9、2.7、2.5、2.3、2.1、1.9、1.8倍。更优选地,所述膜的孔径为所述形状为杆状的病毒的直径的1.6-1.7倍。在优选的实施方案中,本发明的方法中使用的过滤器的孔径为30-70nm,更优选30-60nm,更优选30-50nm,更优选30-40nm,更优选32-38nm,更优选34-36nm,最优选35nm。例如,孔径为35nm的病毒过滤器的实例例如是asahi-kasaiplanova35n膜(www.planovafilters.com)。在另一优选的实施方案中,在本发明的方法中使用的过滤器为ultiportmvf级dv50病毒去除过滤器(pallcorp.;www.pall.com)。
在优选的实施方案中,在本发明中使用的过滤器是病毒过滤器或超滤器。病毒过滤器通常是其中的孔尺寸为纳米级的过滤器。优选地,病毒过滤器是其中的孔尺寸为纳米级并且纤维中有不对称孔的过滤器,所述不对称孔捕获具有一定大小的颗粒,并使较小的颗粒通过。可在本发明中采用的病毒过滤器的实例为所述35nplanova膜。超滤器的实例为pellicon2或pellicon3(millipore)、sartocon(sartorius)和centracette(pall)。
在本发明的优选的实施方案中,所述过滤器,例如35nplanova过滤器,采用表面或深度机制或所述二者的结合,用于辨别具有不同形态的病毒。表面式过滤基于孔径,并涉及在过滤过程中直径比孔直径更大的颗粒在所述过滤器的“流入”侧的表面上滞留,并形成“块状物”。相比之下,在深度式过滤中,颗粒被困在过滤介质中,这是由各个纤维层的组成造成的:通常在流入侧所述层由粗的纤维组成,在流出侧所述层由细纤维组成。深度式过滤器是过滤器的变体,其使用多孔过滤介质来留住整个所述介质的颗粒,而不是仅在所述介质的表面留住颗粒。通常当待过滤的流体含有高负载的颗粒时使用这些过滤器,因为相对于其他类型的过滤器,它们可以在变得被阻塞之前留住大量颗粒。
值得注意的是,“滤膜”应理解为意指在所有过滤器中进行筛分的实际过滤材料。有利地,使用的滤膜优选由再生纤维素组成,例如铜铵再生纤维素,例如优选铜氨再生纤维素中空纤维,而其他适合的材料是聚偏二氟乙烯、聚四氟乙烯、聚丙烯、修饰的或未修饰的聚醚砜、乙酸纤维素、硝酸纤维素或聚酰胺。孔径能够去除大小约40-400nm的颗粒的这类膜的实例为来自pallgmbh,63303dreieic的额定孔径为约50nm或20nm的ultiporvf膜,来自日本东京asahichemicalindustryltd的额定孔径为约15、19、35或72nm的asahichemical'sbemberg微孔膜,或者来自其他制造商即sartoriusag,37075gottingenorschleicherandschuellgmbh,37582dassel的相应的膜。在本发明的优选的实施方案中,所述过滤器包含铜铵再生纤维素、聚偏二氟乙烯、聚砜、聚四氟乙烯、聚丙烯、修饰的或未修饰的聚醚砜、乙酸纤维素、硝酸纤维素、聚酰胺或再生纤维素,优选其中所述过滤器含有铜铵再生纤维素中空纤维或聚偏二氟乙烯。
本发明的方法特别适用于将细小病毒病毒体群从杆状病毒病毒体群中纯化出来。事实上,孔径为35nm的病毒过滤器例如asahi-kasaiplanova35n膜,在本发明的将raav颗粒和杆状病毒分离的方法中特别有优势。特别是,这些过滤器不仅可实现从所述混合的群中基本上定量地去除至少5log10的传染性杆状病毒,而且还可得到高产率(约>90%)的raav颗粒。
杆状形状的病毒的滴度降低(即,待去除的病毒的滴度降低的因子)优选为至少5log,例如,依据本发明的方法将raav病毒体和10×105个杆状病毒体的混合群分离后,然后在滤出物中检测不到杆状病毒体。优选地,通过本发明的方法实现的杆状形状病毒的滴度降低为至少5.5log、至少6log、至少6.5log、至少7log、至少8log、至少9log、最优选至少10log。所述滴度可以通过本领域已知的一般方法,例如通过组织培养感染剂量50%(tcid50)测定来确定。例如,样品中杆状病毒病毒体群的传染性杆状病毒滴度可使用tcid50测定来确定。该方法基于用阳性对照样品中的传染性的杆状病毒感染单层sf9昆虫细胞。使用所述阳性对照样品的培养基的连续稀释物感染所述细胞。将所述细胞在+28℃下孵育7天。随后,将上清物转移到具有单层sf9昆虫细胞的新制备平板中,并在+28℃下孵育7天。随着感染的进行,所述感染的细胞不能保持相互之间的附着和与平板表面的附着,从而形成可用显微镜观察的松散的细胞,即显示出细胞致病效应(cpe)。使用
优选地,使用本发明的方法,形状基本为球形的病毒体群的至少60%、65%、70%、75%、80%、85%、87%、90%、93%、95%、97%、99%被回收。因此,优选地形状基本为球形的病毒体群的至少60%、65%、70%、75%、80%、85%、87%、90%、93%、95%、97%、99%在流出物(或渗透物)中被回收。
在本发明的优选的实施方案中,通过两个或多个过滤器过滤所述样品。
包含待分离的病毒体群的样品通常为来自基于病毒的表达系统的培养上清物(例如培养基)(例如来自用来产生所述aav病毒体的昆虫细胞培养)、来自用来产生aav病毒体的基于病毒的表达系统的昆虫细胞、或培养上清物和昆虫细胞的结合物。优选地,将所述样品进行冻融循环,然后在本发明的方法中使用。更优选地,将所述样品进行预纯化,然后在本发明的方法中使用。这可以增加形状基本为球形的病毒体群(例如所述细小病毒体,优选aav)的过滤产率,并且还被认为对于过滤器的寿命是有利的。因此,在优选的实施方案中,所述样品不含有细胞污染物。
因此,在优选的实施方案中,所述方法包括对包含病毒体群的样品进行预纯化,例如借助于离心、一个或多个密度梯度、预过滤和/或色谱。优选地,在所述样品为例如raav培养物的上清物的情形下,对所述样品进行预纯化,例如通过预过滤以去除较大的颗粒并且其中所述杆状病毒和所述raav颗粒保留在滤出物中。有利地,实施如下文更加详细地描述的预过滤,然后再进行上文所述的病毒体群的实际分离。在优选的实施方案中,使用选自如下的方法对所述样品进行预纯化:密度梯度、预过滤、色谱步骤(优选亲和色谱和/或离子交换色谱)以及这些方法的结合。这类纯化方法的实例包括brumentet.al.,2002moleculartherapy,kaluduvet.al.,2002humangenetherapy、potteret.al.,2002methodsinenzymologyandcecchiniet.al.,2010humangenetherapy。优选地,预纯化包括密度梯度以及一个或多个预过滤和/或离心步骤。优选地,预纯化包括一个或多个预过滤与一个或多个色谱步骤相结合。
优先选择使用一个或多个膜过滤器对所述样品进行预纯化,所述膜过滤器使得待分离的病毒体群能够通过,而留下较大的杂质。通常,所述预纯化防止本发明方法中使用的过滤器阻塞,或致使过滤器更难以阻塞,所述过滤器用于进行杆状形状的病毒体与基本球状的病毒体的群的后续分离。在对所述样品进行本发明的方法之前未去除或未充分去除所述样品中病毒培养物的组分,可导致在病毒体群的分离过程中发生所述过滤器的阻塞。在低速下离心可能不足以充分去除这类组分,因此优选对所述样品进行进一步的预纯化以使所述过滤器的阻塞降到最低。
优选地,通过预过滤来实施预纯化。用于预纯化本发明的方法所要处理的包含aav和杆状病毒的样品的膜过滤器的孔径为70-200nm,更优选80-180nm,90-150nm,100-130nm。例如,孔径为约100nm的膜过滤器(例如ultiporn66过滤器(pallgmbh,63303dreieich))特别好地适用于对raav颗粒和杆状病毒的混合群进行预纯化。因此,在优选的实施方案中,借助于孔径为70-200nm的过滤器实现预过滤。
用于预纯化的适当方法和装置取决于待在本发明的方法中使用的用于如上文所述的分离细小病毒和杆状病毒病毒体的群的过滤器,并可以被本领域技术人员测试。预纯化后的条件必须使得1)所述过滤器保持完整,2)所述细小病毒稳定,3)所述盐浓度接近生理状态以及4)所述过滤器上的压降未大到导致所述细小病毒(例如aav)“裂解”从而不再有功能。
在另一优选的实施方案中,所述样品的ph为6-10,优选7-9,更优选7.5-8.5,尤其约8.0。如果需要的话,用适当的缓冲物(例如tris/hcl缓冲物(三(羟甲基)氨基-甲烷)将所述样品调整至上文指定的ph。所述样品的ph优选为约8.0,因为该ph使过滤后获得较好的aav产率。
在本发明的优选的实施方案中,所述样品的ph为6-8.5(基本为生理的),以确保所述aav是稳定的。ph在该范围内的缓冲物优选还应该具有适用于所述具体细小病毒的导电性。通常,所需导电性取决于aav的血清型和转基因。本领域技术人员能够根据具体情况确定适当的缓冲物。通常,背景导电性应与生理导电性相当,即137mmnacl。适当的缓冲溶物的实例为mes、氨基丁三醇(trizma)、bis-tris、hepes、pbs和双三羟基甲氨基丙烷(bis-trispropane)。
在优选的实施方案中,每1cm2的过滤器表面过滤至少0.5ml的样品,优选每1cm2过滤1-100ml。然而,这高度取决于待分离的样品中病毒的纯度和浓度,并且在大多数事件中,因为在下游过程的最后应用过滤,所以每1cm2可过滤多于1l。替代地或与任何其他优选的实施方案结合,在本发明的优选的实施方案中,每1cm2的过滤器表面过滤至少1-10ml、优选1-5ml、尤其约1.5ml的所述样品。例如,一般而言,这实现了raav颗粒的高产率,同时实现了所述杆状病毒的去除。
因此,本发明提供了一种方法,所述方法以简单并且价廉的方式将形式基本为球形的病毒体群与形状为杆状的病毒体群分离/纯化,并且所述方法可以以工业规模应用。本发明的方法可以在特别温和的条件下应用,并且导致形状基本为球状的病毒体的高产率,而从滤出物中减少或甚至消除形状为杆状的病毒体。本发明的另一益处是已经依照本发明纯化的病毒体可例如被直接应用为病毒载体用于基因治疗,因为它们充分地去除了其他病毒例如杆状细菌。虽然杆状病毒dna的小残余片段可能残留在滤出物中,但是其与能够复制的杆状病毒不相关,而是与所述raav中共组装的dna相关,因此这不代表传染性的杆状病毒。
在优选的实施方案中,本发明的方法减少了杆状病毒组分例如游离的杆状病毒蛋白和亚病毒颗粒。这是特别有利的,因为当所述病毒载体在患者中用于进行基因治疗时,这些组分能够诱导非特异性免疫应答。
替代地或与上述实施方案结合,本发明的一个实施方案是本发明的方法可适用于分离多于两种的不同病毒体群(例如当使用应用多于一种的不同杆状病毒载体从而产生多种类型的杆状病毒病毒体的杆状病毒表达系统时)。如上所述的本发明的方法可以用于从所述细小病毒病毒体群中分离所述杆状病毒群。因此,本发明还涉及一种将样品中的至少两种病毒体群分离的方法,优选其中一种或多种病毒体群包含形状基本为球形的病毒体和一种或多种形状为杆状的其他病毒体群,所述方法包括在过滤器上过滤包含所述病毒体群的样品,只有形状基本为球形的病毒体可以通过所述过滤器。
在本文件及其权利要求书中,动词“包含”及其词形变化是用其非限制性含义,意指包括该词之后的项目,但并不排除未专门提到的项目。另外,不定冠词“a”或“an”提及的要素不排除存在多于一个该要素的可能性,除非上下文明确地要求有一个且只有一个该要素。因此不定冠词“a”或“an”通常意指“至少一个”。
在本说明书中引用的所有专利和文献参考全文以引用的方式纳入本文。
提供以下实施例仅用于说明性的目的,并且不意欲以任何方式限制本发明的范围。
附图说明
图1:在病毒过滤过程中gc和tp的回收率。
该图示出了所述滤出物(包括对样本体积作了校正)、使用膜后洗液和上述等分部分的合并物的回收率,其以基因组拷贝和总颗粒输入的%表示。
图2:病毒过滤过程中杆状病毒减少
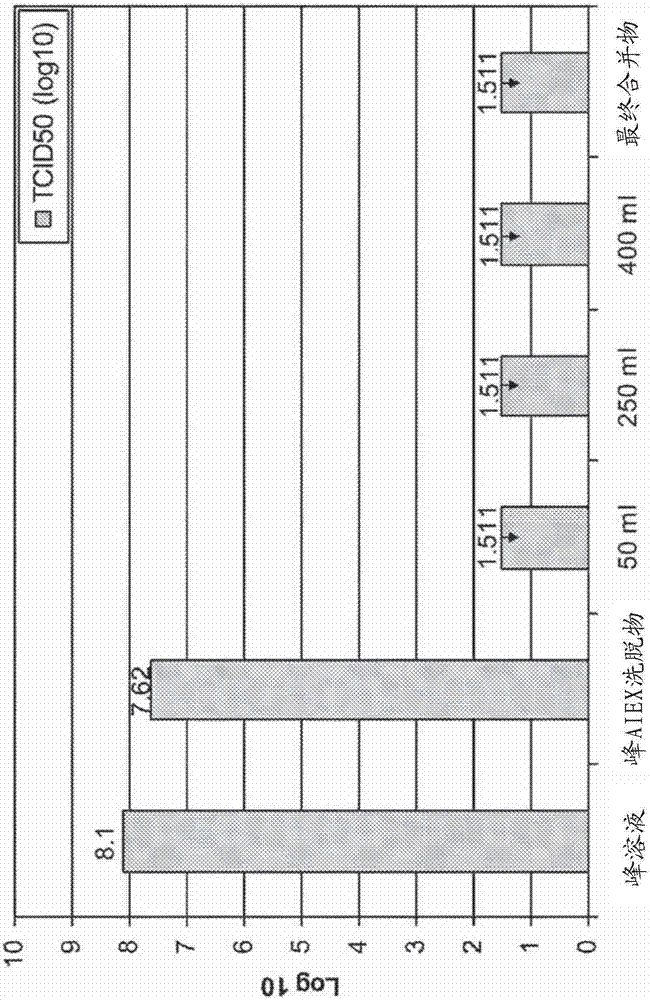
该图示出了通过tcid50测量的所述杆状病毒峰材料、所述病毒过滤器进料(峰aiex洗脱物)、作为过滤体积(xml)的函数的纳米滤出物以及病毒过滤器滤出物与病毒过滤器洗液的最终合并物的杆状病毒滴度。因为所述测定恢复到没有很好的杆状病毒阳性结果,所以所述滤出物和最终合并物是最大可能滴度。
实施例
实施例1
用如urabeetal.,2002(hum.genether13(16):1935-1943)之前所描述的三种重组杆状病毒感染昆虫细胞后,产生了腺伴随病毒载体(aav)。
感染后三天,将所述细胞培养物用洗涤剂裂解,随后通过加入9u/ml的benzonase(merck)进行核酸酶处理,然后在制造商的推荐下进行孵育。
随后通过使用串联的pall
将如urabeetal.(2002;上文)之前所述制造的10%v/v的杆状病毒峰(spike)在1900g下离心15分钟使其变澄清并过滤通过0.2μm的瓶盖式过滤器(bottletopfilter)(corning),然后将其加入到该中和的洗出物中,以提供杆状病毒和aav的混合群,用于向病毒过滤器进料。在使用之前,依据制造商的推荐准备planova35n过滤器。简单地说,去除贮存液,并通过加入40mlph8.0的60mmtris/hcl清除全部空气,然后依据制造商的推荐进行冲洗程序。
如制造商所推荐的(见表2),使用蠕动泵将进入病毒过滤器的进料流速设置为5ml/min。在病毒过滤过程中,监测进料压力和渗透物流(见表2)。
表2:病毒过滤性能
将50、250和400ml滤出物后收集的样品经使用sf9细胞系对传染性的杆状病毒进行tcid50测定来进行杆状病毒滴定。结果以tcid50给出:50%组织培养感染剂量,其指示了在50%的接种的组织培养sf9细胞中产生细胞致病效应所需的病毒量。
从滤出物中取出大约1ml的样品;将所述样品在genomecopies(此后称为gc)上分析aav中的目的基因和aav的总颗粒(totalparticle,此后称为tp),以监测与它们相关的回收率。如下文所述进行gc和tp分析。
为了确定样品的基因组拷贝浓度,制备了测试样品的10倍连续稀释物和合格的工作标准物,通过dna酶消化除去额外的dna,通过蛋白酶k消化将壳体化的dna释放。然后,使用magnesil
使用凝胶过滤色谱确定aav颗粒(含有适当基因组的实心颗粒(载体颗粒)以及空心颗粒)的总数。使用biobasicsec-1000(thermoelectroncorporation)在25℃下用d-pbs的水相以1ml/min的流速进行凝胶过滤hplc。用在214nm下的uv吸光度监测洗脱。使用每ml具有已知量的aav颗粒的合格工作标准物的校正曲线对测试样品的峰面积进行定量。
根据制造商的说明书,使用10mlph8.0的60mmtris/hcl洗涤planova35n过滤器。将洗液与所述滤出物合并,并取样用于经tcid50测定的杆状病毒传染性滴度。在将洗液与滤出物材料混合前,对所述洗液取样,用于以后的gc和tp滴度测定。人工混合滤出物和洗液的合并物以确保同质,并取样用于以后的gc和tp滴度测定。根据tp和gc滴度计算回收率,并在图1中显示。
使用组织培养感染剂量50%(tcid50)测定来确定样品的传染性杆状病毒滴度。该方法基于用测试样品中的传染性杆状病毒感染单层sf9昆虫细胞。使用所述测试样品的培养基的3倍连续稀释物来感染所述细胞,一式八份。将平板+28℃下孵育7天。随后,将上清物转移至新制备的平板,并在+28℃下孵育7天。随着感染的进行,所述感染的细胞不能保持相互之间的附着和与平板表面的附着,并形成可用显微镜观察的松散细胞,即显示出细胞致病效应(cpe)。使用
结果
杆状病毒滴度的结果在图2中。
所述峰溶液的传染性杆状病毒的滴度为8.1log10tcid50/ml。将所述峰溶液以10%加入所述峰aiex洗脱物,传染性杆状病毒的滴度为7.62log10tcid50/ml。纳米滤出物的tcid50值下降了至少6log,达到低于1.511log10tcid50/ml,这是该具体测定的定量水平。因此,纳米过滤使得杆状病毒下降了至少6log,因此对于辨别在两个维度上尺寸相当的两种病毒而言,纳米过滤是可行的单元操作。
- 还没有人留言评论。精彩留言会获得点赞!