一种浓度梯度rhIL‑2依赖的iNKT细胞扩增方法及其应用与流程
本发明属于肿瘤细胞免疫治疗领域,更具体地,本发明涉及具有肿瘤杀伤效应的th1样inkt细胞快速大量扩增的方法和应用。
背景技术:
恒定自然杀伤t(invariantnaturekillert,inkt)细胞是一类天然存在的介导先天性免疫和获得性免疫的免疫细胞,是t淋巴细胞中独特的亚群,具有类nk(naturekiller)细胞样对刺激迅速产生细胞因子和趋化因子来调节免疫反应的天然免疫功能,也通过t细胞受体(tcr)对抗原产生特异性的反应。不同于传统t淋巴细胞的tcr,inkt细胞具有高度保守的tcrα链,人类的tcrα链由vα24-jα28部分组成,可与多种糖脂类抗原反应。此外,不同于传统的t细胞识别抗原提呈细胞(antigenpresentingcell,apc)的i类或ii类主要组织相容性复合体分子(majorhistocompatibilitycomplex,mhciorii)提呈抗原肽,inkt细胞能特异性识别apc表面非经典mhci类分子cdld提呈的糖脂类抗原。活化后的inkt细胞分泌多种细胞因子,直接或间接参与不同的免疫应答。不同亚群或亚型的inkt细胞具有不同的免疫调节功能。
inkt细胞同时具有诱导免疫增强和免疫监控的功能。在抗原刺激下,inkt细胞可以分泌一系列细胞因子,包括:干扰素-γ(interferon-gamma,ifn-γ),白介素(il)-2,4,10,13,17,21,22以及粒-单系集落刺激因子(granulocyte-macrophagecolony-stimulatingfactor,gm-csf)和肿瘤坏死因子(tumornecrosisfactor-alpha,tnf-α)。
inkt细胞通过cd1d-tcr复合物和cd40-cd40l相互作用特异性的诱导树突状细胞(dendriticcells,dc)成熟,并分泌il-12。il-12刺激nk、nkt细胞、及其他t细胞产生更多ifn-γ。这两种细胞因子一起显著的激活了下游效应细胞群如nk细胞、cd8+t细胞和γδt细胞。inkt细胞的活化进一步促进dc上调cd70,cd80和cd86等共刺激分子的表达。而dc表达cd70是cd8+t细胞启动适应性免疫所必须的。活化的inkt细胞分泌的il-2诱导记忆性cd4+t辅助细胞增殖。cd4+t细胞在不同细胞因子的作用下分化为不同t辅助细胞亚群。inkt细胞可以分泌th1/促炎性(ifn-γ、tnf-α)或th2/抗炎性(il-4、10、13)细胞因子,这种级联增强的效应同时激发了天然免疫和获得性免疫,诱导杀伤mhc阳性的肿瘤细胞。对mhc阴性的肿瘤细胞,inkt细胞经α-galcer等糖脂抗原激活后表现出nk细胞样mhc非依赖性细胞毒活性,通过诱导表达穿孔素/颗粒酶fasl/fas或者tnf相关的凋亡诱导配体(trail)等直接杀伤。对cd1d+肿瘤细胞(如急性t淋巴细胞性白血病、单核细胞性白血病和其它血液恶性肿瘤),可以直接识别并表现有效的靶细胞杀伤效应。
肿瘤患者体内常伴有严重的inkt细胞数量减少和功能失调。由于自身表达磷酸鞘氨醇受体(s1p1r)及多种趋化因子受体(c-x-cchemokinereceptor)使inkt细胞选择性转移到肿瘤部位,导致结肠癌、头颈癌、乳腺癌、肾细胞癌、黑色素瘤和肝癌患者外周血中循环性inkt细胞数量显著减少,但细胞产生ifn-γ的能力并未损伤。尽管体内循环性inkt细胞数量减少,但是inkt细胞在体外经α-galcer刺激会迅速增殖,并且体外增殖的inkt细胞同样表现出较好的细胞毒效应杀伤肿瘤细胞。近年来多种基于人体inkt细胞免疫治疗肿瘤的方案得以发展,但临床选择性注射体外活化的inkt细胞到肿瘤病人体内,缓解率较低,免疫反应个体差异较大,抗肿瘤效果不尽理想。人类有cd4+和cd4-inkt细胞,根据细胞因子表达分为th1样inkt细胞和th2样inkt细胞。其中,th1样inkt细胞产生ifn-γ,其功能是介导直接肿瘤杀伤及在肿瘤微环境中上调免疫反应和免疫监控的功能。th1样inkt细胞的表型标志为大量表达cd8α,和非常少的cd8αβ,也存在cd4-cd8-。cd8+inkt细胞比cd4+或cd4-cd8-inkt细胞分泌更多的ifn-γ,细胞毒性也更强。由于人外周血inkt细胞中cd4+inkt细胞占比较高(~90%),传统的扩增方法对th1样inkt细胞扩增没有选择性,扩增后的inkt细胞各亚型比例不稳定,造成了回输给肿瘤病人后免疫反应个体差异较大。因此,目前技术难点主要集中在足够数量的具有肿瘤杀伤及介导免疫监控作用的功能性inkt细胞的扩增上。
传统扩增方法使用固定浓度rhil-2联合α-galcer得到的inkt细胞存在扩增时间比较长(~4周)、扩增后inkt细胞比例比较低(~20%)、生长倍数有限(平均100倍)、扩增后inkt细胞cd4+占比较高(~40%)、体内杀伤功能低下等问题,不能满足临床需求。本发明采用rhil-2浓度梯度增加的方式,使用dc提呈α-galcer,联合rhil-15,rhil-7,cd3单克隆抗体将inkt细胞由cd4+转化为cd4-。培养21天可将inkt细胞扩增10万倍,其中cd8+inkt细胞占比>50%,cd4+inkt细胞占比<10%。解决了inkt数量和纯度的问题,并选择性扩增th1样inkt细胞,能够充分满足临床治疗的需求。
技术实现要素:
本发明提供了一种浓度梯度rhil-2依赖的inkt细胞的扩增激活方法及其应用。本发明的方法针对现有inkt体外扩增培养效率较低、对th1样、th2样inkt细胞无选择性等问题,提出一种更为有效、并特异性扩增th1样inkt淋巴细胞的方法。
本发明提供的一种浓度梯度rhil-2依赖的inkt细胞扩增方法中,培养第0天,加入100ng/mlα-galcer;培养第0-11天,以梯度的方式增加rhil-2浓度。
本发明提供的优选方案为:固定间隔的时间,rhil-2浓度呈等差或等比增加;间隔的时间优选1-72小时,rhil-2浓度浓度优选10-400iu/ml。
本发明更优选的技术方案为:培养第7天加入同一供者诱导培养的成熟dc;dc在加入inkt细胞之前两小时先加入100ng/mlα-galcer进行孵育;培养第14天使用anti-inktmicrobeadshuman进行分选,分选得到的inkt细胞加入okt3单克隆抗体包被的培养瓶中培养;培养基中加入cd28抗体,rhil-15和rhil-7;okt3单克隆抗体浓度为1-5μg/ml,cd28抗体浓度为1-5μg/ml;rhil-15、rhil-7浓度为1-10ng/ml。
本发明进一步优选的技术方案如下:
(1)提取外周血单个核细胞pbmc;
(2)向步骤(1)提取的pbmc细胞中加入终浓度为100ng/mlα-galcer培养48小时;
(3)向步骤(2)培养细胞中以梯度的方式逐渐增加培养基中rhil-2浓度。
进一步地,步骤(3)中rhil-2浓度是以固定时间间隔增加的,所述固定时间间隔是1-72小时。
进一步地,所述rhil-2浓度为10-400iu/ml呈等比或等差方式增加;在培养的第11天时,rhil-2浓度增加至400iu/ml。
进一步地,培养第7天向步骤(3)细胞培养基中加入成熟树突状细胞,成熟树突状细胞与inkt细胞的数量比为1:10。
进一步地,成熟树突状细胞在加入inkt细胞之前两小时先加入100ng/mlα-galcer进行孵育。
进一步地,培养第14天使用anti-inktmicrobeadshuman进行分选,分选得到的inkt细胞加入cd3单克隆抗体包被的培养瓶中培养。
进一步地,cd3单克隆抗体浓度为1-5μg/ml,优选为2μg/ml。
进一步地,培养时加入cd28抗体,rhil-15和rhil-7;cd28抗体浓度为1-5μg/ml,优选为3μg/ml;rhil-15浓度为1-10ng/ml,优选的为5ng/ml;rhil-7浓度为1-10ng/ml,优选为5ng/ml。
所述方法在培养第21天收获inkt细胞,inkt细胞数提高10万倍,其中90%以上为cd4inkt细胞,具有上调免疫反应和杀伤肿瘤的作用。
本发明解决了现有技术中inkt细胞体外扩增培养的数量和纯度的问题,培养21天可将inkt细胞扩增10万倍,并选择性扩增th1样inkt细胞,其中cd8+inkt细胞占比>50%,cd4+inkt细胞占比<10%,能够充分满足临床治疗的需求。逐渐增加rhil-2浓度,可在培养早期选择性扩增inkt细胞,按照此方法,可在第7天将培养物中inkt细胞比例提高至6%左右,inkt细胞数提高60倍。在第7天加入α-galcer包被的成熟dc,可定向的诱导th1样inkt细胞扩增,促进cd4+inkt细胞向cd4-转化。按照此方法,可在第14天将培养物中inkt细胞比例提高至16%左右,inkt细胞数提高1000倍。培养第14天经磁珠分选得到的纯inkt细胞,根据inkt细胞具有的t细胞特性,加入cd3单克隆抗体包被的培养瓶中培养,并加入共刺激分子cd28抗体,可使纯化的inkt细胞大量扩增,加入rhil-15和rhil-7可维持th1样inkt细胞增殖。在培养第21天收获inkt细胞,inkt细胞数提高10万倍,其中90%以上为cd4-inkt细胞,具有上调免疫反应和直接杀瘤作用。本发明扩增和激活的inkt细胞扩增效率更高,选择性地扩增th1样inkt细胞,加强了体外扩增inkt细胞免疫增强和肿瘤免疫监控的功能。
附图说明
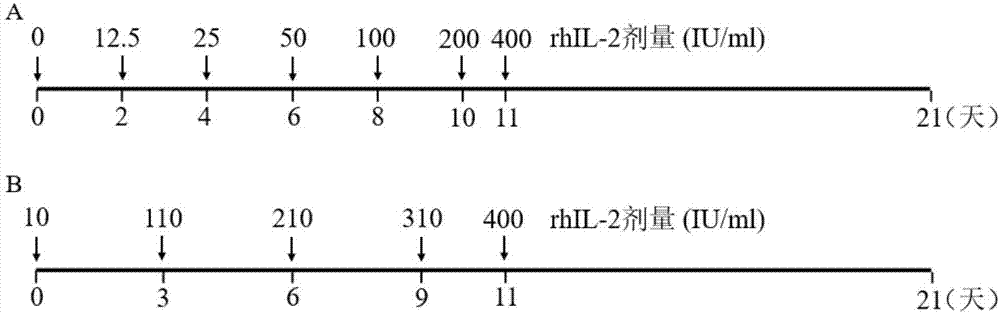
图1.rhil-2处理inkt细胞方法
图2.不同rhil-2浓度梯度法处理inkt细胞流式细胞术检测图
图3.inkt细胞体外扩增细胞数量线性图
图4.inkt细胞杀伤肿瘤细胞实验
图5.inkt细胞分泌ifn-γ能力实验
图6.inkt细胞在动物体内杀伤肝癌细胞实验
具体实施方式
下面详细描述本发明的实施例,所示实施例的示例在附图中示出。下述实施例中的实验方法,未注明具体技术或条件者,则按照常规实验条件如《atcc细胞培养手册》中所述条件,而在实施例中明确说明有试剂公司说明书时,则按照说明书所建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
本发明实施例中所用的试剂:
aimv细胞培养基,thermofisher公司
lymphoprep分离液(即用型),axis-shield公司
cd3单克隆抗体、cd28单克隆抗体,biolegend公司
il-2,il-7,il-15,peprotech公司
α-galcer,enzolifesciences公司
anti-inktmicrobeadshuman,miltenyibiotec公司
fixation/permeabilizationsolutionkitwithbdgolgiplugtm,bd公司
fitcanti-humancd3,peanti-humantcrvα24-jα18,percp/cy5.5anti-humancd8,pe/cy7anti-humancd4,fitcanti-humanifn-γ,biolegend公司
实施例1外周血单个核细胞(pbmc)提取
(1)清晨采20ml抗凝静脉血。
(2)在50ml离心管中加入15mllymphoprep分离液。
(3)抗凝静脉血中缓慢加入等体积0.9%无菌生理盐水轻柔颠倒三次,充分混匀,获得稀释后的血液。
(4)使用2ml无菌滴管将稀释后的血液缓缓加入lymphoprep分离液表层,全部移入后切勿晃动或颠倒。
(5)离心管配平,以水平离心机(水平转头)1700rpm,ace/brake:4/0,室温离心30min。
(6)吸出最上层部分多余的血浆。用2ml无菌吸管轻轻吸出淋巴细胞层,移入新的50ml离心管中,将所有管中的淋巴细胞层吸入同一个50ml离心管中。加入0.9%无菌生理盐水至50ml,充分混匀。
(7)离心管配平,以水平离心机(水平转头)1700rpm,ace/brake:9/9离心,室温离心10min。
(8)取出试管,完全弃去液体。
(9)从37℃培养箱中取出孵育的aimv培养基,取2ml将细胞沉淀充分混匀,注意轻柔操作,避免产生气泡。随后加入其余培养基,混匀细胞。
(10)将混匀的细胞悬液移入75cm2细胞培养瓶,轻轻晃动混匀,放置于37℃培养箱中培养。
实施例2inkt细胞初次扩增
(1)pbmc提取当天加入终浓度为100ng/mlα-galcer培养48小时。
(2)向培养基中逐渐增加rhil-2的浓度,从细胞分离至培养第11天,rhil-2浓度呈等比或等差方式增加。
(3)在培养的第11天,rhil-2浓度增加至400iu/ml。
由图1a所示,从细胞分离开始,每隔48小时(除第10天至第11天间隔24小时),rhil-2浓度呈等比方式增加。
由图1b所示,从细胞分离开始,每隔72小时(除第10天至第11天间隔48小时),rhil-2浓度呈等差方式增加。
实施例3树突状细胞的诱导培养
(1)将密度梯度离心法得到的pbmc以aimv培养基重悬,加入细胞培养皿中,37℃5%co2培养。
(2)3小时候将培养皿取出,轻轻晃动,吸出悬浮细胞。
(3)向培养皿中加入含500iu/mlrhil-4、500iu/mlrhgm-csf的aimv培养基。
(4)分别在培养后第3天、第5天半量换液,加入新鲜含500iu/mlrhil-4、500iu/mlrhgm-csf的aimv培养基。
(5)培养第6天加入终浓度为10ng/mlrhtnf-α.
(6)第7天收获成熟树突状细胞。
实施例4inkt细胞再次刺激
(1)在实施例2细胞和实施例3细胞培养第7天,离心收取实施例3中成熟树突状细胞,以aimv培养基重悬,加入终浓度100ng/mlα-galcer培养2小时。
(2)离心去除游离的α-galcer,进行细胞计数。以inkt细胞初次扩增产物:dc=10:1的比例将步骤(1)培养获得的dc加入实施例2中所述及的inkt细胞初次扩增产物中。
经静脉血分离得到的pbmc分别在培养第0天、第7天、第14天分别进行流式细胞术检测。由图2可以看出,inkt细胞(cd3+6b11+)比例逐渐增加,且inkt细胞中cd4+细胞比例逐渐降低,cd4-cd8-细胞、cd8+细胞比例逐渐提高。由图2a所示,在实施例2中选用rhil-2浓度呈等比方式增加,在第14天inkt细胞>15%,cd8+细胞>50%,cd4+细胞<10%。由图2b所示,实施例2中选用rhil-2浓度呈等差方式增加,在第14天inkt细胞>4%,cd8+细胞>40%,cd4+细胞<10%。综上所述,本发明的一个优选的实施方案为rhil-2浓度呈等差方式增加,一个更优选的实施方案为rhil-2浓度呈等比方式增加。
实施例5纯化的inkt细胞大量扩增
(1)在第13天应制作cd3单克隆抗体包被的细胞培养瓶:制备2μg/mlcd3单克隆抗体工作液(0.9%无菌生理盐水)。准备两个全新的75cm2大瓶,每个大瓶中加入5ml稀释好的抗体工作液。拧紧瓶口,轻轻摇晃瓶身,使cd3单克隆抗体稀释液充分浸润瓶底。用封口膜封好培养瓶管口,平放入4℃冰箱保存。
(2)培养第14天,使用anti-inktmicrobeadshuman进行inkt细胞分选,收取细胞。
(3)使用含有100iu/mlil-2,3μg/mlcd28抗体,5ng/mlrhil-7,5ng/mlrhil-15的aimv培养基将inkt细胞充分混匀,注意轻柔操作,避免产生气泡,制备细胞浓度不低于5×106个/ml的细胞悬液,混匀细胞。
(4)从4℃冰箱中取出cd3单克隆抗体包被的培养瓶,弃去液体,加入10ml0.9%无菌生理盐水洗涤一次培养瓶;将混匀的细胞悬液移入75cm2细胞培养瓶,轻轻晃动混匀,放置于37℃培养箱中培养。
(5)培养过程观察细胞状态及培养基颜色,可根据生长情况补充适量的培养基。
(6)cd3抗体刺激3天后可将细胞转移至新的培养瓶,并补充对应体积的培养基。
(7)培养第21天收获细胞。
由图3可以看出inkt细胞体外扩增细胞数量线性图。从外周血分离pbmc并培养初始第0天inkt细胞数为1×104个(占pbmc细胞总数0.1%左右),经过21天培养可得到1×109个inkt细胞。
实施例6inkt细胞杀伤肝肿瘤细胞实验
效应细胞:实施例5获得的大量扩增的inkt细胞
靶细胞:人肝母细胞瘤细胞系hepg2,人高分化肝癌细胞系huh7,高转移肝癌细胞系lm3
检测inkt细胞对肝肿瘤细胞杀伤能力实验使用乳酸脱氢酶(lacticdehydrogenase,ldh)释放法。具体操作方法如下:
(1)调整靶细胞浓度至1×105个/ml。
(2)将靶细胞按照100μl/孔转移至96孔板中,每组设定三个复孔。
(3)设置靶细胞自然释放孔(阴性对照)。不加效应细胞只加100μl培养液。
(4)设置最大释放孔(阳性对照)。不加效应细胞只加100μl10%np40。
(5)在每个实验孔中加入效应细胞100μl,效应细胞:靶细胞=0:1;1:1;3:1;10:1;30:1;50:1。各孔均加入终浓度为100ng/mlα-galcer。
(6)37℃5%co2培养,于6小时收取细胞上清进行乳酸脱氢酶(ldh)检测。
(7)吸取培养液上清,检测ldh数值计算活性。杀伤活性(%)=[(实验组a值-总自然释放a值)/(最大释放组a值-总自然释放a值)]×100%。
杀伤实验分组为:1、dc联合inkt细胞组;2、inkt细胞单独作用组;3、pbmc对照组;4、磷酸盐缓冲液(pbs)空白对照组。
由图4结果显示,inkt细胞在dc作为抗原提呈细胞提呈α-galcer,可使体外扩增的inkt细胞迅速激活,对不同的肝肿瘤细胞系均可特异性溶解,而在无抗原提呈细胞的inkt细胞单独作用组由于缺乏强激活信号的刺激,在效应细胞数目较少时,对靶细胞杀伤活性较弱,证明了体外扩增inkt细胞功能的有效性。
检测inkt细胞ifn-γ分泌能力使用流式细胞术。具体操作方法如下:
(1)按照杀伤实验靶细胞(本实验选用hepg2细胞)浓度及细胞数接种;
(2)按照效应细胞:靶细胞=50:1接种效应细胞。各孔均加入终浓度为100ng/mlα-galcer。
(3)每孔加入2μlbdgolgiplugtm。
(4)37℃5%co2培养,于6、12小时分别收取细胞,进行表面染色。
(5)按照fixation/permeabilizationsolutionkit说明书进行破膜以及胞内染色。
(6)固定细胞,进行流式细胞术检测及分析。
inkt细胞ifn-γ分泌能力实验分组为:1、dc联合inkt细胞组;2、inkt细胞单独作用组;3、pbmc对照组;4、磷酸盐缓冲液(pbs)空白对照组。
由图5结果显示,inkt细胞在dc作为抗原提呈细胞激活时,分泌ifn-γ的能力明显高于其他组,证明了体外特异性扩增的inkt细胞功能的有效性,进一步说明使用本发明所述方法扩增的inkt细胞主要为th1样inkt细胞,具有强大的肿瘤杀伤及免疫增强功能。
实施例7.inkt细胞动物体内肝癌杀伤实验
选用gfp荧光标记的肝细胞癌细胞系hepg2-gfp作为肿瘤细胞,皮下种植于8周龄,体重在20~30g之间的免疫缺陷小鼠nod-scid小鼠背部,实验分组每组5只nod-scid鼠。待肿瘤长成后,按时间点尾静脉过继人inkt细胞,荧光成像观察肿瘤生长情况并测量肿瘤大小。
具体操作方法如下:
(1)inkt细胞制备:实施例5获得的大量扩增的inkt细胞,注射前悬浮于生理盐水中备用;
(2)inkt细胞注射频率为从14天开始后每周1次,共4周,4次注射,阴性对照组为注射1%含白蛋白生理盐水组,阳性对照组为腹腔注射阿霉素2mg/kg,14天开始后注射到腹腔隔5天1次;
(3)注射inkt细胞剂量的确定:以60kg的成人为基准,inkt细胞在临床预期使用剂量为1×109~1×1010个细胞(约1.6×107~1.6×108个细胞/kg)。以nod-scid小鼠体重30g为基准,其临床预期剂量相当于5×105~5×106个细胞/只。我们以高剂量细胞为实验剂量,每只小鼠过继5×106个细胞;
(4)注射期间,每周3次以上观察一般状态的变化、运动性、外观等的一般症状,并掌握是否有死亡动物。肿瘤的体积(meantumorvolume):注射期间,每周3次使用测径器(calipers)测量肿瘤的长轴及短轴,并利用以下的计算公式,测量肿瘤的体积:v(meantumorvolume,mm3)=ab2/2(a=长轴长度,b=短轴长度)。实验分组每组3只nod-scid鼠。具体分组如下表所示。
由图6结果显示,nod-scid小鼠皮下种植hepg2-gfp肿瘤细胞14天后,尾静脉过继人inkt细胞,过继时间点分别为第14、21、28、35天,此后每周荧光成像观察肿瘤大小,并测量肿瘤体积(图6a)。如图6b、6c结果显示,inkt细胞过继给荷瘤小鼠后,小鼠肿瘤大小比起control阴性对照组明显缩小,提示inkt细胞在体内有明显的抗肝癌肿瘤细胞的作用。
所有本说明书中列出的出版物的内容都包含在本说明书中。此外,本领域技术人员可以理解,在不背离权利要求书中所述的技术范围和实质内容的情况下,对本发明进行多种不同的修饰和改变是可能的。本发明还包括上述这些修饰和更改。
- 还没有人留言评论。精彩留言会获得点赞!