一种非编码RNA靶标及其抑制剂在制备促进骨髓间充质干细胞成骨分化的药物中的应用的制作方法
本发明涉及生物制药领域,尤其涉及一种非编码rna靶标及其抑制剂在制备促进骨髓间充质干细胞成骨分化的药物中的应用。
背景技术:
骨组织工程在患者颌面部骨组织缺损修复中的应用研究不断深入,如何构建理想的组织工程骨移植物成为了研究热点。因此,骨组织工程中应用最广泛的人骨髓间充质干细胞(hmscs)成为重点研究对象,骨髓间充质干细胞成骨分化研究层出不穷。
申请人研究发现三种人参皂苷可促进骨髓间充质干细胞成骨分化,分别为人参皂苷rk1、rg5和rz1。人参皂苷rk1、rg5最早由韩国学者iihopark等发现(参考文献:threenewdammaraneglycosidesfromheatprocessedginseng,archpharmresvol25,no4,428-432,2002),rz1最早由韩国学者sangmyunglee发现(参考文献:ginsenosidesfromheatprocessedginseng,chempharmbull,2009),这三个人参皂苷均是从加热炮制的人参中分离得到,且三者为同分异构体,生源上均由人参皂苷rg3脱水而得。
人参皂苷rk1、rg5和rz1化学结构式及其生源降解途径如下所示:
人参皂苷rg3的c20羟基与c21氢发生消除反应得到人参皂苷rk1,人参皂苷rg3的c20羟基与c22氢发生消除反应得到人参皂苷rg5和rz1,人参皂苷rk1与rg5、rz1为双键位置异构,人参皂苷rg5与rz1为双键顺反异构。其中,人参皂苷rz1双键两端的大基团在双键同侧,由于空间位阻原因,相对不稳定,这可能也是人参皂苷rz1比rk1、rg5较晚发现的原因。而且,由于人参皂苷rz1相对没有rk1、rg5稳定,所以含量低,标准品分离难度大,也限制了人参皂苷rz1的药理作用研究。
申请人经过长期研究,获得了关于人参皂苷rz1的系统性研究成果,包括人参皂苷rz1的高纯度单体制备方法、制剂工艺研究(提高水溶性和稳定性)、药理作用和质量控制方法。申请人发现人参皂苷rk1、rg5和rz1可促进骨髓间充质干细胞成骨分化,尤其以人参皂苷rz1促进分化效果最好。申请人还发现了人参皂苷rk1、rg5和rz1促进骨髓间充质干细胞成骨分化的基因靶标非编码rnamir-498,并进行了过表达验证。目前多项研究表明,mir-498为一种不具有编码功能的microrna,与多种肿瘤的发生发展有关(参考文献:mir-498在人卵巢癌组织中的表达及对人卵巢癌细胞增殖和凋亡的影响,现代实用医学2016年;mir-498通过下调foxm1抑制肺腺癌细胞上皮充质细胞转化,山东大学学报2017年;hsa-mir-498对肾上腺皮质癌细胞sw-13增殖及凋亡的影响,癌症进展2016年;mir-498通过下调foxm1抑制肺腺癌细胞系a549的迁移侵袭,西安交通大学学报2017;micrornaderegulationintriplenegativebreastcancerrevealsaroleofmir-498inregulatingbrca1expression,oncotarget2016;lowmir-498expressionlevelsareassociatedwithpoorprognosisinovariancancer,europeanreviewformedicalandpharmacologicalsciences2015;mir-498inesophagealsquamouscellcarcinoma:clinicopathologicalimpactsandfunctionalinteractions,humanpathology2017;mir-498regulatedfoxo3expressionandinhibitedtheproliferationofhumanovariancancercells,biomedicine&pharmacotherapy2015)。
申请人检索未发现现有技术存在人参皂苷rk1、rg5和rz1及其基因靶标mir-498与骨髓间充质干细胞成骨分化的相关报道。
技术实现要素:
本发明的目的在于提供一种非编码rna靶标及其抑制剂在制备促进骨髓间充质干细胞成骨分化的药物中的应用,以促进骨组织工程在骨组织缺损修复中的应用。
为实现上述目的,本发明提供了以下技术方案:
一种非编码rnamir-498作为药物靶标在制备促进骨髓间充质干细胞成骨分化的药物中的应用,通过使mir-498表达下调促进骨髓间充质干细胞成骨分化。
一种非编码rnamir-498的抑制剂在制备促进骨髓间充质干细胞成骨分化的药物中的应用,该抑制剂下调mir-498表达促进骨髓间充质干细胞成骨分化。
在本发明具体实施例中,所述抑制剂为人参皂苷rk1、rg5或rz1。
在本发明具体实施例中,所述抑制剂优选人参皂苷rz1。
一种促进骨髓间充质干细胞成骨分化的药物制剂,含有上述抑制剂以及药学上可以接受的载体或赋形剂,制成药学上可以接受的剂型。
在药物制剂领域,药学上可以接受的载体或赋形剂包括一种或多种固体、半固体或液体辅料,药学上可以接受的剂型包括片剂、丸剂、颗粒剂、糖浆剂、散剂、膏剂、注射剂等。
本发明首次发现下调非编码rnamir-498表达水平可以促进骨髓间充质干细胞成骨分化,首次发现人参皂苷rk1、rg5和rz1为非编码rnamir-498表达抑制剂,人参皂苷rk1、rg5和rz1通过下调骨髓间充质干细胞中非编码rnamir-498表达水平促进骨髓间充质干细胞成骨分化,尤其以人参皂苷rz1效果最好。
附图说明
图1是流式细胞仪检测第3代hbmscs表面标志物的结果图(×200),可见hbmscs阳性表达间充质细胞表面标志cd44(a)、cd29(b),阳性率均90%以上,不表达造血干细胞表面标志cd34(c)、cd45(d)。
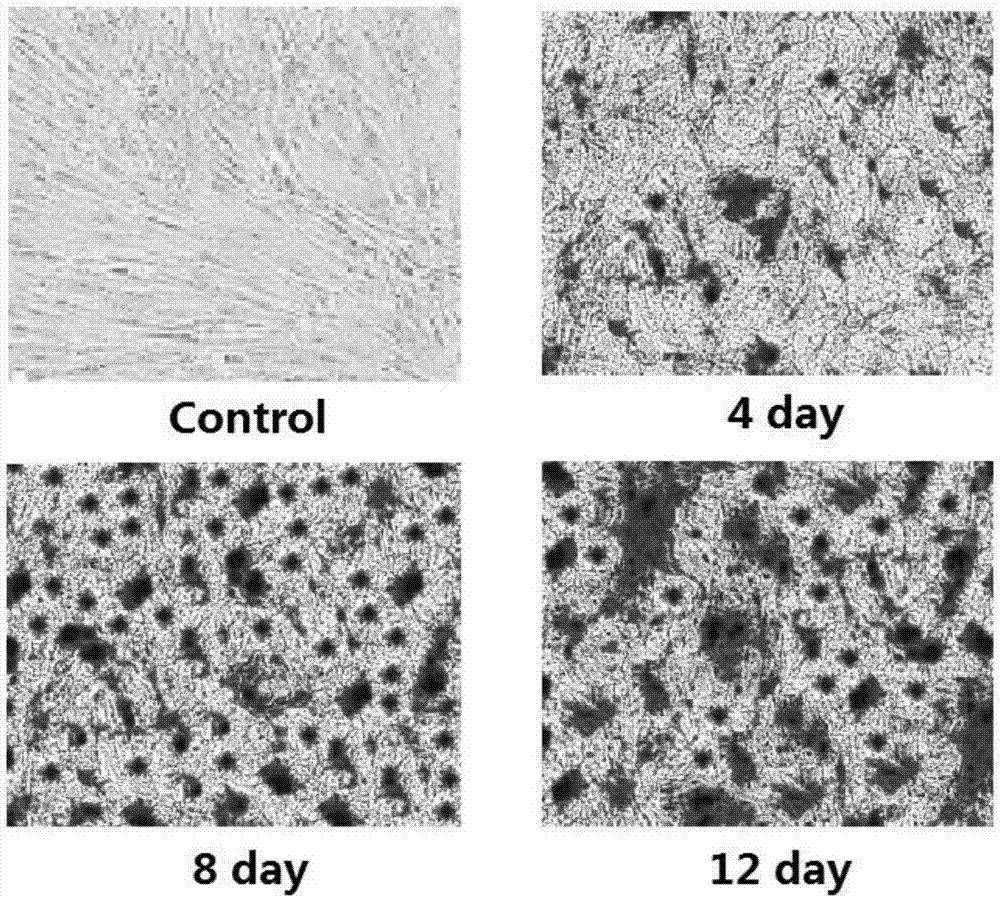
图2是茜素红矿化染色观察hbmscs成骨分化,茜素红染色阳性呈红色,钙化结节数量及阳性染色面积提示矿化程度,可见随着诱导时间增长,矿化程度明显加强。
图3是对照组、成骨诱导4d、8d、12d组细胞内runx2mrna、ocnmrna表达水平。
图4是对照组、成骨诱导4d、8d、12d组细胞内runx2、ocn蛋白表达水平。
图5是对照组、成骨诱导4d、8d、12d组细胞内alp活性。
图6是加药和不加药成骨诱导细胞内mir-498、runx2mrna、ocnmrna表达水平。
图7是加药和不加药成骨诱导细胞内runx2、ocn蛋白表达水平。
图8是加药和不加药成骨诱导细胞内alp活性。
图9是实施例3的rt-qpcr检测结果。
具体实施方式
实施例1:骨髓间充质干细胞成骨分化与非编码rnamir-498表达水平关系
1、试验材料
α-mem细胞培养液,hyclone公司;
胎牛血清(fbs),gibco公司;
低糖dmem培养基,gibco公司;
mircutemirna提取分离试剂盒,天根生化科技(北京)有限公司;
takara逆转录试剂盒,takara公司;
takarart-pcr试剂盒,takara公司;
bca试剂盒,碧云天生物;
runx2、ocn、β-actin一抗和二抗,美国santacruz公司;
pcr引物委托上海吉玛制药技术有限公司设计合成。
2、试验方法
2.1人骨髓间充质干细胞(hbmscs)的分离和培养
按标准骨髓穿刺程序,从自愿者髂后上棘处抽取骨髓5~10ml,肝素抗凝,用等量的pbs稀释,按2:1比例加在ficoll淋巴细胞分离液上,400g离心30min,取中间白膜层,用pbs洗涤2遍,计数,重悬于基础培养液中:每100ml的α-mem细胞培养液中含有10ml胎牛血清、2mm谷氨酰胺、1ml双抗。将一定密度的hbmscs置于基础培养瓶中,然后于37℃、5%co2的孵箱中培养。24h后,用新鲜培养液置换,然后每隔3天,更换一次培养液,直至细胞汇合度达到约90%,用0.05%胰酶-edta消化处理后传代,选择3-6代用于实验。
hbmscs的流式细胞仪鉴定:取培养至3代hbmscs,用pbs冲洗,计数,按照1×106/管分装,抗体用0.1%bsa稀释,100μl/管,双标,抗体室温避光孵育1h。流式细胞仪检测hbmscs表面抗原的表达。
2.2人骨髓间充质干细胞成骨分化培养
取培养至第3代的hbmscs,用0.25%trypsin-edta消化,然后以3×105/孔接种于6孔板中,并分为4组:对照组、成骨诱导4d、8d、12d组。对照组用基础培养液培养,成骨诱导组用成骨诱导培养基(含体积分数10%fbs的低糖dmem培养基+0.1μmol/l地塞米松+50mg/l抗坏血酸+10mmol/lβ-磷酸甘油钠+100u/ml青霉素+100u/ml链霉素)培养。各组每3d更换一次培养基。培养至设定时间后进行相关指标检测。
2.3茜素红s染色
茜素红是一种檀橙色偏黄的粉末,它能与成骨分化后的细胞内沉积的巧发生显色反应,从而得到红色的染色效果。将对照组、成骨诱导4d、8d、12d组的细胞吸去培养基,用pbs冲洗,用4%多聚甲醛30分钟,吸去固定液,用pbs和去离子水冲洗,加入2%茜素红s染液于常温下染色30分钟,吸去染色液,用pbs和去离子水冲洗,至背景染色最浅,在倒置相差显微镜下观察染色结果。
2.4rt-qpcr检测mir-498、runx2mrna、ocnmrna含量变化
runx2蛋白在成骨细胞的分化和骨形成方面起重要的作用,runx2通过丝裂原活化蛋白激酶信号通路使其磷酸化调节其活性和功能,runx2蛋白参与了多种信号转导途径,成骨分化过程中runx2蛋白含量明显升高。成骨分化过程中骨钙素(ocn)含量也明显升高。runx2mrna和ocnmrna表达水平是成骨分化水平的重要指标。
收集对照组、成骨诱导4d、8d、12d组细胞,按照mircutemirna提取分离试剂盒说明书提取mirna,紫外测定所提取rna的浓度及纯度,之后按照takara逆转录试剂盒说明书将其逆转录为cdna,反应条件:25℃×30min,42℃×30min,85℃×5min。以cdna为模板,按照takarart-pcr试剂盒说明书加入相关试剂及引物,以β-actin为内参,在abi-7300实时荧光定量仪上进行pcr扩增。反应条件:95℃×3min,(95℃×12s,62℃×40s)×40循环。实验结果采用2-δδct法进行表达量相对定量分析。
mir-498stem-looprtprimer:5'-ctcaactggtgtcgtggagtcggcaattcagttgaggaaaaacg-3'
mir-498forward:5'-acactccagctgggtttcaagccagggggcg-3'
mir-498reverse:5'-tggtgtcgtggagtcg-3'
runx2forward:5'-atccagccaccttcacttacacc-3'
runx2reverse:5'-gggaccattgggaactgatagg-3'
ocnforward:5'-ggaccatctttctgctcactctg-3'
ocnreverse:5'-accttattgccctcctgctt-3'
β-actinforward:5'-gggtcagaaggattcctatg-3'
β-actinreverse:5'-ggtctcaaacatgatctggg-3'
2.5westernblot检测runx2、ocn蛋白含量变化
runx2蛋白在成骨细胞的分化和骨形成方面起重要的作用,runx2通过丝裂原活化蛋白激酶信号通路使其磷酸化调节其活性和功能,runx2蛋白参与了多种信号转导途径,成骨分化过程中runx2蛋白含量明显升高。成骨分化过程中ocn含量也明显升高。
收集对照组、成骨诱导4d、8d、12d组细胞,以β-actin为内参,步骤如下:用裂解液裂解各组细胞,匀浆后离心取上清,采用bca试剂盒测蛋白含量。按60μg蛋白上样行sds-page电泳。湿转印法将蛋白质转印至pvdf膜;50g/l脱脂奶粉溶液室温封闭2h,加入runx2、ocn一抗稀释液和β-actin一抗稀释液,室温摇床轻摇过夜;tbst洗膜,加入hrp标记的二抗,室温摇床轻摇1.5h;tbst充分漂洗,加入ecl显色液,自动凝胶分析仪照相,以相应蛋白条带灰度值除以内参β-actin灰度值校正得到相应蛋白的相对表达量。
2.6碱性磷酸酶(alp)活性检测
取对照组、成骨诱导4d、8d、12d组细胞,吸去培养液,pbs冲洗3次,用0.05%胰酶-edta消化,刮下细胞,3000r/min离心10min,反复冻融3次至细胞完全裂解;将50μl细胞裂解液、50μlp-npp(浓度1mg/ml)以及100μl2×dea缓冲液充分混匀,37℃孵育45min,加入50μl3nnaoh终止反应,在405nm处测定od值;等量样品以bca法测定总蛋白含量,于562nm处测定od值,分别以总蛋白含量为校对值,得出alp活性。
3、试验结果
3.1人骨髓间充质干细胞的鉴定结果
流式细胞仪检测发现hbmscs阳性表达间充质细胞表面标志cd44、cd29,阳性率均90%以上,不表达造血干细胞表面标志cd34、cd45。结果如图1所示。
3.2茜素红s染色结果
显微镜下观察染色可见,成骨诱导4d,hbmscs出现红色矿化结节,随着诱导时间的增长,红色矿化结节面积进一步增大,而对照组无红色矿化结节出现。结果如图2所示。
3.3rt-qpcr检测结果
与对照组相比,成骨诱导4d、8d、12d组细胞内runx2mrna、ocnmrna表达水平显著升高,且呈时间依赖性;与对照组相比,成骨诱导4d、8d、12d组细胞内mir-498表达水平显著降低,且呈时间依赖性。这表明,随着成骨诱导时间的增长,hbmscs成骨分化率越来越高,而在hbmscs成骨分化过程中,mir-498表达水平越来越低,呈现负相关。对照组、成骨诱导4d、8d、12d组细胞内runx2mrna、ocnmrna表达水平如表1和图3。
表1成骨诱导7d、14d、21d细胞内mir-498、runx2mrna、ocnmrna表达水平
3.4westernblot检测结果
与对照组相比,成骨诱导4d、8d、12d组细胞内runx2、ocn蛋白表达水平显著升高,且呈时间依赖性。这表明,随着成骨诱导时间的增长,hbmscs成骨分化率越来越高。对照组、成骨诱导4d、8d、12d组细胞内runx2、ocn蛋白表达水平如表2和图4。
表2成骨诱导7d、14d、21d细胞内runx2、ocn蛋白表达水平
3.5碱性磷酸酶(alp)活性检测结果
对照组、成骨诱导4d、8d、12d组细胞内alp活性如表3和图5所示,可见与与对照组相比,成骨诱导4d、8d、12d组细胞内alp活性升高,且呈时间依赖性。
表3成骨诱导7d、14d、21d细胞内alp活性
该实施例可以看出,随着成骨诱导时间的增长,hbmscs成骨分化率越来越高,而在hbmscs成骨分化过程中,mir-498表达水平越来越低,呈现负相关。
实施例2:人参皂苷rk1、rg5和rz1下调mir-498表达促进骨髓间充质干细胞成骨分化
1、试验材料
α-mem细胞培养液,hyclone公司;
胎牛血清(fbs),gibco公司;
低糖dmem培养基,gibco公司;
mircutemirna提取分离试剂盒,天根生化科技(北京)有限公司;
takara逆转录试剂盒,takara公司;
takarart-pcr试剂盒,takara公司;
bca试剂盒,碧云天生物;
runx2、ocn、β-actin一抗和二抗,美国santacruz公司;
pcr引物委托上海吉玛制药技术有限公司设计合成;
人参皂苷rk1、rg5和rz1自制,纯度大于98%。
2、试验方法
2.1人骨髓间充质干细胞(hbmscs)的分离和培养
同实施例1。
2.2人骨髓间充质干细胞成骨分化培养
取培养至第3代的hbmscs,用0.25%trypsin-edta消化,然后以3×105/孔接种于6孔板中,并分为4组:对照组、不加药成骨诱导4d、8d、12d组、加药成骨诱导3d、7d组。对照组用基础培养液培养,不加药成骨诱导组用成骨诱导培养基(同实施例1)培养,加药成骨诱导组用含药成骨诱导培养基(在成骨诱导培养基基础上添加5μm人参皂苷rk1、rg5或rz1)培养。各组每3d更换一次培养基。培养至设定时间后进行相关指标检测。
2.3茜素红s染色
将对照组、成骨诱导组细胞吸去培养基,用pbs冲洗,用4%多聚甲醛30分钟,吸去固定液,用pbs和去离子水冲洗,加入2%茜素红s染液于常温下染色30分钟,吸去染色液,用pbs和去离子水冲洗,至背景染色最浅,在倒置相差显微镜下观察染色结果。
2.4rt-qpcr检测mir-498、runx2mrna、ocnmrna含量变化
收集对照组、成骨诱导组细胞,按照mircutemirna提取分离试剂盒说明书提取mirna,紫外测定所提取rna的浓度及纯度,之后按照takara逆转录试剂盒说明书将其逆转录为cdna,反应条件:25℃×30min,42℃×30min,85℃×5min。以cdna为模板,按照takarart-pcr试剂盒说明书加入相关试剂及引物,以β-actin为内参,在abi-7300实时荧光定量仪上进行pcr扩增。反应条件:95℃×3min,(95℃×12s,62℃×40s)×40循环。实验结果采用2-δδct法进行表达量相对定量分析。
mir-498stem-looprtprimer:5'-ctcaactggtgtcgtggagtcggcaattcagttgaggaaaaacg-3'
mir-498forward:5'-acactccagctgggtttcaagccagggggcg-3'
mir-498reverse:5'-tggtgtcgtggagtcg-3'
runx2forward:5'-atccagccaccttcacttacacc-3'
runx2reverse:5'-gggaccattgggaactgatagg-3'
ocnforward:5'-ggaccatctttctgctcactctg-3'
ocnreverse:5'-accttattgccctcctgctt-3'
β-actinforward:5'-gggtcagaaggattcctatg-3'
β-actinreverse:5'-ggtctcaaacatgatctggg-3'
2.5westernblot检测runx2、ocn蛋白含量变化
收集对照组、成骨诱导组细胞,以β-actin为内参,步骤如下:用裂解液裂解各组细胞,匀浆后离心取上清,采用bca试剂盒测蛋白含量。按60μg蛋白上样行sds-page电泳。湿转印法将蛋白质转印至pvdf膜;50g/l脱脂奶粉溶液室温封闭2h,加入runx2、ocn一抗稀释液和β-actin一抗稀释液,室温摇床轻摇过夜;tbst洗膜,加入hrp标记的二抗,室温摇床轻摇1.5h;tbst充分漂洗,加入ecl显色液,自动凝胶分析仪照相,以相应蛋白条带灰度值除以内参β-actin灰度值校正得到相应蛋白的相对表达量。
2.6碱性磷酸酶(alp)活性检测
取对照组、成骨诱导组细胞,吸去培养液,pbs冲洗3次,用0.05%胰酶-edta消化,刮下细胞,3000r/min离心10min,反复冻融3次至细胞完全裂解;将50μl细胞裂解液、50μlp-npp(浓度1mg/ml)以及100μl2×dea缓冲液充分混匀,37℃孵育45min,加入50μl3nnaoh终止反应,在405nm处测定od值;等量样品以bca法测定总蛋白含量,于562nm处测定od值,分别以总蛋白含量为校对值,得出alp活性。
3、试验结果
3.1人骨髓间充质干细胞的鉴定结果
流式细胞仪检测发现hbmscs阳性表达间充质细胞表面标志cd44、cd29,阳性率均90%以上,不表达造血干细胞表面标志cd34、cd45。
3.2茜素红s染色结果
显微镜下观察染色可见,成骨诱导组hbmscs出现红色矿化结节,随着诱导时间的增长,红色矿化结节面积进一步增大,而对照组无红色矿化结节出现。而且,加人参皂苷rk1、rg5成骨诱导7d与不加药成骨诱导12d红色矿化结节面积相当;加人参皂苷rz1成骨诱导3d与不加药成骨诱导12d红色矿化结节面积相当。
3.3rt-qpcr检测结果
与对照组相比,成骨诱导组细胞内runx2mrna、ocnmrna表达水平显著升高,且呈时间依赖性;与对照组相比,成骨诱导组细胞内mir-498表达水平显著降低,且呈时间依赖性。这表明,随着成骨诱导时间的增长,hbmscs成骨分化率越来越高,而在hbmscs成骨分化过程中,mir-498表达水平越来越低,呈现负相关。
而且,加人参皂苷rk1、rg5成骨诱导7d与不加药成骨诱导12d细胞内mir-498、runx2mrna、ocnmrna表达水平相当;加人参皂苷rz1成骨诱导3d与不加药成骨诱导12d细胞内mir-498、runx2mrna、ocnmrna表达水平相当。结果如表4和图6所示。
表4成骨诱导细胞内mir-498、runx2mrna、ocnmrna表达水平(对照为1)
3.4westernblot检测结果
与对照组相比,成骨诱导组细胞内runx2、ocn蛋白表达水平显著升高,且呈时间依赖性。这表明,随着成骨诱导时间的增长,hbmscs成骨分化率越来越高。
而且,加人参皂苷rk1、rg5成骨诱导7d与不加药成骨诱导12d细胞内runx2、ocn蛋白表达水平相当;加人参皂苷rz1成骨诱导3d与不加药成骨诱导12d细胞内runx2、ocn蛋白表达水平相当。结果如表5和图7所示。
表5成骨诱导细胞内runx2、ocn蛋白表达水平(对照为1)
3.5碱性磷酸酶(alp)活性检测结果
对照组、成骨诱导组细胞内alp活性如表6和图8所示,可见与与对照组相比,成骨诱导组细胞内alp活性升高,且呈时间依赖性。
而且,加人参皂苷rk1、rg5成骨诱导7d与不加药成骨诱导12d细胞内alp活性相当;加人参皂苷rz1成骨诱导3d与不加药成骨诱导12d细胞内alp活性相当。见表6和图8。
表6成骨诱导细胞内alp活性(对照为1)
该实施例可以看出,人参皂苷rk1、rg5和rz1可以抑制hbmscs中mir-498表达水平,进而具有促进hbmscs成骨分化的作用,且人参皂苷rz1的药效强于rk1、rg5。
实施例3:过表达实验验证骨髓间充质干细胞成骨分化与mir-498靶标相关性
1、试验材料
α-mem细胞培养液,hyclone公司;
胎牛血清(fbs),gibco公司;
低糖dmem培养基,gibco公司;
mircutemirna提取分离试剂盒,天根生化科技(北京)有限公司;
takara逆转录试剂盒,takara公司;
takarart-pcr试剂盒,takara公司;
bca试剂盒,碧云天生物;
pcr引物委托上海吉玛制药技术有限公司设计合成,mir-498mimics、mir-498inhibitor、mir-498nagativecontrol委托上海吉玛制药技术有限公司设计合成;
人参皂苷rk1、rg5和rz1自制,纯度大于98%。
2、试验方法
2、试验方法
2.1人骨髓间充质干细胞(hbmscs)的分离和培养
同实施例1。
2.2人骨髓间充质干细胞转染和成骨分化培养
取培养至第3代的hbmscs,用0.25%trypsin-edta消化,随机分组如下:
对照组:转染mir-498nagativecontrol(mir-498nc);
低表达组:转染mir-498inhibitor;
过表达组:转染mir-498mimics;
过表达+人参皂苷rk1干预组:转染mir-498mimics;
过表达+人参皂苷rg5干预组:转染mir-498mimics;
过表达+人参皂苷rz1干预组:转染mir-498mimics。
转染按照脂质体转染试剂盒lipofectamine2000说明书操作,mir-498inhibitor、mir-498mimics、mir-498nc转染浓度均为25pmol/ml。转染5h后pbs冲洗换液,制成细胞悬液,以3×105/孔接种于6孔板中,用成骨诱导培养基(同实施例1)培养,其中过表达+人参皂苷rk1干预组、过表达+人参皂苷rg5干预组、过表达+人参皂苷rz1干预组的成骨诱导培养基中还添加5μm人参皂苷rk1、rg5或rz1。培养48小时后进行相关指标检测。
2.3rt-qpcr检测mir-498、runx2mrna、ocnmrna含量变化
收集各组细胞,按照mircutemirna提取分离试剂盒说明书提取mirna,紫外测定所提取rna的浓度及纯度,之后按照takara逆转录试剂盒说明书将其逆转录为cdna,反应条件:25℃×30min,42℃×30min,85℃×5min。以cdna为模板,按照takarart-pcr试剂盒说明书加入相关试剂及引物,以β-actin为内参,在abi-7300实时荧光定量仪上进行pcr扩增。反应条件:95℃×3min,(95℃×12s,62℃×40s)×40循环。
实验结果采用2-δδct法进行表达量相对定量分析。
mir-498stem-looprtprimer:5'-ctcaactggtgtcgtggagtcggcaattcagttgaggaaaaacg-3'
mir-498forward:5'-acactccagctgggtttcaagccagggggcg-3'
mir-498reverse:5'-tggtgtcgtggagtcg-3'
runx2forward:5'-atccagccaccttcacttacacc-3'
runx2reverse:5'-gggaccattgggaactgatagg-3'
ocnforward:5'-ggaccatctttctgctcactctg-3'
ocnreverse:5'-accttattgccctcctgctt-3'
β-actinforward:5'-gggtcagaaggattcctatg-3'
β-actinreverse:5'-ggtctcaaacatgatctggg-3'
3、试验结果
3.1人骨髓间充质干细胞的鉴定结果
流式细胞仪检测发现hbmscs阳性表达间充质细胞表面标志cd44、cd29,阳性率均90%以上,不表达造血干细胞表面标志cd34、cd45。
3.2rt-qpcr检测结果
与对照组相比,过表达组mir-498表达水平显著提高,低表达组mir-498表达水平显著降低;与过表达组相比,过表达+人参皂苷rk1干预组、过表达+人参皂苷rg5干预组、过表达+人参皂苷rz1干预组mir-498表达水平显著降低。
与对照组相比,过表达组runx2mrna、ocnmrna表达水平显著降低,低表达组runx2mrna、ocnmrna表达水平显著提高;与过表达组相比,过表达+人参皂苷rk1干预组、过表达+人参皂苷rg5干预组、过表达+人参皂苷rz1干预组runx2mrna、ocnmrna表达水平显著提高,且过表达+人参皂苷rz1干预组提高更为显著。
rt-qpcr检测结果如表7和图9所示。
表7rt-qpcr检测结果(以mir-498nc对照组为1)
该实施例可以看出,mir-498表达水平与hbmscs成骨分化有关,抑制mir-498的表达水平有助于hbmscs成骨分化。人参皂苷rk1、rg5和rz1可以抑制mir-498的表达水平,为mir-498表达的有效抑制剂,人参皂苷rk1、rg5和rz1通过抑制mir-498表达促进hbmscs成骨分化,且人参皂苷rz1具有更为优异的药效。
本领域技术人员应当知道,上述具体实施方式仅用于解释本发明,本发明的保护范围并不局限于上述具体实施方式。
- 还没有人留言评论。精彩留言会获得点赞!