表达NY‑ESO‑1特异性TCR的T细胞及其应用的制作方法
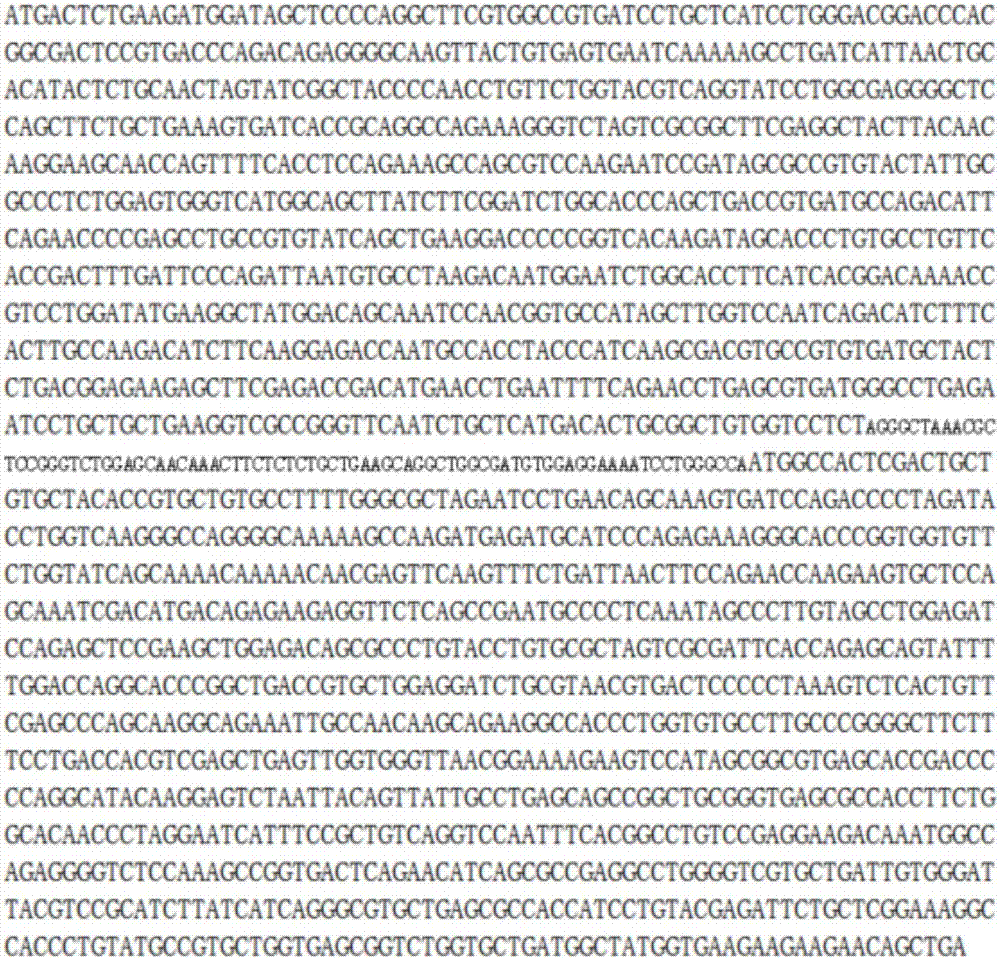
本发明涉及免疫学和医药领域。具体的,本发明提供了含有特异性识别ny-eso-1的t细胞受体和同时表达所述tcr和细胞因子的t细胞。本发明还提供了所述t细胞在预防或治疗癌症或制备预防或治疗癌症的药物中的用途。
背景技术:
近年来,肿瘤免疫治疗发展迅速,但整体效果依然欠佳。究其原因,可能与肿瘤通过各种机制产生免疫逃逸有关。如肿瘤细胞表达与正常组织细胞相同的抗原而逃避机体免疫系统的识别;通过分泌免疫抑制因子如tgf-β和il-10等来抑制免疫活性细胞的功能;通过下调tnf-α受体、fas受体等来抵抗细胞因子及细胞毒性t淋巴细胞(cytotoxiclymphocyte,ctl)的抗肿瘤效应;通过丢失肿瘤抗原下调hla使抗原不能有效提呈等。肿瘤浸润性t细胞(tumor-infiltratinglymphocyte,til)过继性免疫治疗虽然在部分肿瘤取得成功,但是在大多数肿瘤中并没有达到预期的效果。其主要原因包括:til难以获取,这些t细胞体外扩增后功能活性下降,到达肿瘤组织的t细胞数量不足以及在肿瘤组织微环境中丧失免疫活性等。为此,研究者已尝试使用基因修饰t细胞来解决这个问题,如用来修饰t细胞的基因有car(chimericantigenreceptor,嵌合型抗原受体)、促进免疫细胞增殖的细胞因子如il-2、il-15等均已取得较好的疗效,但由于脱靶性、安全性等问题极大地限制了它们在临床上的应用。
t细胞过继性转移可以增强免疫系统介导的对肿瘤细胞的消除,是近年来获得较高关注的特异性、无毒性的癌症新疗法。在t细胞过继转移中,t细胞受体(tcr)基因转移作为一种发展迅速的免疫治疗方法,可以在体外产生大量的具有已知抗原特异性和功能亲和性的t细胞,应用于恶性肿瘤的过继细胞免疫治疗。tcr基因工程化t细胞的产生首先筛选和克隆肿瘤特异性tcr基因,随后以之转染t细胞赋予其抗原特异性,从而获得基因工程化抗原特异性t细胞,最终将tcr基因转染t细胞回输患者体内,重建针对抗原阳性肿瘤的t细胞免疫反应。
至今,适于用于治疗作用的tcr候选物还是少量。另外,这些鉴定的tcr转导的t细胞依然存在t细胞活化信号转导弱以及在体内的存活时间短等问题。
ny-eso-1属于癌症睾丸抗原(cta)家族,其在肿瘤细胞和睾丸和胎盘的不表达mhc的生殖细胞中表达(chen,pnasusa,1997,94(5):1914-1918)。已经发现ny-eso-1在多种人癌症中表达,包括黑素瘤,乳腺癌,肺癌,前列腺癌,甲状腺癌,卵巢癌,骨肉瘤和滑膜细胞肉瘤。
骨肉瘤是一种起源于骨间叶组织的恶性肿瘤,占原发恶性骨肿瘤的20%,约70%-80%的患者发病年龄在10-25岁,年发病率约为(1-3)/100万人。骨肉瘤恶性程度高,早期有可能发生肺转移,约有10-20%的病人在诊断时发现有转移灶,预后极差。目前,尽管人们尝试用新的化疗药物或联合用药,病人的生存率不再提高。
白细胞介素2(interleukin2,il-2)是一类具有广泛免疫学活性的细胞因子,主要由cd4+和cd8+t细胞产生。其在免疫系统中发挥着非常重要的作用:促进所有亚型t细胞增殖及产生细胞因子,延长其生存期;促进nk细胞毒活性;激活单核/巨噬细胞,并增强其杀瘤活性等。il-2作为免疫治疗剂及免疫佐剂应用也取得了一定的免疫效果。il-2的抗肿瘤作用除与lak,til有关外,还与其诱导no的产生有关,但因il-2价格昂贵、体内半衰期短、大量注射不良反应重,从而限制了它的应用。
本领域还需要获得新的抗原特异性tcr,以及获得表达这些tcr的t细胞,同时可通过其它免疫手段,增加这些t细胞的活性,以便更有效地进行抗原特异性免疫治疗。
技术实现要素:
本发明提供了一种新的特异性识别ny-eso-1的t细胞受体,即tcr,以及其或是其与细胞因子,特别是白细胞介素2(il-2)的联合在t细胞中表达的应用。本发明提供了表达所述tcr或共同表达所述tcr与il-2的t细胞,所述t细胞具有ny-eso-1抗原特异性并具有更高的增殖能力。本发明还提供了包含所述tcr或其与il-2的编码序列并且能高效转化t细胞的慢病毒表达载体。本发明还提供了采用表达所述tcr的t细胞治疗癌症的方法或制备治疗癌症的药物的用途。
本发明提供了一种t细胞,其包含编码特异性识别ny-eso-1的tcr的核酸并表达所述特异性识别ny-eso-1的tcr,所述tcr包括α链和β链。在本发明的其中一个方面,所述编码特异性识别ny-eso-1的tcr的核酸包括编码所述tcr的α链的第一核酸片段。优选的,所述第一核酸片段具有序列为seqidno:1的核苷酸序列。在本发明的其中又一个方面,所述核酸还包括编码所述tcr的β链的第二核酸片段。优选的,所述第二核酸片段具有序列为seqidno:2的核苷酸序列。在本发明的其中又一个方面,所述编码特异性识别ny-eso-1的tcr的核酸进一步包括所述第一核酸片段和第二核酸片段之间的接头。优选的,所述接头为编码t2a的核酸序列,例如,所述接头的核苷酸序列为agggctaaacgctccgggtctggagcaacaaacttctctctgctgaagcaggctggcgatgtggaggaaaatcctgggcca(seqidno:4)。
ny-eso-1是属于癌症睾丸抗原家族的抗原。在本发明中,ny-eso-1主要是指人ny-eso-1,其蛋白序列如genbank:caa05908.1所定义。编码ny-eso-1的基因为ctag1b(cancer/testisantigen1b),其核酸序列如geneid:1485所定义。
在本发明的其中又一个方面,前述t细胞还包含编码能够表达白细胞介素2,即il-2的核酸并表达白细胞介素2。优选的,所述编码白细胞介素2的核酸具有序列为seqidno:3的核苷酸序列。在本发明的其中又一个方面,所述编码白细胞介素2的核酸通过编码t2a的核酸序列与所述编码特异性识别ny-eso-1的tcr的核酸连接。所述编码t2a的核酸的核苷酸序列例如为agggctaaacgctccgggtctggagcaacaaacttctctctgctgaagcaggctggcgatgtggaggaaaatcctgggcca(seqidno:4)。
本发明提供的t细胞能够特异性识别表达或在细胞表面呈递ny-eso-1的细胞。本发明的t细胞可以是cd8+t细胞和cd4+t细胞。在本发明的一个方面,本发明的t细胞为cd8+t细胞。本发明提供的t细胞对表达或在细胞表面呈递ny-eso-1的细胞,包括癌症细胞,有杀伤力,使癌症细胞破裂而死亡,并且能成为记忆细胞,再次遇到相同抗原刺激时,将更迅速地增殖分化。
本发明还提供了包含编码特异性识别ny-eso-1的tcr的核酸的重组表达载体。在本发明的其中一个方面,所述编码特异性识别ny-eso-1的tcr的核酸包括编码所述tcr的α链的第一核酸片段。优选的,所述第一核酸片段具有序列为seqidno:1的核苷酸序列。在本发明的其中又一个方面,所述核酸包括编码所述tcr的β链的第二核酸片段。优选的,所述第二核酸片段具有序列为seqidno:2的核苷酸序列。在本发明的其中又一个方面,所述编码特异性识别ny-eso-1的tcr的核酸进一步包括连接所述第一核酸片段和第二核酸片段的接头。优选的,所述接头为编码t2a的核酸序列,例如,所述接头的核苷酸序列为seqidno:4的核苷酸序列。
在本发明的其中又一个方面,所述重组表达载体还包含编码能够表达白细胞介素2的核酸。优选的,所述编码白细胞介素2的核酸具有序列为seqidno:3的核苷酸序列。在本发明的其中又一个方面,所述编码白细胞介素2的核酸通过t2a序列与所述编码特异性识别ny-eso-1的tcr的核酸连接,所述t2a序列例如为seqidno:4的核苷酸序列。
在本发明的其中一个方面,本发明的重组表达载体是质粒。在本发明的其中又一个方面,本发明的重组表达载体是用于包装病毒载体的质粒,例如是用于包装杆状病毒表达载体,腺病毒载体,逆转录病毒载体,疱疹病毒载体或慢病毒载体等的质粒。
在本发明的其中一个方面,本发明的重组表达载体为在哺乳动物中表达蛋白的载体。在本发明的其中又一个方面,所述重组表达载体为病毒载体,例如杆状病毒表达载体,腺病毒载体,逆转录病毒载体,疱疹病毒载体或慢病毒载体等。优选的,本发明的重组表达载体为慢病毒载体。病毒载体中,外源dna插入片段连接至病毒基因组中,并可以感染目标细胞(例如t细胞)以及将外源dna插入片段带入目标细胞/整合到目标细胞基因组,并表达其编码的蛋白。
本发明的重组表达载体除了包括上述编码特异性识别ny-eso-1的tcr的核酸和或编码白细胞介素2的核酸,还包括可包含其它序列,如:调节载体在宿主细胞中复制的序列(例如:复制起点)及选择性标记基因。
在本发明的一个方面,提供了含有上述本发明的t细胞或重组表达载体的药物组合物。在本发明的一个方面,提供了上述本发明的t细胞或重组表达载体在用于制备治疗或预防癌症的药物中的用途。本发明的重组表达载体可以将编码特异性识别ny-eso-1的tcr和/或il-2的核酸在t细胞中表达。本发明的t细胞具有特异性识别ny-eso-1,通过细胞毒性作用和淋巴因子的产生发挥抗肿瘤作用。因此,本发明的t细胞可用于治疗或预防癌症,即可为用于治疗或预防肿瘤的药物组合物的活性成分。
本发明的上述药物组合物的施用的方法包括皮内、皮下、肌肉内、静脉施用等等。本发明的药物组合物的施用的方法包括静脉内施用。可将含有本发明的t细胞的试剂返回患者的体内,因此可在被本发明t细胞识别和有反应的患者体内有效杀伤肿瘤,结果可治疗或预防肿瘤。
上述本发明的药物组合物可用于预防或治疗癌症。所述癌症包括血癌、实体瘤等,更具体地讲,包括黑素瘤,乳腺癌,肺癌,前列腺癌,甲状腺癌,卵巢癌,骨肉瘤和滑膜细胞肉瘤。优选的,包含本发明的t细胞或重组表达载体的药物组合物可用于预防或治疗骨肉瘤。
在本文中,蛋白符号不用斜体,并全部大写;基因符号使用斜体。例如ny-eso-1表示抗原蛋白,编码该蛋白的基因写为ctag1b。但有时在本文中基因符号也不使用斜体。
在本文中,术语“编码多肽或蛋白质的核酸或核酸片段”包括含有所述多肽或蛋白质编码序列的核苷酸。除了所述多肽或蛋白质编码序列的核苷酸,该核酸或核酸片段还可包括其它单一连续区域或不连续区域(例如,多核苷酸被整合噬菌体、整合插入序列、整合载体序列、整合转座子序列中断或由于rna编辑或基因组dna重排而被中断)的蛋白或非蛋白编码序列的核苷酸,例如用于协助插入片段的整合的序列、表达调控的序列、编码信号肽的序列等。
附图说明
图1本发明提供的质粒pgreenpuro-tcr(ny-eso-1)和pgreenpuro-tcr(ny-eso-1)-il2的插入片段的结构示意图。
图2是本发明提供的重组表达载体pgreenpuro-tcr(ny-eso-1)的插入片段的编码碱基序列。
图3是本发明提供的重组表达载体pgreenpuro-tcr(ny-eso-1)-il2的插入片段的编码碱基序列。
图4是本发明的质粒转染的t淋巴细胞表达ny-eso-1特异性tcr的上流式细胞仪检测结果图。
图5是本发明的质粒转染的t淋巴细胞抗肿瘤效果。
具体实施方式
下面将结合实施例进一步说明本发明的实质内容和有益效果,该实施例仅用于说明本发明而非对本发明的限制。
实施例1重组表达载体pgreenpuro-tcr(ny-eso-1)的构建
构建了重组表达载体pgreenpuro-tcr(ny-eso-1)。载体的插入片段的结构如图1所示。pgreenpuro-tcr(ny-eso-1)的插入片段包括编码tcr的α链的第一核酸片段和编码tcr的β链的第二核酸片段;第一核酸片段和第二核酸片段通过t2a序列连接。
构建过程包括:
合成编码ny-eso-1tcrα-t2a-ny-eso-1tcrβ(称为tcr(ny-eso-1)序列)的核酸片段,其由包括编码ny-eso-1-tcr的α链的第一核酸片段(碱基序列如seqidno.1所示)、包括编码ny-eso-1-tcr的β链的第二核酸序列(碱基序列如seqidno.2所示)、以及将所述第一核酸片段和第二核酸片段串联起来的t2a序列(agggctaaacgctccgggtctggagcaacaaacttctctctgctgaagcaggctggcgatgtggaggaaaatcctgggcca)组成。所述tcr(ny-eso-1)序列的核酸片段如图2所示。其中小号字体的序列为编码t2a序列的核酸;小号字体的序列前为第一核酸片段;小号字体的序列后为第二核酸片段。
在所述tcr(ny-eso-1)序列的核酸片段两端加入ecori和bamhi限制性内切酶位点序列。将该核酸片段与慢病毒核心载体pgreenpuro用限制性内切酶ecori和bamhi进行双酶切,酶切产物切胶回收后,用t4连接酶16℃过夜连接。连接后转化大肠杆菌hb2151感受态,涂布平板,次日挑取单克隆双酶切及测序鉴定,得到重组表达载体pgreenpuro-tcr(ny-eso-1)。
实施例2重组表达载体pgreenpuro-tcr(ny-eso-1)-il2的构建
pgreenpuro-tcr(ny-eso-1)-il2的插入片段包括编码tcr的α链的第一核酸片段和编码tcr的β链的第二核酸片段,以及编码白细胞介素2的第三核酸片段;第一核酸片段和第二核酸片段通过t2a序列连接;第二核酸片段和第三核酸片段通过t2a序列连接。
构建过程包括:
合成编码ny-eso-1tcrα-t2a-ny-eso-1tcrβ和il-2的核酸片段(称为tcr(ny-eso-1)-il2序列),其由包括编码ny-eso-1-tcr的α链的第一核酸片段(碱基序列如seqidno.1所示)、包括编码ny-eso-1tcr的β链的第二核酸序列(碱基序列如seqidno.2所示)、包括编码il-2的第三核酸片段(碱基序列如seqidno.3所示)、以及在所述第一核酸片段和第二核酸片段之间、第二核酸片段和第三核酸片段之间的两个t2a序列(用于将所述三个序列串联起来)组成。所述tcr(ny-eso-1)-il2序列的插入片段的核酸片段如图3所示。其中前一个小号字体的序列为编码t2a序列的核酸,其序列前为第一核酸片段,其序列后为第二核酸片段;后一个小号字体的序列为编码t2a序列的核酸,其序列后为第三核酸片段。
在所述tcr(ny-eso-1)-il2序列的核酸片段两端加入ecori和bamhi限制性内切酶位点序列。将该核酸片段与慢病毒核心载体pgreenpuro用限制性内切酶ecori和bamhi进行双酶切,酶切产物切胶回收后,用t4连接酶16℃过夜连接。连接后转化大肠杆菌hb2151感受态,涂布平板,次日挑取单克隆双酶切及测序鉴定,得到重组表达载体pgreenpuro-tcr(ny-eso-1)-il2。
实施例3慢病毒的包装
将得到的重组表达载体pgreenpuro-tcr(ny-eso-1)及pgreenpuro-tcr(ny-eso-1)-il2分别与慢病毒骨架质粒pmdlgprre、prsv-rev和pmd2.g(addgene)等量通过lipofectamine2000脂质体(life,invitrogen,货号11668-019)转染进入hek293t细胞(atcc,商品号为crl-3216)中进行慢病毒的包装。
按照慢病毒转化试剂供应商的说明书进行操作。具体步骤包括:用含10%fbs的1640培养基培养293t细胞;然后将293t细胞以3x105/cm2的密度传至直径15cm的培养皿中培养20h,保证转染时细胞汇合度为80-90%;用不含血清的1640培养基换液,备用;取两个ep管,分别在ep管中加入1ml1640,将慢病毒载体pgreenpuro-tcr(ny-eso-1)或pgreenpuro-tcr(ny-eso-1)-il2与pmdlgprre、prsv-rev和pmd2.g质粒按照摩尔比1:1:1:1于其中一个ep管中混匀,在另一个ep管中加入150ullipo2000,混匀放置5min,将混有lipo2000的1640培养基加入含有质粒的ep管中,混匀,室温放置20min,然后将混合液逐滴加入上述制备的细胞培养皿中,继续培养4h后,用含10%fbs的1640培养基更换培养液。同时做gfp荧光对照组,看转染效率,病毒包装成功。继续培养48h后收集细胞上清用于病毒纯化。
实施例4慢病毒的纯化
将病毒上清用0.22μm过滤膜过滤,滤液收集在50ml超滤管中,3000g/min离心45min;将剩余的浓缩液转移至ep管,放-80℃保存备用。
分别得到带有pgreenpuro-tcr(ny-eso-1)的插入片段和pgreenpuro-tcr(ny-eso-1)-il2的插入片段的慢病毒载体。
实施例5cd8+t细胞的分离
a:采集来自志愿者(均签署知情同意书)的全血,倒入50ml离心管,室温离心700g20分钟(普通离心)。
b:取上述离心下部细胞成分,加dpbs至50ml。
c:分别取25ml上述液体加到20ml人淋巴细胞分离液,将离心管室温离心800g15分钟。
d:取白膜层细胞,加入dpbs,补足至50ml。
e:离心600g10分钟,弃上清液,得pbmc。
f:采用cd8+t细胞磁珠分选试剂盒分选cd8+t细胞。
实施例6慢病毒载体感染t淋巴细胞
用含10%胎牛血清的rpmi1640完全培养基培养cd8+t细胞,第一天加入抗cd3单克隆抗体活化;第三天加入150moi的根据实施例4制备得到的慢病毒(带有pgreenpuro-tcr(ny-eso-1)的插入片段或pgreenpuro-tcr(ny-eso-1)-il2的插入片段的慢病毒),未感染的t淋巴细胞作为空白对照;16h后将培养基更换为含有50iu/ml重组人il-2的rpmi1640完全培养基,继续培养10-20天,然后观察t淋巴细胞生长情况。
观察显示:
细胞在感染病毒后,能够形成典型的增殖克隆团。
实施例7特异性识别ny-eso-1的tcr在t细胞中的表达
将培养至14天的已感染病毒的t细胞,600g离心10min,弃尽上清以收集细胞;pbs溶液重悬细胞,并将细胞调整密度为1x107个/ml;将100μl细胞置于ep管,加入10μlfitc标记小鼠抗人cd8单克隆抗体和10μlpe标记的ny-eso-1五聚体(sllmwitqc)(proimmune,code:f049-2a-g,usa);4℃孵育30min,pbs溶液洗涤2次,上流式细胞仪检测tcr的正确表达。
图4是带有pgreenpuro-tcr(ny-eso-1)的插入片段的慢病毒感染的cd8+t细胞表达ny-eso-1特异性tcr上流式细胞仪检测结果图。上流式细胞仪检测结果表明,带有pgreenpuro-tcr(ny-eso-1)的插入片段的慢病毒感染的cd8+t细胞中,ny-eso-1特异性tcr的表达为23.81%。
以没有插入片段的载体pgreenpuro与骨架质粒pmdlgprre、prsv-rev和pmd2.g转染hek293t细胞得到的空载体病毒感染的t细胞作为对照。对照的t细胞的ny-eso-1特异性tcr的表达率为0.46%)。
在另一实验中,流式细胞仪检测结果表明,带有pgreenpuro-tcr(ny-eso-1)-il2的插入片段的慢病毒感染的cd8+t细胞也表达了ny-eso-1特异性tcr。
实施例8表达tcr(ny-eso-1)和tcr(ny-eso-1)-il2的t淋巴细胞抗肿瘤效果验证
以稳定表达ny-eso-1的成骨肉瘤细胞系saos-2(atcc#htb-85)作为靶细胞,分别用慢病毒载体pgreenpuro-tcr(ny-eso-1)和pgreenpuro-tcr(ny-eso-1)-il2感染的t细胞制得效应细胞,将靶细胞按照密度1x105个/ml接种96孔板,每孔100μl,按照5:1,10:1,20:1效靶比将效应细胞加入靶细胞,置于5%co2,37℃培养箱培养4h,采用wst-1检测细胞活力,按以下公式计算杀伤效率:
杀伤效果(增殖抑制率)=[1-(实验组od值-效应细胞od值)/靶细胞od值]×100%。
结果如图5所示:
本发明提供的仅表达ny-eso-1tcr以及同时表达ny-eso-1tcr和细胞因子il-2的t淋巴细胞都对ny-eso-1阳性肿瘤细胞具有杀伤作用。
另外,同时表达ny-eso-1tcr和细胞因子il-2的t淋巴细胞较仅表达ny-eso-1tcr而未表达il-2的t淋巴细胞对ny-eso-1阳性肿瘤细胞具有显著增强的杀伤作用。
上面是对本发明进行的说明,不能将其看成是对本发明进行的限制。除非另外指出,本发明的实践将使用有机化学、聚合物化学、生物技术等的常规技术,显然除在上述说明和实施例中所特别描述之外,还可以别的方式实现本发明。其它在本发明范围内的方面与改进将对本发明所属领域的技术人员显而易见。根据本发明的教导,许多改变和变化是可行的,因此其在本发明的范围之内。
如无特别表示,本文中出现的温度的单位“度”是指摄氏度,即℃。
序列表
<110>深圳市北科生物科技有限公司
<120>表达ny-eso-1特异性tcr的t细胞及其应用
<160>4
<170>siposequencelisting1.0
<210>1
<211>819
<212>dna
<213>人工序列()
<400>1
atgactctgaagatggatagctccccaggcttcgtggccgtgatcctgctcatcctggga60
cggacccacggcgactccgtgacccagacagaggggcaagttactgtgagtgaatcaaaa120
agcctgatcattaactgcacatactctgcaactagtatcggctaccccaacctgttctgg180
tacgtcaggtatcctggcgaggggctccagcttctgctgaaagtgatcaccgcaggccag240
aaagggtctagtcgcggcttcgaggctacttacaacaaggaagcaaccagttttcacctc300
cagaaagccagcgtccaagaatccgatagcgccgtgtactattgcgccctctggagtggg360
tcatggcagcttatcttcggatctggcacccagctgaccgtgatgccagacattcagaac420
cccgagcctgccgtgtatcagctgaaggacccccggtcacaagatagcaccctgtgcctg480
ttcaccgactttgattcccagattaatgtgcctaagacaatggaatctggcaccttcatc540
acggacaaaaccgtcctggatatgaaggctatggacagcaaatccaacggtgccatagct600
tggtccaatcagacatctttcacttgccaagacatcttcaaggagaccaatgccacctac660
ccatcaagcgacgtgccgtgtgatgctactctgacggagaagagcttcgagaccgacatg720
aacctgaattttcagaacctgagcgtgatgggcctgagaatcctgctgctgaaggtcgcc780
gggttcaatctgctcatgacactgcggctgtggtcctct819
<210>2
<211>912
<212>dna
<213>人工序列()
<400>2
atggccactcgactgctgtgctacaccgtgctgtgccttttgggcgctagaatcctgaac60
agcaaagtgatccagacccctagatacctggtcaagggccaggggcaaaaagccaagatg120
agatgcatcccagagaaagggcacccggtggtgttctggtatcagcaaaacaaaaacaac180
gagttcaagtttctgattaacttccagaaccaagaagtgctccagcaaatcgacatgaca240
gagaagaggttctcagccgaatgcccctcaaatagcccttgtagcctggagatccagagc300
tccgaagctggagacagcgccctgtacctgtgcgctagtcgcgattcaccagagcagtat360
tttggaccaggcacccggctgaccgtgctggaggatctgcgtaacgtgactccccctaaa420
gtctcactgttcgagcccagcaaggcagaaattgccaacaagcagaaggccaccctggtg480
tgccttgcccggggcttctttcctgaccacgtcgagctgagttggtgggttaacggaaaa540
gaagtccatagcggcgtgagcaccgacccccaggcatacaaggagtctaattacagttat600
tgcctgagcagccggctgcgggtgagcgccaccttctggcacaaccctaggaatcatttc660
cgctgtcaggtccaatttcacggcctgtccgaggaagacaaatggccagaggggtctcca720
aagccggtgactcagaacatcagcgccgaggcctggggtcgtgctgattgtgggattacg780
tccgcatcttatcatcagggcgtgctgagcgccaccatcctgtacgagattctgctcgga840
aaggccaccctgtatgccgtgctggtgagcggtctggtgctgatggctatggtgaagaag900
aagaacagctga912
<210>3
<211>462
<212>dna
<213>人工序列()
<400>3
atgtacaggatgcagctgctcagctgcatcgccctgagcctggccctggtcacaaacagc60
gcccccaccagcagcagcaccaagaagacccagctccagctggagcacctgctgctggac120
ctccagatgatcctgaacggcatcaacaattacaagaatcccaagctgactcgcatgctg180
accttcaagttttatatgcctaagaaagctaccgagctgaagcacctccagtgcctggag240
gaagagctgaagccactggaagaggtgctgaacctggcacaatctaagaatttccacctg300
cggccccgggacctgatcagcaacatcaatgtgatcgtgctggagctgaaggggtccgag360
accaccttcatgtgcgaatatgcagatgagactgccacgattgtggagttcctgaaccgg420
tggatcacattttgtcagagtatcatttcaaccctgacatga462
<210>4
<211>81
<212>dna
<213>人工序列()
<400>4
agggctaaacgctccgggtctggagcaacaaacttctctctgctgaagcaggctggcgat60
gtggaggaaaatcctgggcca81
- 还没有人留言评论。精彩留言会获得点赞!