一种高效高纯度制备成熟DC细胞的方法与流程
本发明涉及免疫细胞制备领域,具体涉及一种高效高纯度制备成熟dc细胞的方法。
背景技术:
树突状细胞(dendriticcells,dc),是目前发现的功能最强的抗原递呈细胞。dc细胞可以有效诱导抗原特异性t细胞的增殖和活化,是机体肿瘤免疫反应的主要启动者和参与者。非成熟dc细胞有很强的抗原摄取能力;成熟的dc细胞具有很强的抗原递呈能力,能够把抗原递呈给初始型t细胞,处于启动、调控、并维持免疫应答的中心环节。dc疫苗就是首先在体外通过细胞培养的方法制备得到大量的成熟dc细胞,同时让肿瘤抗原负载dc细胞,再将这些dc细胞注入体内刺激体内特异的杀伤性淋巴细胞增殖,发挥长期肿瘤监视作用和肿瘤杀伤作用,达到消灭肿瘤的目的。
dc细胞的数量稀少,可能占外周血单个核细胞的1%;临床上使用的dc疫苗需要大量的成熟dc细胞,只能通过体外培养和制备的方法。目前获得临床级别dc细胞的主要途径是分离患者外周血单个核细胞,利用外周血单个核细胞里面的单核细胞诱导分化成成熟的dc细胞。所以,能获得大量高质量的成熟dc细胞是成为决定dc疫苗治疗效果的关键环节。
常规的dc细胞制备方法存在一系列没有被解决的问题,例如dc细胞纯度低,dc细胞成熟度不高,导致dc疫苗效果不佳、质量不稳定和产业化滞后等问题。
免疫磁珠分选法是细胞制备中常用的获取高纯度目标细胞的一种手段,磁珠分选法分为正向分选和负向分选。在正向分选流程中,磁珠结合的细胞就是目标细胞;在负向分选中,磁珠结合不需要的细胞,目标细胞就被保留在上清中。应用正向分选法虽然能得到纯度很高的目标细胞,但是抗体和磁珠会结合在目标细胞上面,从而可能会非特异性激活目标细胞或者影响目标细胞在下游实验中的功能,而且正向分选的细胞用于临床治疗也是不安全的。
技术实现要素:
本发明的目的是提供一种高效高纯度制备成熟dc细胞的方法,以解决常规制备方法中dc细胞纯度低和dc细胞成熟度不高等问题。
为达到上述目的,本发明提供了一种高效高纯度制备成熟dc细胞的方法,包括以下步骤:
步骤1:从外周血中分离出外周血单个核细胞和自体血清;
步骤2:采用免疫磁珠负向分选法从外周血单个核细胞中分离出单核细胞;
步骤3:将分离出的单核细胞分化成未成熟的dc细胞:向单核细胞的无血清基础培养基内加入自体血清、gm-csf和il-4后进行培养,得到未成熟的dc细胞;
步骤4:促使未成熟的dc细胞成熟:向未成熟的dc细胞的无血清基础培养基内加入gm-csf、il-4、il-1β、tnf-α、il-6、前列腺素e2和r848后继续培养,得到成熟的dc细胞。
上述的高效高纯度制备成熟dc细胞的方法,其中,所述步骤1具体包括:
步骤1.1:将外周血进行离心分离,分离后上层为血清层,下层为血细胞层;
步骤1.2:吸取上层血清并进行灭活处理,得到自体血清;
步骤1.3:向血细胞层加入生理盐水,得到血细胞悬液;将血细胞悬液加到人淋巴细胞分离液上并离心分离;离心后吸取中间层,得到外周血单个核细胞。
上述的高效高纯度制备成熟dc细胞的方法,其中,所述步骤2具体包括:
步骤2.1:使用分选缓冲液重悬外周血单个核细胞,以形成细胞悬液;向细胞悬液中加入fc受体阻断剂,以封闭单核细胞表面的fc受体;再加入生物素化抗体,以使其结合非单核细胞;
步骤2.2:待生物素化抗体和细胞孵育一段时间之后洗去没有结合的生物素化抗体;再向细胞悬液中加入链霉亲和素磁珠,其通过链霉亲和素结合生物素化抗体,从而使链霉亲和素磁珠间接结合非单核细胞;
步骤2.3:将细胞悬液进行磁分离,以使单核细胞富集在上清液,吸取上清液离心以得到单核细胞。
上述的高效高纯度制备成熟dc细胞的方法,其中,所述分选缓冲液为含有0.2%人血清白蛋白的生理盐水。
上述的高效高纯度制备成熟dc细胞的方法,其中,在步骤2.1中,每5×107个外周血单个核细胞加500μl分选缓冲液、100μlfc受体阻断剂和100μl生物素化抗体。
上述的高效高纯度制备成熟dc细胞的方法,其中,在步骤3中,按无血清基础培养基的体积计算,自体血清浓度是0.1~1%,gm-csf的浓度是100~1000u/ml,il-4的浓度是100~1000u/ml。
上述的高效高纯度制备成熟dc细胞的方法,其中,在步骤3中,无血清基础培养基中单核细胞的浓度为(0.2-0.8)×106个/ml。
上述的高效高纯度制备成熟dc细胞的方法,其中,在步骤4中,按无血清基础培养基的体积计算,gm-csf的浓度是100~1000u/ml,il-4的浓度是100~1000u/ml,tnf-α的浓度是100~1000u/ml,il-6的浓度是100~1000u/ml,il-1β的浓度是10~30ng/ml,前列腺素e2的浓度是1~10μg/ml和r848的浓度是1~10μg/ml。
上述的高效高纯度制备成熟dc细胞的方法,其中,步骤3中单核细胞分化成未成熟的dc细胞的培养时间是3-8天,步骤4中促使未成熟的dc细胞成熟的培养时间是1-4天。
相对于现有技术,本发明具有以下有益效果:
(1)本发明采用磁珠负向分选的方法,用生物素标记的抗体和磁珠去除掉pbmc里面的t细胞、b细胞和nk等多种杂细胞,直接收集未被抗体结合的单核细胞(untouchedmonocytes)。这既能保证得到高纯度的单核细胞,而且单核细胞的功能不会受到任何的影响。
(2)本发明在dc细胞的分化和成熟两个阶段,采用了不同的细胞因子组合,而且对细胞因子的浓度做了优化,所以本发明制备的细胞高表达多种成熟dc细胞的标志物,dc细胞的成熟度在98%以上。
(3)本发明的制备方法保证了dc细胞的纯度和成熟度,为今后制备高质量的dc疫苗打下了坚实的研发基础。
附图说明
图1为用流式细胞仪分析本发明所制得免疫细胞所得到的前向散射光和侧向散射光的散点图;
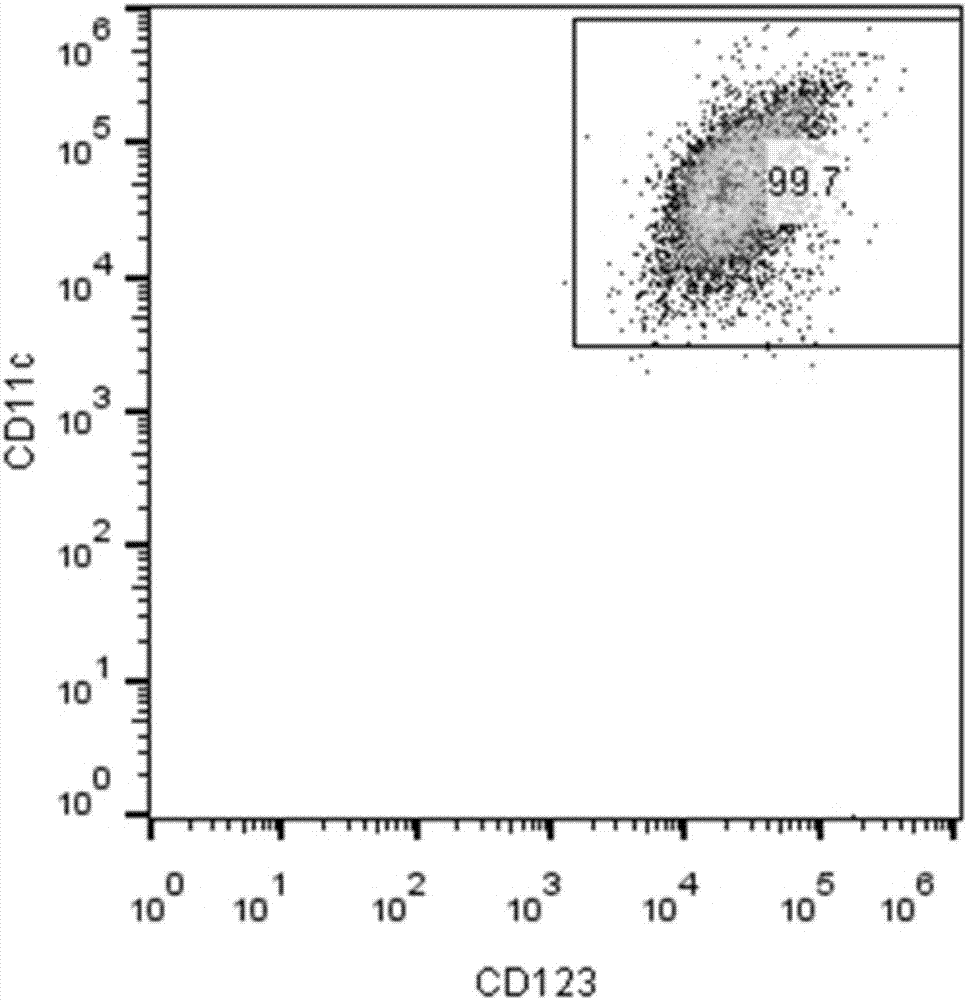
图2为所制得dc细胞中cd123和cd11c两种标志物的散点图;
图3为所制得dc细胞中cd80和cd86两种标志物的散点图。
具体实施方式
以下结合附图通过具体实施例对本发明作进一步的描述,这些实施例仅用于说明本发明,并不是对本发明保护范围的限制。
本发明提供了一种高效高纯度制备成熟dc细胞的方法,包括以下步骤:
步骤1:从外周血中分离出外周血单个核细胞和自体血清,具体包括:
步骤1.1:将外周血进行离心分离,分离后上层为血清层,下层为血细胞层;
步骤1.2:吸取上层血清并进行灭活处理,得到自体血清;
步骤1.3:向血细胞层加入生理盐水,得到血细胞悬液;将血细胞悬液加到人淋巴细胞分离液上并离心分离;离心后吸取中间层,得到外周血单个核细胞;
步骤2:采用免疫磁珠负向分选法从外周血单个核细胞中分离出单核细胞,具体包括:
步骤2.1:使用分选缓冲液重悬外周血单个核细胞,以形成细胞悬液;向细胞悬液中加入fc受体阻断剂,以封闭单核细胞表面的fc受体;再加入生物素化抗体,以使其结合非单核细胞;所述分选缓冲液为含有0.2%人血清白蛋白的生理盐水;每5×107个外周血单个核细胞加500μl分选缓冲液、100μlfc受体阻断剂和100μl生物素化抗体;
步骤2.2:待生物素化抗体和细胞孵育一段时间之后洗去没有结合的生物素化抗体;再向细胞悬液中加入链霉亲和素磁珠,其通过链霉亲和素结合生物素化抗体,从而使链霉亲和素磁珠间接结合非单核细胞;
步骤2.3:将细胞悬液进行磁分离,以使单核细胞富集在上清液,吸取上清液离心以得到单核细胞;
步骤3:将分离出的单核细胞分化成未成熟的dc细胞:向单核细胞的无血清基础培养基内加入自体血清、gm-csf和il-4后进行培养,得到未成熟的dc细胞;无血清基础培养基中单核细胞的浓度为(0.2-0.8)×106个/ml;按无血清基础培养基的体积计算,自体血清浓度是0.1~1%,gm-csf的浓度是100~1000u/ml,il-4的浓度是100~1000u/ml;单核细胞分化成未成熟的dc细胞的培养时间是3-8天;
步骤4:促使未成熟的dc细胞成熟:向未成熟的dc细胞的无血清基础培养基内加入gm-csf、il-4、il-1β、tnf-α、il-6、前列腺素e2和r848后继续培养,得到成熟的dc细胞;按无血清基础培养基的体积计算,gm-csf的浓度是100~1000u/ml,il-4的浓度是100~1000u/ml,tnf-α的浓度是100~1000u/ml,il-6的浓度是100~1000u/ml,il-1β的浓度是10~30ng/ml,前列腺素e2的浓度是1~10μg/ml和r848的浓度是1~10μg/ml;促使未成熟的dc细胞成熟的培养时间是1-4天。
在一具体实施例中,一种高效高纯度制备成熟dc细胞的方法,包括以下步骤:
步骤1:分离出自体血清和外周血单个核细胞
抽取100毫升外周血,用注射器吸出血液缓缓滴入50ml离心管中。用600g的转速离心20分钟;分离后的血液上层为血清层,下层为血细胞层。吸取上层血清,封口,56℃灭活30分钟,灭活完毕;4℃放置15分钟,用1800g的速度离心15分钟,自体血清离心结束后,分装到15ml离心管中,根据需要把血清保存在-20℃或4℃的冰箱中。
用与血细胞层等体积的生理盐水重悬下层血细胞沉淀,混合均匀。预先把人淋巴细胞分离液(密度为1.077g/ml)平衡到室温。把20ml人淋巴细胞分离液缓慢加入到50ml体积的无菌离心管中,倾斜离心管45度,在离人淋巴细胞分离液液面上1cm处把等体积的细胞悬液缓慢加到人淋巴细胞分离液上面。把离心管放入水平离心机,用500g的速度离心20分钟。
从离心管中吸取中间层白色的外周血单个核细胞,加入到新的50ml离心管中。吹打均匀,用生理盐水定容至40~50ml,600g离心10分钟。离心后弃上清,用生理盐水定容至40~50ml,吹打细胞至混匀,再次以500g离心10分钟,弃上清得到外周血单个核细胞。用无血清基础培养基(x-vivo15无血清培养基)重悬细胞,同时细胞计数;以500g离心10分钟,弃上清。
步骤2:负向分选单核细胞
每5×107个pbmc加500μl预冷的分选缓冲液、100μlfc受体阻断剂和100μl生物素化抗体混合液,混匀后,放置在4℃冰箱内,20分钟后取出。
加入4毫升分选缓冲液,混合细胞几次,在4℃下以350g的速度离心8分钟,去除上清。用500μl分选缓冲液重悬细胞,加入500μl磁珠,放置在4℃冰箱内,15分钟后取出。再加入4毫升分选缓冲液,轻轻吹打细胞十次以上。
把装有细胞的管子置于磁架上静置2分钟,把上清转移到另外一个干净的管子里面;然后在原管里面加入4毫升分选缓冲液,轻轻吹打细胞十次以上,静置在磁架上2分钟,转移上清;把两份上清合并在一起,单核细胞包含在上清里面。在含有单核细胞的上清里面加入2倍体积的无血清基础培养基,350g的速度离心8分钟,丢掉上清。
步骤3:dc细胞的分化
用无血清基础培养基调节单核细胞,使其浓度为0.5×106个/ml,加到六孔板中,每孔2~3毫升培养基;然后往基础培养基里面加入0.2%的灭活自体血清、1000u/mlgm-csf和800u/mlil-4。把六孔板放入37℃的培养箱,第2.5天时换液一次,换液的同时补足灭活的自体血清、gm-csf和il-4。
步骤4:dc细胞的成熟
细胞诱导培养到第5天的时候,换掉全部上清;往六孔板里面加入新鲜的无血清培养基,补加1000u/mlgm-csf、800u/mlil-4、10ng/mlil-1β、500u/mltnf-α、1000u/mlil-6、1μg/ml前列腺素e2和1μg/mlr848。培养到第7天的时候,收集被反复吹打起来的成熟dc细胞。
对本发明所制备的dc细胞的纯度和表型分析:
用荧光抗体标记所制备的dc细胞,然后用流式细胞仪分析dc细胞。图1是免疫细胞的前向散射光和侧向散射光的散点图,可以看出在制得的免疫细胞中dc细胞的比例在99%以上。
图2和图3是代表成熟dc细胞标志物cd123、cd11c、cd80和cd86表达水平的散点图。可以看出所制得的dc细胞高表达这些标志物,dc细胞的成熟度超过98%。
本发明采用免疫磁珠负向分选法从外周血单个核细胞中分离单核细胞,其原理如下:用预冷的分选缓冲液(含有0.2%人血清白蛋白的生理盐水)重悬外周血单个核细胞(pbmc),加入fc受体阻断剂封闭单核细胞表面的fc受体,然后往细胞里面加入多种生物素化的抗体(这些抗体能识别多种非单核细胞,分别结合cd3、cd7、cd16、cd19、cd56、cdw123和cd235a等标志物)。在抗体和细胞孵育一段时间之后洗去没有结合的抗体,往细胞悬液里面加入磁珠;磁珠是一种具有超顺磁性的化学材料,并且里面含有能够结合生物素的链霉亲和素。当把磁珠加入到细胞悬液里面以后,磁珠上面的链霉亲和素通过生物素结合抗体,从而磁珠间接的结合了pbmc里面的非单核细胞。最后把有细胞的离心管静置在磁架上,在磁场的作用下,磁珠被吸附在离心管的底部或管壁上,结合在磁珠上面的非单核细胞也被吸附在离心管的底部或管壁上,单核细胞被留在上清里面,直接吸走上清就能得到单核细胞。在负向分选中,用生物素化的抗体结合非单核细胞,再用磁珠和磁架去除非单核细胞,就能得到单核细胞。单核细胞没有被任何抗体和磁珠结合,保持了功能的完整性。
综上所述,本发明采用磁珠负向分选的方法,用生物素标记的抗体和磁珠去除掉pbmc里面的t细胞、b细胞和nk等多种杂细胞,直接收集未被抗体结合的单核细胞(untouchedmonocytes)。这既能保证得到高纯度的单核细胞,而且单核细胞的功能不会受到任何的影响。本发明在dc细胞的分化和成熟两个阶段,采用了不同的细胞因子组合,而且对细胞因子的浓度做了优化,所以本发明制备的细胞高表达多种成熟dc细胞的标志物,dc细胞的成熟度在98%以上。本发明的制备方法保证了dc细胞的纯度和成熟度,为今后制备高质量的dc疫苗打下了坚实的研发基础。
尽管本发明的内容已经通过上述优选实施例作了详细介绍,但应当认识到上述的描述不应被认为是对本发明的限制。在本领域技术人员阅读了上述内容后,对于本发明的多种修改和替代都将是显而易见的。因此,本发明的保护范围应由所附的权利要求来限定。
- 还没有人留言评论。精彩留言会获得点赞!