特异性细胞药物混合剂在美容护肤中的应用的制作方法
本发明涉及生物医药领域,具体的,本发明涉及药物组合物及其用途。
背景技术:
从古至今,美是一个永恒的话题。但岁月流逝,无论您如何保养和爱护,也不能阻止皮肤自然松弛和皱纹生成。这令人们特别是众多爱美女士显露衰老神态,自信和个人魅力减弱,产生消极情绪,影响了工作和生活的质量。同样,因为痤疮、外伤等因素引起的面部凹陷性疤痕也给人们带来了无限的烦恼和痛苦。
从皮肤的结构来看,真皮组织的厚薄与其纤维组织和基质的多少关系密切,并与皮肤的致密性,饱满度,松弛和起皱现象密切相关,近年来受到越来越多的美容皮肤科学家的关注。伴随着人生理性衰老以及外界各种刺激,真皮层中胶原蛋白、透明质酸流失的速度就开始加快,供给不及耗损;同时胶原蛋白和透明质酸的结构也逐步遭到破坏,失去了原有的弹力;而皮肤组织中能够分泌胶原蛋白和透明质酸的成纤维细胞的数量减少,合成能力也逐渐减弱,这使得皮肤开始变得松弛,出现皱纹。凹陷性疤痕主要是由于真皮层被破坏,真皮层变薄,局部凹陷,纤维细胞减少,分泌胶原蛋白和弹力纤维减少所致。
然而,如何有效延缓皮肤衰老,美化容颜仍是人们不断探求和解决的问题。
技术实现要素:
本发明旨在至少在一定程度上解决相关技术中的技术问题之一。为此,本发明提出了一种可以用于阻止皮肤自然松弛和皱纹生成的药物组合物,该药物组合物具有免疫原性低、见效快、自然性、疗效好、效果持久、风险低的优势。
在本发明的第一方面,本发明提出了一种药物组合物,所述药物组合物用于提高细胞活性。根据本发明的实施例,该药物组合物包括:间充质干细胞;以及软组织填充剂,所述软组织填充剂包括选自胶原蛋白、透明质酸、钙羟基磷灰石、聚乳酸、脂肪和富血小板血浆的至少之一,其中,所述间充质干细胞为经过依据细胞表面标志物进行分选处理后的间充质干细胞。利用根据本发明实施例的药物组合物提高细胞活性、消除皱纹、美容,相比于现有技术,克服了自体成纤维细胞移植见效慢、效果不稳定的缺陷,克服了自体脂肪移植的远期脂肪细胞成活率不稳定,并且易受重力影响而下垂,脂肪吸收不均匀,治疗效果不佳的缺陷,克服了脂肪干细胞移植手术风险高、应用范围受限等不利因素。根据本发明实施例的药物组合物,细胞群更为单一,注射到真皮层与皮下脂肪层时更有利于胶原蛋白的分泌,更有效的活化自体细胞并刺激血管的发生,使得更多的营养物质被运送到皱纹部位的皮肤,这样可以使得该部位的细胞获得更多的营养,进一步刺激自体细胞分泌胶原蛋白、透明质酸、弹性蛋白等;从而形成良性循环,促进皮肤饱满、弹性增加,也进一步使得皱纹变平隆起直至消失。此外,根据本发明实施例的药物组合物,软组织填充剂与间充质干细胞联合使用,软组织填充剂可以将间充质干细胞维持在一定的空间和体积范围内,不仅可以起到保护和润滑细胞的作用,还能够提高该范围内有效因子的作用浓度,更高效的促进目标细胞活性的增加。根据本发明实施例的药物组合物具有免疫原性低、见效快、自然性、疗效好、效果持久、风险低的优势。
根据本发明的实施例,上述药物组合物还可以进一步包括如下附加技术特征至少之一:
根据本发明的实施例,所述间充质干细胞为脐带间充质干细胞。脐带间充质干细胞来源广泛,且脐带间充质干细胞免疫原性更低,更加安全,脐带间充质干细胞则能够不断分泌胶原蛋白并进一步分泌包括SCF、bFGF、VEGF、IGF等在内的因子,刺激真皮层中成纤维细胞存活与增殖并进一步分泌胶原蛋白、透明质酸和弹性纤维。此外,脐带间充质干细胞以旁分泌方式产生多种血管生成因子,可以促进形成新的毛细血管网。不仅如此,由于脐带间充质干细胞在一定条件下也可转化为内皮细胞参与微血管的形成,而经过特殊表面标志分选后的脐带间充质干细胞招募机体本身内皮细胞的潜能、脐带间充质干细胞向内皮分化的潜能都有明显提高,可以进一步起到营养真皮及皮下相关细胞的作用,本发明实施例的方法用于提高细胞活性更加持久、有效。
根据本发明的实施例,所述间充质干细胞为P1~P6代间充质干细胞。发明人通过实验发现,大于P6代的间充质干细胞细胞状态不如早代次的细胞、分泌的细胞因子量也有所减少,P1~P6代间充质干细胞本身状态良好、细胞活性和因子分泌较强,用于提高细胞活性效果更佳。
根据本发明的实施例,所述细胞表面标志物包括选自NG-2、Cx43、DLK1、PDGFR-α(CD140a)、PDGFR-β(CD140b)、CD13、CD44、CD105、CD133、CD146、CD248、Flt-1和KDR(CD309)的至少之一。发明人发现,间充质干细胞经过依据NG-2、Cx43、DLK1、PDGFR-α(CD140a)、PDGFR-β(CD140b)、CD13、CD44、CD105、CD133、CD146、CD248、Flt-1和KDR(CD309)的至少之一的细胞表面标志物分选后,所得的间充质干细胞对营养细胞、细胞进一步的血管化有明显的促进作用,采用上述分选后的间充质干细胞的用于提高细胞活性,药效更好。
根据本发明的实施例,所述分选处理后间充质干细胞以悬浮于培养基、悬浮于生理盐水或贴壁培养于培养基中的形式提供的。根据本发明的实施例,所述间充质干细胞以上述三种形式的其中一种提供,可保持间充干细胞的良好细胞状态。
根据本发明的实施例,所述分选处理后间充质干细胞以悬浮于培养基或悬浮于生理盐水中的形式提供,所述间充质干细胞的密度为0.1*106-10*106个/ml。发明人通过实验发现,间充质干细胞在培养基或生理盐水中的悬浮密度为0.1*106-10*106个/ml,可进一步保证间充质干细胞的良好状态并提供合适大小的体积比,进而使得本发明实施例的药物组合物用于提高细胞活性的效果更佳。
根据本发明的实施例,所述培养基或所述生理盐水与所述软组织填充剂的体积比为1:0.5~1:5。发明人发现,间充质干细胞的在培养基或生理盐水中的悬浮密度为0.1*106-10*106个/ml,培养基或生理盐水与软组织填充剂的体积比为1:0.5~1:5,使得本发明实施例的药物组合物用于提高细胞活性的效果更佳。
根据本发明的实施例,所述分选处理后间充质干细胞以贴壁培养于培养基中的形式提供,所述间充质干细胞的贴壁密度为1*104~3*104个/cm2。发明人通过实验发现,间充质干细胞贴壁培养于培养基中,贴壁密度为1*104~3*104个/cm2,可进一步保证间充质干细胞的良好状态,进而使得本发明实施例的药物组合物用于提高细胞活性的效果更佳。
根据本发明的实施例,所述培养基与所述软组织填充剂的体积比为1:0.5~1:5。发明人发现,培养基与软组织填充剂的体积比在1:0.5~1:5范围内,所述药物组合物在提高细胞的活性上效果更加显著。
根据本发明的实施例,所述药物组合物的剂型为注射剂。药物组合物以注射剂的剂型提供,药物组合物能够更加精准地抵达待治疗位点,且能够避免药物组合物在胃部被降解,药物组合物的治疗效果会更加有效、持久。
在本发明的第二方面,本发明提出了前面所述药物组合物在制备药物中的用途,所述药物用于抵抗衰老、消除皱纹。本发明实施例的药物用于抵抗衰老、消除皱纹,具有见效快、药效持久、免疫原性低、自然性和风险低的优势。
附图说明
图1是根据本发明实施例的脐带间充质干细胞的形态图;以及
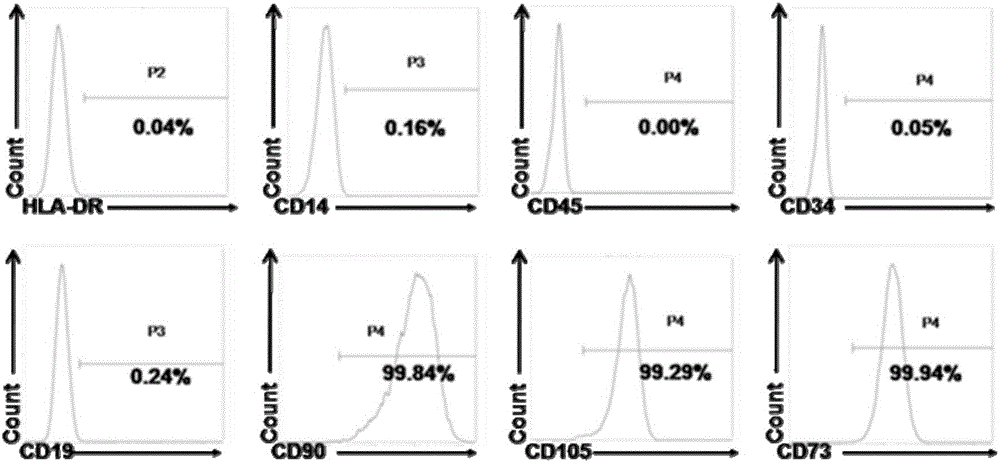
图2是根据本发明实施例的通过流式细胞检测鉴定所选择的脐带间充质干细胞的表面标志物的结果图。
具体实施方式
下面详细描述本发明的实施例。下面描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。
药物组合物
本发明的第一方面,本发明提出了一种药物组合物,该药物组合物用于提高细胞活性。根据本发明的实施例,该药物组合物包括:间充质干细胞;以及软组织填充剂,所述软组织填充剂包括选自胶原蛋白、透明质酸、钙羟基磷灰石、聚乳酸、脂肪和富血小板血浆的至少之一,其中,所述间充质干细胞为经过依据细胞表面标志物分选处理后的间充质干细胞。利用根据本发明实施例的药物组合物提高细胞活性、消除皱纹、美容,相比于现有技术,克服了自体成纤维细胞移植见效慢、效果不稳定的缺陷,克服了自体脂肪移植的远期脂肪细胞成活率不稳定,并且易受重力影响而下垂,脂肪吸收不均匀,治疗效果不佳的缺陷,克服了脂肪干细胞移植手术风险高、应用范围受限等不利因素。根据本发明实施例的药物组合物采用经过依据细胞表面标志物分选处理后的间充质干细胞,纯度更高,细胞群更为单一,注射到真皮层与皮下脂肪层时更有利于胶原蛋白的分泌,更有效的活化自体细胞并刺激血管的发生,使得更多的营养物质被运送到皱纹部位的皮肤。间充质干细胞和包括选自胶原蛋白、透明质酸、钙羟基磷灰石(微晶瓷)、聚乳酸、脂肪和富血小板血浆的至少之一复合填充,塑型丰满、见效快;其修复疤痕和皱纹,不破坏皮肤原本结构,用间充质干细胞分泌的生长因子激活自体成纤维细胞的功能,并进一步增加数量,达到填充改善皮肤活性状态,具有自然性;此外,注射到皮肤缺陷处的包括选自胶原蛋白、透明质酸、钙羟基磷灰石(微晶瓷)、聚乳酸、脂肪和富血小板血浆的至少之一复合填充具有除皱的效果,修复皮肤的平整、光泽和弹性,效果持久;最后,该药物组合物可采用注射填充,规避了手术的失败风险,是一种非常安全的药物。另外,发明人发现,本发明公开的提高细胞活性的方法具有明显优于二者单独使用的优势——软组织填充剂可以将间充质干细胞维持在一定的空间和体积范围内,不仅可以起到保护和润滑细胞的作用,还能够提高该范围内有效因子的作用浓度,更高效的促进目标细胞活性的增加。以透明质酸为例,其与间充质干细胞的联合使用除了有上述优势之外,透明质酸还可以起到保持间充质干细胞水分,保护间充质干细胞不受病原菌的侵害等作用。
根据本发明的另一具体实施例,所述间充质干细胞为脐带间充质干细胞。脐带间充质干细胞来源广泛,它可采用从医疗废弃物——脐带中分离间充质干细胞,不需要从患者身上取材,免去患者手术的风险和痛苦,且脐带间充质干细胞免疫原性更低,更加安全,脐带间充质干细胞可进一步分泌包括SCF、bFGF、VEGF、IGF等在内的因子,刺激真皮层中成纤维细胞存活与增殖并进一步分泌胶原蛋白、透明质酸和弹性纤维,此外,脐带间充质干细胞以旁分泌方式产生多种血管生成因子,可以促进形成新的毛细血管网。不仅如此,由于脐带间充质干细胞在一定条件下也可转化为内皮细胞参与微血管的形成,而经过特殊表面标志分选后的脐带间充质干细胞招募机体本身内皮细胞的潜能、脐带间充质干细胞向内皮分化的潜能都有明显提高,可以进一步起到营养真皮及皮下相关细胞的作用,药效更加有力。
根据本发明的具体示例,所述间充质干细胞为P1~P6代间充质干细胞。发明人通过实验发现,P6代以上的间充质干细胞的细胞状态不如早代次的细胞、分泌的细胞因子量也有所减少,P1~P6代间充质干细胞的细胞状态佳,细胞活性和因子分泌能力较强,用于提高细胞的活性的效果更加显著。
根据本发明的实施例,所述细胞表面标志物包括选自NG-2、Cx43、DLK1、PDGFR-α(CD140a)、PDGFR-β(CD140b)、CD13、CD44、CD105、CD133、CD146、CD248、Flt-1和KDR(CD309)的至少之一。发明人发现,间充质干细胞经过依据NG-2、Cx43、DLK1、PDGFR-α(CD140a)、PDGFR-β(CD140b)、CD13、CD44、CD105、CD133、CD146、CD248、Flt-1和KDR(CD309)的至少之一的细胞表面标志物分选处理后,间充质干细胞的纯度更高,所得的间充质干细胞对细胞活性、营养细胞、细胞进一步的血管化有明显的促进作用,本发明的药物组合物采用上述分选后的间充质干细胞的用于提高细胞活性,药效更好。
根据本发明的具体示例,所述分选处理后间充质干细胞以悬浮于培养基、悬浮于生理盐水或贴壁培养于培养基中的形式提供的。发明人通过实验意外地发现,间充质干细胞以悬浮于培养基、悬浮于生理盐水或贴壁培养于培养基中的形式提供,可保证间充质干细胞良好的生长状态。
根据本发明的具体实施例,所述分选处理后间充质干细胞以悬浮于培养基或悬浮于生理盐水中的形式提供,所述间充质干细胞的密度为0.1*106-10*106个/ml。有利于保持间充质干细胞的活性,有利于保持间充质干细胞较高的分泌生长因子以及胶原蛋白,进而使得本发明实施例的药物组合物用于提高细胞活性的效果更加显著。
根据本发明的实施例,所述培养基或所述生理盐水与所述软组织填充剂的体积比为1:0.5~1:5。发明人发现,分选处理后间充质干细胞的在培养基或生理盐水中的悬浮密度为0.1*106-10*106个/ml,培养基或生理盐水与软组织填充剂的体积比为1:0.5~1:5,既可以保证间充质干细胞良好的细胞状态,又可以保证软组织填充剂有力的正向生理效应,如体外模拟或者应用于法令纹、嘴角凹纹、额眉间皱纹的填补,甚至可以用在修鼻尖鼻梁、丰唇、修下巴、青春痘与水痘凹疤修正,从而产生光滑、饱满、有弹性的皮肤。培养基或生理盐水与软组织填充剂的体积比为1:0.5~1:5,使得本发明实施例的药物组合物用于提高细胞活性的效果更佳。
根据本发明的一些具体实施例,所述分选处理后间充质干细胞以贴壁培养于培养基中的形式提供,所述间充质干细胞在所述培养基中的密度为1*104~3*104个/cm2。发明人发现,细胞生长有密度依赖效应,过密或者过稀都会影响细胞状态,密度小于1*104个/cm2时,细胞状态差;高于3*104个/cm2时,细胞没有足够的空间生长,培养基的过度消耗,细胞状态差。根据本发明的具体实施例,间充质干细胞贴壁培养于培养基中,其贴壁密度为1*104~3*104个/cm2,有利于保持间充质干细胞的活性,有利于保持间充质干细胞较高的分泌生长因子以及胶原蛋白,进而使得本发明实施例的药物组合物用于提高细胞活性的效果更加显著。
根据本发明的实施例,所述药物组合物的剂型为注射剂。本发明的药物组合物可以通过任何常见的途径被给药,只要它可以到达预期的组织,主要通过注射的途径给药。给药的各种方式是可以预期的,包括皮下,皮层,局部,但是本发明不限于这些已举例的给药方式。优选地,本发明的组合物以注射剂的剂型提供,本发明的药物组合物能够更加精准地抵达待治疗位点,药物组合物的治疗效果会更加有效、持久。此外,本发明的药物组合物可以使用将活性成分传送到靶细胞的特定器械来给药。
本发明的药物组合物的给药频率和剂量可以通过多个相关因素被确定,该因素包括要被处理的人的年龄,性别,体重和疤痕等的严重程度以及作为活性成分的药物类型。根据本发明的一些实施例,剂量可分为适宜形式的1剂、2剂或多剂,以在整个时间段内以1次、2次或多次给药,只要达到美容有效量即可。
术语“美容有效量”是指药物组合物足以显著改善某些症状的量,也即为给定症状提供美容效果的量。例如,在美容中,减少、预防、延缓、抑制或阻滞任何症状的药物应当是美容有效的。美容有效量的药物不需要消除症状,但将为症状提供美容,使得个体症状的发作被延缓、阻止或预防,或者症状得以缓解,或者症状的期限被改变。术语“美容”用于指获得期望的药理学和/或生理学效果。所述效果就完全或部分预防症状而言可以是预防性的。本文使用的“美容”涵盖哺乳动物、特别是人的症状。本文使用的“美容”涵盖将药物给予个体以治愈、缓解、改善、减轻或抑制个体的症状的任何用药,包括但不限于将含本文所述药物组合物给予有需要的个体。
根据本发明的实施例,本发明的药物组合物可与常规美容方法和/或疗法相结合使用,或者可与常规美容方法和/或疗法分开使用。当本发明的药物组合物在采用与其它药物的联合疗法中给药时,它们可序贯地或同时地给予个体。或者,本发明的药物组合物可包含药学上可接受的载体或药学上可接受的赋形剂以及本领域已知的其它美容药的组合。
药物组合物的用途
在本发明的第二方面,本发明提出了前面所述药物组合物在制备药物中的用途,所述药物用于抵抗衰老、消除皱纹。本发明实施例的药物组合物中的间充质干细胞不仅可以分泌包括bFGF、VEGF、IGF等在内的细胞因子,发挥营养、刺激真皮层中成纤维细胞存活与增殖,进一步分泌胶原蛋白、透明质酸和弹性纤维,充盈真皮层结构,抚平皱纹,填补凹陷;本身就可以分泌产生胶原蛋白,进一步增加皮肤的厚度和弹性,使凹陷部分得到舒展,填平皱纹和缺损,恢复皮肤的弹性和光泽。本发明实施例的药物组合物中的间充质干细胞为经过细胞表面标志物分选后的间充质干细胞,纯度更高、疗效更好。同时进一步复合透明质酸、胶原蛋白等回输到患者皮肤缺陷处可进行有效的皱纹消除、疤痕及创伤修复、抵抗衰老等。本发明实施例的药物用于抵抗衰老、消除皱纹,具有见效快、药效持久、免疫原性低、自然性和风险低的优势。
提高细胞活性的方法
在本发明的第三方面,本发明提出了一种提高细胞活性的方法。根据本发明的实施例,该方法包括:将间充质干细胞依据细胞表面标志物进行分选处理;以及将目标细胞与分选处理后间充质干细胞以及软组织填充剂进行接触,所述软组织填充剂包括选自胶原蛋白、透明质酸、钙羟基磷灰石、聚乳酸、脂肪和富血小板血浆的至少之一。利用根据本发明实施例的提高细胞活性的方法,以用来消除皱纹、美容,相比于现有技术,克服了自体成纤维细胞移植见效慢、效果不稳定的缺陷,克服了自体脂肪移植的远期脂肪细胞成活率不稳定,并且易受重力影响而下垂,脂肪吸收不均匀,治疗效果不佳的缺陷,克服了脂肪干细胞移植手术风险高、应用范围受限等不利因素。根据本发明实施例的方法,使得该细胞群更为单一,注射到真皮层与皮下脂肪层时更有利于胶原蛋白的分泌,更有效的活化自体细胞并刺激血管的发生,使得更多的营养物质被运送到皱纹部位的皮肤。间充质干细胞和包括选自胶原蛋白、透明质酸、钙羟基磷灰石(微晶瓷)、聚乳酸、脂肪和富血小板血浆的至少之一复合填充,塑型丰满、见效快;其修复疤痕和皱纹,不破坏皮肤原本结构,用间充质干细胞分泌的生长因子激活自体成纤维细胞的功能,并进一步增加数量,达到填充改善皮肤活性状态,具有自然性;此外,注射到皮肤缺陷处的透明质酸或胶原蛋白本身就具有除皱的效果,修复皮肤的平整、光泽和弹性,效果持久;最后,该方法规避了手术的失败风险,是一种非常安全的方法。另外,发明人发现,本发明公开的提高细胞活性的方法具有明显优于二者单独使用的优势——软组织填充剂可以将间充质干细胞维持在一定的空间和体积范围内,不仅可以起到保护和润滑细胞的作用,还能够提高该范围内有效因子的作用浓度,更高效的促进目标细胞活性的增加。以透明质酸为例,其与间充质干细胞的联合使用除了有上述优势之外,透明质酸还可以起到保持间充质干细胞水分,保护间充质干细胞不受病原菌的侵害等作用。
根据本发明的另一具体实施例,所述间充质干细胞为脐带间充质干细胞。脐带间充质干细胞来源广泛,它可采用从医疗废弃物——脐带中分离间充质干细胞,不需要从患者身上取材,免去患者手术的风险和痛苦,且脐带间充质干细胞免疫原性更低,更加安全,脐带间充质干细胞可进一步分泌包括SCF、bFGF、VEGF、IGF等在内的因子,刺激真皮层中成纤维细胞存活与增殖并进一步分泌胶原蛋白、透明质酸和弹性纤维,此外,脐带间充质干细胞以旁分泌方式产生多种血管生成因子,可以促进形成新的毛细血管网。不仅如此,由于脐带间充质干细胞在一定条件下也可转化为内皮细胞参与微血管的形成,而经过特殊表面标志分选后的脐带间充质干细胞招募机体本身内皮细胞的潜能、脐带间充质干细胞向内皮分化的潜能都有明显提高,可以进一步起到营养真皮及皮下相关细胞的作用,药效更加有力。
根据本发明的具体示例,所述间充质干细胞为P1~P6代间充质干细胞。发明人通过实验发现,P6代以上的间充质干细胞的细胞状态不如早代次的细胞、分泌的细胞因子量也有所减少,P1~P6代间充质干细胞的细胞状态佳,细胞活性和因子分泌能力较强,用于提高细胞的活性的效果更加显著。
根据本发明的实施例,所述细胞表面标志物包括选自NG-2、Cx43、DLK1、PDGFR-α(CD140a)、PDGFR-β(CD140b)、CD13、CD44、CD105、CD133、CD146、CD248、Flt-1和KDR(CD309)的至少之一。发明人发现,间充质干细胞经过依据NG-2、Cx43、DLK1、PDGFR-α(CD140a)、PDGFR-β(CD140b)、CD13、CD44、CD105、CD133、CD146、CD248、Flt-1和KDR(CD309)的至少之一的细胞表面标志物进行分选后,间充质干细胞的纯度更高,所得的间充质干细胞对营养细胞、细胞进一步的血管化有明显的促进作用,采用上述分选后的间充质干细胞的用于提高细胞活性,药效更好。
根据本发明的具体示例,所述分选处理后间充质干细胞以悬浮于培养基、悬浮于生理盐水或贴壁培养于培养基中的形式提供的。发明人通过实验意外地发现,间充质干细胞以悬浮于培养基、悬浮于生理盐水或贴壁培养于培养基中的形式提供,可保证间充质干细胞良好的生长状态。
根据本发明的具体实施例,所述分选处理后间充质干细胞以悬浮于培养基或悬浮于生理盐水中的形式提供,所述间充质干细胞的密度为0.1*106-10*106个/ml。有利于保持间充质干细胞的活性,有利于保持间充质干细胞较高的分泌生长因子以及胶原蛋白,进而使得本发明实施例的方法用于提高细胞活性的效果更加显著。
根据本发明的实施例,所述培养基或所述生理盐水与所述软组织填充剂的体积比为1:0.5~1:5。发明人发现,分选处理后间充质干细胞的在培养基或生理盐水中的悬浮密度为0.1*106-10*106个/ml,培养基或生理盐水与软组织填充剂的体积比为1:0.5~1:5,既可以保证间充质干细胞良好的细胞状态,又可以保证软组织填充剂有力的正向生理效应,如体外模拟或者应用于法令纹、嘴角凹纹、额眉间皱纹的填补,甚至可以用在修鼻尖鼻梁、丰唇、修下巴、青春痘与水痘凹疤修正,从而产生光滑、饱满、有弹性的皮肤。培养基或生理盐水与软组织填充剂的体积比为1:0.5~1:5,使得本发明实施例的用于提高细胞活性的方法的效果更佳。
根据本发明的一些具体实施例,所述分选处理后间充质干细胞以贴壁培养于培养基中的形式提供,所述间充质干细胞在所述培养基中的密度为1*104~3*104个/cm2。发明人发现,细胞生长有密度依赖效应,过密或者过稀都会影响细胞状态,密度小于1*104个/cm2时,细胞状态差;高于3*104个/cm2时,细胞没有足够的空间生长,培养基的过度消耗,细胞状态差。根据本发明的具体实施例,间充质干细胞贴壁培养于培养基中,其贴壁密度为1*104~3*104个/cm2,有利于保持间充质干细胞的活性,有利于保持间充质干细胞较高的分泌生长因子以及胶原蛋白,进而使得本发明实施例的方法用于提高细胞活性的效果更加显著。
根据本发明的一些具体实施例,所述培养基与所述软组织填充剂的体积比为1:0.5~1:5。发明人发现,培养基与软组织填充剂的体积比在1:0.5~1:5范围内,所述方法在提高细胞的活性上效果更加显著。
根据本发明的实施例,所述目标细胞、所述分选处理后间充质干细胞的个数比为1:0.1~1:10。发明人发现,目标细胞、分选处理后间充质干细胞的个数比高于1:0.1,间充质干细胞的数量相对较少,其分泌的因子量低,不足以促进大量的目标细胞活性的增加;目标细胞、间充质干细胞的个数比低于1:10,目标细胞的数量过少,造成间充质干细胞分泌因子的饱和,在一定程度上造成一定的细胞和因子的浪费。目标细胞、所述间充质干细胞的个数比为1:0.1~1:10内,对提高目标细胞的活性更加快速、有效。
需要说明的是,本申请所述“美容”“去皱”“疤痕及创伤修复”等是以非治疗为目的的。
需要说明的是,本申请中所述的“目标细胞与间充质干细胞以及软组织填充剂进行接触”,既可以是细胞个体与填充剂之间的接触,也可以是间充质干细胞分泌的细胞因子与目标细胞及软组织填充剂之间的接触。
需要说明的是,本申请中所述的“细胞活性”是指细胞的生理状态和功能,包括细胞基本状态、细胞增殖能力(有时称为活力)、分泌因子的能力以及常规细胞功能的维持。
需要说明的是,本申请所述的“细胞状态良好”是指细胞维持正常培养时的形态好(以间充质干细胞为例,细胞贴壁,细胞呈梭形,片状生长),细胞透亮、边缘清楚,细胞折光性较好,整个细胞培养过程中无污染物(包括支原体、细菌、真菌、黑胶充、原虫等)出现。
下面详细描述本发明的实施例。下面描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
实施例1
在本实施例中,发明人筛选了包括不同来源的间充质干细胞与胶原蛋白或透明质酸或钙羟基磷灰石(微晶瓷)或聚乳酸或脂肪或富血小板血浆的药物组合物对提高细胞活性的影响,在本实施例中,所待提高活性的细胞为成纤维细胞,不同来源的间充质干细胞包括:脐带血来源的、外周血来源的、脐带来源的、胎盘来源的、羊膜来源的、骨髓来源的、骨膜来源的、脂肪来源的、牙齿来源的等。发明人发现,脐带来源的间充质干细胞相比于其他来源的间充质干细胞,本身属于医疗废弃物,细胞免疫原性更低,具有一定的通用性,所获得的细胞质量高、数量多、纯度也较高。进而在后续实验中,发明人选择包括脐带来源的间充质干细胞与胶原蛋白或透明质酸或钙羟基磷灰石(微晶瓷)或聚乳酸或脂肪或富血小板血浆的药物组合物进行后续检测。以下,以间充质干细胞与透明质酸的药物组合物为例,进行详细分析和描述。
实施例2
在本实施例中,发明人对所选用的脐带间充质干细胞的形态和表型进行了观察和鉴定。结果如下所述:
脐带间充质干细胞的形态表现为细胞贴壁,呈梭形,片状生长。具体形态如图1所示。脐带间充质干细胞在如图1的生长状态下,脐带间充质干细胞的增殖能力强,分泌包括bFGF、VEGF、IGF等在内的细胞因子以及胶原蛋白的增殖能力强,适于选择作为本发明药物组合物的脐带间充质干细胞。
发明人通过流式细胞检测鉴定所选择的脐带间充质干细胞表达CD90(阳性细胞率:99%)、CD105(阳性细胞率:99%),CD73(阳性细胞率:99%),不表达HLA-DR,CD14,CD19,CD34和CD45,结果如图2所示。
实施例3
在本实施例中,发明人进一步对所获得的脐带间充质干细胞进行细胞表面标志物分选,发明人发现,依据NG-2、Cx43、DLK1、PDGFR-α(CD140a)、PDGFR-β(CD140b)、CD13、CD44、CD105、CD133、CD146、CD248、Flt-1和KDR(CD309)的至少之一细胞表面标志物进行分选后,所得的间充质干细胞对细胞活性、营养细胞、细胞进一步的血管化有明显的促进作用。
实施例4
在本实施例中,发明人对所分选处理后的脐带来源的间充质干细胞与透明质酸的用量上进行了筛选。
发明人进行了间充质干细胞的细胞活率实验,实验过程如下所述:
1、消化脐带间充质干细胞:将一瓶生长至80%~90%的分选处理后的脐带间充质干细胞使用胰酶消化,培养基中和后,在1200rpm的条件下离心5min。
2、重悬细胞:离心后弃上清,使分选处理后的脐带间充质干细胞培养基进行重悬。
3、接种细胞:将细胞按照同样的体积(100ul)进行接种(每孔2000个间充质干细胞),每个孔重复5次,一共开展实验3天,即每个孔有15个重复样。之后将接种后的细胞于37℃,5%CO2培养箱中过夜培养。
4、添加透明质酸/胶原蛋白:待细胞过夜培养贴壁后弃旧的培养基,并添加入新鲜的培养基。其中,对照组只添加培养基,实验组按照如下体积比添加透明质酸,其中培养基:透明质酸的体积比为:1:0.01,1:0.1,1:0.5,1:1,1:5,1:10,总体积为100μl。
5、检测:24小时、48小时和72小时后用枪头丢掉培养基和透明质酸/胶原蛋白,之后PBS洗一次,加入100μl新鲜的培养基,并加入10μl CCK8,轻柔混匀,避免气泡的产生,之后37℃,5%CO2培养箱中静置3-4小时,之后于OD560处检测吸光光度值。全部时间点检测完毕后,进行统计数据的分析。
实验结果显示,培养基与透明质酸的体积比在1:0.5-1:5的范围内均可保持间充质干细胞的基本活性,间充质干细胞的活性佳。在体积比为1:0.01和1:0.1时,透明质酸过稀,影响透明质酸的效果的发挥;体积比为1:10,则间充质干细胞的细胞状态变差,间充质干细胞死亡率明显上升。故优选培养基与透明质酸的体积比为1:0.5-1:5。
实施例5
在本实施例中,发明人利用分选处理后的脐带来源的间充质干细胞与透明质酸与成纤维细胞共培养,并对成纤维细胞的活性进行了检测。
实验过程如下所述:
1、消化成纤维细胞:将一瓶生长至80%~90%的成纤维细胞使用胰酶消化,培养基中和后,在1200rpm的条件下离心5min。
2、在消化成纤维细胞的同时,消化分选处理后贴壁培养的脐带间充质干细胞。具体操作如下所述:将一瓶生长至80%~90%的脐带间充质干细胞使用胰酶消化,培养基中和后,在1200rpm的条件下离心5min。
3、重悬细胞:离心后弃上清,使用培养基将细胞按照1*105个/ml的密度进行重悬。
4、接种细胞:将1*104个成纤维细胞接种到24孔板中,每个孔重复3次(一共有3个检测时间点,即每个孔有9个重复样),之后放置孔径为1μm的Transwell小室(悬挂式细胞培养皿)并将0.7*104个间充质干细胞接种于小室,培养基总体积为接近小室上沿为最佳,之后将接种后的细胞于37℃,5%CO2培养箱中过夜培养。
5、添加透明质酸:待细胞过夜培养贴壁后弃旧的培养基,PBS洗1次后加入新鲜的无血清培养基。其中,对照组只添加培养基,实验组按照Transwell小室(悬挂式细胞培养皿)培养基体积与透明质酸体积比为1:1添加透明质酸。
6、检测:12小时、24小时和48小时后仅保留成纤维细胞并使用PBS洗一次,加入1ml新鲜的无血清培养基,并加入100μl CCK8,轻柔混匀,避免气泡的产生,之后37℃,5%CO2培养箱中静置3-4小时,之后于OD560处检测吸光光度值。全部时间点检测完毕后,进行统计数据的分析。
实验结果显示,细胞培养12和24小时后有间充质干细胞以及软组织填充剂所在的实验组,细胞状态和检测的OD值要明显优于单独使用无血清培养基组;48小时后,由于细胞长期处于无血清培养的状态下,整体状态均不如12小时和24小时,但是也可观察到实验组的结果优于对照组。上述实验结果证明,分选处理后的间充质干细胞以及软组织填充剂可以提高目标细胞的活性,例如成纤维细胞。
实施例6
在本实施例中,发明人进一步通过动物实验验证了本发明实施例的药物组合物的用药效果。
将分选处理后间充质干细胞以1×106/mL的密度(悬浮于生理盐水)与注射用玻尿酸(透明质酸)(瑞蓝2号)按照1:2的比例在进行实验之前进行混合,混合均匀后形成细胞-玻尿酸复合物。之后开展动物实验,具体操作为分组植入雄性BLAB/c裸鼠(体量约20g,购自维通利华,生产许可证号:SCXK(京)2012-0001)。实验鼠自身即为对照组和实验组,分别将注射用玻尿酸(左侧),脐带间充质干细胞-玻尿酸复合物(右侧),按每一样本0.3mL注射于裸鼠背部腰臀皮肤的左侧和右侧,每组各1个点,6-10周后再次观察注射部位形态。
具体结果如下:
(1)未注射之前的观察:准备开展动物实验的雄性BLAB/c裸鼠在未注射前,其背部皮肤规整,没有异常突起的形态。
(2)完成注射后的观察:将裸鼠左侧腰臀部皮肤皮内注射300μl玻尿酸,右侧腰臀部平行部位的皮肤注射300μl脐带间充质干细胞-玻尿酸复合物。从形态上看,小鼠腰臀部左右各有一个大小相当的突起,隆起高度约为0.5cm,半径约为0.4cm左右的圆形(接近圆形,基本为椭圆形)用手感觉有一定的硬度,能够维持一定形态。
(3)完成注射后6-10周的观察:实验开展6-10周后,再次观察动物形态。左侧单独注射玻尿酸组形成的皮肤隆起状态已逐渐降低(大小基本可以忽略),但是右侧注射脐带间充质干细胞-玻尿酸复合物的一侧还有一定的隆起形态,隆起高度约为0.3cm,半径约为0.4cm左右的圆形(接近圆形,基本为椭圆形),隆起幅度明显高于单独注射玻尿酸组。这表明脐带间充质干细胞-玻尿酸复合物对塑形后的维持更为长久。
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种肿瘤特异抗原及其应用的制作方法与工艺
- 用于制备具有增加的特异性基因表达的树突细胞的方法和包含使用所述方法制备的树突细胞的用于治疗或预防自身免疫性疾病的组合物与流程
- 一种兼有NK细胞特质的抗原特异性T细胞的制备方法与流程
- 一种特异性肿瘤抗原NSE的CTL识别表位肽及其应用的制作方法与工艺
- 一种特异性肿瘤抗原SF的CTL识别表位肽及其应用的制作方法与工艺
- 用于建立具有编码抗原特异性T细胞受体的基因的多能性干细胞的方法与流程
- 用于建立具有编码抗原特异性T细胞受体的基因的多能性干细胞的方法与流程
- 特异性识别胃癌细胞的DNA适配子GCA‑5及其应用的制造方法与工艺
- 一种制备结直肠癌抗原特异性T细胞的方法与流程
- 用作诱导抗原特异性T细胞反应的免疫原性增强剂的融合蛋白的制造方法与工艺