蓝舌病病毒VP7蛋白群特异性抗原表位多肽及其应用的制作方法
本发明涉及一种抗原表位多肽,特别涉及一种蓝舌病病毒25型VP7蛋白单克隆抗体3H7细胞株识别的蓝舌病病毒VP7蛋白群特异性抗原表位多肽及其在检测蓝舌病病毒中的用途,本发明属于生物技术领域。
背景技术:
目前世界上多个国家都已分离到蓝舌病病毒(Bluetongue virus,BTV),并且随着全球气候变暖该病的分布范围在不断的扩大,呈现全球性分布。迄今为止已发现27种血清型的蓝舌病病毒,各型之间无交叉保护[1-2]。世界动物卫生组织(OIE)将蓝舌病列为必须通报疫病,我国也将蓝舌病列为一类疫病。该病主要通过库蠓、伊蚊等进行传播,也可经由胎盘感染胎儿进行垂直传播[3]。BTV主要感染绵羊等反刍类动物,其主要症状为病畜体温升高,精神萎靡、厌食流涎,患畜诸多部位出现不同程度的水肿。口腔黏膜充血、糜烂、发绀,为蓝舌病的典型症状。BTV25型于2008年从瑞士山羊血液样本中分离获得。BTV 25型的VP2与其他血清型病毒VP2的同源性仅为23%-79%。感染BTV25型的牲畜无典型症状,常常被忽略,疫病一旦爆发,会造成极为严重的经济损失[4]。
蓝舌病于1876年首次发现以来,新的血清型不断的被发现,同时爆发的范围也在逐渐的扩大。2014年在法国科西嘉岛首次发现并分离到了27型蓝舌病病毒[5],有报道称目前正在中东及南非相继发现并正在分离28型和29型蓝舌病病毒[6-7]。我国已检测出BTV-1、BTV-2、BTV-3、BTV-4、BTV-12、BTV-15、BTV-16七种血清型,其中BTV1型和16型为我国主要的致病血清型[8]。
BTV基因组由10个线性双链RNA组成,总分子量为1.3×107Da。基因组由大片段(L1-L3)、中片段(M4-M6)、小片段(S7-S10)组成,其共编码7个结构蛋白(VP1-VP7)和4种非结构蛋白(NS1、NS2、NS3/NS3a和NS4)[9-10]。蓝舌病的病毒有双衣壳结构,L2和M5基因编码的VP2和VP5是构成BTV外壳主要成分,约为病毒总蛋白的40%。病毒内壳即核心衣壳主要由L3和S7编码的VP3和VP7构成。VP7在核衣壳内主要是以三聚体的形式存在,VP3是亚核心颗粒的主要蛋白,两者均是BTV群特异性抗原。
病毒基因组及VP1、VP4、VP6三种结构蛋白被包裹在核心衣壳内部[11]。VP7蛋白是用于建立BTV群特异性血清学检测方法的最佳选择,由于在所有血清型当中其序列和抗原性是高度保守。细胞被BTV感染后,VP7是最早被检测出的抗原,而且BTV感染动物后,抗VP7抗体是机体产生的抗BTV主要的抗体之一。在缺乏VP2或VP5的情况下VP7可调节BTV对昆虫细胞的吸附和侵入[12]。
因此,蓝舌病病毒VP7蛋白的群特异性抗原表位多肽的鉴定,对于BT疫苗的设计及高通量蓝舌病病毒检测试剂盒的研制均具有重要意义。
参考文献:
[1]苗志强,郑明学等.蓝舌病流行状况及防控措施[J].黑龙江畜牧兽医,2010(5):28-30.
[2]Legisa.,et al.Bluetongue virus in South America,Central America and the Caribbean[J].Virus research,2014,182:87-94.
[3]王凌凤,杨涛,等.蓝舌病病毒17型VP2蛋白单克隆抗体的制备及其抗原表位的鉴定[J].中国预防兽医学报,2011,33(6):465-470.
[4]Hofmann M A,Renzullo S,Mader M,et al.Genetic characterization of toggenburg orbivirus,a new bluetongue virus,from Goats,Switzerland[J].Emerg Infect Dis,2008,14(12):1855-1861.
[5]Zientara S,Sailleau C,Viarouge C,et al.Novel bluetongue virus in Goats,Corsica,France,2014[J].Emerg Infect Dis,2014,20(12):2123-2125.
[6]Maan S,Maan N S,Nomikou K,et al.Novel bluetongue virus serotype from Kuwait[J].Emerg Infect Dis,2011,17(5):886-889.
[7]Maan S,Maan N S,Belaganahalli M N,et al.Full-genome sequencing as a basis for molecular epidemiology studies of bluetongue virus in India[J].PLoS One,2015,10(6):e0131257.
[8]李楠,朱建波,肖雷等.云南蓝舌病病毒1型毒株M6基因序列分析[J].中国畜牧兽医,2016,43(2):340-347
[9]Umeshappa CS,Singh KP,Pandey A B,et al.Cell-mediated immune response and cross-protective efficacy of binary ethylenimine-inactivated bluetongue virus serotype-1vaccine in sheep[J].Vaccine,2010,28(13):2522-2531.
[10]黄绣,普淑英.甘肃省动物蓝舌病流行病学调查与病原分离、鉴定.第一届东南亚太平洋地区蓝舌病学术讨论会论文汇编[C].云南昆明,1995.
[11]Hassan S.H,Wirblich C,Forzan M,et al.Expression and functional characterization of bluetongue virus VP5protein:role in cellular permeabilization[J].Virol,2001,75(18):8356-8367.
[12]Mertens,P.,Burroughs,J.,Walton,A.et al.,Enhanced Infectivity of Modified Bluetongue Virus Particles for Two Insect Cell Lines and for TwoCulicoidesVector Species[J].Virology.1996,217:582-593.
技术实现要素:
本发明所要解决的技术问题是提供一种蓝舌病病毒VP7蛋白群特异性抗原表位多肽及其应用及其在检测蓝舌病病毒中的用途。
为了达到上述目的,本发明采用了以下技术手段:
本发明使用前期制备的稳定分泌抗25型BTV VP7的杂交瘤细胞株3H7,利用噬菌体展示肽技术对3H7细胞株识别的抗原表位进行筛选。经过3轮淘选后进行测序,结果表明3H7细胞株识别的抗原表位为QYHAM(SEQ ID NO.1所示)。进一步合成短肽利用间接ELISA对3H7细胞株进行鉴定。实验结果表明3H7细胞株识别的抗原表位为QYHAM;通过与NCBI中25种蓝舌病病毒VP7蛋白氨基酸序列进行对比,分析表明3H7细胞株识别的线性抗原表位QYHAM与蓝舌病病毒VP7蛋白发生两个氨基酸突变,即239位氨基酸由精氨酸突变成酪氨酸,240位氨基酸由天冬酰胺突变成组氨酸,其他氨基酸在蓝舌病病毒25种血清型中高度保守。因此可作为蓝舌病病毒VP7蛋白群特异性抗原表位多肽,用于蓝舌病毒的检测。
在上述研究的基础上,本发明提出了一种蓝舌病病毒VP7蛋白群特异性抗原表位多肽,所述的抗原表位多肽的氨基酸序列如SEQ ID NO.1所示。
编码所述的抗原表位多肽的核苷酸序列、含有所述核苷酸序列的表达载体以及含有所述表达载体的宿主细胞也在本发明的保护范围之内。
进一步的,本发明还提出了所述的抗原表位多肽在制备检测蓝舌病毒试剂中的用途。
本发明的提出为采用间接ELISA法检测蓝舌病病毒提供了技术支持,对于蓝舌病毒的早期检测具有重要的意义。
附图说明
图1为3H7与BHK细胞间接免疫荧光反应结果;
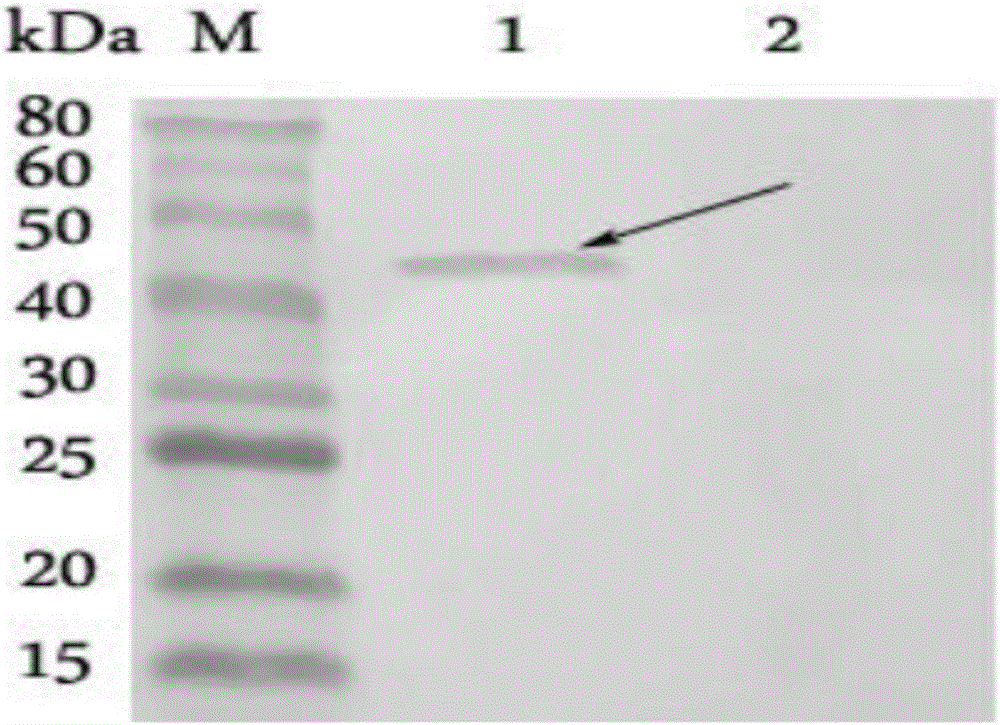
图2为重组蛋白VP7与3H7细胞上清Western blot鉴定结果;
M、蛋白Marker;1、pET-28a-VP7/BL21纯化蛋白;2、pET-28a-VP7/BL21诱导前;
图3为18个噬菌体克隆展示的12肽测序结果;
图4为合成短肽与单抗上清及腹水间接ELISA鉴定结果;
图5为合成短肽与不同型BTV阳性血清间接ELISA鉴定结果;
图6为短肽序列与BTV1-BTV12型基因序列BLAST结果;
图7为短肽序列与BTV13-BTV26型基因序列BLAST结果。
具体实施方式
下面结合具体实施例和附图来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
实施例1 3H7细胞株识别的抗原表位多肽的鉴定
1材料与方法
1.1细胞、病毒与抗体
稳定分泌抗25型BTV VP7的杂交瘤细胞株3H7(该细胞株已记载以下非专利文献中:25型蓝舌病病毒VP7和VP2蛋白的原核表达及其单克隆抗体的制备,武啸,东北农业大学硕士学位论文,2015)由东北农业大学保存并提供、蓝舌病病毒阳性血清、BHK21细胞由本实验室保存、辣根过氧化物酶标记的山羊抗鼠IgG、FITC荧光标记的山羊抗鼠、鼠抗His标签单抗购自中杉金桥有限公司,蓝舌病标准阳性血及阴性清购自蓝舌病参考实验室Pirbright institute。
1.2主要试剂
PRMI 1640培养液购自Gibicol公司;HAT(50×)、HT(100×)、二甲基亚砜(DMSO)、抗体亚类链特异性鉴别试剂盒购自SIGMA公司产品;蛋白质Marker购自宝生物工程(大连)有限公司。
1.3细胞复苏与鉴定
将本实验室保存的稳定分泌抗25型BTV VP7的杂交瘤细胞株3H7进行复苏。并进行连续传代,留取细胞上清。使用竞争ELISA方法对单抗上清进行鉴定,以原核表达纯化的VP7蛋白作为抗原,单抗上清为一抗,HRP标记山羊抗鼠IgG为二抗。
1.4间接免疫荧光鉴定
将BHK21细胞传至24孔板上,孔内放置爬片,待细胞长满单层后接种8型BTV,同时设置正常BHK21细胞作为阴性对照。37℃,5%CO2培养48h后弃去培养上清液,用PBS轻轻洗涤3次,4%多聚甲醛固定液室温固定30min,每孔加入3%的BSA 37℃封闭1h,每孔加入1ml的杂交瘤细胞培养上清液作为一抗,以及对照组SP2/0细胞培养上清液,37℃作用1h,加入以0.3%BSA稀释的FITC标记山羊抗鼠IgG作为二抗,200μL/孔,避光37℃作用1h,在荧光显微镜下观察结果,并拍照记录。
1.5 Western-Blot鉴定
以原核表达纯化的蛋白进行SDS-PAGE电泳整齐的切去积层胶部分,将分离胶部分电转印至硝酸纤维素膜上,50mA转印50min然后将NC膜放入5%的脱脂乳中37℃作用2.5h,取出NC膜用PBST洗涤三次,10min/次,然后以3H7细胞培养上清中作为一抗进行孵育,4℃封闭过夜。取出NC膜用PBST洗涤三次,10min/次,然后放入用经5%脱脂乳按1∶2000稀释的HRP标记山羊抗鼠IgG中,进行二抗孵育,室温作用2.5h,取出NC膜用PBST洗涤三次,10min/次,用DAB-H2O2显色液室温显色,观察结果。
1.6抗原表位鉴定
参照Ph.D.-12TM13噬菌体肽库说明书,用纯化后的单克隆抗体IgG对噬菌体肽库进行3次淘选。将经纯化的单克隆抗体腹水IgG用包被稀释液稀释到100ng/mL浓度,按照150μL/孔的包被量加入到微孔板中。去除包被液,每孔加满封闭液。用100μLPBST稀释10μL原始噬菌体文库,加入到微孔板中,室温温和摇动。取100μL洗脱缓冲液,加入到微孔板中,室温温和摇动。取出洗脱物并加入中和液,即为第一轮淘选后的噬菌体。取100μL淘选后的噬菌体加入到用于噬菌体扩增的ER2738菌液中,37℃震荡培养。取上清,加入2.67mL PEG/NaCl溶液,4℃过夜沉淀扩增后的噬菌体。将经过夜沉淀的喷菌体溶液4℃离心,弃上清,短暂离心,吸去残留液。取上清加入PEG/NaCl,冰上作用1h。4℃离心沉淀噬菌体,弃上清,短暂离心,吸去残留液。沉淀用200μLTBS回溶,4℃离心1min,上清转入新的离心管中,此即为扩增后的噬菌体。取10μL扩增后的噬菌体,用LB液体培养基进行10倍系列的倍比稀释,在每一稀释度的溶液中各取10μL分别接种在200mL宿主菌ER2738中,室温作用5min后,将其加入到3mL 45℃预热的顶层琼脂中,快速混勾后倾倒于经37℃预热的LB/IPTG/X-gal固体琼脂蹄选平板上,37℃避光培养过夜查平板,计数有约100个蓝色噬菌斑的平板上的斑数,用此数目乘以其对应的稀释倍数,即为扩增后每10μL噬菌体的滴度(pfu)。重复三次淘选。将三次淘选后的产物测序。并合成短肽与单抗上清进行间接ELISA鉴定。
1.7短肽ELISA鉴定
包被:用包被稀释液将短肽稀释100μl/孔包被酶标板,4℃过夜;封闭:弃去板中包被液体,加入200μl/孔的PBST溶液震荡洗涤每孔加200μl封闭液(5%的脱脂乳),阳性血清用5%的脱脂乳稀释每孔加入100μl,每个样品作2个平行孔,同时设置空白对照孔,37℃作用1h,二抗用5%脱脂乳将山羊抗鼠酶标二抗,100μl/孔加入各反应孔,37℃作用1h.。显色:加入现配制的OPD-H2O2底物显色液,100μl/孔,37℃避光显色15min,加入终止液(2M/H2SO4)50μl/孔,终止显色。
1.8保守性分析
利用NCBI数据库中的Blast对3H7细胞株的抗原表位保守性进行分析。
2结果
2.1单抗的特异性鉴定
3H7与BHK细胞间接免疫荧光反应结果如图1所示,其中,图A为3H7细胞上清与接种25型BTV的BHK细胞21细胞反应的结果。图B为3H7上清与未接种25型BTV的BHK21细胞反应结果。结果表明,3H7细胞呈明显的阳性反应,与对照呈阴性反应。
2.2单克隆抗体的Western-Blot鉴定
用3H7上清检测原核表达纯化的VP7蛋白,同时设置空白菌体对照。经DAB显色后结果显示3H7分泌的抗体能与原核表达的蛋白特异性的结合,同时与空白菌体对照不能特异性结合。用3H7上清检测原核表达纯化的VP7蛋白,同时设置空白菌体对照。经DAB显色后结果显示3H7分泌的抗体能与原核表达的蛋白特异性的结合,同时与空白菌体对照不能特异性结合(图2)。
2.3 DNA序列测定及表位分析
将18个噬菌体阳性克隆进行DNA测序并对展示的短肽进行序列比对,结果如图3所示,结果显示18个噬菌体克隆展示有共同的序列QYHAM(SEQ ID NO.1所示)。并经过序列比对表明该序列在各个BTV血清型中相对保守。我们推测QYHAM序列可能是一个线性B细胞表位。
2.4短肽ELISA鉴定结果
用合成短肽分别与单抗上清及腹水反应,所取结果为进行20次ELISA反应的平均值,结果显示,与腹水反应的值明显高于上清,这可能是由于腹水中与短肽结合的非特异性抗体较多。短肽与单抗上清反应S/N比值均大于2表明短肽能与上清中的抗体发生特异性结合(图4)。
使用合成短肽鉴定不同血清型BTV阳性血清进行间接ELISA鉴定,结果如图5所示,结果表明,合成肽QYHAM与BTV2型、3型、5型、7型、8型、11型、12型、13型、14型、15型、16型、17型、18型、19型、20型、21型、22型、23型、24型均呈阳性反应。与BTV1型、BTV4型、BTV9型、BTV10型的反应呈弱阳性。合成肽能与大多数BTV血清型阳性血清呈阳性反应,表明QYHAM序列为蓝舌病病毒群特异性抗原的关键表位。
2.5保守性分析结果
将噬菌体克隆展示技术测序结果得到的短肽序列与Genbank中25个血清型蓝舌病病毒VP7蛋白氨基酸序列进行比对,结果如图6和图7所示,结果发现在第239氨基酸序列处由精氨酸突变成酪氨酸,在第240氨基酸序列处由天冬酰胺突变成组氨酸。在BTV 7、BTV15、BTV19第239氨基酸序列处由丙氨酸突变成酪氨酸。
使用合成短肽鉴定不同血清型BTV阳性血清进行间接ELISA鉴定,结果表明,合成肽与BTV2型、3型、5型、7型、8型、11型、12型、13型、14型、15型、16型、17型、18型、19型、20型、21型、22型、23型、24型均呈阳性反应。与BTV1型、BTV4型、BTV9型、BTV10型的反应呈弱阳性。合成肽能与大多数BTV血清型阳性血清呈阳性反应,表明QYHAM序列为蓝舌病病毒群特异性抗原的关键表位。
3、讨论
迄今为止已发现27种蓝舌病血清型,且各个型之间不存在交叉保护。蓝舌病目前没有有效的治疗方法,因此该病主要以预防为主。本研究中以实验室保存的单克隆抗体3H7株为实验基础,应用噬菌体展示技术检测该单克隆抗体的抗原表位。经过三次淘选检测出该单抗的一条线性表位QYHAM。并通过合成短肽应用竞争ELISA方法与24种蓝舌病病毒阳性血清反应,结果表明合成短肽可与大多数阳性血清呈阳性反应,分析原因可能由于蓝舌病病毒阳性血清长期保存于-80℃条件下,血清效价下降导致与少数几种血清反应呈弱阳性。通过与NCBI中25种蓝舌病病毒VP7蛋白氨基酸序列进行对比,分析表明3H7细胞株识别的线性抗原表位QYHAM与蓝舌病病毒VP7蛋白发生两个氨基酸突变,即239位氨基酸由精氨酸突变成酪氨酸,240位氨基酸由天冬酰胺突变成组氨酸,其他氨基酸在蓝舌病病毒25种血清型中高度保守。本发明鉴定了蓝舌病病毒VP7蛋白群特异性抗原表位多肽,为建立针对蓝舌病病毒的竞争ELISA方法奠定了基础,鉴定出的抗原表位也可应用于今后疫苗设计中,对于我国蓝舌病的防治具有重要的意义。
序列表
<110> 东北农业大学
<120> 蓝舌病病毒VP7蛋白群特异性抗原表位多肽及其应用
<130> KLPI161343
<160> 1
<170> PatentIn 3.5
<210> 1
<211> 5
<212> prt
<213> 表位多肽
<400> 1
Gln Tyr His Ala Met
- 还没有人留言评论。精彩留言会获得点赞!