一种以多表位肽段组合抗原刺激免疫系统产生抗体的方法与流程
本发明涉及一种以多表位肽段组合抗原刺激免疫系统产生抗体的方法,属于生物技术、特异性抗体检测和疫苗制备领域。
背景技术:
乙型肝炎是由乙型肝炎病毒感染所致。HBV颗粒由乙肝表面抗原(HBsAg)和来自宿主的脂质组成,是直径约为42nm的球形结构。HBsAg包括3种被膜糖蛋白,即大蛋白(LHBs)、中蛋白(MHBs)和小蛋白(SHBs)。乙肝病毒大分子蛋白表面又分为前S1区、前S2区和S区。有研究表明,PreS1只存在于表面抗原的大分子蛋白中,是乙肝早期诊断和病毒复制的指标,在病毒颗粒的装配和感染中起重要作用;目前最受关注的两个重要表位:第21-47号氨基酸所在的表位(简称P21表位)和第94-117号氨基酸所在的表位(简称P94表位),存在病毒与肝细胞膜的结合位点。
根据HBV全基因组序列差别>8%将HBV分为A-I九个基因型,根据S基因的差别>4%可将HBV基因型分为20个亚型。目前,国际上已经存在不同基因型的参照序列以及以此为依据建立了多种基因型检测方法,但这些参照株多为单一患者来源,本身就存在多种碱基替代情况,且不同地区的相同基因型或亚型间还有较大差异,对于不同地区需建立相应适合的参照序列,这对于具体研究时所用的多肽序列选择造成了很大的困难。
目前,多肽主要通过化学合成和生物合成制备得到,其中多肽的化学合成有液相合成和固相合成之分,每种多肽合成方法应用方式不同且各有利弊。对于小片段多肽的合成(30个氨基酸以内,少数为50个氨基酸以内)多采用固相逐步合成方法,该方法精准和有针对性,但随着氨基酸数量的增加,合成效率逐步下降,非目的肽含量逐步增长,目的肽的纯度相应降低,后续的纯化和重复性愈加困难。对于大片段多肽(含100个以上氨基酸)目前大多应用液相分段合成法,原理是根据多肽片段在溶液中的专一性或化学选择性,自发连接成长肽,但步骤繁琐,不易合成,且精准度和针对性有待完善。
疫苗是将病原微生物(如细菌、立克次氏体、病毒等)及其代谢产物,经过人工减毒、灭活或利用基因工程等方法制成的用于预防传染病的自动免疫制剂。目前疫苗的制备仍不完善,不同人群接种疫苗后会产生不同程度的副反应,效果不稳定。
技术实现要素:
为了解决同一基因型的抗原肽段复杂多变或者抗原突变株增生,大片段多肽合成较困难的现状,以及目前疫苗存在的效果不稳定的问题,本发明提供一种多表位肽段组合抗原,以及以组合抗原刺激免疫系统产生抗体的方法。本发明应用肽段组合的方式,由几个重要的小肽的合成来替代原病原微生物,会更为纯净,相应的副反应较小,免疫针对性相比于完整的病原微生物要好。
本发明的第一个目的是提供了一种组合抗原,所述组合抗原是将多个表位肽段组合而得到的抗原。
在本发明的一种实施方式中,所述组合抗原,是用于检测乙肝病毒PreS1抗体、乙肝病毒PreS2抗体、甲肝病毒VP1抗体、甲肝病毒VP3抗体、丙肝病毒E2抗体等。
在本发明的一种实施方式中,所述组合抗原,是用于检测抗乙型肝炎病毒抗体的组合抗原。
在本发明的一种实施方式中,所述表位,包括乙肝病毒PreS1抗体的P21表位、P94表位,PreS2抗体的120-145号氨基酸表位;甲肝VP1抗体的11-25号氨基酸表位、VP3抗体的102-121号氨基酸表位;丙肝病毒E2抗体的384-410号氨基酸表位、412-423号氨基酸表位、523-535号氨基酸表位等。
在本发明的一种实施方式中,所述组合抗原包含氨基酸序列为SEQ ID NO.1和SEQ ID NO.2的肽段。
在本发明的一种实施方式中,所述氨基酸序列为SEQ ID NO.1的肽段即为P21表位的肽段;氨基酸序列为SEQ ID NO.2的肽段即为P94表位的肽段。
在本发明的一种实施方式中,所述组合抗原是将序列为SEQ ID NO.1和SEQ ID NO.2的肽段分别偶联大蛋白后,将偶联后的复合物混合得到的。
在本发明的一种实施方式中,所述大蛋白可以是KLH、OVA、BSA等中的任意一种。
在本发明的一种实施方式中,所述组合抗原中氨基酸序列为SEQ ID NO.1、SEQ ID NO.2的肽段的摩尔比在1:10~10:1之间。
本发明的第二个目的是提供一种以组合抗原刺激免疫系统产生特异性抗体的方法,所述方法是以多表位肽段组合的方式代替全长肽段作为抗原刺激免疫系统产生特异性抗体。
在本发明的一种实施方式中,所述方法,是采用两个以上表位的肽段,分别偶联大蛋白,然后以偶联有大蛋白的两个以上的肽段作为抗原。
在本发明的一种实施方式中,所述特异性抗体是指乙肝病毒PreS1抗体、乙肝病毒PreS2抗体、甲肝病毒VP1抗体、甲肝病毒VP3抗体、丙肝病毒E2抗体等。
在本发明的一种实施方式中,所述表位,包括乙肝病毒PreS1抗体的P21表位、P94表位,PreS2抗体的120-145号氨基酸表位;甲肝VP1抗体的11-25号氨基酸表位、VP3抗体的102-121号氨基酸表位;丙肝病毒E2抗体的384-410号氨基酸表位、412-423号氨基酸表位、523-535号氨基酸表位等。
在本发明的一种实施方式中,所述肽段包括氨基酸序列为SEQ ID NO.1和SEQ ID NO.2的肽段。
在本发明的一种实施方式中,所述氨基酸序列为SEQ ID NO.1的肽段即为P21表位的肽段;氨基酸序列为SEQ ID NO.2的肽段即为P94表位的肽段。
在本发明的一种实施方式中,所述两个以上的肽段,各肽段相互之间的摩尔比在1:10~10:1之间。
在本发明的一种实施方式中,所述大蛋白可以是KLH、OVA、BSA等中的任意一种。
本发明的有益效果:
本发明应用肽段组合的方式,由几个重要的小肽的合成来替代原病原微生物,会更为纯净,相应的副反应较小,免疫针对性相比于完整的病原微生物要好。
附图说明
图1:不同包被方式抗体检测吸光度值及显著性图;
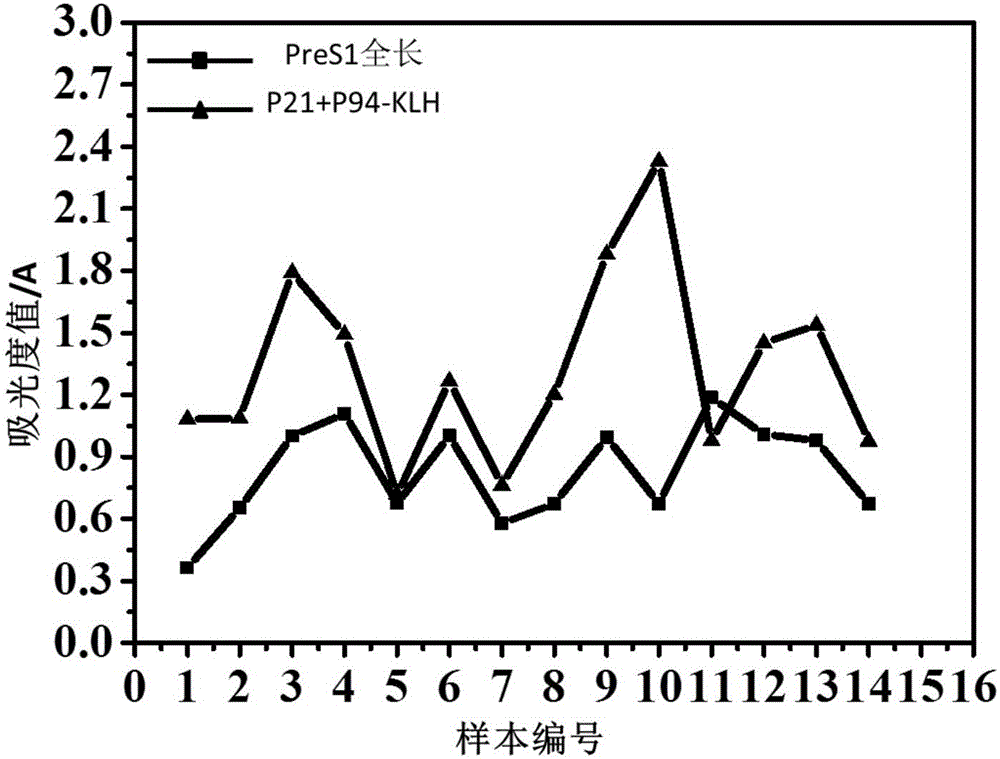
图2:包被P21&P94-KLH与PreS1全长的抗体检测吸光度值图;
图3:包被P21-KLH、P94-KLH与PreS1全长的抗体检测吸光度值图
图4:包被P21&P94-KLH与PreS1全长的抗体检测吸光度值显著性图;
图5:包被P21-KLH与PreS1全长的抗体检测吸光度值显著性图;
图6:包被P94-KLH与PreS1全长的抗体检测吸光度值显著性图。
具体实施方案
下面结合附图,通过对本发明较佳实施方式,即通过以B基因型为例两表位肽段组合代替全长检测乙型肝炎病毒前S1抗体来具体说明本发明方法,但不限制本发明。
实施例1:通过两表位肽段组合代替全长的方式检测抗乙型肝炎病毒前S1抗体
间接ELISA方法检测HBV患者血清中抗体浓度,其中包被抗原的选择至关重要。常规ELISA方法需提前确定HBV患者的基因型,根据其选择合适的包被多肽序列。但是存在两个问题:第一,目前,HBV分为A-I九个基因型;即便对于同种基因型的参照株,由于地区差异及自身碱基替换等情况,存在多种不同的氨基酸序列,对于研究时选择何种多肽序列造成了困难;第二,目前对于小片段多肽(少于30个氨基酸)多采用固相合成的方法,易于合成,但随着氨基酸数量的增加,合成效率逐步下降,后续的纯化和重复性愈加困难;
大片段多肽(多于100个氨基酸)多采用液相分段合成法,但步骤繁琐,不易合成,且精准度和针对性有待完善。
根据本申请的研究方法,结合实际情况,检测抗体的方法为:确定全长肽段上几个重要的表位肽段,通过偶联大蛋白提高其免疫原性,通过全长肽段中两个重要表位肽段组合来代替全长肽段作为抗原进行特异性抗体检测。
具体实施步骤设计如下:
步骤一:提取慢性乙肝患者血清中的病毒DNA
获取慢性乙肝患者血样213例,血样提供者年龄跨度较大(7岁-73岁),男性占61%(130/213),具有研究意义。使用TAKARA公司的DNA提取试剂盒(MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0,Catalog No.9766),对213例样本进行病毒基因提取,将提取的乙肝病毒DNA作为模板链进行PCR扩增。
步骤二:PCR扩增病毒前S1区域并进行测序
通过聚合酶链式反应(Polymerase Chain Reaction,PCR)分别对213例DNA样本进行DNA模板链的扩增,同时设置进行对照品(未添加DNA模板的空白组),反应体系均为50μL,各试剂加入量详见表1。
为提高产物纯度,采用巢式PCR进行扩增,使用的引物序列见表2。
第一轮PCR反应程序设置为95℃预变性3min,95℃变性40sec,55℃退火30sec,72℃链延长40sec,72℃稳定3min,共进行36个循环。第二轮PCR反应程序设置为95℃预变性3min,95℃变性40sec,50℃退火30sec,72℃链延长40sec,72℃稳定3min,共进行36个循环。扩增产物使用1.2%的琼脂糖凝胶电泳进行鉴定。
213例DNA提取样品中,一次扩增不成功的样品将进行第二次扩增,以排除PCR实验误差。若两次扩增均未成功(相应位置没有呈现条带),则认为该样品的DNA提取步骤未成功。
PCR扩增结果为:202例DNA提取样品扩增成功;11例样品扩增失败。
表1 PCR反应体系试剂加入量表
表2 PCR扩增使用的引物表
步骤三:比对前S1区域中P21和P94肽段序列,确定患者感染的P21和P94基因型及相应的氨基酸序列
委托生工生物工程(上海)股份有限公司,对202例PCR扩增产物进行DNA测序,测序引物序列为GGTTGGTCTTCCAAACCTCG(SEQ ID NO:7),单向测通,测序片段长度约600bp。将各样本的测序结果翻译为氨基酸序列后,分别与P21和P94的参照序列进行比对分析,确定感染B基因型的患者血清样本14例。
步骤四:将P21B基因型和P94B基因型肽段偶联大蛋白,以提高其免疫原性。
分别订购B基因型的P21和P94肽段,并将其偶联KLH大蛋白;订购B基因型的PreS1全长肽段(安比奇生物科技有限公司)。
P21(B基因型)肽段序列为(SEQ ID NO:1):PLGFFPDHQLDPAFKANSENPDWDLNP
P94(B基因型)肽段序列为(SEQ ID NO:2):PASTNRQSGRQPTPLSPPLRDTHP
PreS1全长(B基因型)肽段序列为(SEQ ID NO:8):
MGGWSSKPRKGMGTNLSVPNPLGFFPDHQLDPAFKANSENPDWDLNPHKDNWPDANKVGVGAFGPGFTPPHGGLLGWSPQAQGLLTTVPAAPPPASTNRQSGRQPTPLSPPLRDTHPQA
步骤五:组合包被P21-KLH和P94-KLH肽段,ELISA检测感染B基因型的患者血样14个。
将B基因型P21-KLH肽段和B基因型P94-KLH肽段在0.05mol/L,pH9.6的碳酸盐缓冲液中以浓度10μg/ml稀释后,在96孔板(NEST)上包被过夜。用含1%BSA的PBS溶液将待测血清样本稀释125倍,37℃孵育1h。酶标二抗(从山羊体内分离出的人IGg抗体,目录号A-8667,Sigma Aldrich)稀释20000倍后,37℃孵育1h。使用辣根过氧化物酶标记的TMB作为显色底物,室温孵育20min后,2M H2SO4终止反应。终止反应后10min内在酶标仪上测定OD450的值。
每个样品做3个复孔。
步骤六:单一包被PreS1全长肽段,ELISA检测感染B基因型的患者血样14个。
将PreS1全长肽段在0.05mol/L,pH9.6的碳酸盐缓冲液中以浓度10μg/ml稀释后,在96孔板(NEST)上包被过夜。用含1%BSA的PBS溶液将待测血清样本稀释125倍,37℃孵育1h。酶标二抗(从山羊体内分离出的人IGg抗体,目录号A-8667,Sigma Aldrich)稀释20000倍后,37℃孵育1h。使用辣根过氧化物酶标记的TMB作为显色底物,室温孵育20min后,2M H2SO4终止反应。终止反应后10min内在酶标仪上测定OD450的值。
每个样品做3个复孔。
步骤七:单一包被P21-KLH肽段,ELISA检测感染B基因型的患者血样14个。
将P21-KLH肽段在0.05mol/L,pH9.6的碳酸盐缓冲液中以浓度10μg/ml稀释后,在96孔板(NEST)上包被过夜。用含1%BSA的PBS溶液将待测血清样本稀释125倍,37℃孵育1h。酶标二抗(从山羊体内分离出的人IGg抗体,目录号A-8667,Sigma Aldrich)稀释20000倍后,37℃孵育1h。使用辣根过氧化物酶标记的TMB作为显色底物,室温孵育20min后,2M H2SO4终止反应。终止反应后10min内在酶标仪上测定OD450的值。
每个样品做3个复孔。
步骤八:单一包被P94-KLH肽段,ELISA检测感染B基因型的患者血样14个。
将P94-KLH肽段在0.05mol/L,pH9.6的碳酸盐缓冲液中以浓度10μg/ml稀释后,在96孔板(NEST)上包被过夜。用含1%BSA的PBS溶液将待测血清样本稀释125倍,37℃孵育1h。酶标二抗(从山羊体内分离出的人IGg抗体,目录号A-8667,Sigma Aldrich)稀释20000倍后,37℃孵育1h。使用辣根过氧化物酶标记的TMB作为显色底物,室温孵育20min后,2M H2SO4终止反应。终止反应后10min内在酶标仪上测定OD450的值。
每个样品做3个复孔。
步骤九:利用SPSS软件分析组合两肽段组合检测能否代替全长检测特异性抗体。
为验证组合两肽段检测能否代替全长检测特异性抗体,本专利利用SPSS 19.0软件对HBV患者血清中PreS1抗体的检测吸光度值进行显著性分析,采用t检验法,置信度为95%。
(1)质量比:组合P21&P94-KLH肽段、单一PreS1全长肽段、单一P21-KLH、单一P94-KLH的包被浓度均为10μg/ml,即目标包被抗原的质量相同。
(2)摩尔数比:P21含有27个氨基酸,P94含有24个氨基酸,PreS1全长含有119个氨基酸,KLH约由3400个氨基酸组成。
因此组合P21&P94-KLH的摩尔数仅为PreS1全长的3.5%,证明P21&P94-KLH肽段的抗体捕捉能力更强。
(3)显著性分析:(其中显著性均为t检验的单边检验)
P21&P94-KLH与PreS1全长的检测结果分析如表3所示。
表3 P21&P94-KLH与PreS1全长包被检测吸光度值显著性分析结果
包被P21&P94-KLH检测的抗体浓度大于包被PreS1全长检测的抗体浓度(除11号)(图1、图2),两种包被方式之间的显著性均小于0.05(*)(图3)。证明两表位肽段组合可以提高抗体检测的灵敏度,且P21和P94两个表位可以较好地覆盖PreS1抗体的抗原抗体结合位点,即P21和P94两表位肽段组合可以有效地代替代替全长肽段用于PreS1抗体检测。
P21-KLH与PreS1全长的检测结果分析如表4所示。
表4 P21-KLH与PreS1全长包被检测吸光度值显著性分析结果
表5 P94-KLH与PreS1全长包被检测吸光度值显著性分析结果
P21-KLH与PreS1全长的检测结果分析如表4所示。其中12例样本包被P21-KLH检测的抗体浓度大于包被PreS1全长检测的抗体浓度,2例样本(11号和14号)包被P21-KLH检测的抗体浓度略小于包被PreS1全长检测的抗体浓度(图1、图3);其中13例样本的两种包被方式之间的显著性均小于0.05(*),1例样本(12号)的显著性大于0.05(图5)。P94-KLH与PreS1全长的检测结果分析如表5所示。其中1例样本(1号)包被P94-KLH检测的抗体浓度大于包被PreS1全长检测的抗体浓度,其余13例样本包被P94-KLH检测的抗体浓度小于包被PreS1全长检测的抗体浓度(图1、图3);其中11例样本的两种包被方式之间的显著性均小于0.05(*),3例样本(5号、7号、8号)的显著性大于0.05(图6)。单一包被P21-KLH或P94-KLH时检测抗体与包被全长检测抗体的显著性关系不唯一,证明PreS1抗体的抗原抗体结合位点主要位于P21和P94两个表位上,而单一的P21表位或P94表位不能够有效地覆盖PreS1抗体的全部抗原抗体结合位点,即单一的P21表位或P94表位不能有效地代替全长肽段用于PreS1抗体检测。
综上所述,通过全长肽段中两个重要表位肽段组合作为抗原的方式检测特异性抗体,可以有效地覆盖抗原抗体的全部抗原抗体结合位点,可以有效地代替全长肽段用于PreS1抗体检测,还可以提高抗体的检测灵敏度。
实施例2:以两表位肽段组合作为抗原刺激小鼠制备单克隆抗体
步骤一:多肽合成及偶联
合成P21和P94表位肽段,各肽段分别偶联KLH和BSA。偶联KLH的肽段将分别用于免疫两组动物,而BSA偶联复合物将用于筛选,以排除针对KLH的抗体反映。
步骤二:动物免疫
1)第一次免疫:以P21-KLH和P94-KLH按照1:1组合,作为组合抗原分别免疫动物,与弗氏完全佐剂(MP公司产品,Cat No.642852)等体积进行混合乳化,皮下初次免疫6只Balb/C小鼠,用量为60μg蛋白/200μl/只小鼠。
2)第二次免疫:皮下免疫,用弗氏不完全佐剂(MP公司产品,Cat No.642862)与组合抗原等体积混合乳化,免疫量为30μg蛋白/200μl/只小鼠。
3)第一次取血:眼眶取血100μl,室温放置半小时后,2000g离心5分钟,收集血清,用于测定血清滴度,测定完毕,放-20℃低温保存。
4)第三次免疫:同步骤2)的第二次免疫。
5)第二次取血:同步骤3)的第一次取血。
6)第四次免疫:同步骤2)的第二次免疫。
7)第三次取血:同步骤3)的第一次取血。
步骤三:血清滴度测定
步骤四:与临床样本比对筛选和确认
步骤五:冲击免疫
根据小鼠血清与临床样本比对评估结果,选取小鼠进行冲击免疫。冲击免疫步骤为:将多肽偶联KLH蛋白取出50ng,用生理盐水稀释为0.3ml,用1ml注射器注射到小鼠腹腔,这个过程操作需要缓慢,避免刺破小鼠肠道。
步骤六:细胞融合
步骤七:阳性克隆筛选
步骤八:杂交瘤细胞株的筛选和确认
步骤九:杂交瘤细胞株的亚克隆
结果表明,将组合抗原作为抗原刺激小鼠免疫系统,在小鼠体内会产生相应的抗体,通过筛选克隆可以得到特异性的B基因型单克隆抗体。
综上,组合P21-KLH和P94-KLH两表位肽段作为一个组合抗原代替全长肽段作为抗原刺激机体,机体的免疫系统会产生相应的PreS1抗体,有利于机体对抗病毒侵染,起到疫苗的作用。因此为了预防乙肝病毒的感染,可用该组合抗原代替传统乙肝疫苗(灭活病毒、基因重组表达抗原等)制备新型疫苗,有三点优点:(1)组合抗原为多表位小肽偶联KLH等大蛋白,显著增强了抗原的免疫原性,与原来的全长肽段相比,可以更好地刺激机体产生相应抗体;(2)组合抗原疫苗更为纯净,刺激机体后产生的副反应较小:该组合抗原仅为固相合成的氨基酸片段,相比于灭活病毒,会大大减少病毒致病因素;(3)组合抗原疫苗更易于纯化制得:相比于灭活病毒和基因重组表达抗原,组合抗原在肽段制备时可选择明确的氨基酸序列,因此可大大简化后期纯化的过程。因此,利用组合抗原制备新型疫苗可解决传统疫苗制备中副反应较大和后期纯化过程复杂的问题,并且组合抗原可以代替完整的病原微生物会增强疫苗的免疫针对性。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
序列表
<110> 江南大学
<120> 一种以多表位肽段组合抗原刺激免疫系统产生抗体的方法
<160> 8
<170> PatentIn version 3.3
<210> 1
<211> 27
<212> PRT
<213> 人工序列
<400> 1
Pro Leu Gly Phe Phe Pro Asp His Gln Leu Asp Pro Ala Phe Lys Ala
1 5 10 15
Asn Ser Glu Asn Pro Asp Trp Asp Leu Asn Pro
20 25
<210> 2
<211> 24
<212> PRT
<213> 人工序列
<400> 2
Pro Ala Ser Thr Asn Arg Gln Ser Gly Arg Gln Pro Thr Pro Leu Ser
1 5 10 15
Pro Pro Leu Arg Asp Thr His Pro
20
<210> 3
<211> 20
<212> DNA
<213> 人工序列
<400> 3
gggtcaccat attcttggga 20
<210> 4
<211> 20
<212> DNA
<213> 人工序列
<400> 4
ccccgcctgt aacacgagca 20
<210> 5
<211> 20
<212> DNA
<213> 人工序列
<400> 5
ttgggaacaa gatctacagc 20
<210> 6
<211> 20
<212> DNA
<213> 人工序列
<400> 6
gtcctgatgc gatgttctcc 20
<210> 7
<211> 20
<212> DNA
<213> 人工序列
<400> 7
ggttggtctt ccaaacctcg 20
<210> 8
<211> 119
<212> PRT
<213> 人工序列
<400> 8
Met Gly Gly Trp Ser Ser Lys Pro Arg Lys Gly Met Gly Thr Asn Leu
1 5 10 15
Ser Val Pro Asn Pro Leu Gly Phe Phe Pro Asp His Gln Leu Asp Pro
20 25 30
Ala Phe Lys Ala Asn Ser Glu Asn Pro Asp Trp Asp Leu Asn Pro His
35 40 45
Lys Asp Asn Trp Pro Asp Ala Asn Lys Val Gly Val Gly Ala Phe Gly
50 55 60
Pro Gly Phe Thr Pro Pro His Gly Gly Leu Leu Gly Trp Ser Pro Gln
65 70 75 80
Ala Gln Gly Leu Leu Thr Thr Val Pro Ala Ala Pro Pro Pro Ala Ser
85 90 95
Thr Asn Arg Gln Ser Gly Arg Gln Pro Thr Pro Leu Ser Pro Pro Leu
100 105 110
Arg Asp Thr His Pro Gln Ala
115
- 还没有人留言评论。精彩留言会获得点赞!