一种三重态光敏剂及其制备方法和一种上转换体系与流程
本发明属于光子上转换技术领域,具体涉及一种三重态光敏剂及其在三重态湮灭上转换中的应用。
背景技术:
光子上转换是一种特殊技术,是可以将低能量长波长的光子转换为高能量短波长光子的技术。即能实现反斯托克斯位移发光。这一性能使其在光催化有机合成,光动力治疗,生物成像以及太阳能电池等领域有广泛应用。
目前应用于上转换的技术主要有三种:一是稀土材料上转换,二是双光子吸收上转换,三是三重态-三重态湮灭上转换(tta-uc),在这三种技术中前两者需要的激发光能量高。相对而言,三重态-三重态湮灭上转换所需激发光强度低,上转换效率高,吸收光带宽,而且激发、发射波长可调。因此有较大的应用价值。
三重态-三重态湮灭上转换的过程:1)光敏剂分子吸收光子达到其单重激发态后经过系间窜越达到三重激发态;2)三重态光敏剂分子将能量传递给湮灭剂分子的三重态;3)当三重态湮灭剂分子到达一定浓度时,两个处于三重态的湮灭剂分子相互碰撞,一个到达单重激发态另一个回到基态;4)处于单重激发态的湮灭剂分子发射出荧光。
经调查研究发现,目前大多数的光敏剂分子在tta上转换过程中需要高功率的激发光,但却获得较低的上转换发光效率,难以实现对自然可见光的应用。
技术实现要素:
有鉴于此,本发明要解决的技术问题在于提供一种三重态光敏剂及其在三重态湮灭上转换中的应用,本发明提供的光敏剂在低功率激发光源的条件下实现高效上转换。
本发明提供了一种三重态光敏剂,具有式(bdp-1)~式(bdp-3)所示结构:
本发明还提供了上述光敏剂的制备方法,包括以下步骤:
具有式(i)所示结构的化合物与i2/hio3发生碘代反应,得到具有式(bdp-1)~式(bdp-3)所示结构的光敏剂;
优选的,具有式(i)所示结构的化合物与碘单质的摩尔比为1:2~1:25。
优选的,所述具有式(i)所示结构的化合物按照如下方法进行制备:
在保护气氛条件下,将具有式(ii)所示结构的化合物与吡咯进行反应,得到具有式(i)所示结构的化合物;
优选的,所述具有式(ii)所示结构的化合物按照如下方法进行制备:
对羟基苯甲醛与正溴丁烷进行反应,得到具有式(ii)所示结构的化合物。
本发明还提供了一种上转换体系,由光敏剂和湮灭剂分散于有机溶剂中制备得到,所述光敏剂选自上述光敏剂。
优选的,所述光敏剂为bdp-1或bdp-2时,湮灭剂为苝,所述光敏剂为bdp-3时,湮灭剂为溶剂绿5。
优选的,所述有机溶剂为二氯甲烷。
优选的,所述光敏剂与所述湮灭剂的摩尔比为1:(0.5~10)。
优选的,所述光敏剂在所述上转换体系中的浓度为10-5m~10-4m,所述湮灭剂浓度为10-6m~10-4m。
与现有技术相比,本发明提供了一种具有式(bdp-1)~式(bdp-3)所示结构的光敏剂,本发明提供的光敏剂为三重态光敏剂,该光敏剂在可见光具有高摩尔消光系数,其在tta上转换中发出高强度的光,即在低功率(5.0mw)激发光源的条件下实现高效上转换;并且可实现可见光的强吸收,通过三重态-三重态湮灭的过程实现绿光向蓝光、红光向绿光的上转换,这一性能使其在光催化有机合成,光动力治疗,生物成像以及太阳能电池等领域有广泛应用。
附图说明
图1为bdp-1的核磁谱图;
图2为bdp-2的核磁谱图;
图3为bdp-3的核磁谱图;
图4为bdp-1、bdp-2与bdp-3的紫外可见吸收光谱;
图5为bdp-1、bdp-2与bdp-3的荧光发射光谱;
图6为光敏剂bdp-1、bdp-2、bdp-3作为光敏剂,苝作为受体在二氯甲烷溶液中的上转换对照图;
图7光敏剂bdp-3选用溶剂绿5作为受体在二氯甲烷中的上转换发光谱图。
具体实施方式
本发明提供了一种三重态光敏剂,具有式(bdp-1)~式(bdp-3)所示结构:
本发明还提供了一种上述光敏剂的制备方法,包括以下步骤:
具有式(i)所示结构的化合物与i2和hio3发生碘代反应,得到具有式(bdp-1)~式(bdp-3)所示结构的光敏剂;
具体的,在保护气氛条件下,将具有式(i)所示结构的化合物、碘单质以及碘酸饱和溶液混合加热,进行反应,得到反应产物;
将所述反应产物进行纯化,得到具有式(bdp-1)~式(bdp-3)所示结构的光敏剂。
其中,所述bdp-1保护气氛条件优选为氮气,所述具有式(i)所示结构的化合物与碘单质的摩尔比为1:5~1:10。所述反应的温度为30~40摄氏度,所述反应的时间为4~5h。
所述bdp-2保护气氛条件优选为氮气,所述具有式(i)所示结构的化合物与碘单质的摩尔比为1:2~1:5。所述反应的温度为60~80摄氏度,所述反应的时间为2~3h。
所述bdp-3保护气氛条件优选为氮气,所述具有式(i)所示结构的化合物与碘单质的摩尔比为1:20~1:30。所述反应的温度为60~80摄氏度,所述反应的时间为5~7h。
在本发明中,随着碘的个数与取代位置的不同,其吸收红移并且上转换效果变化明显。
在本发明中,当产物为具有式(bdp-1)所示结构的光敏剂时,所述纯化的方法具体为:
将反应产物用硫代硫酸钠饱和溶液洗涤后,旋转蒸发除去溶剂;
接着,用二氯甲烷和水萃取后,用无水硫酸钠进行干燥,再旋转蒸发除去溶剂;
最后,用体积比为2:1的石油醚和二氯甲烷的混合溶液过柱提纯后得到具有式(bdp-1)所示结构的光敏剂。
当产物为具有式(bdp-2)所示结构的光敏剂时,所述纯化的方法具体为:
将反应产物用硫代硫酸钠饱和溶液洗涤后,旋转蒸发除去溶剂;
接着,用二氯甲烷和水萃取后,用无水硫酸钠进行干燥,再旋转蒸发除去溶剂;
最后,用体积比为3:1的二氯甲烷和石油醚的混合溶液过柱提纯后得到具有式(bdp-2)所示结构的光敏剂。
当产物为具有式(bdp-3)所示结构的光敏剂时,所述纯化的方法具体为:
将反应产物用硫代硫酸钠饱和溶液洗涤后,旋转蒸发除去溶剂
接着,用二氯甲烷和水萃取后,用无水硫酸钠进行干燥,再旋转蒸发除去溶剂;
最后,用体积比为4:6的二氯甲烷和石油醚的混合溶液过柱提纯后得到具有式(bdp-3)所示结构的光敏剂。
在本发明中,所述具有式(i)所示结构的化合物按照如下方法进行制备:
在保护气氛条件下,将具有式(ii)所示结构的化合物与吡咯进行反应,得到具有式(i)所示结构的化合物;
具体的,在保护气氛条件下,将具有式(ii)所示结构的化合物、吡咯和催化剂进行反应,得到反应产物;
将所述反应产物与ddq(二氯二氰基苯醌)进行反应后,再加入三乙胺进行反应,最后加入三氟化硼乙醚进行反应,得到具有式(i)所示结构的化合物。
在本发明中,首先在保护气氛条件下,将具有式(ii)所示结构的化合物、吡咯和催化剂进行反应,得到反应产物。
其中,所述保护气氛条件优选为氮气。所述催化剂优选为三氟乙酸。所述具有式(ii)所示结构的化合物、吡咯和催化剂的摩尔比优选为1:2:0.24~1:2:0.30,所述反应的温度优选为20~30℃,优选为室温条件。所述反应的时间优选为5~10h。
得到反应产物后,将所述反应产物与ddq(二氯二氰基苯醌)进行反应,所述反应的温度优选20~30℃,所述反应的时间优选为1~2h。
反应结束后,用冰水冷却,再向反应体系中加入三乙胺进行反应,所述反应的温度优选为0~10℃,所述反应的时间优选为30min。
上述反应结束后,最后再加入三氟化硼乙醚进行反应,所述反应的温度优选为0~10℃,所述反应的时间优选为30min。
将最终的反应产物进行纯化,得到具有式(i)所示结构的化合物。在本发明中,所述纯化优选按照如下方法进行:
将最终的反应产物旋蒸除去溶剂后,再加大量水除去三乙胺和三氟化硼乙醚,接着,再加入二氯甲烷和水萃取、无水硫酸钠干燥后,旋转蒸发,最后用体积比为1:1的二氯甲烷和石油醚的混合溶液进行提纯,得到橙色固体产物,即具有式(i)所示结构的化合物。
其中,在进行具有式(i)所示结构的化合物的制备时,所用的反应原料具有式(ii)所示结构的化合物按照如下方法进行制备:
对羟基苯甲醛与正溴丁烷进行反应,得到具有式(ii)所示结构的化合物。
具体的,将对羟基苯甲醛、碳酸钾溶于dmf中,加热回流1~2h后,降温至30~40℃,再加入正溴丁烷混合进行加热回流反应10~12h,得到反应产物。
接着,将所述反应产物进行纯化,得到具有式(ii)所示结构的化合物。其中,所述纯化按照如下方法进行:
将反应产物旋蒸除去溶剂,用二氯甲烷和水萃取,萃取产物用无水硫酸钠干燥后,旋蒸除去溶剂,最后用体积比为1:1的石油醚和乙酸乙酯混合溶液进行提纯,得到黄色油状液体,即具有式(ii)所示结构的化合物。
本发明还提供了一种上转换体系,由光敏剂和湮灭剂分散于有机溶剂中制备得到,所述光敏剂选自上述光敏剂或者上述制备方法制备得到的光敏剂。
其中,所述光敏剂为bdp-1或bdp-2时,湮灭剂为苝,所述光敏剂为bdp-3时,湮灭剂为溶剂绿5。所述有机溶剂为二氯甲烷。所述光敏剂与所述湮灭机的摩尔比为1:(0.5~10),优选为1:(1~8),更优选为1:(3~6)。
所述光敏剂在所述上转换体系中的浓度为1~10×10-5m,所述湮灭剂浓度为10-6m~10-4m,优选为0.5×10-5m~10-5m。
本发明提供的光敏剂为三重态光敏剂,该光敏剂在可见光具有高摩尔消光系数,其在tta上转换中发出高强度的光,即在低功率(0.8~5.0mw)激发光源的条件下实现高效上转换;并且可实现可见光的强吸收,通过三重态-三重态湮灭的过程实现绿光向蓝光的转换,这一性能使其在光催化有机合成,光动力治疗,生物成像以及太阳能电池等领域有广泛应用。
为了进一步理解本发明,下面结合实施例对本发明提供的光敏剂及其制备方法和上转换体系进行说明,本发明的保护范围不受以下实施例的限制。
实施例1
通过对羟基苯甲醛和正溴丁烷制备具有式(ii)所示结构的化合物
将对羟基苯甲醛(2.44g,20mmol),碳酸钾(4.15g,30mmol)溶于50mldmf溶液中。加热回流1h后,降温至35℃,缓慢加入正溴丁烷(20mmol,2.72g),搅拌10min后,升温回流12h。冷却至室温后,旋蒸除去溶剂,用二氯甲烷和水萃取,无水硫酸钠干燥后,旋蒸除走溶剂,再用石油醚和乙酸乙酯(体积比为1:1)提纯后的黄色油状液体3.04g,即具有式(ii)所示结构的化合物。测定其产率为85.4%。
核磁数据:1hnmr(400mhz,cdcl3)δ9.88(s,1h),7.82(d,j=8.0hz,2h),6.99(d,j=8.0hz,2h),4.05(s,2h),1.88–1.73(m,2h),1.52(t,j=11.2hz,2h),0.99(t,j=8.0hz,3h).
实施例2
通过具有式(ii)所示结构的化合物和吡咯制备具有式(i)所示结构的化合物(bdp)
将具有式(ii)所示结构的化合物(8.43mmol,1.5g)溶于150ml干燥的二氯甲烷中,在氮气保护下,加入吡咯(1.13g,16.86mmol,1.18ml)和0.15ml三氟乙酸催化剂,在室温下(加三氟乙酸后,颜色逐渐加深,半小时后,溶液变黑色。)反应10h后,加ddq(8.43mmol,1.91g),反应1h,再用冰水冷却下,加入三乙胺(10equiv,11.6ml),反应30min,再加入三氟化硼乙醚(11.6ml)。反应30min后停止反应。旋蒸除走溶剂,再加大量水除走三乙胺和三氟化硼乙醚,再加入二氯甲烷和水萃取、无水硫酸钠干燥后,旋蒸,用二氯甲烷:石油醚(1:1)提纯。得到橙色固体产物203mg,即具有式(i)所示结构的化合物。测定其产率为7.06%。
核磁数据:1hnmr(400mhz,dmso)δ8.09(s,2h),7.65(d,j=8.0hz,2h),7.17(d,j=8.0hz,2h),7.07(d,j=4.0hz,2h),6.69(d,j=4.0hz,2h),4.12(t,j=8.0hz,2h),1.79–1.72(m,2h),1.50–1.45(m,2h),0.98(t,j=8.0hz,3h).
实施例3
通过具有式(i)所示结构的化合物和碘单质制备bdp-1
将具有式(i)所示结构的化合物(70mg,0.205mmol)溶于30ml的无水乙醇中。在氮气保护下,抽真空后,将碘单质(521mg,2.05mmol)和碘酸饱和溶液(72.2mg,0.410mmol)加入,将温度加热到40℃,反应4小时。用五水合硫代硫酸钠清洗三遍,旋蒸除去溶剂。用二氯甲烷和水萃取,无水硫酸钠进行干燥,再旋蒸除走溶剂。用体积比为2:1的石油醚和二氯甲烷的混合溶液过柱提纯后得到红色固体产物75mg,即bdp-1,测定其产率为78%。
对其进行核磁检测,结果见图1,图1为bdp-1的核磁谱图。核磁数据:1hnmr(400mhz,cdcl3)δ7.97(s,1h),7.82(s,1h),7.53(d,j=8.0hz,2h),7.06-7.03(m,4h),6.61(d,j=4.0hz,1h),4.08(t,j=8.0hz,2h),1.87–1.80(m,2h),1.55-1.48(m,2h),1.03(t,j=8.0hz,3h)。
对其进行紫外可见吸收光谱测试以及荧光发射光谱测试,结果见图3和图4,图3为bdp-1、bdp-2与bdp-3的紫外可见吸收光谱,图4为bdp-1、bdp-2与bdp-3的荧光发射光谱。
实施例4
通过具有式(i)所示结构的化合物和碘单质制备bdp-2
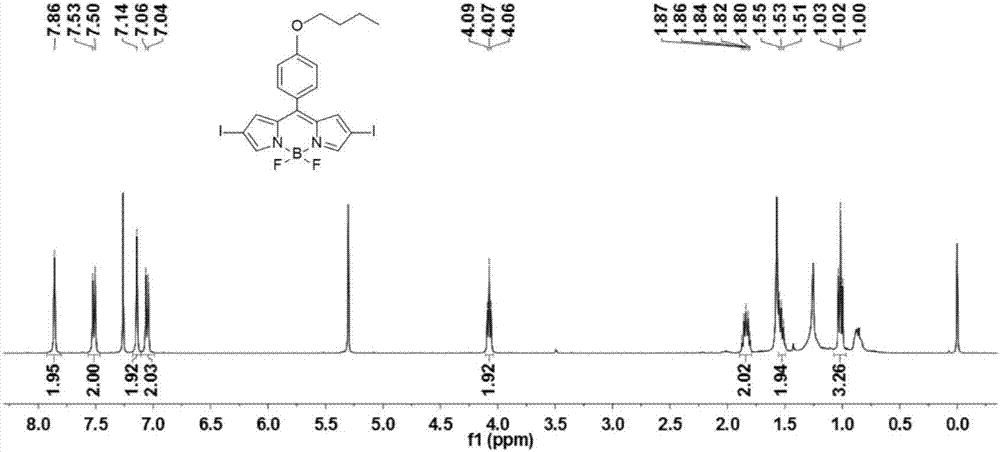
将具有式(i)所示结构的化合物(100mg,0.293mmol)溶于20ml无水乙醇中。在氮气保护下,抽真空后,将碘单质(2.5equiv,187mg),碘酸饱和溶液(0.586mmol,103mg)加入,加热至60℃,回流3小时后。将反应液冷却至室温。用五水合硫代硫酸钠洗涤三次后,旋蒸除走溶剂。再用二氯甲烷和水萃取三遍。用无水硫酸镁干燥,旋蒸除去溶剂后,用体积比为3:1的二氯甲烷和石油醚混合溶液过柱提纯。得到红色固体产物119mg,即bdp-2,测定其产率为68.7%。
对其进行核磁检测,结果见图2,图2为bdp-2的核磁谱图。核磁数据:1hnmr(400mhz,cdcl3)δ7.86(s,2h),7.53(d,j=8.0hz,2h),7.14(s,2h),7.06(d,j=8.0hz,2h),4.09(t,j=8.0hz,2h),1.87–1.80(m,2h),1.55-1.51(m,2h),1.03(t,j=8.0hz,3h).
对其进行紫外可见吸收光谱测试以及荧光发射光谱测试,结果见图3和图4,图3为bdp-1、bdp-2与bdp-3的紫外可见吸收光谱,图4为bdp-1、bdp-2与bdp-3的荧光发射光谱。
实施例5
通过具有式(i)所示结构的化合物和碘单质制备bdp-3
将具有式(i)所示结构的化合物(50mg,0.146mmol)溶于30ml无水乙醇中,在氮气保护下,抽真空。将碘单质(931mg,25equiv)和碘酸饱和溶液(2equiv,52mg)。将反应加热到60摄氏度,回流5h,冷却至室温。用五水合硫代硫酸钠饱和溶液清洗3遍,旋蒸除走乙醇。用二氯甲烷和水萃取,用无水硫酸钠干燥,旋蒸后,用体积比为4:6的二氯甲烷和石油醚混合溶液过柱提纯后得到产物26mg,即bdp-3,测定其产率为21.1%。
对其进行核磁检测,结果见图3,图3为bdp-3的核磁谱图。核磁数据:1hnmr(400mhz,cdcl3)δ7.45(d,j=8.0hz,2h),7.05(d,j=12.0hz,2h),7.01(s,2h),4.08(t,j=8.0hz,2h),1.87–1.80(m,2h),1.54-1.49(m,2h),1.03-0.99(t,j=8.0hz,3h)。
对其进行紫外可见吸收光谱测试以及荧光发射光谱测试,结果见图3和图4,图3为bdp-1、bdp-2与bdp-3的紫外可见吸收光谱,图4为bdp-1、bdp-2与bdp-3的荧光发射光谱。
实施例6
将实施例3中的光敏剂(10-5m)bdp-1和湮灭剂苝(10-5m)在二氯甲烷溶剂中的上转换图与实施例4中的光敏剂(10-5m)bdp-2和湮灭剂苝(10-5m)在二氯甲烷溶剂中的上转换图,以及实施例5中的光敏剂(10-5m)bdp-3和湮灭剂苝(10-5m)在二氯甲烷溶剂中的上转换图进行比较,结果见图6,图6为光敏剂bdp-1、bdp-2、bdp-3和湮灭剂在二氯甲烷溶剂中的上转换比较图。上述溶液均需通入氩气后鼓泡除氧20min,bdp-1、bdp-2用功率为5.0mw的532nm激光激发,bdp-3采用功率为5.0mw的589nm激光激发。由图6可知光敏剂bdp-1、bdp-2分别选用苝作为受体分别可获得高达9.0%与4.2%上转换发光效率,而bdp-3由于与受体苝的三重态能级不匹配,仅获得较弱的上转换效率。
实施例7
为解决实施例6中bdp-3上转换效率较低的问题,将一定量的实施例5制备的光敏剂bdp-3溶解于二氯甲烷中,配制成浓度为10-5m的溶液,并加入适量的溶剂绿5(1~40×10-5m)。将上述溶液通入氩气后鼓泡除氧20min后,用功率5.0mw的589nm激光激发,测试上转换光谱如图7所示。图7为bdp-3作为光敏剂,溶剂绿5发生有效上转换图。通过图7可知,bdp-3可在低功率条件下,对589nm光进行有效上转换,上转换效率达4.0%。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!