一种红壤旱地非共生固氮菌及其培养方法和应用与流程
本发明涉及微生物技术领域,尤其是一种红壤旱地非共生固氮菌及其培养方法和应用。
背景技术:
红壤旱地面积大,水、热、光资源丰富,生物生产潜力巨大,是我国农业结构调整后的主要农业用地之一。但受自然因素以及长期不合理利用等人为因素的影响,形成了该区土壤蚀、瘠、酸、粘、旱等障碍因素,土壤退化严重,增加化肥投入量成为该区农民培肥土壤、提高产量的主要手段。氮肥作为农业生产不可缺少的肥料,更是养分贫瘠红壤的基本营养肥料,对提高红壤旱地肥力和作物产量以及我国农业增产增收都发挥了巨大的作用。然而,由于过量及不合理的氮肥施用方式,导致我国氮肥当季利用率仅为30%~35%。加之,该地区水土流失严重,大量的氮素随地表径流和渗漏淋失向水体迁移也是造成该区农业面源污染的重要原因。近年来,由于不合理施用化肥和酸沉降加剧,旱地红壤酸化加剧、土壤结构、肥力退化严重进而引起土壤生物群落多样性、生态功能急剧衰退。激发和定向培育土壤中微生物群落结构成为提升红壤地力、农民增产增收的重要措施之一。
土壤中许多固氮微生物能将空气中的氮素固定为微生物的氮,进而为作物提供能利用的氮素,在红壤生态系统中氮素增加、运移转化和利用中发挥重要作用。将固氮微生物作为生物肥料,不但可以提高土壤中氮素的利用效率,节肥增产,还可以改善土壤结构,改善土壤肥力。但现在大部分自生固氮菌还未被驯化成可有效固氮并应用于促进植物氮素吸收利用的菌种,未必适应红壤的土壤环境。
技术实现要素:
本发明要解决的技术问题是提供一种红壤旱地非共生固氮菌及其培养方法和应用,该固氮菌可在红壤旱地环境中有效固定氮素,并促进作物对氮素的吸收利用;以及固氮菌在花生栽培上的应用。
为解决上述技术问题,本发明所采取的技术方案是:一种红壤旱地非共生固氮菌,命名为nm2,分类名为稳定伯克霍尔德氏菌(burkholderiastabilis),已于2017年08月07日在中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc)保藏,其菌种保藏编号为:cgmccno.14500;中国科学院微生物研究所菌种保藏中心地址:北京市朝阳区北辰西路1号院3号。
菌落nm2较小为白色、隆起,边缘整齐,表面干燥,不透明,不规则杆状排列。
菌nm2的生理生化特性是:革兰氏阴性,固氮能力试验阳性,好氧兼性厌氧,接触酶试验阴性,m.r试验阳性,vp试验阴性,淀粉水解阴性,硝酸盐还原阴性,柠檬酸盐利用阴性。
固氮菌nm2能高产吲哚乙酸。本发明固氮菌nm2分泌吲哚乙酸(iaa)的能力强,达45.84μg·ml-1。吲哚乙酸是植物激素的一种,能够促进根的发育。产吲哚乙酸的菌种,往往附着在植物根系或叶表面,利用植物代谢产生分泌物的同时产生iaa和少量ga3等植物激素来影响植物的生理过程和形态变化。表现为直接促进根的伸长,从而增大了与土壤中营养物质的接触的机会;可提高植物体内源iaa的含量;诱导植物防卫基因的表达,提高植物体抗病,抗旱等抗逆性。作为本发明的优化方案,固氮菌nm2的发酵在ph5~7下进行,该环境下产iaa量最高。
在实验室摇瓶条件下,固氮菌nm2固氮酶活性达39.1nmolc2h4/h·ml,具有较好的固氮能力。
一种红壤旱地非共生固氮菌,固氮菌命名为nm2,分类名为稳定伯克霍尔德氏菌(burkholderiastabilis),保藏在中国微生物菌种保藏管理委员会普通微生物中心,其菌种保藏编号为:cgmccno.14500。
上述红壤旱地非共生固氮菌的培养方法,步骤如下:
在液体培养基中加入0.8%~1.2%w/v的碳源,然后取25~150ml装于250ml的三角瓶中,按1~1.5%v/v接种量接种处于对数生长期的nm2后,置于28~32℃,摇床培养36~60h;
碳源包括葡萄糖、木糖、蔗糖、甘露醇、乳糖和/或麦芽糖;
液体培养基中使用的无机组分包括氯化钠、磷酸二氢钾、二水硫酸钙、碳酸钙和七水合硫酸镁;
液体培养基的ph值为5~9。
优选的,液体培养基为ashby无氮液体培养基:磷酸二氢钾0.2g,甘露醇10g,碳酸钙5g,氯化钠0.2g,七水合硫酸镁0.20g,二水合硫酸钙0.1g,蒸馏水1000ml;121℃灭菌30min。
优选的,液体培养基的ph值为5~7。
进一步优选的,液体培养基的ph值为5。
优选的,在液体培养基中加入1%w/v的碳源,然后取50ml装于250ml的三角瓶中。
优选的,碳源为麦芽糖。
本发明还提供了红壤旱地非共生固氮菌在红壤旱地环境中固定氮素,促进作物对氮素的吸收利用,增加土壤矿质氮含量中的应用。以及红壤旱地非共生固氮菌在花生栽培上的应用。
本发明从红壤中分离得到土著自生固氮菌nm2,和作物形成互惠共生体系,提升红壤旱地土著生物固氮潜力,促进土壤氮素生物固定扩容。
本发明从供试红壤中筛选出一株自生固氮菌nm2,通过实验发现nm2能够固氮并分泌植物激素iaa,强化固氮作物的固氮能力。
采用上述技术方案所产生的有益效果在于:
(1)本发明的一种固氮菌nm2可有效固氮并高产吲哚乙酸,提高氮素的利用率,促进植物对肥料的吸收,增加土壤矿质氮含量;
(2)本发明固氮菌nm2针对花生具有良好的固氮效果,高产的吲哚乙酸促进花生的生长发育,土壤矿质氮含量的提高也使得花生对氮肥的利用率更高。
附图说明
下面结合附图和具体实施方式对本发明作进一步详细的说明;
图1是本发明实施例2中不同碳源对固氮菌nm2生长影响的柱状图;
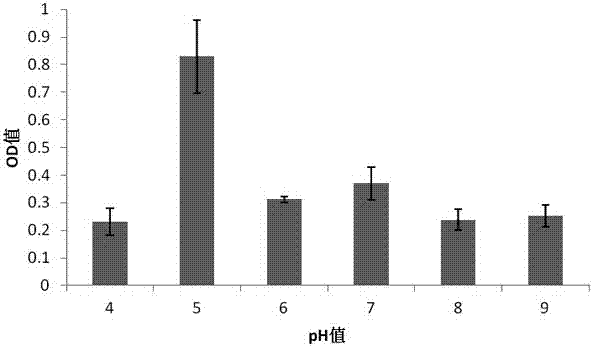
图2是本发明实施例2中不同ph对固氮菌nm2生长影响的柱状图;
图3是本发明实施例2中不同装液量对固氮菌nm2生长影响的柱状图;
图4是本发明实施例4中经接菌nm2处理后,种植花生后土壤微生物生物量氮(mbn)含量变化柱状图;
图5是本发明实施例4中经接种nm2处理后,种植花生后土壤碱解氮含量变化柱状图;
图6是本发明实施例4中经接种nm2处理后,种植花生后土壤矿质氮含量变化柱状图;
图7是本发明实施例4中经接种nm2处理后,花生根的全氮含量变化柱状图。
具体实施方式
实施例1
红壤旱地非共生固氮菌的筛选及其固氮酶活性检测和生理生化特性的测定
(1)三种培养基的准备
ashby无氮固体培养基:磷酸二氢钾0.2g,甘露醇10g,碳酸钙5g,氯化钠0.2g,七水合硫酸镁0.20g,二水合硫酸钙0.1g,琼脂20g,蒸馏水1000ml,ph7.0~7.2。121℃灭菌,30min。
改良ashby无氮固体培养基:三水合磷酸氢二钾0.5g,蔗糖10g,碳酸钙1g,氯化钠0.2g,七水合硫酸镁0.20g,二水合硫酸钙0.1g,琼脂1.5%~2.0%,蒸馏水1000ml,ph7.0~7.2。121℃灭菌,30min。
ashby无氮液体培养基:不加琼脂,其它条件同ashby无氮固体培养基。
(2)红壤旱地非共生固氮菌的筛选
将从江西省红壤所旱地化肥长期定位试验采取的红壤,挑根过筛后,称取l0g,置于盛有100ml灭菌水的250ml的三角瓶中,在摇床中,30℃,150r·min-1振荡20min,静置10min,得到土壤悬浮液。该土壤悬浮液中含有若干种细菌,采用稀释法稀释后涂于ashby无氮固体培养基,将平板倒置,于30℃,恒温箱中培养72h后,挑取不同类型典型单个菌落,经改良ashby无氮固体培养基平板多次纯化后,筛选出该菌株形成的菌落为较小的白色、隆起,边缘整齐,表面干燥,不透明,不规则杆状排列,株型命名为nm2。4℃保存在改良ashby无氮固体培养基斜面待用。
将上述方法筛选分离出的菌株,经北京美亿美生物技术有限公司测序,根据16srdna的测序结果,在http://www.ncbi.nlm.nih.gov在线查询分析,利用blast软件在genbank中与其它的16srdna序列进行同源性比较,选择相近的序列与jx15的序列用megaversion3软件构建nm2的16srdna系统进化树。根据该菌株的生理生化特征,鉴定为稳定伯克霍尔德氏菌(burkholderiastabilis),同源性为99%。
(3)固氮酶活性检测试验
将纯化后的nm2菌株接种到改良ashby无氮固体培养基中,30℃下培养4d,可看到有明显菌落,初步判断nm2有一定的固氮能力,下面对其固氮酶活性进行了测定,具体步骤如下:
将已纯化的固氮菌nm2分别接入ashby无氮液体培养基中,培养24h后用离心法收集菌细胞,再在收集到的菌细胞中加入45ml无菌水和5ml无氮液体培养基,形成50ml固氮菌悬浮液(每毫升约107个菌细胞)作为待接种菌液。
固氮酶活性采用乙炔还原法测定,具体操作如下:将纯化后的菌株nm2,接种在装有2mlashby无氮液体培养基的青霉素小瓶中,30℃下培养18~24h;将棉塞换为反口胶塞密封,用密封性好的注射器先从培养有菌的青霉素小瓶抽取0.5ml空气,再注入0.5mlc2h2,用胶布密封针眼;继续培养24h后,取100μl气样在气相色谱仪上测定c2h4峰值,标准气c2h4浓度为130mg/l。
采用美国hp公司生产的hp6890型气相色谱仪,其工作条件设置为:氢火焰离子化检测器,温度250℃,h2流量30ml/min,压力20kpa;色谱柱为毛细管,柱长15.0m,内径320μm,炉温30℃;载气n2,流量30ml/min,压力20kpa;空气流量250ml/min;前进样口温度250℃,压力20kpa。乙炔还原活性(ara),计算方法为:
(单位:nmolc2h4/h·ml)
经测定计算,nm2的固氮酶活性达39.1nmolc2h4/h·ml,说明其有较好的固氮能力。
(4)好氧性试验
把灭过菌的ashby无氮培养基倒入3个已灭菌的试管中,大约在2/3处,在无菌操作台上,用接种针挑取斜面培养的所述菌nm2,穿刺接种到上述ashby无氮培养基中(必须穿刺到管底)。30℃培养,分别在3天至7天观察结果。在琼脂柱表面上生长者为好氧菌,如沿穿刺线生长者为厌氧菌或兼性厌氧菌。试验结果表现,菌落沿琼脂柱表面生长,穿刺线内也有菌落生长,nm2为好氧兼性厌氧菌。
(5)过氧化氢酶的测定
在干净载玻片上滴1滴3%h2o2,取18~24h的ashby无氮斜面培养物1环,在h2o2中涂抹,若有气泡产生则为阳性,否则为阴性。试验结果:nm2为接触酶阴性。
(6)甲基红试验(m.r试验)
a.培养液及试剂:蛋白胨5g,葡萄糖5g,氯化钠5g,蒸馏水1000ml,调节ph7.0~7.2,分装试管,每管装4~5ml,121℃灭菌20min。试剂:甲基红0.1g,95%酒精300ml,蒸馏水200ml。
b.菌种培养及结果观察接种菌株nm2于上述培养液中,30℃培养l~2天。在培养液中加入几滴甲基红试剂,如培养液呈现红色,为甲基红阳性,黄色为阴性(甲基红变色范围4.4红色~6.0黄色)。
试验结果:nm2为m.r阳性。
(7)乙酞甲基甲醇试验(vp试验)
a.培养液培养液同甲基红试验。b.菌种培养及结果观察接种与培养同甲基红试验。做vp试验时,取培养液(约2ml)和等量的40%naoh相混合,加少量肌酸,充分振荡2~5min后,如培养液出现红色,即为vp阳性。
试验结果:nm2为vp阴性。
(8)淀粉水解试验
a.培养基及试剂在肉汤蛋白胨琼脂中添加0.2%的可溶性淀粉,分装三角瓶,121℃灭菌20min备用。路哥氏碘液:碘片1g,碘化钾2g,先用少量(3~5ml)蒸馏水溶解碘化钾,现加入碘片,待碘完全溶解后,加水稀释至300ml。
b.菌种培养及结果观察:取菌种nm2点接于平板上,30℃培养2~4天,形成菌落后,在平板上滴加路哥氏碘液,以铺满菌落周围为度,平板呈蓝色,而菌落周围如有无色透明圈出现,说明淀粉已被水解。透明圈的大小一般说明水解淀粉能力的大小。
试验结果:nm2为淀粉水解阴性。
(9)硝酸盐还原试验
a.培养基及试剂蛋白胨10g,kno31g,蒸馏水1000ml,ph7.0~7.4。格里斯氏(gries)试剂:a液:对氨基苯磺酸0.5g,稀醋酸(10%左右)150ml;b液:蔡胺0.1g,蒸馏水20ml,稀醋酸(10%左右)150ml。二苯胺试剂:二苯胺0.5g溶于l00ml浓硫酸中,用20ml蒸馏水稀释。
b.菌种培养及结果观察:将试验菌nm2接种于硝酸盐液体培养基中,30℃培养1、3、5天。在白色瓷盘小孔中倒入少许培养液,然后在其中分别滴1滴试剂a和b液,当培养液变为粉红色、玫瑰红色、橙色或棕色等时,表示有亚硝酸盐存在,为硝酸盐还原阳性,否则为阴性。
试验结果:nm2为硝酸盐还原阴性。
(10)柠檬酸盐的利用
a.培养基及试剂柠檬酸钠2g,nacl5g,mgso4·7h2o0.2g,(nh4)2·hpo41g,1%澳百里香酚蓝水溶液10ml,琼脂20g,蒸馏水1000ml,ph6.8-7.0,121℃灭菌20min。
b.菌种培养及结果观察:取幼龄菌种nm2接种于斜面上,30℃培养3-7天,培养基呈碱性(蓝色)者为阳性反应,不变者则为阴性。
柠檬酸盐利用的试验结果:nm2为阴性。
实施例2
为了进一步验证实施例1得到的固氮菌nm2的最适生长条件,下面针对不同碳源、不同ph、装液量探索对固氮菌nm2生长的影响。
在ashby无氮液体培养基中分别加入1%(w/v)的碳源,碳源有葡萄糖、木糖、蔗糖、甘露醇、乳糖、麦芽糖,取50ml装于250ml的三角瓶中,按1%(v/v)接种量接种处于对数生长期的nm2后,置于30℃,180r·min-1摇床培养48h,测定od600的值,结果如图1所示,表明该菌株nm2最适碳源为麦芽糖,其次是葡萄糖,乳糖的利用率最低。
将ashby无氮液体培养基分别调节到不同的ph(4、5、6、7、8、9),取50ml装于250ml的三角瓶中,按1%(v/v)接种量接种处于对数生长期的nm2后,置于30℃,180r·min-1摇床培养48h,测定od600的值。结果如图2所示,表明该菌种nm2生长的ph为5~7,最适ph为5。
将ashby无氮液体培养基按25ml,50ml,75ml,100ml,150ml装于250ml的三角瓶中,按1%(v/v)接种量接种处于对数生长期的nm2后,置于30℃,180r·min-1摇床培养48h,测定od600的值。结果如图3所示,由于菌株nm2是好养兼性厌氧代谢,通气量影响菌株生长,50ml装液量时,菌株生长最快,之后随着装液量增大,生长速度减慢。
实施例3
下面再通过定性测定和定量测定筛选出菌株nm2的分泌吲哚乙酸的能力。
定性测定:将分离纯化后的细菌接种于采用含有l-色氨酸(100mg/l)的ashby无氮液体培养基,30℃,180r·min-1摇床培养2d。取50μl菌悬液滴于白色陶瓷板上,同时加50μlsalkowski比色液(50ml35%hclo4+1ml0.5mfecl3)。将加入50μl50mg/l吲哚乙酸的比色液作为阳性对照。白色陶瓷板于室温避光放置30min后观察,颜色变红者表示能够分泌吲哚乙酸。
定量测定:对初筛获得的分泌iaa的细菌进行定量测定,培养条件同上。首先用分光光度法测定菌悬液的od600值,然后将菌悬液以10000r·min-1离心10min取上清液加入等体积salkowski比色液,避光静置30min,测定其od530值。计算菌浓度od600值为1时,单位体积发酵液中吲哚乙酸的含量。标准曲线的绘制采用分析纯的吲哚乙酸梯度稀释制备。
测定结果表明:该固氮菌nm2分泌吲哚乙酸(iaa)的能力较强,达45.84μg·ml-1。
实施例4
本发明固氮菌nm2对花生氮素吸收具有明显促进作用,下面通过盆栽试验进行说明。
采集自然条件下0~20cm土层的新鲜红壤,过5mm筛,每盆装土400g,种植花生,调节含水量至田间最大持水量的60%,30天后采样,用氯仿熏蒸法测定土壤微生物生物量氮(mbn)含量,用流动分析仪测定土壤矿质氮含量,用h2so4-h2o2消煮法测定植株全氮含量。
作物种子:花生种子进行20%双氧水表面消毒20min,无菌水冲洗多次,催芽2d,选取发芽一致的种子备用。
接菌处理:将本发明的nm2接种于ashby无氮液体培养基,30℃,180r·min-1摇床培养,培养菌长至对数生长期,然后将菌悬液10000r·min-1离心10min,再用无菌水重悬同样离心三次,接种量为108cfu·g-1。
对照处理:作为对照,土壤不接种nm2菌液,加等量无菌无氮液体培养基。
结果如图4、图5、图6、图7所示。从图4可以看出,经接菌处理后,种植花生后土壤微生物生物量氮(mbn)含量显著增加;从图5、图6可以看出,经接种处理后,种植花生后土壤碱解氮和矿质氮含量较对照组增加2.03%-37.6%,其中尤以硝态氮含量增加明显。从图7可以看出,经接种处理后,花生根的全氮含量较对照组有所增加。结合以上结果可以看出,本发明的固氮菌nm2固氮能力好,将空气中的氮固定为mbn和土壤矿质氮,可以有效促进作物对氮素的吸收。
- 还没有人留言评论。精彩留言会获得点赞!